-
Medical journals
- Career
Neobvyklý zdroj krvácení do gastrointestinálního traktu
Authors: J. Válek 1; B. Matějovská 2
Authors‘ workplace: Endoskopické centrum, Interní oddělení, Česko-německá horská nemocnice Krkonoše, s. r. o., Vrchlabí 1; Interní oddělení, Nemocnice v Semilech 2
Published in: Gastroent Hepatol 2014; 68(6): 488-491
Category: Gastrointestinal Oncology: Case Report
doi: https://doi.org/10.14735/amgh2014488Overview
Uvádíme případ 62letého muže, který navštívil lékaře pro téměř týden trvající melénu. Po přijetí na interní oddělení byla provedena gastroskopie a kolonoskopie, které byly bez průkazu zdroje akutního krvácení, následovala hemosubstituce a byla doplněna CT enterografie s nálezem ložiskového postižení tenkého střeva. Nemocný byl přeložen na vyšší pracoviště, kde byla provedena dvojbalonová enteroskopie s nálezem vícečetných submukózních tumorózních ložisek s ulceracemi na povrchu, která již aktuálně nekrvácela. Nemocný byl indikován k chirurgické revizi s peroperační enteroskopií a k následné resekci. Histologicky byla zjištěna ložiska karcinoidu. Nemocný je onkologicky dispensarizován v našem zařízení, po šesti měsících bez známek generalizace onemocnění nebo recidivy tumoru.
Klíčová slova:
neuroendokrinní tumor – karcinoid – krvácení do gastrointestinálního traktu – balonová enteroskopiePopis případu
Prezentujeme případ 62letého muže, který byl v září roku 2013 přijat cestou chirurgické ambulance naší nemocnice na interní oddělení pro šest dní trvající melénu. U pacienta se jednalo o první epizodu zjevného krvácení do trávicího traktu. Pacient byl léčen pro arteriální hypertenzi, v anamnéze dále neurastenie, radikulopatie L5-S1 s algickým syndromem dolních končetin, artróza nosných kloubů, hypercholesterolemie, dyspepsie, astma bronchiale, po polypektomii dvou benigních adenomů sigmatu s nízkým stupněm dysplazie, apendektomii a cholecystektomii v mládí. Z medikace užíval pouze metoprolol a bromazepam. NSAID neužíval.
Při přijetí nebyly patrny klinické projevy anemického syndromu. Z laboratorních vyšetření byla hodnota hemoglobinu (Hb) 114 g/l, leu 11,1 giga/l, onkomarkery (CEA, C15-3, C125, PSA), moč chemicky a sediment, zánětlivé parametry, minerály, ledvinné a jaterní funkce v mezích normálních hodnot. V den přijetí jsme indikovali gastroskopii, která neprokázala zdroj akutního krvácení. V horní části trávicí trubice v antru žaludku byly nalezeny jen tři drobné vyvýšené eroze bez stigmat krvácení. Následovala kolonoskopie s nálezem reziduí melény v celém tračníku i vyšetřeném úseku terminálního ilea, zdroj krvácení nebyl v tračníku nalezen. Následně byla ještě provedena kontrolní gastroskopie, opět bez nálezu čerstvého či proběhlého krvácení. Čtvrtý den hospitalizace byla provedena CT-enterografie (obr. 1 a 2) s nálezem tří měkkotkáňových struktur ve stěně ilea vyklenujících se intraluminálně se zvětšenou mezenteriální lymfatickou uzlinou (10 mm). Vysloveno podezření na tumorózní etiologii.
Obr. 1 a 2. Karcinoid – Ct enterografie (Radiodiagnostické oddělení, nemocnice Jablonec nad nisou). Fig. 1 and 2. Karcinoid – CT enterography (Department of radiology, Hospital Jablonec nad Nisou). 
V průběhu hospitalizace došlo k hemodynamicky významné ztrátě krve s poklesem hemoglobinu (Hb 86 g/l). Byly podány dvě erytrocytární náplavy, po kterých následoval vzestup Hb na 117 g/l. Bylo konzultováno vyšší pracoviště a objednána dvoubalonová enteroskopie (DBE). Krvácení však ustalo a pacient po odeznění melény podepsal negativní revers a odešel do domácí péče. Dodatečně změnil názor a desátý den po propuštění z našeho oddělení nastoupil na vyšší pracoviště k provedení dvoubalonové enteroskopie (DBE) orálním přístupem (pozn. na pracovišti, které zavedlo u nás v ČR tuto metodu do rutinní praxe jako první) [1]. Byly nalezeny vícečetné submukózní útvary s ulceracemi (obr. 3) krytými fibrinovým povlakem na povrchu, odebrány četné biopsie. Tyto léze byly identifikovány jako zdroj krvácení do tenkého střeva. Místo bylo označeno tetováží. Odebraná histologie byla vzhledem k submukóznímu uložení tumorů nevýtěžná, nicméně pacient byl v každém případě indikován k resekčnímu výkonu vzhledem k riziku pokračujícího krvácení a suspektnímu vzhledu lézí. Byl naplánován chirurgický výkon – resekce postižené části tenkého střeva s provedením peroperační enteroskopie ke kontrole zbývajícího tenkého střeva. Chirurgicky byla resekována označená část distálního ilea (100 cm) s celkově šesti lézemi s lokální lymfadenektomií. Operace i pooperační průběh byly bez komplikací.
Image 1. Ulcerace tenkého střeva – DBS endoskopie (ii. interní gastroenterologická klinika, Fn Hradec Králové). Fig. 3. Ulceration of small intestine – DBS endoskopy (II. internal gastroenterology clinic, Faculty hospital Hradec Kralove). 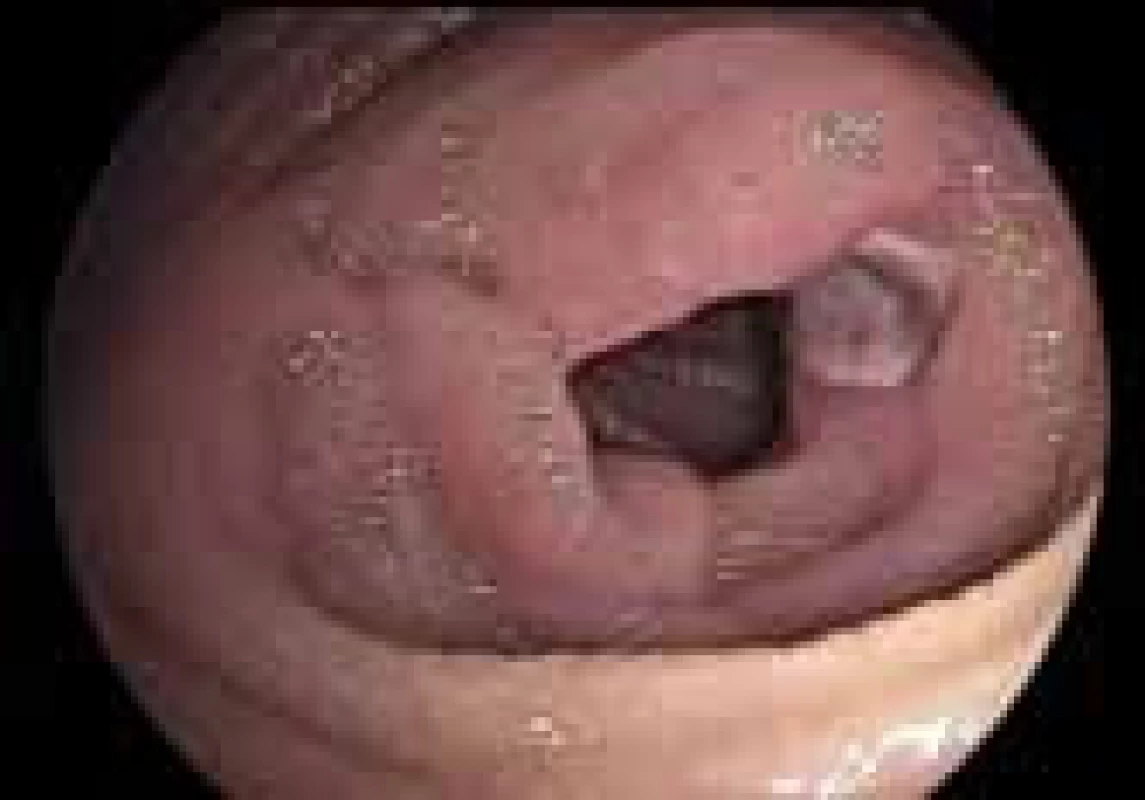
Histologicky byl ve všech šesti ložiscích zjištěn neuroendokrinní tumor grade I–II. Největší ložisko (obr. 4) jevilo známky lymfangioinvaze, angioinvaze a perineurálního šíření s prorůstáním na serózní povrch a metastázami v lymfatických uzlinách (9/17) – pT4(m) N1(9/17) MX.
Image 2. Histologický nález: karcinoid – barvení hematoxylin-eozin (Fingerlandův ústav patologie, Fn Hradec Králové). Fig. 4. Histological investigation: karcinoid – hematoxylin-eosin staining (The Fingerland Department of Pathology, Faculty hospital Hradec Kralove). 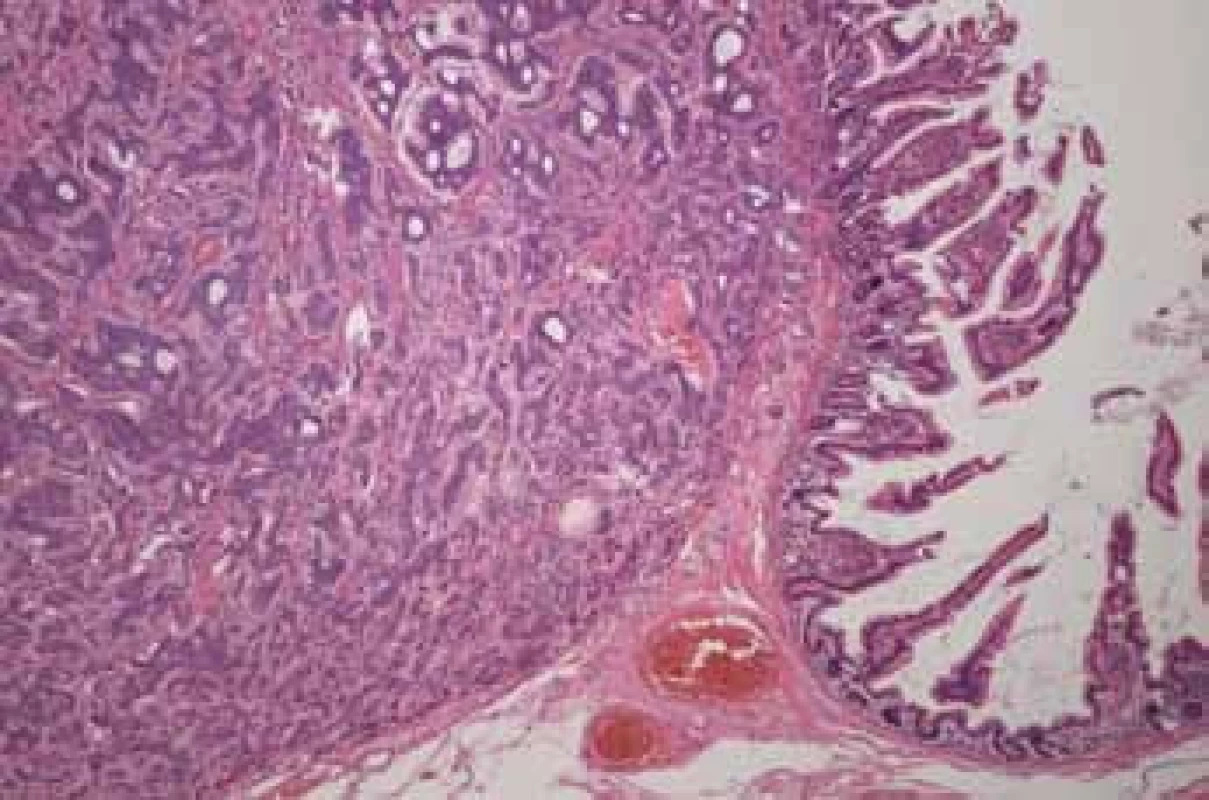
Pacient byl propuštěn sedmý pooperační den domů ve stabilizovaném stavu s chronickou medikací (metoprolol 10 mg, bromazepam 3 mg, dosulepin 75 mg). Proběhlo konziliární vyšetření na spádové onkologické ambulanci, stagingové CT hrudníku, břicha a octreotidový scan, které neprokázaly metastatické šíření nádoru. Nádor nebyl hormonálně aktivní. Nemocný bude nadále pravidelně dispenzarizován onkologem. Po šesti měsících od chirurgické resekce je pacient klinicky v dobrém stavu, bez obtíží a komplikací.
Diskuze
Krvácení do trávicího traktu může probíhat nenápadně při pozvolném a chronickém krvácení nebo může být dramatické v případě akutního silného krvácení. Vývoj a z toho vyplývající morbidita jsou tedy závislé na stupni krvácení, jeho rozsahu, rychlosti a velikosti krevních ztrát. Podle těchto parametrů se vyvíjí klinický obraz a typická symptomatologie.
Incidence krvácení je udávána 100–200/100 000 dospělých obyvatel za rok. V ČR je ročně ošetřeno kolem 12 000–15 000 pacientů s touto komplikací. Letalita je rozdílná podle příčiny. U varixů jícnu dosahuje až 50 %, u krvácejícího žaludečního nebo duodenálního vředu 20–40 %, u ostatních příčin 5–10 % [2].
Krvácení do horní části trávicího traktu představuje 80–85 % krvácení do trávicího traktu. Nejčastější příčinou krvácení je peptický vřed žaludku a duodena, dosahuje až 40 %. Druhou nejčastější příčinou jsou varixy jícnu, dosahují až 30 %. Třetí nejčastější příčinou krvácení jsou stresové vředy žaludku a duodena, případně erozivní gastritida. Způsobují až 20 % ze všech krvácení do horních partií trávicí trubice. Posledních 10 % krvácení zaviní nádory, polékové slizniční léze, hiátové hernie, divertikly, krevní choroby a některé další vzácnější onemocnění [2].
Krvácení do dolní části trávicího traktu definujeme jako akutní nebo chronickou krevní ztrátu způsobenou krvácením ze stěny gastrointestinálního traktu (GIT) distálně od Treitzova ligamenta. Krvácení v této lokalizaci je méně časté než krvácení z horní části GIT, představuje asi 10–20 % krvácení do GIT. Ve většině případů nepatří k tak dramatickým a život ohrožujícím stavům jako krvácení z horní části GIT. Jeho letalita nepřekračuje 2 % [3–5].
S rozvojem endoskopických metod se v posledních letech vyvíjí i přístup ke krvácení z tenkého střeva, tzv. midgut bleeding (distálně od Treitzova ligamenta po Bauhinskou chlopeň), které činí jen 3–5 % krvácení do GIT. V porovnání s kapslovou endoskopií přibývá terapeutických možností DBE. Jejím užitím se můžeme vyhnout často rizikovějšímu a náročnějšímu chirurgickému výkonu [5–8].
Gastroenteropankreatické neuroendokrinní nádory (GEP-NEN) představují skupinu relativně vzácných nádorů, které tvoří přibližně 2 % všech malignit GIT. Ve více než polovině (asi 65 % případů) jsou dobře diferencované – grade I. Zastoupení dle lokalizace v rámci GIT (jejunum, ileum, apendix, pravé kolon 50–70 % – midgut, levé kolon a rektum 15–20 % – hindgut, žaludek, duodenum a pankreas 10–15 % – foregut). Incidence neuroendokrinních nádorů všech lokalizací (včetně např. plicních atd.) je v ČR dle Národního onkologického registru (NOR) 1–2/100 000 (cca 210 případů ročně). Častěji jsou postiženy ženy. Maximum výskytu je ve 4.–6. decenniu [9].
Pokud je prokázána hormonální produkce buňkami neuroendokrinních tumorů (NET), je možná i klasifikace dle příslušného humorálního produktu (např. NET produkující serotonin (z EC buněk), histamin (z ECL buněk), gastrin, glukagon, inzulin, somatostatin, VIP). Termíny „gastrinom“, „glukagonom“ apod. je doporučeno používat pouze v případech, kdy je vyjádřen příslušný syndrom z nadprodukce hormonu.
Klasifikace WHO z roku 2010 uvádí tři základní typy GEP-NEN: 1. neuroendokrinní tumor (NET) G1/G2; 2. neuroendokrinní karcinom (NEC) velkobuněčný//malobuněčný a 3. smíšený adenoneuroendokrinní karcinom (MANEC) [10].
Četnost GEP-NEN tenkého střeva stoupá směrem od jejuna k ileu. Riziko metastáz významně narůstá s velikostí tumoru. GEP-NEN se projevují nespecifickou bolestí břicha, průjmem a nespecifickými projevy, jako je váhový úbytek, únava, vzácněji horečkou, nauzeou, zvracením, žloutenkou a výjimečně i krvácením do gastrointestinálního traktu, jak tomu bylo u našeho pacienta. Karcinoidový syndrom s flushem, Hedingerův syndrom (postižení srdce) či karcinoidová krize jsou projevy spíše pozdních stadií [11].
Terapie neuroendokrinních nádorů odpovídá jejich rozsahu a hormonální aktivitě. Pokud se jedná o nádory lokalizované, bez hormonální symptomatologie, je za kurativní léčbu považován dostatečný chirurgický výkon. Následně bez adjuvantní terapie s pravidelnou dispenzarizací.
V případě zjištěné generalizace onemocnění terapie odpovídá rozsahu metastatického postižení, hormonální aktivitě a celkovému klinickému stavu. U neuroendokrinních nádorů dobře diferencovaných (grade I–II) je snaha o maximální chirurgický výkon. Obzvláště u postižení tenkého střeva je výkon spojený s delším přežitím a snížením nebo oddálením komplikací (obstrukce, krvácení, perforace). Chirurgický výkon by měl respektovat případnou morbiditu extenzivní resekce tenkého střeva a zároveň být dostatečně radikální. Pokud jsou jaterní nebo jiné vzdálené metastázy operačně řešitelné resekčním výkonem, doporučuje se jejich odstranění. Případně je možné využít metod invazivní radiologie (RFA, TACE) [12,13].
V případě funkčních NET je indikována antisekreční terapie somatostatinovými analogy (SSA – octreotid, lanreotid, pasireotid) ke kontrole symptomů i před chirurgickou či lokoregionální intervencí. V druhé linii či v kombinaci přidáváme interferon α (IFN-α). SSA jsou doporučena též v 1. linii u nefunkčních, progresivních NET G1. U pokročilých stadií nebo při selhání léčby podáváme chemoterapii (streptozotocin, 5-fluorouracil, doxorubicin) (pozn.: chemoterapie je první linií léčby u NET pankreatu).
U vybraných pacientů (mladších 50 let) s difuzním jaterním postižením s karcinoidovým syndromem po vyloučení extrahepatických metastáz přichází v úvahu po chirugické resekci primárního tumoru transplantace jater [14].
Prognóza GEP-NEN v jejunoileální oblasti zavisí na stagingu a gradingu, který vychází z WHO a TNM klasifikace 2010. V posledních letech dochází nejen z důvodů lepší organizace péče, ale i dostupnější diagnostiky a léčby ke zlepšování prognostických ukazatelů. Přesto pětileté přežití pro všechna stadia činí v průměru 50–60 %, pro lokálně ohraničené NEN 80–100 %, s postižením regionálních lymfatických uzlin 70–80 % a při pokročilých stadiích s metastatickým postižením činí pětileté přežití 35–80 % [15–17].
Pacienti by měli být doživotně v péči specialisty. Pacienti s NET G1/G2 by měli být sledováni každých 3–6 měsíců, pacienti s NEC G3 nebo s postižením jater bez resekce každé 2–3 měsíce. Při stabilizaci stavu se interval může prodloužit na 6–12 měsíců.
Dispenzární vyšetření by měla obsahovat kontrolu klinického stavu včetně dotazu na přítomnost příznaků karcionoidového syndromu, základní biochemické vyšetření, KO, sledování hladin chromograninu A a 5-HIAA v moči, skiagram plic, UZ břicha, event. CT/MRI. Před každým terapeutickým rozhodováním by měl být proveden octreoscan. U hormonálně aktivních forem je nezbytné monitorovat i případný rozvoj karcinoidové srdeční nemoci, která výrazně zhoršuje prognózu pacienta, prováděním echokardiografie. Po 25 letech sledování je pouze 20 % pacientů bez recidivy NEN [12,14,18].
Závěr
Uvedenou kazuistikou jsme chtěli upozornit na vzácnou příčinu krvácení do trávicího ústrojí, připomenout měnící se přístup a možnosti při krvácení do tenkého střeva, tzv. midgut bleeding, s možností provedení DBE a dále přiblížit problematiku neuroendokrinních tumorů – karcinoidu.
Provedení všech potřebných specializovaných vyšetření a získání výsledků, které jsou nutné k cílené léčbě méně obvyklých chorob, je mnohdy v podmínkách menší nemocnice nemožné. Úzká spolupráce s vyšším pracovištěm a mezioborová spolupráce je proto pro nás při diagnostice vzácnějších onemocnění nezbytná.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 3. 8. 2014
Přijato: 15. 9. 2014
MUDr. Jan Válek
Endoskopické centrum
Interní oddělení, Česko-německá horská nemocnice Krkonoše, s. r. o.
Fügnerova 50, 543 01 Vrchlabí
jan.valek@centrum.cz
Sources
1. Kopáčová M, Rejchrt S, Tachecí I et al. Double-balloon enteroscopy. The first fifty investigations in the Czech Republic. Folia Gastroenterol Hepatol 2006; 4(4): 135–148.
2. Havlíček K. Doporučené postupy pro praktické lékaře. Krvácení do horní části GIT. ČLS JEP 2001. [online]. Dostupné z: http://www.cls.cz/dokumenty2/os/r021.rtf.
3. Ahlquist DA. Approach to the patient with occult gastrointestinal bleeding. In Yamada T et al (ed.). Textbook of gastroenterology. 4th ed. Philadelphia: J. P. Lippincott comp 2003 : 724–738.
4. Konečný M, Ehrmann J, Procházka V. Krvácení do trávicího traktu. Postgrad Med 2004; 6 : 610–615.
5. Zavoral M. Krvácení do dolní části trávicí trubice. In: Dítě P et al (ed). Akutní stavy v gastroenterologii. 1. ed. Praha: Galén 2005 : 31–39.
6. Büschel P, Mönkemüller K, von Falkenhausen U et al. Emergency double balloon enteroscopy: a feasible and promising diagnostic as well as possible therapeutic option in recurrent midgut bleeding. BMJ Case Rep 2011. doi: 10.1136/bcr.06.2010.3068.
7. Mönkemüller K, Neumann H, Meyer F et al. A retrospective analysis of emergency double-balloon enteroscopy for small--bowel bleeding. Endoscopy 2009; 41(8): 715–717. doi: 10.1055/s-0029-1214974.
8. Yano T, Yamamoto H et al. Current state of double balloon endoscopy: the latest approach to small intestinal diseases. J Gastroenterol Hepatol 2009; 24(2): 185–192. doi: 10.1111/j.1440-1746.2008.05773.x.
9. Novák J, Šachlová M. Karcinoidy v populaci České republiky. Klin Onkol 2008; 21(2): 75–76.
10. Bosman TF, Carneiro F, Hruban RH et al. WHO classification of tumours of the digestive system. 4. ed. Lyon, France: IARC Press 2010.
11. Landerholm K, Falkmer S, Järhult J. Epidemiology of small bowel carcinoids in a defined population. World J Surg 2010; 34(7): 1500–1505. doi: 10.1007/s00268-010-0519-z.
12. Oberg K, Jelic S. Neuroendocrine gastroenteropancreatic tumors: ESMO clinical recommendation for diagnosis, treatment and follow-up. Ann Oncol 2009; 20 (Suppl 4): 150–153. doi: 10.1093/annonc/mdp158.
13. Norlén O, Stalberg P, Öberg K et al. Long-term results of surgery for small intestinal neuroendocrine tumors at a tertiary referral center. World J Surg 2012; 36(6): 1419–1431. doi: 10.1007/s00268-011-1296-z.
14. Pavel M, Baudin E, Couvelard A. ENETS consensus guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary. Neuroendocrinology 2012; 95(2): 157–176. doi: 10.1159/000335597.
15. Garcia-Carbonero R, Capdevila J, Crespo-Herrero G et al. Incidence, patterns of care and prognostic factors for outcome of gastroenteropancreatic neuroendocrine tumors (GEP-NETs): results from the National Cancer Registry of Spain (RGETNE). Ann Oncol 2010; 21(9): 1794–1803. doi: 10.1093/annonc/mdq022.
16. Jann H, Roll S, Couvelard A et al. Neuroendocrine tumors of midgut and hindgut origin: tumor-node-metastasis classification determines clinical outcome. Cancer 2011; 117(15): 3332–3341. doi: 10.1002/cncr.25855.
17. Boudreaux JP, Klimstra DS, Hassan MM et al. The NANETS consensus guideline for the diagnosis and management of neuroendocrine tumors: well-differentiated neuroendocrine tumors of the jejunum, ileum, appendix, and cecum. Pancreas 2010; 39(6): 753–766. doi: 10.1097/MPA.0b013e3181ebb2a5.
18. Louthan O. Neuroendokrinní tumory tenkého střeva – jejuna a ilea. Čes a Slov Gastroent a Hepatol 2009; 63(6): 284–291.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2014 Issue 6-
All articles in this issue
- Vedolizumab – nová antiintegrinová protilátka s vysokou gastrointestinální selektivitou
- OVESCO klip jako řešení komplikace ERCP
- Neobvyklý zdroj krvácení do gastrointestinálního traktu
- Problematika diferenciální diagnostiky autoimunitní formy pankreatitidy a pankreatického adenokarcinomu
- Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C
- Doporučený postup diagnostiky a léčby chronické hepatitidy B
- Zpráva o celorepublikovém mezilaboratorním porovnání vyšetření fekálního kalprotektinu
- Podzimní pracovní den České hepatologické společnosti
- Karlovy Vary gastroenterologické – letos už potřinácté
- International professional competition Dr. Bares Award lived to see the 20th anniversary
- Poděkování recenzentům
- Zimní mix...
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- OVESCO klip jako řešení komplikace ERCP
- Neobvyklý zdroj krvácení do gastrointestinálního traktu
- Vedolizumab – nová antiintegrinová protilátka s vysokou gastrointestinální selektivitou
- Karlovy Vary gastroenterologické – letos už potřinácté
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


