-
Medical journals
- Career
Metastatické postižení tenkého střeva jako první projev generalizace kožního melanomu
Authors: Š. Hlava 1; R. Keil 1; J. Šťovíček 1; M. Grega 2
Authors‘ workplace: Interní klinika – gastroenterologie FN v Motole 1; Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole 2
Published in: Gastroent Hepatol 2013; 67(2): 127-131
Category: Digestive Endoscopy: Case Report
Overview
Melanom je nejčastější nádor metastazující do trávicí trubice. U generalizovaného melanomu jsou při sekci metastázy v gastrointestinálním traktu zjištěny u 60 % pacientů. Metastázy se mohou objevit řadu let po excizi primárního ložiska. Častým symptomem metastatického postižení gastrointestinálního traktu je anemizace. Prezentujeme případ 79letého muže, u kterého byly metastázy v oblasti tenkého střeva prvním projevem generalizace onemocnění. Naše kazuistika dokládá, že u pacientů s nejasným krvácením do gastrointestinálního traktu je nutno myslet na možné metastatické postižení střev i léta po excizi primárního ložiska melanomu.
Klíčová slova:
melanom – krvácení – polyp – tenké střevo – metastáza
Melanom patří mezi nejagresivnější nádorová onemocnění vůbec. Jeho incidence se v ČR pohybuje okolo 12 případů na 100 tis. obyvatel se stoupající tendencí [1].
U pacientů s generalizovaným onemocněním je postižení tenkého střeva relativně časté, avšak vzhledem k nespecifickým symptomům je většinou zjištěno až post mortem.
Vlastní kazuistika
79letý muž s anamnézou excize drobného maligního melanomu bradavky v roce 2008 (stadium IA, s kurabilní resekcí) byl v červenci a srpnu 2012 dvakrát hospitalizován pro symptomatickou mikrocytární sideropenickou anémii s nutností opakovaného podání krevních převodů. Během hospitalizace byl bez melény či enteroragie. Připouštěl černou stolici na počátku roku 2012. Gastroskopické ani koloskopické vyšetření neprokázalo zdroj krvácení, avšak při koloskopii byla v tračníku nalezena dvě plovoucí koagula. Vzhledem k suspekci na krvácení z tenkého střeva byl pacient odeslán ambulantně na naše pracoviště k provedení push enteroskopie. Orálním přístupem bylo proniknuto do 140 cm postpyloricky. V 60 a 100 cm za pylorem po zkrácení přístroje byly nalezeny dva stopkaté polypy, proximální exulcerovaný se známkami proběhlého krvácení (obr. 1). Histologické vyšetření bioptických vzorků bylo nevýtěžné, kapslová enteroskopie prokázala několik vyvýšených pigmentovaných ložisek v průběhu jejuna a minimálně čtyři polypy, dva z nich exulcerované, nejdistálnější ve 40 % tranzitního času tenkým střevem (obr. 2,3). Byla zopakována push enteroskopie s kličkovou polypektomií polypu ve 100 cm postpyloricky (obr. 4). Spodina polypu byla antracitově černá. Od polypektomie druhého, proximálně uloženého polypu bylo upuštěno. Histologicky byly popsány částky na povrchu kryté fokálně nekrotickou a ulcerovanou sliznicí tenkého střeva (obr. 5). V submukóze bylo zastiženo ložisko tvořené maligním solidním nádorem, místy nodulárně uspořádaným, tvořeným většími polygonálními buňkami s jadernými atypiemi s mitotickou aktivitou (obr. 6) s patrným tmavavým pigmentem s imunohistochemickou pozitivitou protilátky anti-melan A (obr. 7) a HMB 45 (antimelanoma antibody) (obr. 8). Slabě pozitivní bylo také imunochemické vyšetření proti proteinu S100, který je přítomen v buňkách neuroektodermového původu. Nález odpovídá metastáze melanomu.
Image 1. Exulcerovaný polyp jejuna, push enteroskopie. Fig. 1. Ulcerated poylp of jejunum, push enteroscopy. 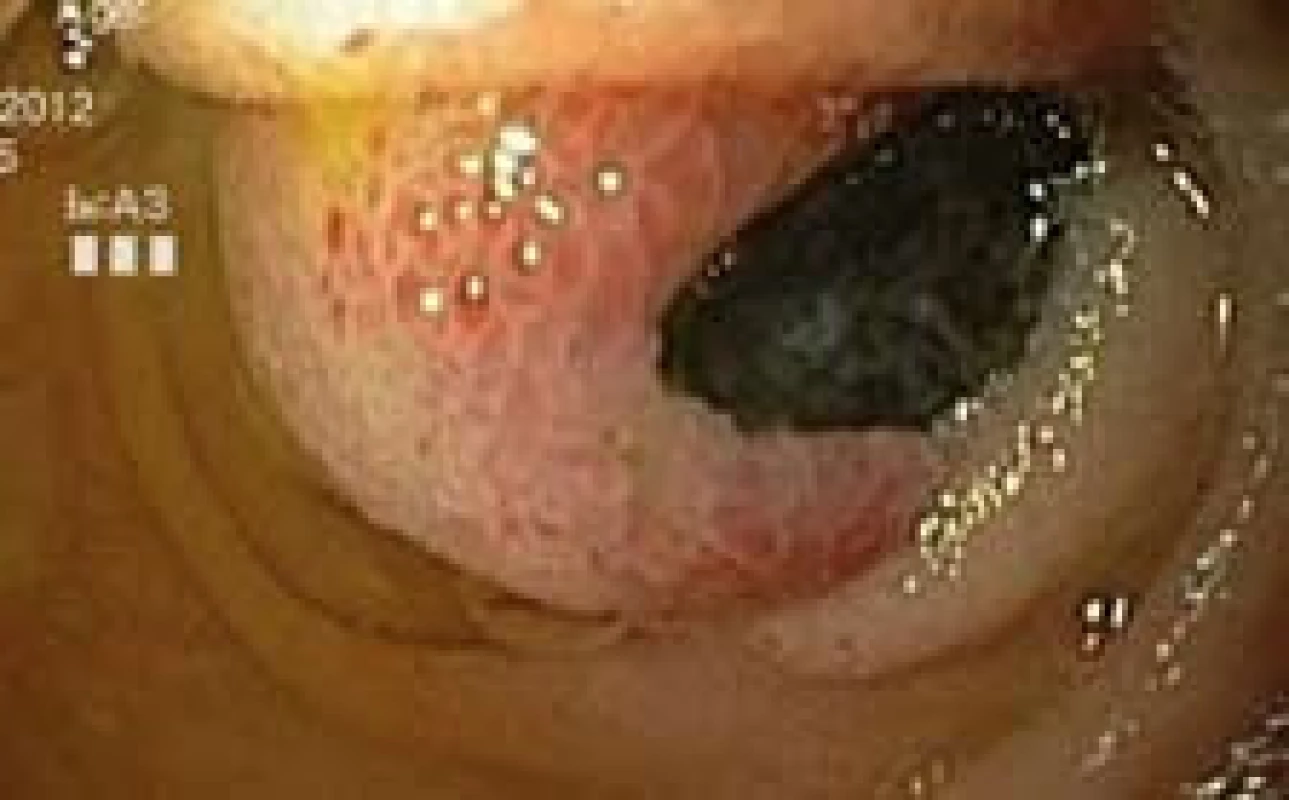
Image 2. Polyp jejuna, kapslová enteroskopie. Fig. 2. Polyp in jejunum, capsulle enteroscopy. 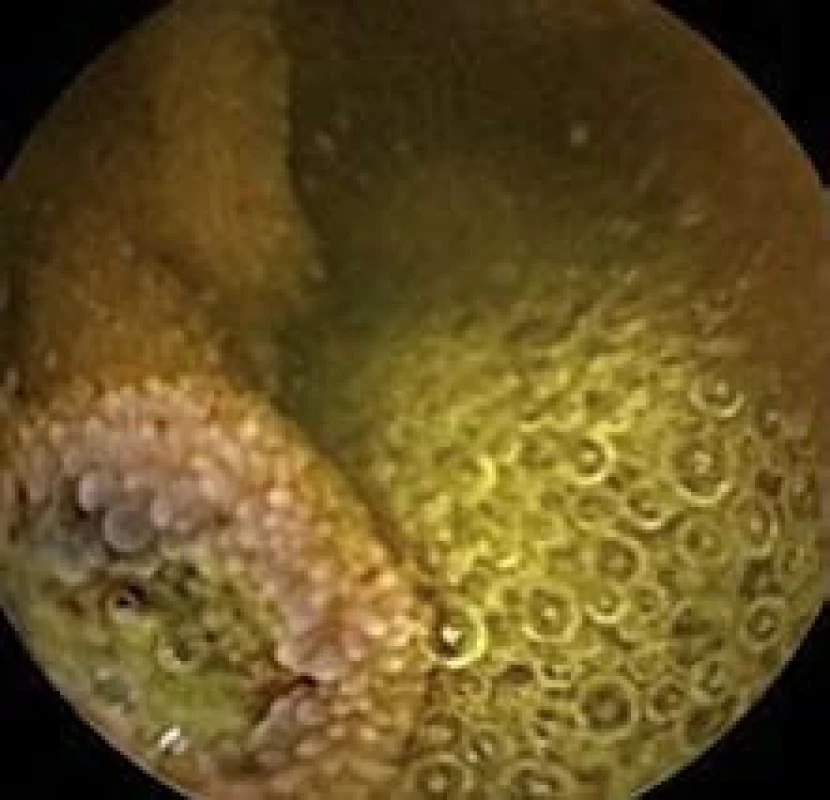
Image 3. Polyp jejuna, kapslová enteroskopie. Fig. 3. Polyp in jejunum, capsulle enteroscopy. 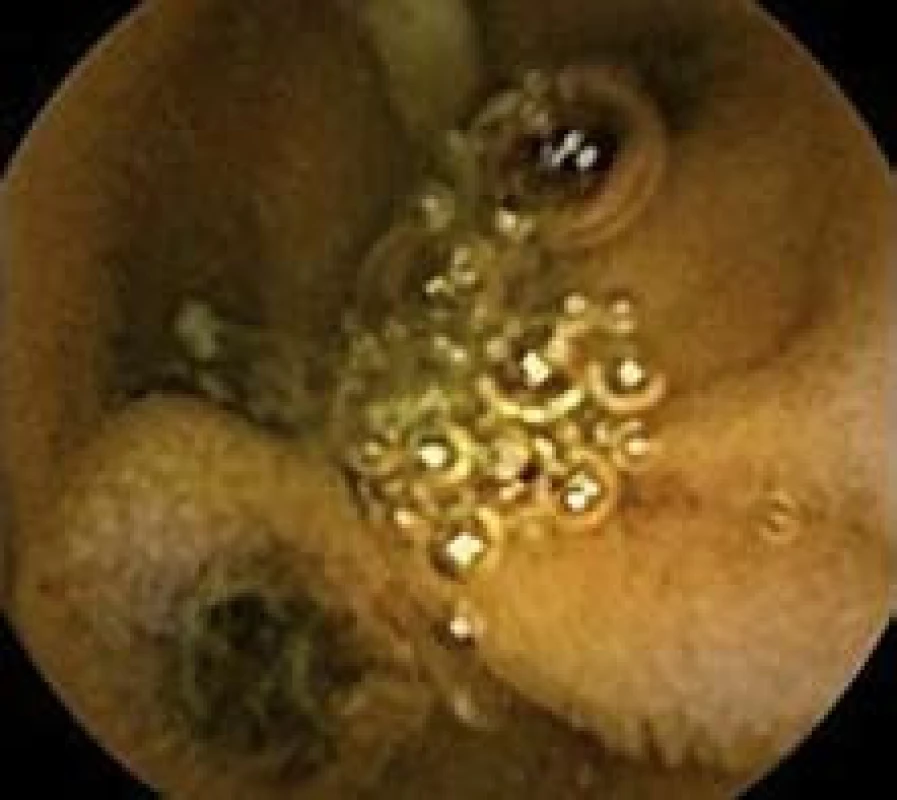
Image 4. Endoskopická polypektomie exulcerovaného polypu jejuna polypektomickou kličkou. Patrna tmavá hmota v místě polypektomie. Push enteroskopie. Fig. 4. Endoscopic polypectomy of jejunal polyp. Dark material in place of polypectomy. Push enteroscopy. 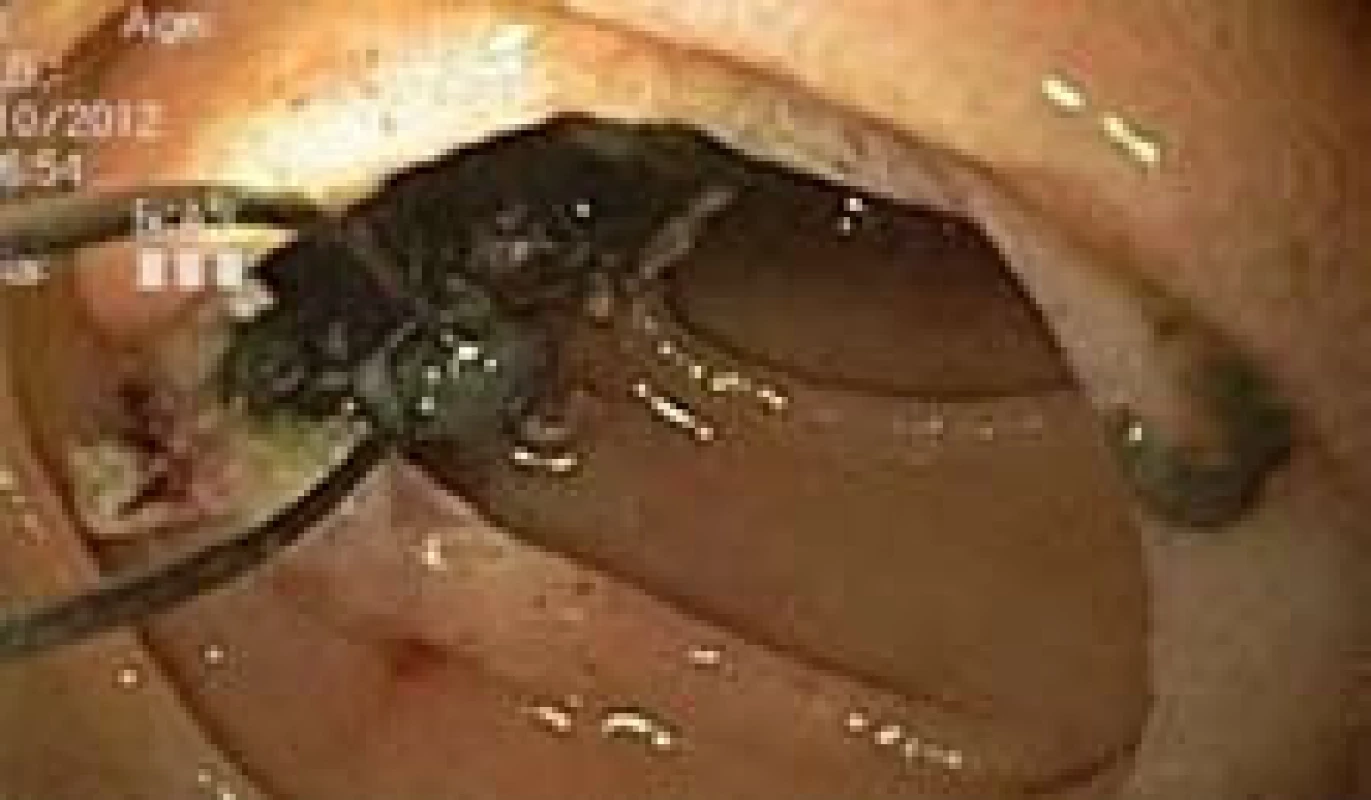
Image 5. Submukózní ložisko metastázy melanomu. Na povrchu ulcerovaná sliznice tenkého střeva (šipka). Hematoxilin-eozin. Fig. 5. Submucosal melanom metastasis. Ulcerated small bowell mucosa (arrow). Hematoxilin-eosin staning. 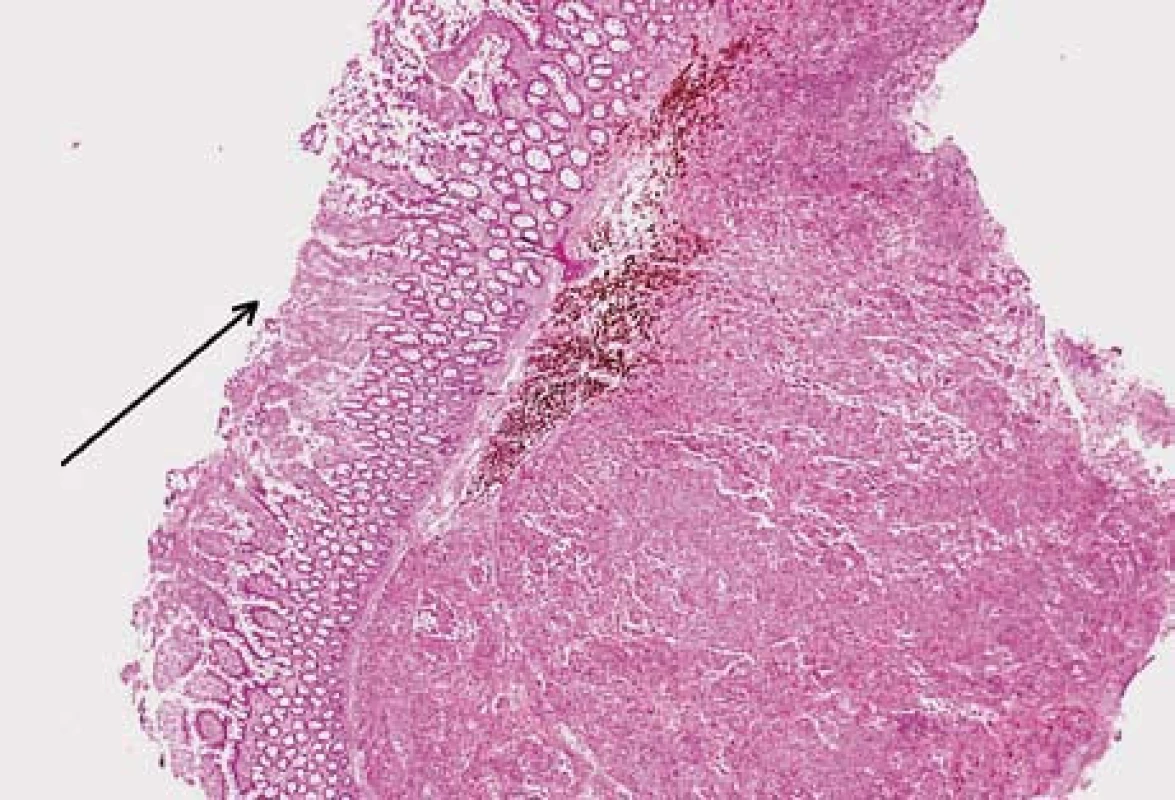
Image 6. Při větším zvětšení jsou patrny polygonální buňky s jadernými atypiemi s hojným výskytem hnědého pigmentu. Barvení hematoxilin-eozin. Fig. 6. Polygonal cells with nuclear atypia. Brown pigmentation. Hematoxilin- eosin satining. 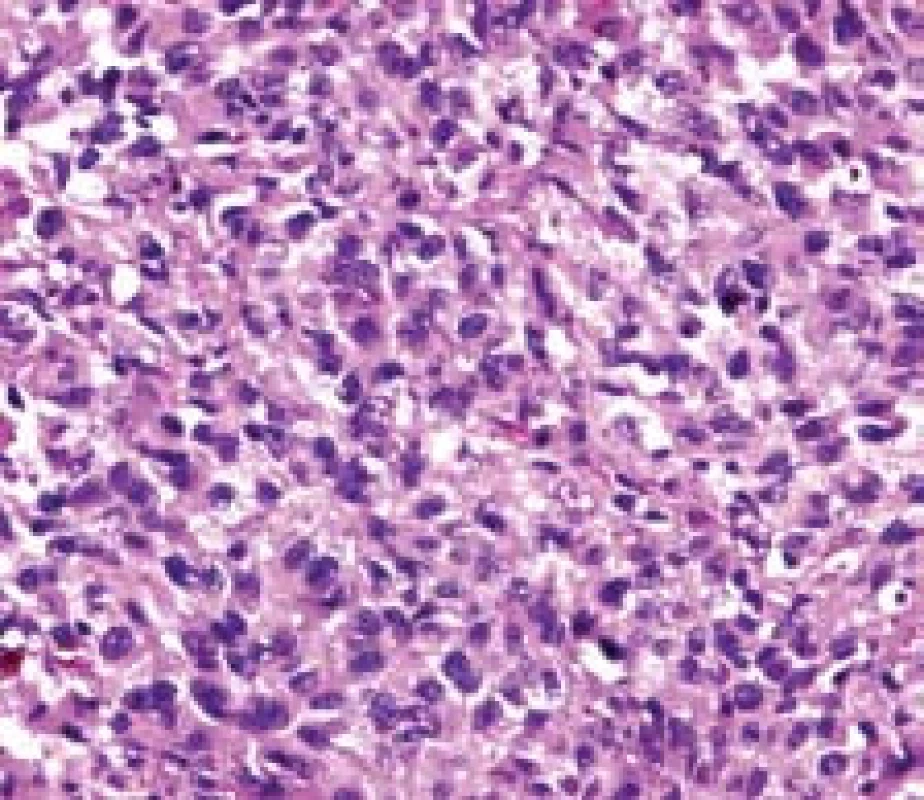
Image 7. Metastáza melanomu v jejunu, kličková polpyektomie. Imunohistochemické vyšetření – HMB 45 pozitivita. Fig. 7. Small bowell metastatic melanoma, snare polypectomy. Imunohistochemy – HMB 45 positivity. 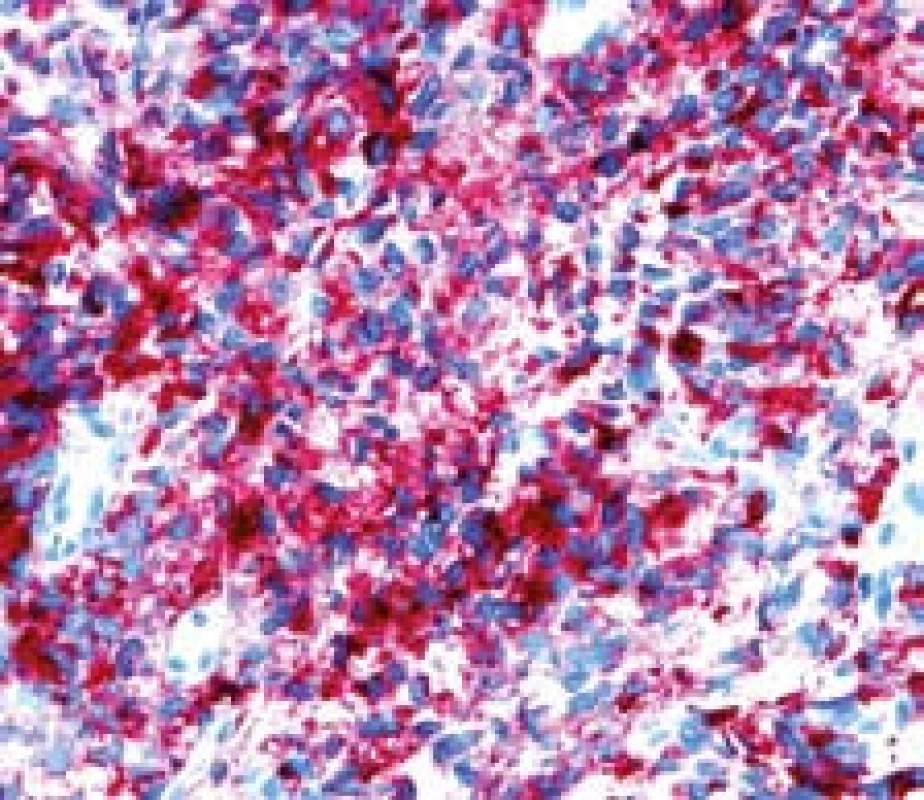
Image 8. Metastáza melanomu v jejunu, kličková polpyektomie. Imunohistochemické vyšetření – Melan A pozitivita. Fig. 8. Small bowell metastatic melanoma, snare polypectomy. Imunohistochemy – melan A positivity. 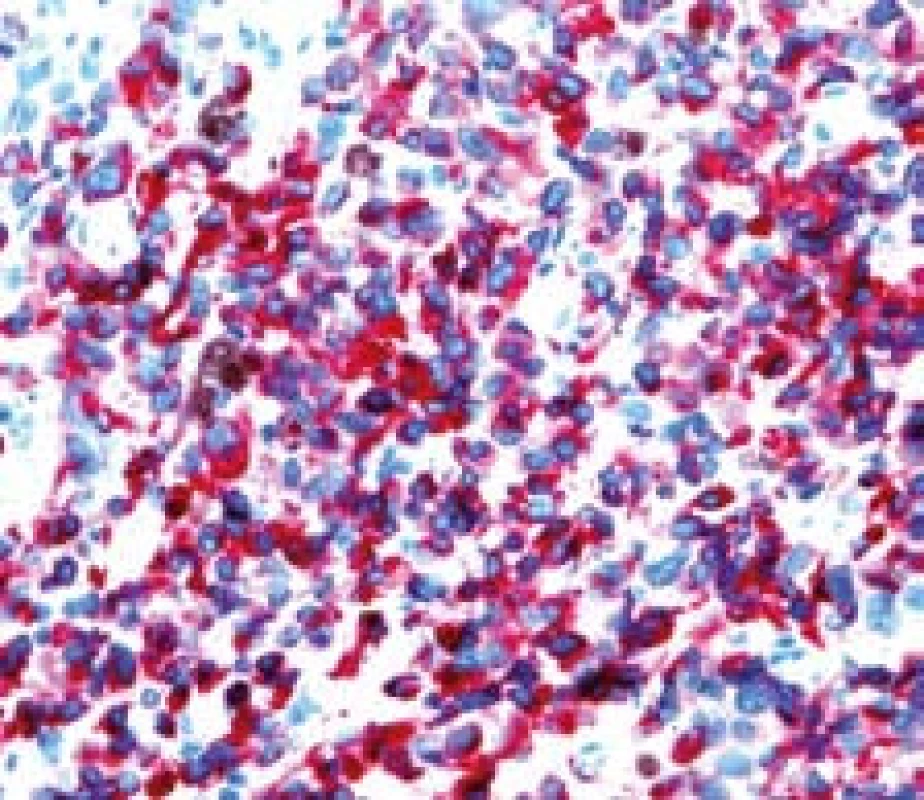
Dále již byl pacient v péči dermatologického a onkologického oddělení v místě bydliště. Ze získaného histologického materiálu bylo doplněno genetické vyšetření k potvrzení přítomnosti mutace genu BRAF (gen pro serin/threoninovou proteinovou kinázu B-RAF uplatňující se v signalizační kaskádě řídící mitotickou aktivitu buňky). V rámci klinického stagingu bylo v listopadu 2012 provedeno PET/CT s nálezem vícečetného metastatického postižení plic, tří úseků tenkého střeva, obou nadledvin, m. pectineus vlevo a v adduktoru levého stehna (obr. 9–11). Chirurgická resekce vzhledem k rozsáhlému metastatickému postižení nebyla indikována. Byla zahájena konvenční paliativní cytostatická chemoterapie dacarbazinem. V lednu 2013 již bylo prokázáno bilaterální metastatické postižení mozku (obr. 12). Na kontrolní vyšetření v březnu 2013 tj. šest měsíců od získání histologického materiálu z tenkého střeva) po absolvování dvou cyklů chemoterapie se již pacient nedostavil.
Image 9. PET CT – metastáza v oblasti kliček tenkého střeva (šipka). Fig. 9. PET CT – small bowell metastasis (arrow). 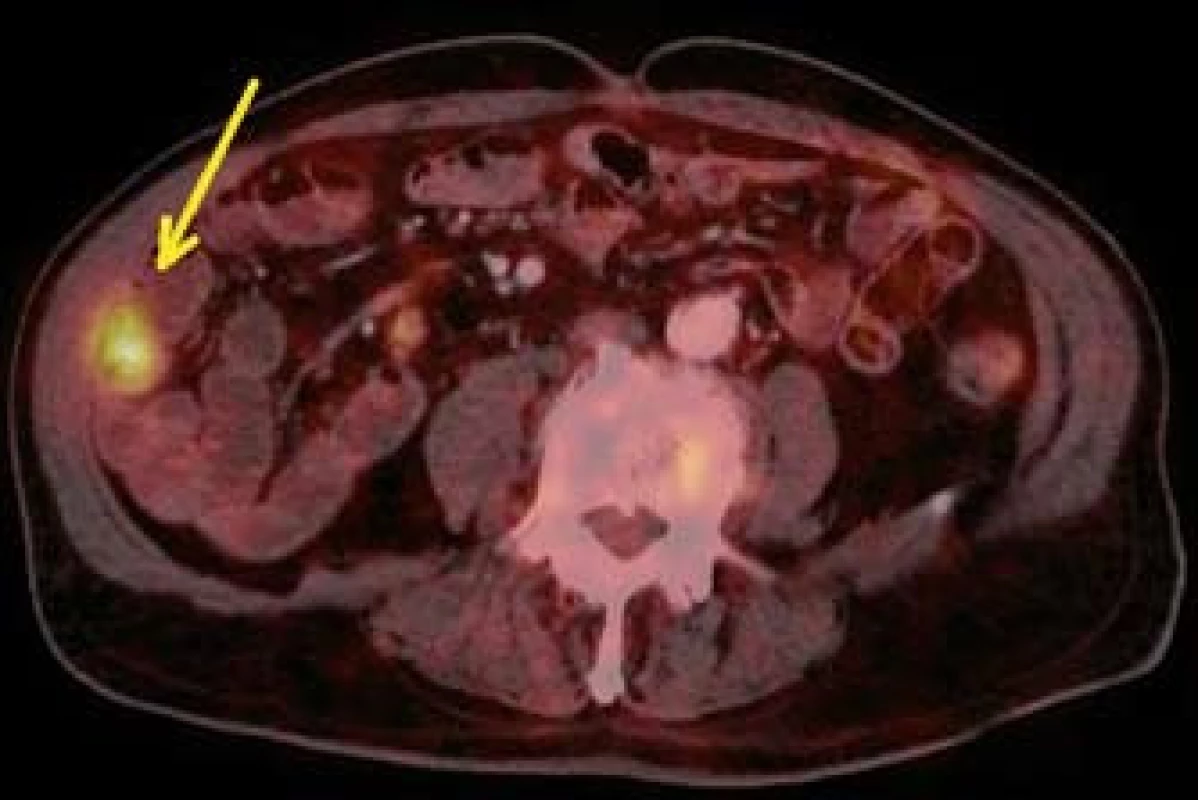
Image 10. PET CT – metastáza v distálnější části tenkého střeva (šipky). Fig. 10. PET CT – melanoma metastasis in lower part of small bowell (arrow). 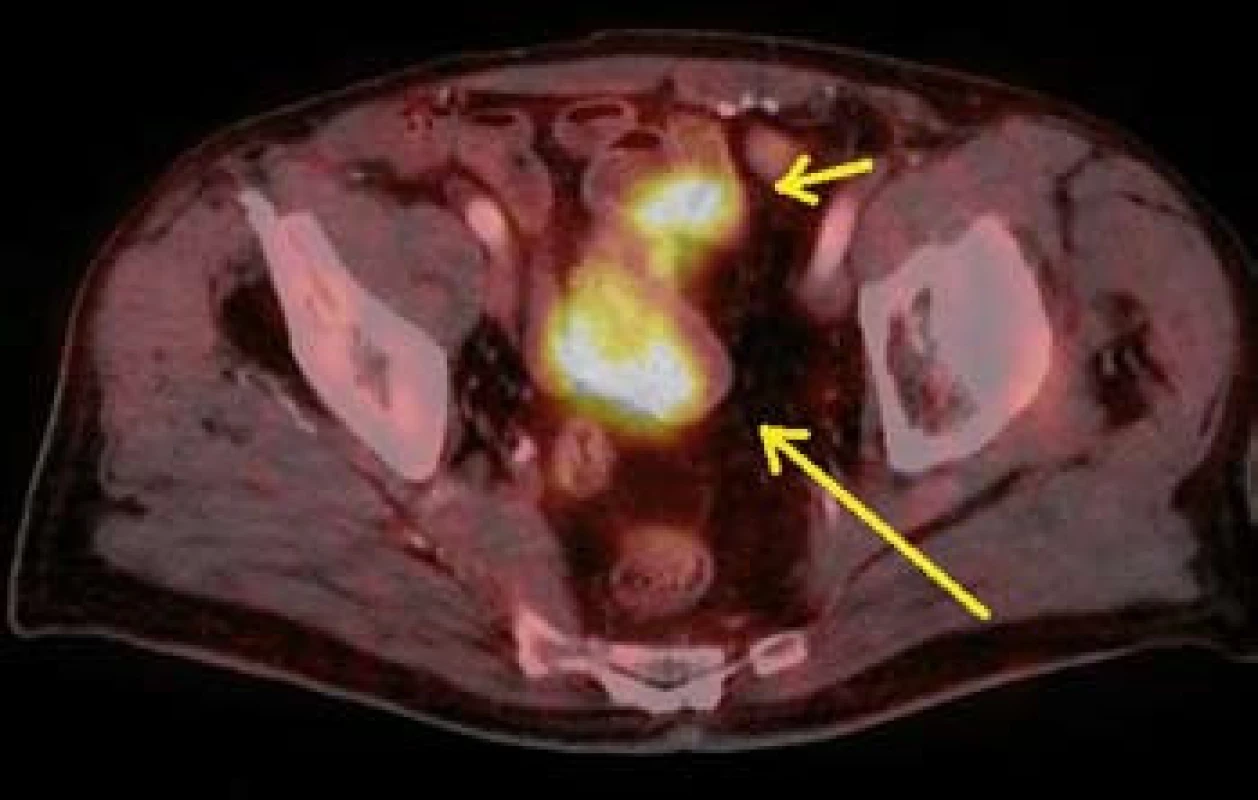
Image 11. PET CT – zvýšená akumulace FDG v adduktoru levého stehna – metastáza melanomu. Fig. 11. PET CT – higher FDG accummulation in left adductor – melanoma metastasis. 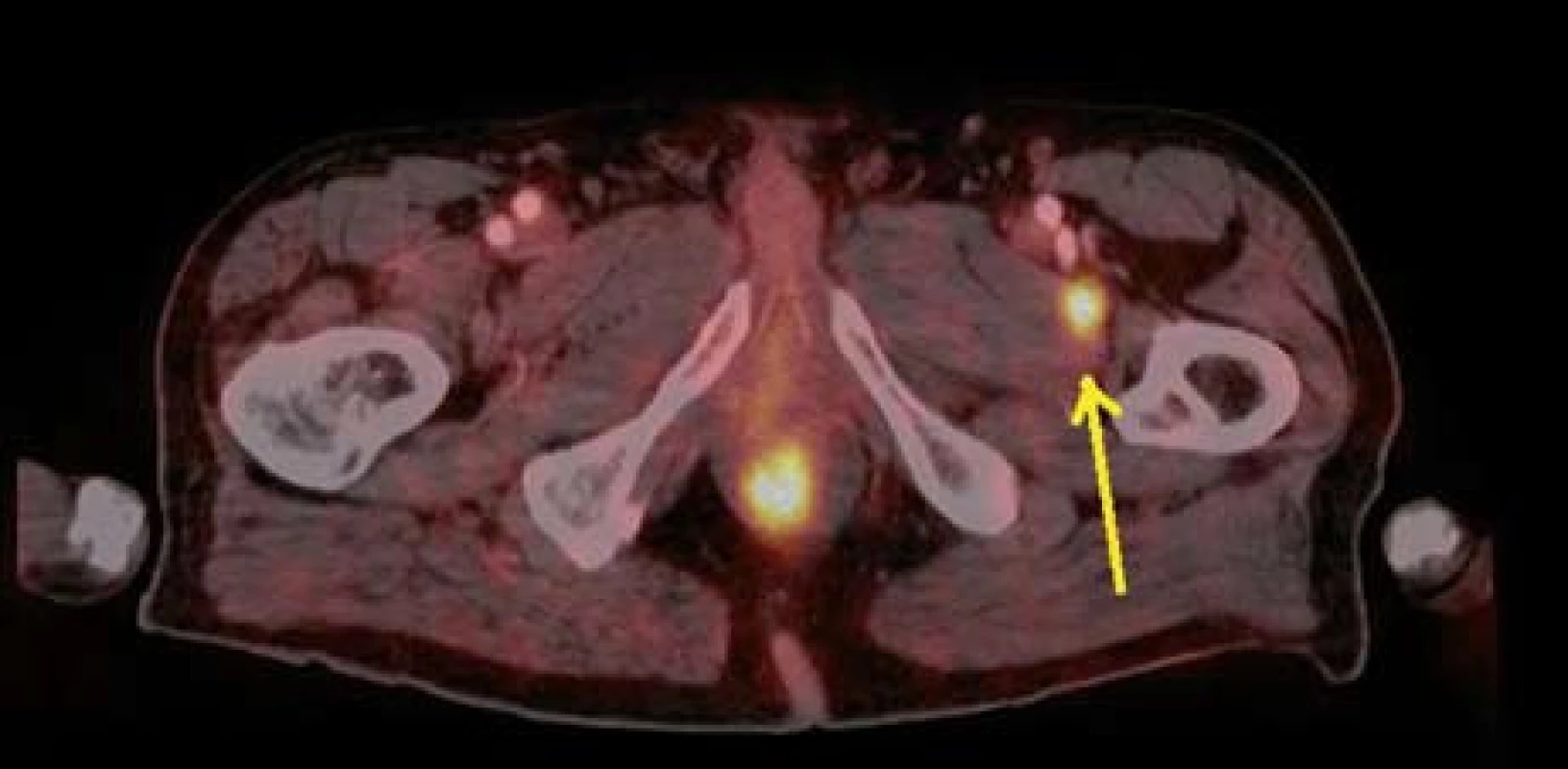
Image 12. CT mozku – metastatické postižení CNS (šipka). Fig. 12. Brain CT scan – brain metastatic leasion. 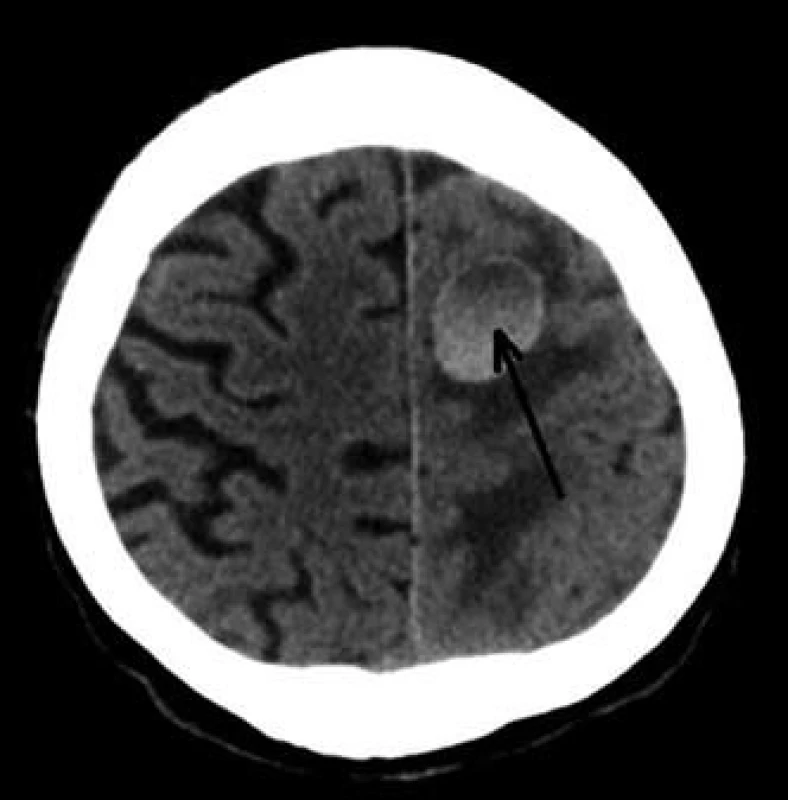
Diskuze
Metastatické postižení zažívací trubice je velice vzácné. Zdaleka nejčastěji je popisováno u maligního melanomu. Ložiska se mohou vyskytovat v průběhu celé zažívací trubice, nejčastěji je postiženo tenké střevo – v 60–70 % [2,3]. Méně často pak tračník, žaludek a duodenum, metastatické postižení rekta a jícnu se vyskytuje pouze ve 4–5 % [4,5]. Četnost ložisek je rovnoměrně rozdělena mezi jejunum a ileum [6]. Jsou popisovány melanotické či amelanotické noduly a polypoidní útvary s centrální vkleslinou, často exulcerované [7]. U stejného pacienta se mohou současně vyskytovat ložiska melanotická i amelanotická [8].
Metastázy maligního melanomu do trávicí trubice se mohou projevit bolestmi břicha, akutním krvácením do zažívacího traktu [9], chronickou anemizací, intususcepcí, ileózním stavem či perforací. V 50 % jsou zjištěny u pacientů s již známými metastázami v jiných orgánech [10], v naprosté většině se jedná o pozdní stadium onemocnění [11]. V našem případě byla anemizace způsobená exulcerovanými melanomovými polypy prvním projevem generalizace maligního melanomu po čtyřletém asymptomatickém průběhu. Za života je metastatické postižení zažívací trubice diagnostikováno u 10 % nemocných s generalizovaným procesem, nekropticky je však přítomno v 60 % [2,3].
U metastazujícího melanomu se solitární metastázou, či s omezeným počtem metastatických ložisek je možno zvolit jako terapii první volby chirurgickou metastazektomii následovanou systémovou terapií. Chirurgické řešení je výhodné i v případě reziduálního onemocnění po úspěšné farmakologické léčbě [14].
Konvenční cytotoxická terapie dacarbazinem (5-[3,3-dimethyl-1-triazenyl]-imidazole-4-carboxamide) a jeho analogem temozolomidem byla před uvedením imunoterapie a biologické léčby jedinou nechirurgickou systémovou léčebnou alternativou. V monoterapii byla léčebná odpověď zaznamenána u 10 % pacientů s mediánem terapeutického efektu v rozmezí 4–8 měsíců, bez výraznějšího vlivu na celkovou dobu přežití [15,16]. Další léčebnou modalitou je imunoterapie. Léčbou vysokými dávkami interleukinu 2 lze dosáhnout terapeutické odpovědi až u 16 % pacientů, kompletní remise bylo dosaženo až u 5 % léčených [17]. Ještě o něco lepší terapeutický efekt byl prokázán kombinací interferonu alfa s dacarbazinem, kde léčebná odpověď dosahovala 24 %. Dlouhodobější mortalita se však signifikantně nesnížila oproti kontrolní skupině pacientů léčených dacarbazinem v monoterapii [18].
Výrazně lepší výsledky přináší biologická léčba založená na inhibici kaskády MAP kinázy (mitogen activated protein kinase), jejíž zvýšená aktivita vede k nadměrné produkci cyklinu D, který potencuje mitogenní aktivitu buňek. Nejčastější je mutace v protoonkogenu BRAF kódující serin-threoninovou kinázu [19]. Tuto mutaci nacházíme u 40–60 % pacientů s generalizovaným melanomem [20,21]. Melanomy s BRAF mutací mají agresivnější chování [22]. Mezi inhibitory BRAF patří vemurafenib a dabrafenib. Při terapii vemurafenibem u BRAF pozitivních pacientů ve srovnání s terapií dacarbazinem bylo výrazně prodlouženo období bez progrese onemocnění (6,9 vs 1,6 měsíce) i celková délka přežítí (13,6 vs 9,7 měsíce) [23]. Hlavním nežádoucím účinkem terapie vemurafenibem je vznik spinocelulárního karcinomu kůže a keratoacantomu (6–12 % léčených pacientů). Tato komplikace je řešena opakovanými excizemi bez nutnosti přerušení léčby [24].
Table 1. TNM klasifikace melanomu [24]. Tab. 1. TNM staging of melanoma [24]. ![TNM klasifikace melanomu [24].
Tab. 1. TNM staging of melanoma [24].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/19e6467d2683cfd147ea0266ec8f7bdf.png)
Table 2. Stadia melanomu [24]. Tab. 2. Classification of melanoma [24]. ![Stadia melanomu [24].
Tab. 2. Classification of melanoma [24].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3d6145df5c5b0160852facdeecdaf424.png)
Závěr
Maligní melanom je nejčastějším zdrojem metastáz zažívací trubice s predominancí tenkého střeva. Metastatické postižení může vzniknou řadu let po excizi primárního ložiska. Při gastrointestinálních symptomech, anemizaci či akutním krvácení do zažívacího traktu u pacientů s anamnézou maligního melanomu je třeba na tuto možnost myslet.
Prognóza pacientů s generalizovaným melanomem je velmi závažná, terapeutický efekt má zejména biologická terapie v kombinaci s chirurgickou léčbou.
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00064203 (FN MOTOL).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 25. 3. 2013
Přijato: 9. 4. 2013
MUDr. Štěpán Hlava
Interní klinika – gastroenterologie FN v Motole
V Úvalu 84, 150 06 Praha 5
stepan.hlava@fnmotol.cz
Sources
1. Incidence a mortalita – vývoj v čase C 43 zhoubný melanom kůže 1977–2010. Národní onkologický registr [online] [cit. 2013-08-01]. Dostupné z: http://www.svod.cz/analyse.php?modul=incmor#.
2. Blecker D, Abraham S, Furth EE et al. Melanoma in the gastrointestinal tract. Am J Gastroenterol 1999; 94(12): 3427–3433.
3. Das Gupta TK, Richard D, Brasfield. Metastatic Melanoma of the Gastrointestinal Tract Arch Surg 1964; 88(6): 969–973.
4. Reintgen DS, Thompson W, Garbutt J et al. Radiologic, endoscopic, and surgical considerations of melanoma metastatic to the gastrointestinal tract. Surgery 1984; 95(6): 635–639.
5. Schuchter LM, Green R, Fraker D. Primary and metastatic diseases in malignant melanoma of the gastrointestinal tract. Curr Opin Oncol 2000; 12(2): 181–185.
6. Bender GN, Maglinte DD, McLarney JH et al. Malignant melanoma: patterns of metastasis to the small bowel, reliability of imaging studies, and clinical relevance. Am J Gastroenterol 2001; 96(8): 2392–2400.
7. Kadakia SC, Parker A, Canales L. Metastatic tumors to the upper gastrointestinal tract: Endoscopic experience. Am J Gastroenterol 1992; 87(10): 1418–1423.
8. Prakoso E, Selby WS. Capsule endoscopy in patients with malignant melanoma. Am J Gastroenterol 2007; 102(6): 1204–1208.
9. Goláňová J, Hrdlička L., Šťovíček J et al. Akutní krvácení z horní části gastointestinálního traktu – přehled urgentních endoskopií horní části trávicího traktu na našem pracovišti. Vnitř Lék 2004; 50 : 274–277.
10. Caputy GG, Donohue JH, Goellner JR et al. Metastatic melanoma of the gastrointestinal tract. Results of surgical management. Arch Surg 1991; 126(11): 1353–1358.
11. Tsao H, Atkins MB. Management of Cutaneous Melanoma. N Engl J Med 2004; 351(10): 998–1012.
12. Krige JE, Nel PN, Hudson DA. Surgical treatment of metastatic melanoma of the small bowel. Am Surg 1996; 62(8): 658–663.
13. Ihde J, Coit D. Melanoma metastatic to stomach, small bowel, or colon. Am J Surg 1991; 162(3): 208–211.
14. Ollia DW, Essner R, Wanek LA et al. Surgical resection for melanoma metastatic to the gastrointestinal tract. Arch Surg 1996; 131(9): 957–980.
15. Prosby T, Fish R. Systemic treatments for metastatic cutaneous melanoma. Cochrane Database Syst Rev 2000; (2): CD001215.
16. Champan PB, Einhorn LH, Mezera ML et al. Phase III multicenter randomized trial of Darmouth Regiment Versus Dacarbazepine in patiens with metastatic Melanoma. Clin Oncology 1999; 17(9): 2745–2751.
17. Atkins MB, Kunkel L, Sznol M et al. High dose recombinant interleukin 2 therapy in patiens with metastatic melanoma: long term surfoval update. Cancor Sci Am; 6 (Suppl 1): S11–S14.
18. Kaufmann R, Spieth K, Leiter U et al. Temozolomide in combination with interferon alfa versus temezolomide alone i patiens with advanced metastatic melanom: a randomized, phase III, multicenter study from Dermatologic Cooperative Oncology group. J Clin Oncol 2005; 23(35): 9001.
19. Davies H, Bignell GR, Cox C et al. Mutations of BRAF gene in human cancor; Nature 2002; 417(6892): 949–954.
20. Wellbrock C, Hurlstone A. BRAF as therapeutic target in melanoma. Biochem Pharmacol 2010; 80(5): 561–567.
21. Long GV, Menzies AM, Nagrial M et al. Prognostic and clinicopatholigic associations of oncogenic BRAF in metastatic melanoma. J Clin Oncol 2011; 29(10): 1239–1246.
22. Champan PB, Hauschild A, Robert C et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med 2011; 364(26): 2507–2516.
23. Anforth R, Fernandez-Penas P, Long GV. Cutaneous toxicity of RAF inhibitors. Lancet Oncol 2013; 14(1): e11–e18.
24. Balch CM, Gerschenwald JE, Soong SJ et al. Final Version of 2009 AJCC Melanoma Staging and Classificacion. J Clin Oncol 2009; 27(36): 6199–6206.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2013 Issue 2-
All articles in this issue
- Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV) – aktualizace
- Danišův jícnový stent v terapii varikózního krvácení
- Co nového v hepatologii?
- Doporučení České gastroenterologické společnosti pro podávání antiagregační terapie kyselinou acetylsalicylovou
- Cholangiopankreatoskopie pomocí SpyGlassTM direct visualization system: seznámení s metodou a první vlastní zkušenosti
- Multifokální hepatocelulární karcinom imitující jaterní cirhózu
- Chirurgická léčba metastáz hepatocelulárního karcinomu do nadledvin
- Kolonoskopie ve vodní imerzi s „capem“ – prospektivní, randomizovaná studie
- Metastatické postižení tenkého střeva jako první projev generalizace kožního melanomu
- Endoskopická léčba Zenkerova divertiklu
- Doporučené postupy Evropské společnosti pro gastrointestinální endoskopii (ESGE): profylaxe pankreatitidy po provedené ERCP
- Invazivní léčba chronické pankreatitidy je indikována pro bolesti, podezření na malignitu, biliární obstrukci, leak a cystoid
- Zdravotní stav a karcinom pankreatu
- 3rd Prague Endoscopy Workshop (and 14th Endoscopy Workshop in IKEM)
- Životní jubileum prof. MUDr. Marie Brodanové, DrSc.
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Mozkový natriuretický peptid je markerem horší prognózy při dekompenzaci jaterní cirhózy
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Danišův jícnový stent v terapii varikózního krvácení
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Cholangiopankreatoskopie pomocí SpyGlassTM direct visualization system: seznámení s metodou a první vlastní zkušenosti
- Multifokální hepatocelulární karcinom imitující jaterní cirhózu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

