-
Medical journals
- Career
Danišův jícnový stent v terapii varikózního krvácení
: T. Fejfar 1; V. Šafka 2; V. Jirkovský 1; P. Hůlek 1
: II. interní gastroenterologická klinika FN Hradec Králové 1; Ústav fyziologie, LF UK v Hradci Králové 2
: Gastroent Hepatol 2013; 67(2): 98-103
: Hepatology: Review article
Krvácení z jícnových varixů je stále závažnou a život ohrožující komplikací symptomatické portální hypertenze. Ani současná léčba volumexpanzí, adekvátní hemosubstitucí, podáním vazoaktivní léčby a širokospektrých antibiotik spolu s adekvátní endoskopickou léčbou nevede ve 100 % k zástavě krvácení. Hrozí i časná recidiva. Jako záchranná léčba je dnes možné krátkodobé zavedení balonkové sondy nebo vytvoření portosystémové spojky. V posledních deseti letech se objevuje stále více dokladů o možnosti zástavy refrakterního krvácení pomocí speciálního samoexpandibilního potahovaného metalického jícnového stentu jako alternativy balonkové sondy nebo v případech kontraindikací vytvoření portosystémové spojky.
Klíčová slova:
portální hypertenze – varikózní krvácení – terapie – stent
Portální hypertenze je definována jako vzestup portosystémového gradientu (PSG) nad 5 mmHg a v mnoha zemích je nejčastěji spojena s jaterní cirhózou (85–90 %). Méně častou příčinou je prehepatální portální hypertenze při okluzi portální žíly nebo hypertenze posthepatální nejčastěji se vyskytující při Buddově Chiariho syndromu. Portální hypertenze je asociována s celým souborem možných klinicky významných komplikací, které se objevují převážně při vzestupu PSG nad 10–12 mmHg. Nejčastější komplikací je krvácení při portální hypertenzi, tvorba ascitu, cirhotického hydrotoraxu a systémové oběhově změny ve formě hepatorenálního a hepatopulmonálního syndromu, portopulmonální hypertenze a cirhotické kardiomyopatie.
Varikózní krvácení (obr. 1) je přitom nejčastější smrtící komplikací portální hypertenze a současně třetí nejčastější příčinou krvácení do horní části zažívací trubice. V populaci nemocných s jaterní cirhózou je roční riziko varikózního krvácení kolem 4 %. U nemocných s již endoskopicky diagnostikovanými významnými varixy (F2–3) však přesahuje 10–15 % a stoupá s pokročilostí jaterního onemocnění a přítomností varovných známek na varixech (60–75 %) [1]. I při intenzivní terapii má první ataka krvácení stále vysokou letalitu (15–20 %), přičemž dvě třetiny nemocných, kteří v důsledku krvácení zemřou, zemře v prvních 24 hodinách. Navíc je spojena s vysokým rizikem recidivy krvácení, zejména v prvních pěti dnech [2]. Nejčastějším zdrojem krvácení bývají varixy v oblasti jícnu a žaludku, méně často varixy ektopické nebo portální hypertenzní gastropatie, která bývá spíše zdrojem chronických krevních ztrát. Za léčebnou metodu volby akutního varikózního krvácení v oblasti jícnu se dnes spolu s farmakoterapií vazoaktivní látkou snižující splanchnickou perfuzi (terlipresin, somatostatin, octreotid) považuje endoskopické ošetření pomocí ligačních kroužků nebo sklerotizací (1–3% polidokanol – Aethoxysklerol®). U žaludečních varixů kromě gastroezofageálních varixů (GOV) prvního typu, kdy můžeme volit mezi ligací a tkáňovým lepidlem, je za metodu volby považováno použití okluze krvácejícího varixu syntetickým či přirozeným tkáňovým lepidlem. Nejlépe je zdokumentovaný efekt při užití syntetického N-butyl-2-cyanoacrylátu (Histoacryl®). V případě selhání kombinované léčby a stejně tak při opakované časné recidivě po již druhém endoskopickém ošetření je u nemocných s jícnovými varixy indikováno vytvoření portosystémové spojky, nejlépe transjugulární intrahepatální portosystémové („TIPS“) s využitím potahovaného stentu (expandovaným polytetrafluoroetylénem – ePTFE) [2–4]. TIPS jako záchranná léčba v současnosti těžko hledá alternativu. Okamžité zástavy krvácení je dle dostupných dat dosahováno v 91–100 % [5,6]. Recidiva krvácení v prvních 30 dnech je popisována v 7–30 % případů a v naprosté většině případů je spojena s řešitelnou stenózou nebo okluzí zkratu. Ještě větší význam má TIPS u nemocných s krvácením ze žaludečních a ektopických varixů a u nemocných s významným krvácením z portální hypertenzní gastropatie, kde je vhodné tuto léčbu zvážit již po první atace krvácení. U nemocných s malou pokročilostí jaterního onemocnění ve funkční třídě A a B dle Child-Pugh klasifikace lze dle mezinárodních doporučení zvažovat i vytvoření portosystémové spojky chirurgicky [2].
1. Akutní krvácení z varixu jícnu (nemocný s jaterní cirhózou). Fig. 1. Acute bleeding from oesophageal varix (patient with liver cirrhosis). 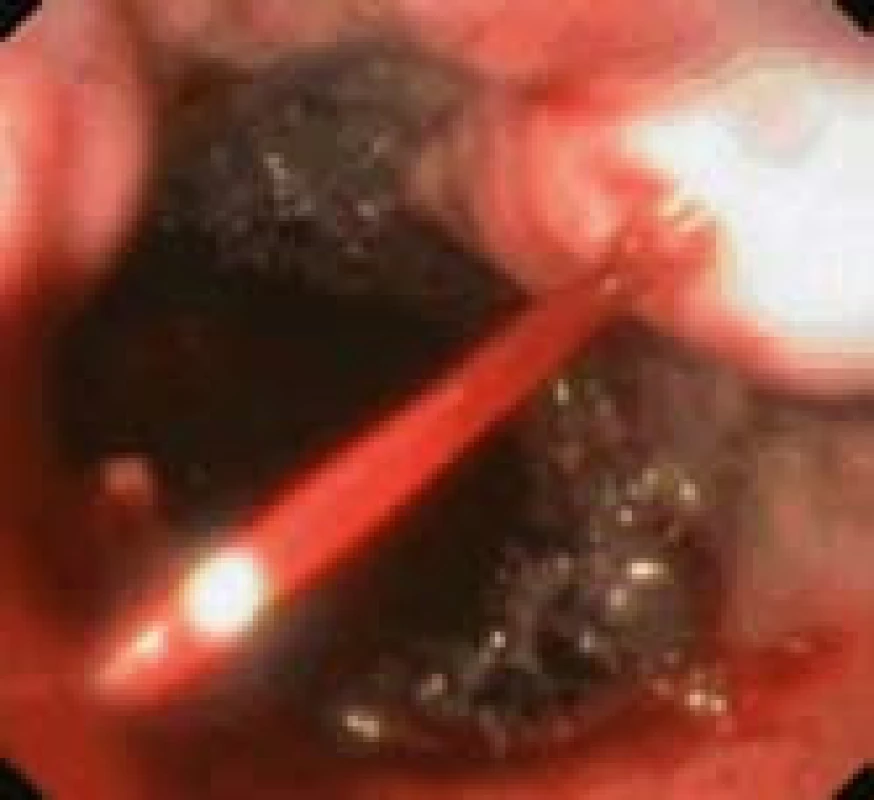
I TIPS má však své kontraindikace. Mezi hlavní kontraindikace patří závažná plicní hypertenze (střední tlak v plicnici > 45 mmHg), závažné manifestní srdeční selhávání a nekontrolovatelná systémová infekce nebo sepse. Další limitací je i pokročilost vlastního jaterního onemocnění a u nemocných s MELD nad 18 a Child-Pugh skóre nad 12 musíme bedlivě zvažovat přínos pro nemocného [5,7]. Roli samozřejmě hraje i časová a regionální dostupnost TIPS jako záchranné léčby.
Balonková sonda (Sengstaken Blakemorova)
V případě dočasného zajištění, nedostupnosti TIPS nebo jeho kontraindikaci bylo dosud jedinou možností zavedení balonkové sondy (Sengstakenova Blakemorova). Poprvé bylo její použití popsáno autory v roce 1950 [8]. Tato sonda je v různých modifikacích používána více než 60 let. Zástavy krvácení je dosahováno téměř v 80 %, ale po uvolnění je recidiva krvácení popisována ve více než 50 % [9,10]. Její zavedení s insuflací je navíc možné jen na dobu 24 hod a je zatíženo poměrně velkým rizikem komplikací. Často se též zapomíná na nutnost plnit balonky vzduchem a zajistit monitorování dostatečného tlaku v jícnovém balonku. Po dobu zavedení balonkové sondy je k prevenci aspirace často vhodné nemocného intubovat. Kromě aspirace (10–20 %) hrozí i řada lokálních komplikací ve formě otlakových ulcerací nebo při neadekvátní manipulaci i lacerace, tlaková nekróza nebo perforace jícnu. Jsou popisovány i případy asfyxie při proximální migraci sondy a kompresi dýchacích cest [11]. V případě netlumeného nemocného je zavedení sondy spojeno i s jeho značným nepohodlím.
Potahovaný metalický samoexpandibilní jícnový stent
Metalické samoexpandibilní stenty (SEMS) jsou již dlouhou dobu užívány v terapii maligních stenóz jícnu, leaků a perforací jícnu nebo tracheoezofageálních píštělí.
V současné době se objevuje stále více dat o využití potahovaného jícnového stentu i při zástavě refrakterního krvácení z jícnových varixů. Použití pro tuto indikaci speciálně designovaného potahovaného metalického jícnového stentu lze nyní zvažovat i v této specifické indikaci [2,12].
Otcem myšlenky použít potahovaný jícnový stent k zástavě krvácení z jícnových varixů byl rodák ze slovenského Lučence, doc. Ján Daniš, pracující dlouhodobě v Rakousku. Myšlenka využití expanzní síly samoexpandibilního stentu ke kompresi krvácejícího varixu a zástavě krvácení vznikla na přelomu tisíciletí a poprvé byl Danišem stent v této indikaci zaveden v roce 2002. Pracovním týmem v rakouském Linci byla tato myšlenka dále rozvíjena. Po období testování na zvířecích modelech byly ještě v rámci klinického zkoušení první dedikované stenty používány od roku 2003 a první novátorská publikace R. Hubmanna [13] na toto téma vyšla v roce 2006. V této práci je již jasně popsána metodika výkonu za použití speciálního stentu a zavaděče a na 20 nemocných dokumentována vysoká úspěšnost zástavy refrakterního varikózního krvácení při minimálních komplikacích. Rakouský tým pokračoval ve své práci a v roce 2008 publikoval v prospektivní studii [14] rozšířené výsledky, kdy u 34 nemocných byl již použit speciálně upravený samoexpandibilní potahovaný metalický jícnový stent (SX Ella stent Danis®) (obr. 2), který je s mírnými úpravami používán dosud. Opět byla popsána 100% zástava krvácení s minimálními komplikacemi ve smyslu nevýznamných otlakových ulcerací v jícnu.
2. Potahovaný jícnový stent – (SX Ella stent Danis<sup>®</sup>). Fig. 2. Coated oesophageal stent – (SX Ella stent Danis<sup>®</sup>). 
V roce 2010 byla publikována práce anglických autorů [15], kteří referovali o použití tohoto stentu u deseti nemocných s refrakterním varikózním krvácením. V této práci bylo zaznamenáno technické selhání zaváděcího mechanizmu, kdy při prvním zavedení praskl fixační balon a musel být použit druhý stent. Taktéž bylo zdůrazněno, že není možné očekávat žádný efekt komprese v oblasti jícnu na žaludeční varixy a pokračující krvácení u dvou nemocných v této skupině bylo spojeno se zprvu nerozpoznaným krvácením právě ze žaludečních varixů. V ostatních případech bylo opět zástavy krvácení dosaženo ihned. Vysoká úmrtnost v tomto souboru je, i dle mínění autorů, dána výraznou pokročilostí jaterního onemocnění a těžkým stavem nemocných referovaných z jiných pracovišť do vyššího centra.
Po zvládnutí ataky krvácení a stabilizaci nemocného je možné stent snadno extrahovat. V obou publikacích bylo rozmezí od zavedení po extrakci 5 (2–14) a 9 dnů. V tomto období pak kromě již zmíněných nevýznamných otlakových ulcerací při distálním nebo proximálním okraji stentu nebyly zaznamenány žádné závažnější komplikace a extrakce stentu byla snadno proveditelná pomocí speciálního extraktoru. Extrakce nebyla spojena s recidivou krvácení u žádného z nemocných.
Poslední práce s podobnými výsledky při použití stentu u osmi nemocných pochází z německého centra v Essenu [15] (souhrn prací viz. tab. 1).
1. Souhrn publikovaných prospektivních studií. Tab. 1. Set of published prospective studies. 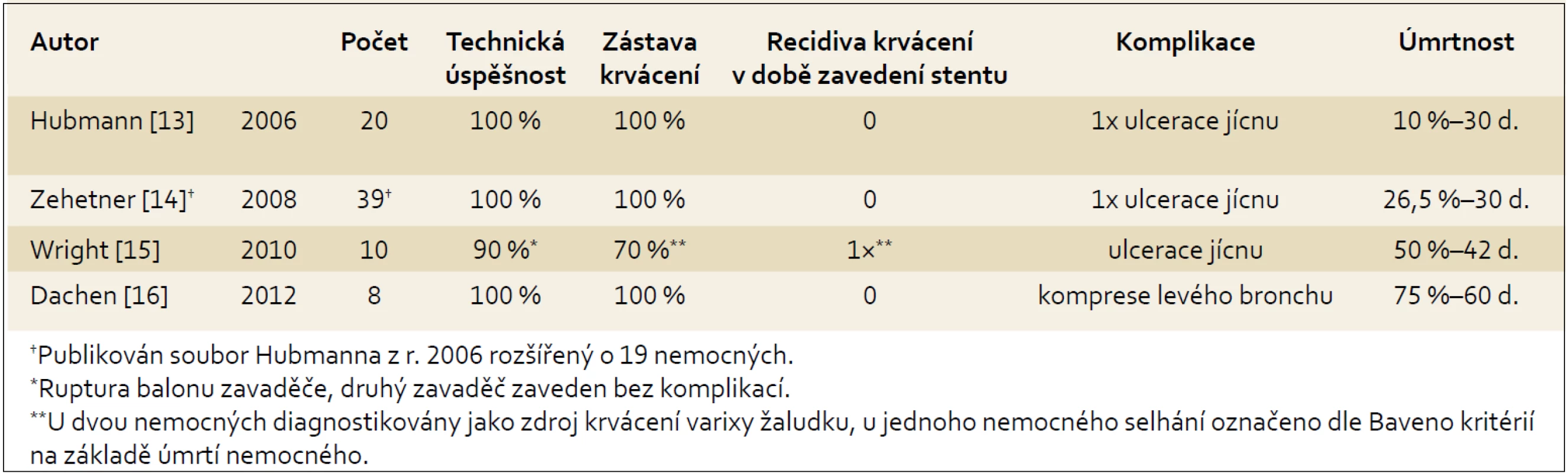
Všichni autoři se shodují na výrazném zlepšení komfortu pro nemocné, kdy je možno prakticky ihned po zavedení obnovit alespoň částečný perorální příjem a nemocný není zatížen jako v případě zavedení jícnové sondy často nutnou orotracheální intubací v rámci prevence aspirace.
Nejčastější komplikací spojenou se zavedením stentu se ukázalo riziko jeho spontánní migrace. V práci Zehetnera byla popsána u 20 % nemocných, ale u žádného z nich nebyla spojena s recidivou krvácení. V pozdějších publikacích již tato komplikace popisována nebyla, pravděpodobně v důsledku částečné úpravy designu stentu. Kazuisticky byla v literatuře popsaná parciální obstrukce dýchacích cest přeneseným tlakem rozvinutého stentu [16,17] ihned řešitelná jeho extrakcí. Z dosud známých údajů je tedy použití této metody spojeno s malým množstvím spíše nezávažných komplikací.
Z publikovaných údajů lze zavedení tohoto typu jícnového stentu zvažovat i u některých komplikací předchozí endoskopické terapie, jako je krvácení z ulcerací po předchozí ligaci/skleroterapii [18], při laceraci jícnu po předchozím zavedení Sengstakenovy Blakemorovy sondy [15,19] nebo traumatickém poranění jícnu u nemocných se současnou portální hypertenzí [20].
Na základě dosud publikovaných povzbudivých údajů byla tato metoda v roce 2010 na konsenzuálním workshopu v italském Bavenu [2,4] již uvedena v doporučeních jako možná alternativa léčby v případě refrakterního varikózního jícnového krvácení (evidence 4; C). V porovnání s balonkovou sondou přináší delší období zajištění nemocného a překlenutí období s vysokým rizikem recidivy krvácení s možností zahájení následné adekvátní sekundární profylaxe. U nemocných s vyšší pokročilostí jaterního onemocnění ve vysokém riziku recidivy umožňuje i delší dobu restituce jaterních funkcí po proběhlém krvácení a v některých případech umožňuje již následnou léčbu pomoci TIPS [14–16].
Technika zavedení stentu
K zástavě krvácení z jícnového varixu dochází přímým expanzním tlakem potahovaného stentu na stěnu varixu. Metalický potahovaný stent rozměru 135 × 25 mm je připraven k použití ve speciálně připraveném zavaděči. Zavaděč (obr. 3) je na distálním konci vybaven balonkem (obr. 6), který stejně jako u Sengstakenovy Blakemorovy sondy slouží v průběhu zavádění stentu k fixaci zavaděče v žaludeční kardii, a tím umožňuje cílené umístění stentu v oblasti distálního jícnu i bez rentgenové kontroly. Dle výrobce i zkušeností z terénu je možné stent zavést již v přednemocniční péči bez endoskopické podpory. Ve většině případů však endoskopické vyšetření zavedení stentu předchází a je i jasným přístupem k vyloučení jiného, i nevarikózního zdroje krvácení. V případě verifikace zdroje krvácení v oblasti jícnových varixů v distálním jícnu je následné zavedení stentu technicky snadno proveditelné a nevyžaduje další přístrojové vybavení. Endoskopicky je pod kontrolou zraku zaveden vodič do oblasti žaludečního antra. Současně je změřena vzdálenost od řezáků po gastroezofageální junkci, kterou pak lze pomocí zarážky pro kontrolu nastavit na zavaděči. Po vodiči i bez skiaskopické kontroly je distální konec zavaděče se stentem snadno zaveden do oblasti žaludečního těla, to znamená asi 5–10 cm pod gastroezofageální junkci. Po odstranění první, modré zarážky je stent posunut do první polohy (obr. 4) umožňující insuflaci balonku zaváděcího systému vzduchem (obr. 5,6). Zavaděč je navíc vybaven ochrannou tlakovou chlopní, která nám při insuflaci balonu v neadekvátní pozici indikuje nadměrný tlak v systému (obr. 7,8). Po insuflaci na 100–120 ml je možná následná fixace systému ve správné pozici v kardii a za mírného zpětného tahu dále již standardní rozevření potahovaného stentu v distálním jícnu. Endoskopická kontrola polohy proximální a distálního konce stentu je dostatečná (obr. 9,10) a opět nevyžaduje rentgenovou asistenci. Bezprostředně po zavedení je nutná prevence aspirace, jelikož stent není vybaven antirefluxní chlopní. Po zavedení je doporučována v odstupu 24 hod RTG kontrola polohy stentu.
3. Stent připravený k zavedení v zavaděči (připravená stříkačka k insuflaci balonku). Fig. 3. Stent prepared for application in an applicator (prepared syringe for balloon insufflation). 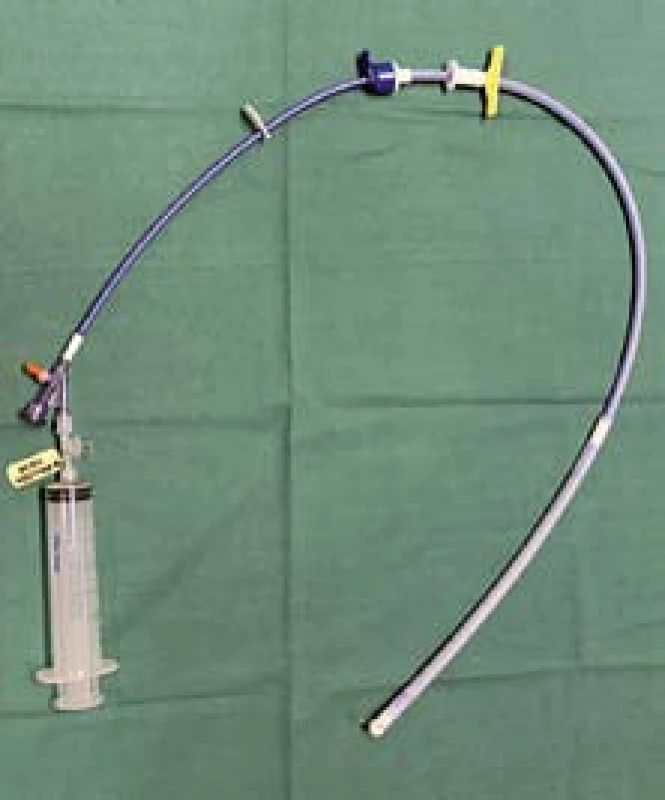
4. Odjištění první zarážky na zavaděči stentu a rozevření stentu v první poloze umožňující insuflaci balonku a fixaci stentu. Fig. 4. Unlocking the first stop in the stent applicator and opening stent in the first position, enabling balloon insufflation and stent fixation. 
5. Distální konec zavaděče v první poloze po rozevření před insuflací balonku. Fig. 5. Distal end of the applicator in the first position for opening before the balloon insufflation. 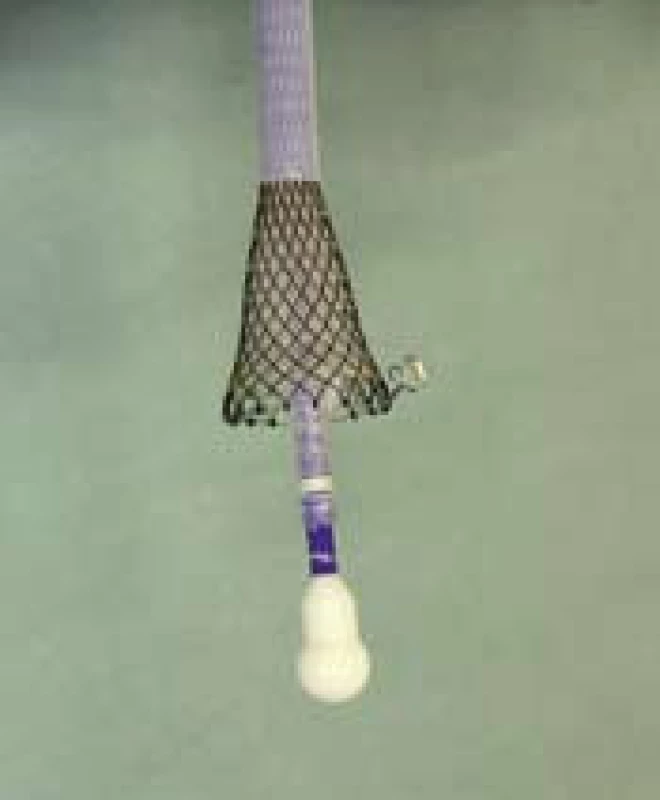
6. Distální konec zavaděče v první poloze po rozevření s insuflovaným balonkem umožňující fixaci v kardii. Fig. 6. Distal end of the applicator in the first position after opening with an insufflated balloon, enabling fixation in cardia. 
7. Proximální konec zavaděče připravený k insuflaci. Oranžová tlaková chlopeň na zavaděči v normální pozici. Fig. 7. Proximal end of the applicator prepared for insufflation. Orange pressure valve in the applicator in the normal position. 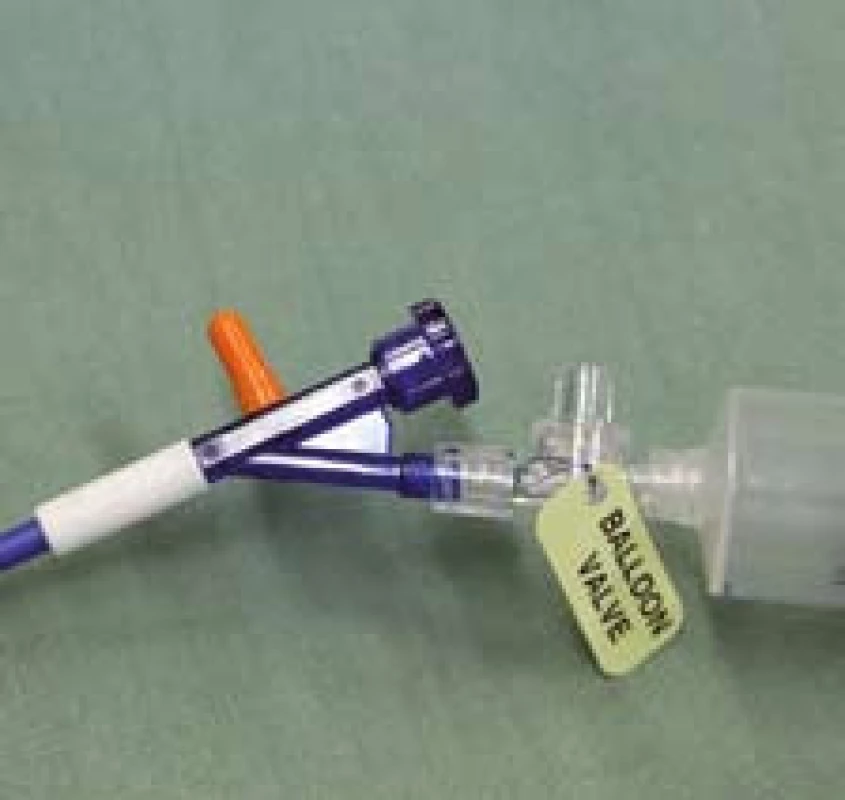
8. Oranžová tlaková chlopeň na zavaděči signalizující abnormální tlak v systému (špatná poloha balonku). Fig. 8. Orange pressure valve in the applicator signalling abnormal pressure in the system (bad position of the balloon). 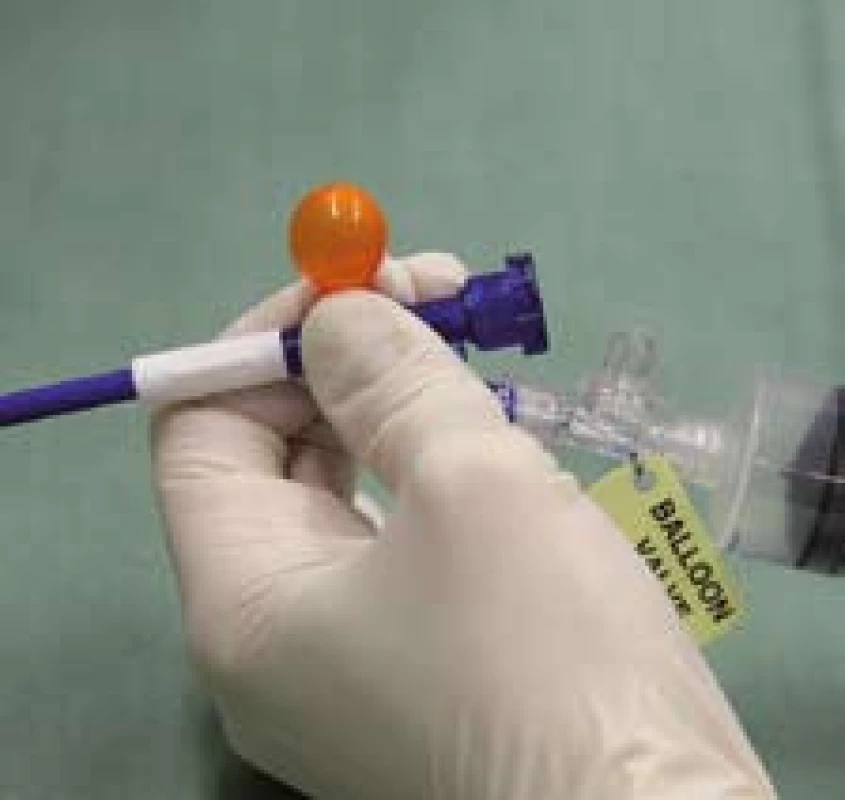
9. Proximální konec stentu po zavedení do jícnu (endoskopický obraz). Fig. 9. Proximal end of the stent after application into oesophagus (endoscopic picture). 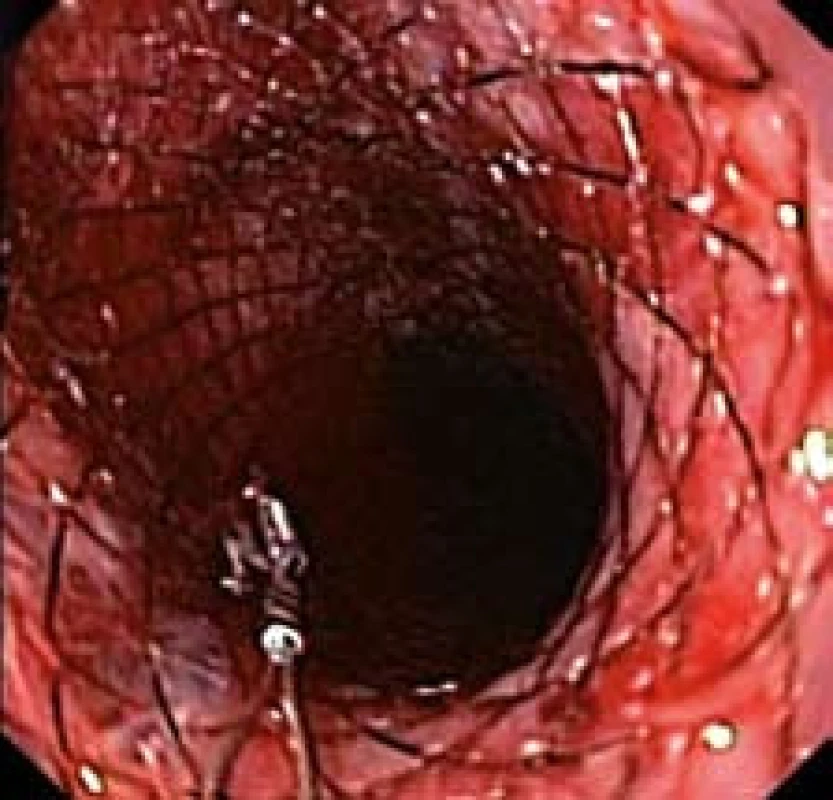
10. Distální konec stentu po zavedení přesahující kardii (endoskopický obraz). Fig. 10. Distal end of the stent after application overlapping cardia (endoscopic image). 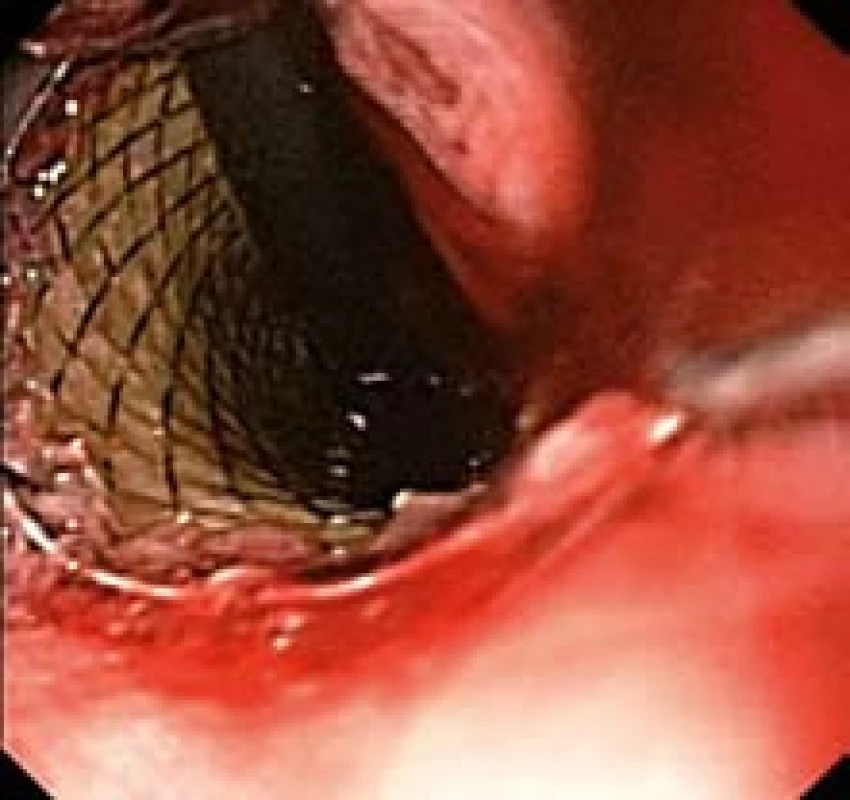
Endoskopická extrakce je po stabilizaci nemocného prováděna lépe za skiaskopické kontroly pomocí speciálního extraktoru (ELLA extraktor®). Extrakce je možná i bez RTG asistence, ale naším pracovištěm i výrobcem je doporučována. Po zachycení proximálního vývazového lanka stentu extrakčním háčkem pod kontrolou zraku (obr. 11,12) je stent zasouváním převlečné trubice extraktoru postupně odlučován od stěny jícnu a zavinován do extraktoru (obr. 13). Tento unikátní mechanizmus umožňuje jeho postupné odloučení od sliznice a zavinutí do extraktoru a teprve následné vytažení s minimálním rizikem traumatizace stěny jícnu při jeho odstraňování.
11. Stent s očkem vývazového lanka pro extrakci zachyceným do extraktoru (endoskopický obraz). Fig. 11. Stent with a loop of an unbinding cable for extraction, attached to the extractor (endoscopic image). 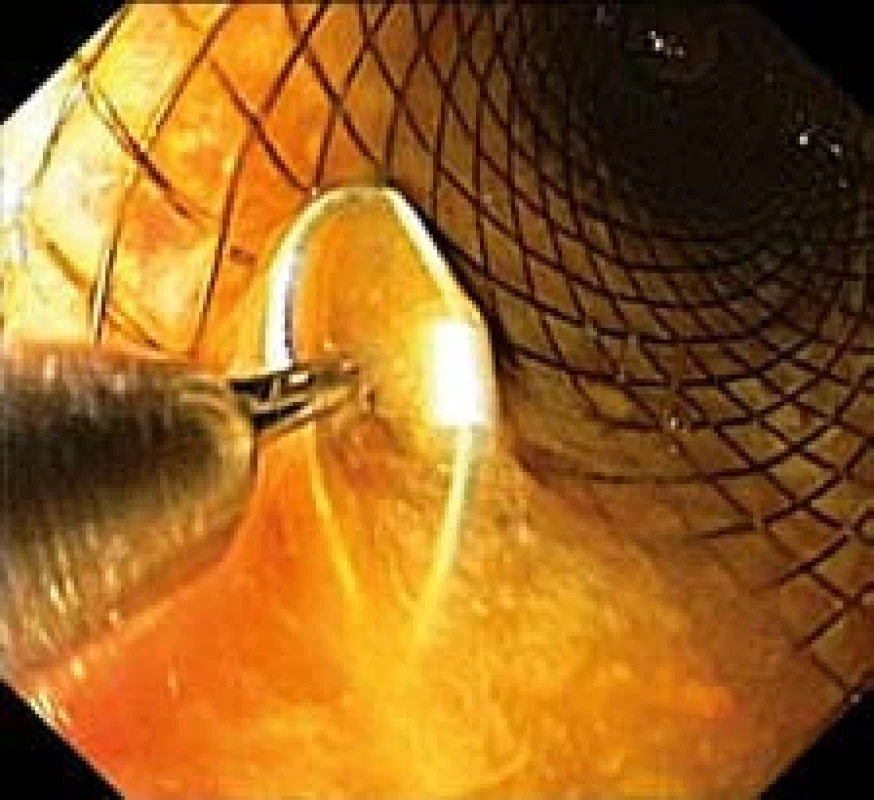
12. Stent s očkem vývazového lanka pro extrakci zachyceným do extraktoru. Fig. 12. Stent with a loop of an unbinding cable for extraction, attached to the extractor. 
13. Zavinování stentu do extraktoru. Fig. 13. Binding a stent to the extractor. 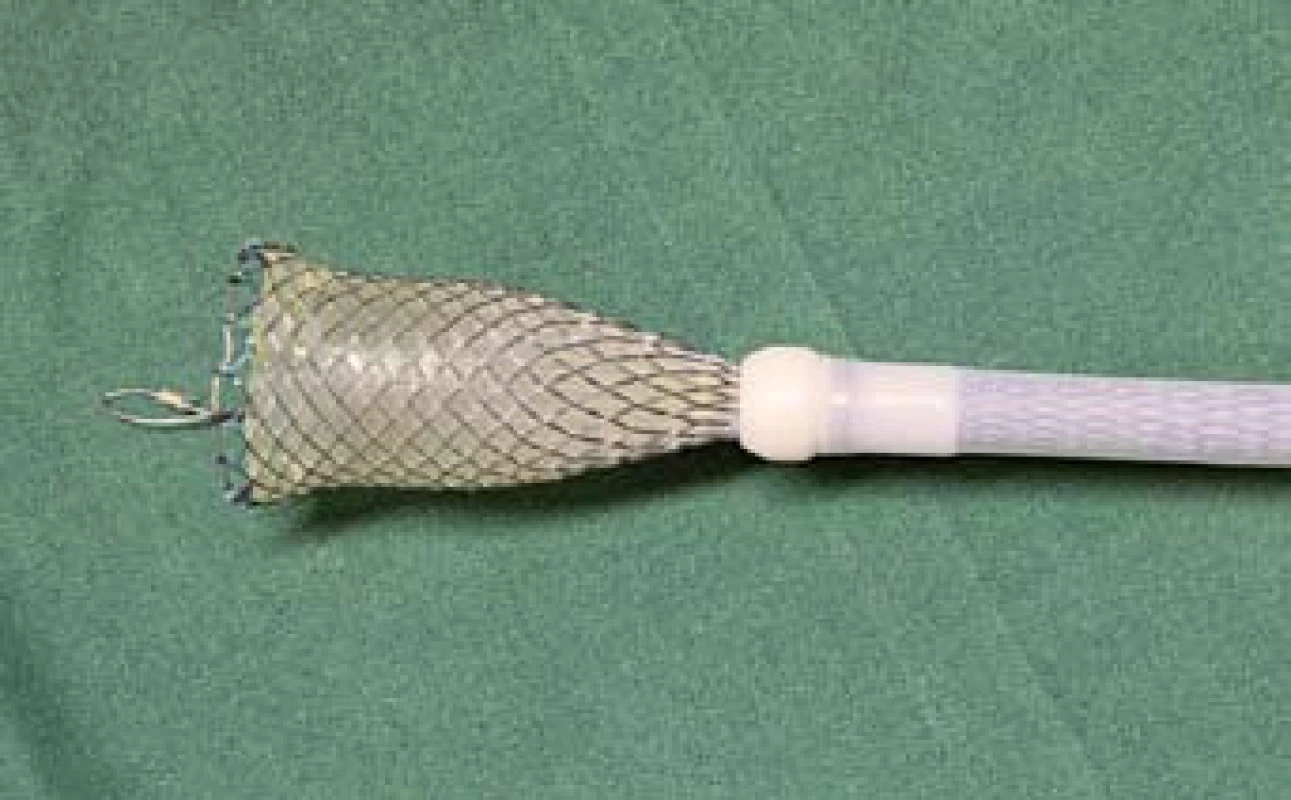
Budoucnost léčby pomocí stentu
V budoucích letech by na základě probíhajících studií mohlo dojít k rozšíření indikací i na primární zástavu krvácení. Po technické stránce bude asi řešen problém migrací a pravděpodobně vzniknou i nové rozměry stentů v závislosti na potřebách klinické praxe. Objevují se i data o využití biodegradabilního materiálu, který by umožnil pouze jeden endoskopický výkon v úvodu a následně jen případné dokončení eradikace varixů po rozpadu stentu. Vzhledem k současným doporučením intenzivnějšího a agresivnějšího přístupu k sekundární prevenci u nemocných s vysokým portosystémovým gradientem (HVPG > 16–20 mm Hg) [2] by zavedení stentu mohlo být i mostem k „časnému TIPS“. Výrazně limitujícím faktorem je též otázka ceny, která se pohybuje na cca trojnásobku ceny multiligátoru.
Úkolem současnosti je ověřit výše uvedená data na větších kohortách nemocných. Tato metoda zatím není doporučena k primární zástavě varikózního krvácení. Snahou dalších prospektivních studií proto bude nejen porovnat efektivitu zástavy krvácení pomocí stentu v porovnání s balonkovou sondou, ale i se současnou standardní endoskopickou léčbou.
Právě porovnání efektivity Danišova stentu se standardní endoskopickou léčbou má za cíl i zahajovaná multicentrická randomizovaná studie organizovaná Farmaceutickou fakultou UK v Hradci Králové v rámci projektu dotovaného ESF v rámci operačního programu Vzdělávání pro konkurenceschopnost č. CZ.1.07/2.3.00/20.0054 „Hepin II“ na deseti endoskopických pracovištích v ČR a dalších pracovištích v okolních zemích, především na Slovensku a v Litvě. V randomizované studii navržené ve spolupráci s prof. A. K. Burroughsem z londýnského Sheila Sherlock Liver Center v Londýnské univerzitní nemocnici Royal Free Hampstead je cílem porovnat účinnost Danišova stentu s endoskopickou ligací jak v sekundární, tak i primární léčbě varikózního krvácení. První výsledky této studie by měly být k dispozici v druhé polovině roku 2014.
Závěr
Na základě dostupných informací je u nemocných s refrakterním krvácením z jícnových varixů jako alternativy s vysokou mírou úspěšnosti možné použití potahovaného samoexpandibilního metalického jícnového stentu (SX Ella stent Danis®). Použití potahovaného stentu jistě není léčbou definitivní, ale na rozdíl od balonkové sondy vytváří větší časový prostor pro zahájení adekvátní sekundární prevence. Ověření těchto údajů a případné rozšíření indikací je ale nutné v dalších prospektivních randomizovaných studiích.
Podpořeno projektem MZ koncepčního rozvoje výzkumné organizace 00179906.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 10. 3. 2013
Přijato: 24. 3. 2013
MUDr.Tomáš Fejfar, Ph.D.
II. interní gastroenterologická klinika FN Hradec Králové
Sokolská 581, 500 05 Hradec Králové
tomas.fejfar@fnhk.cz
Sources
1. North Italian Endoscopic Club for Study and Treatment of Esophageal Varices. Prediction of the first variceal haemorrhage in patiens with cirrhosis of the liver and esophageal varices. A prospective multicentre study. N Engl J Med 1988; 319(15): 983–989.
2. De Franchis R et al. Portal Hypertension V: Proceedings of the Fifth Baveno International Consensus Workshop. London: Wiley-Blackwell press 2011.
3.Working group for portal hypertension at the Czech Society of Hepatology, Czech Medical Association of J. E. Purkyně, Bruha R et al. Guidelines on the diagnosis and treatment of bleeding into the digestive tract caused by portal hypertension. Gastroent Hepatol 2001; 65(3): 141–142.
4. de Franchis R, Baveno V Faculty. Revising connsensus in portal hypertension: Report of the Baveno V consensus workshop on metodology of diagnosis and therapy in portal hypertension. J Hepatol 2010; 53(4): 762–768.
5. Boyer TD, Haskal ZJ, American Association for the Study of Liver Diseases. The Role of Transjugular Intrahepatic Portosystemic Shunt (TIPS) in the Management of Portal Hypertension: update 2009. Hepatology 2010; 51(1): 306.1-16.
6. Hulek P, Krajina A et al. Current Practice of TIPS. Hradec Králové: Olga Štambergová 2001.
7. Krajina A, Hulek P, Fejfar T et al. Quality improvement guidelines for Transjugular Intrahepatic Portosystemic Shunt (TIPS). Cardiovasc Intervent Radiol 2012; 35(6): 1295–1300.
8. Sengstaken RW, Blakemore AH. Balloon tamponage for the control of hemorhagie from esophageal varices. Ann Surg 1950; 131(5): 781–789.
9. Bosch J, Berzigotti A, Garcia-Pagan JC et al. The management of portal hypertension: rational basis, available treatments and future options. J Hepatol 2008; 48 (Suppl 1): S68–92.
10. D'Amico G, Pagliaro L, Bosch J. The treatment of portal hypertension: a meta-analytic review. Hepatology 1995; 22(1): 332–354.
11. Collyer TC, Dawson SE, Earl D. Acute upper airway obstruction due to displacement of a Sengstaken-Blakemore tube. Eur J Anaesthesiol 2008; 25(4): 341–342.
12. McDonald JWD, Burroughs AK, Feagan BG et al. Portal hypertensive bleeding In: Evidence-Based Gastroenterology and Hepatology. London: Wiley-Blackwell press 2011 : 579–580.
13. Hubmann R, Bodlaj G, Czompo M et al. The use of self-expanding metal stents to treat acute esophageal variceal bleeding. Endoscopy 2006; 38(9): 896–901.
14. Zehetner J, Shamiyeh A, Wayand W et al. Results of a new method to stop acute bleeding from esophageal varices: implantation of a self-expanding stent. Surg Endosc 2008; 22(10): 2149–2152.
15. Wright G, Lewis H, Hogan B et al. A self-expanding metal stent for complicated variceal hemorrhage: experience at a single center. Gastrointest Endosc 2010; 71(1): 71–78.
16. Dechen A, El Fouly AH, Bechmann LP et al. Acute management of refractory variceal bleeding in liver cirrhosis by self-expanding metal stent. Digestion 2012; 85(3):185–191.
17. Dechene A, Adamzik M, Gerken G et al. Bronchial obstruction following esophageal stent implantation. Endoscopy 2009; 41 (Suppl 2): E146–E147.
18. Mishin I, Ghidirim G, Dolghii A et al. Implantation of self-expanding metal stent in the treatment of severe bleeding from esophageal ulcer after endoscopic band ligation. Dis Esophagus 2010; 23(7): E35–38.
19. Matull WR, Cross TJ, Yu D et al. A removable covered self-expanding metal stent for the management of Sengstaken-Blakemore tubeinduced esophageal tear and variceal hemorrhage. Gastrointest Endosc 2008; 68(4): 767–768.
20. Kaya E, Lenz P, Lebiedz P et al. Placement of covered self-expanding metal stent to treat razor blade-induced esophageal hemorrhage. Endoscopy 2010; 42 (Suppl 2): E201–202.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2013 Issue 2-
All articles in this issue
- Standard diagnostic and therapeutic process of HCV chronic infection – update
- Danis oesophageal stent in treatment of variceal bleeding
- What´s new in hepatology?
- Guidelines for anti-aggregative therapy by acetylsalicylic acid. Czech Society of Gastroenterology Statement
- Cholangiopancreatoscopy using SpyGlassTM direct visualization system: description of the method and initial experience
- Multifocal hepatocellular carcinoma imitating hepatal cirrhosis
- Surgical treatment of adrenal metastases from hepatocellular carcinoma
- Cap-assisted water immersion colonoscopy – a prospective, randomized trial
- Metastatic affection of small intestine as the first symptom of generalization of malignant melanoma
- Endsocopic treatment of Zenker´s diverticulum
- Endoscopic treatment of chronic pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline
- An invasive therapy of chronic pancreatitis is indicated if pain, suspicion on malignancy, biliary tract obstruction, leak and cystoid appeared
- Health status and pancreatic cancer
- 3rd Prague Endoscopy Workshop (and 14th Endoscopy Workshop in IKEM)
- Anniversary of Professor MUDr. Marie Brodanová, DrSc.
- The Mutaflor – Escherichia coli strain Nissle 1917, serotype 06:K5:H1
- Brain natriuretic peptide is a marker of poor prognosis in decompensated liver cirrhosis
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Danis oesophageal stent in treatment of variceal bleeding
- The Mutaflor – Escherichia coli strain Nissle 1917, serotype 06:K5:H1
- Cholangiopancreatoscopy using SpyGlassTM direct visualization system: description of the method and initial experience
- Multifocal hepatocellular carcinoma imitating hepatal cirrhosis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

