-
Medical journals
- Career
Rifaximin v terapii Crohnovy nemoci. Výsledky studie GRACE 02
Authors: D. Ďuričová 1; M. Bortlík 1,3; M. Lukáš 1,2
Authors‘ workplace: Klinické a výzkumné centrum pro střevní záněty ISCARE a. s. Lighthouse a 1. LF UK v Praze 1; Ústav klinické biochemie a laboratorní diagnostiky 1. LF UK v Praze 2; Interní klinika 1. LF UK v Praze 3
Published in: Gastroent Hepatol 2010; 64(3): 31-36
Category: IBD
Overview
Mikrobiální střevní flora má rozhodující význam při indukci a udržení střevního zánětu u nemocných s Crohnovou chorobou. Dlouhodobá antimikrobiální terapie je u nemocných s Crohnovou chorobou součástí léčebného armamentaria, především v případě septických komplikací a perianální formy nemoci. Studie GRACE 02 hodnotila biologickou dostupnost, bezpečnost a efektivitu antibiotika rifaximinu podávaného v podobě gastro-rezistentních granulí ve dvou léčebných schématech (800 mg vs 1 600 mg denně) u pacientů s Crohnovou chorobou ve fázi mírné až středně těžké zánětlivé aktivity. Studie provedená v jednom centru na souboru 24 nemocných potvrdila, že jde o lék velmi dobře tolerovaný, se zanedbatelnou biologickou dostupností. Počet dosažených klinických remisí na konci sledování byl vyšší u nemocných s vyšším dávkováním (58 % vs 33 %) v porovnání s pacienty s nižší dávkou léku.
Klíčová slova:
Crohnova choroba – ulcerózní kolitida – rifaximin – idiopatické střevní zánětyÚvod
I přes intenzivní výzkum v posledních dvaceti letech zůstává etiologie a patogeneze idiopatických střevních zánětů (IBD), Crohnovy nemoci (CN) a ulcerózní kolitidy (UC) neobjasněna. V nedávné době ukázala řada experimentálních studií na zvířecích modelech střevních zánětů i výsledky klinických studií, a také četné klinické zkušenosti, že významné místo při vyvolání a udržení chronického střevního zánětu má mikrobiální střevní flora. Přesné mechanizmy, kterými se bakteriální střevní flora podílí na spouštění patogeneze IBD, však do podrobností objasněny nejsou [1–4]. Swidsinski a Schultz nalezli významně vyšší kontaminaci střevní sliznice bakteriemi u nemocných s CN v porovnání se zdravými kontrolami a nemocnými s UC [2,3]. Již dlouhou dobu je známo, že střevní obsah z oblasti terminálního ilea, přicházející do kontaktu se zdravou sliznicí tlustého střeva u pacientů s CN, způsobuje aktivizaci zánětu v dosud nepostižené části střeva [5]. V etiologii CN má mimořádně významné místo přirozený imunitní systém střeva, který tvoří řada součástí včetně hlenu, epiteliální slizniční vrstvy a lymfocyto-makrofágového systému. Klíčové postavení v tomto ohledu mají Panethovy buňky, které jsou lokalizovány v bazích Lieberkühnských krypt a produkují alfa defenziny. Jde o malé molekuly peptidů, které mají antimikrobiální-baktericidní vlastnosti a podílí se na tom, že vlastní sliznice tenkého a tlustého střeva je za fyziologických okolností sterilní a neobsahuje žádné mikroby. Snížená tvorba alfa defenzinů vede ke snížení antimikrobiální rezistence sliznice a zvýšené invazi mikrobů do ní. Zajímavé je, že byla potvrzena vazba mezi nedávno objevenou mutací, a to NOD2-CARD15 genu, která se vyskytuje cca u 1/3 pacientů s CN a kóduje syntézu defektního NOD2 proteinu, což vede ke snížené expresi alfa defenzinů u nemocných s CN [6,7].
Antibiotika jsou součástí terapeutického armamentaria u pacientů s CN již po několik desetiletí. Vedoucí indikací k jejich podávání jsou septické komplikace IBD, perianální lokalizace CN a akutní pouchitida u nemocných s UC po vytvořené ileo-pouch-anální anastomóze. V jiných indikacích, jako je profylaxe recidivy po ileo-cékální resekci a léčba nekomplikované luminální formy CN ve stadiu mírné až střední aktivity, zůstávají sporné. Metronidazol a fluorochinolony jsou nejčastěji užívaná antimikrobiální léčiva. Jejich dlouhodobé podávání, především v případě nitroimadazolů, je limitováno výskytem závažných nežádoucích účinků (periferní polyneuropatie). Kovová pachuť v ústech, abdominální dyskomfort v důsledku dysmikrobie a intolerance alkoholu jsou dalšími frekventně se vyskytujícími nežádoucími důsledky léčby metronidazolem. V případě chinolonových chemoterapeutik jde hlavně o tendinopatie [8].
Rifaximin je derivát rifamycinu, širokospektrálního antibiotika, které má baktericidní účinnost na gram pozitivní i gram negativní aerobní a anaerobní bakterie. Výhodou je zcela minimální absorpce z trávicího ústrojí (0,1–2 % podané perorální dávky je detekováno v plazmě u experimentálních zvířat). Rifaximin má velmi příznivý bezpečnostní profil s nízkým výskytem nežádoucích účinků [9].
Prezentovaná studie byla provedena s cílem vyšetřit biologickou dostupnost, bezpečnost a efektivitu rifaximinu ve formě gastro-rezistentních granulí podávaných u nemocných s CN ve fázi lehké až střední zánětlivé aktivity, a to ve dvou odlišných dávkovacích schématech.
Metody
Pacienti
Do studie byli zařazení pacienti s CN ve věku 18 až 70 let s lokalizací na terminálním ileu a (nebo) tlustém střevě. Onemocnění muselo být ověřeno rentgenologicky nebo endoskopicky nejméně šest měsíců před zařazením pacientů do studie. Aktivita nemoci vyjádřená indexem aktivity Crohnovy nemoci (CDAI) musela vykazovat mírnou až střední aktivitu charakterizovanou zvýšením hodnoty CDAI od 151–320 bodů. Nemocní byli screenováni do studie 10 dnů před randomizací. Podmínkou zařazení do studie byl podpis informovaného souhlasu, negativní fyzikální vyšetření, normální hodnoty základních laboratorních vyšetření a u žen negativní těhotenský test. U všech nemocných byla vyloučena koincidující střevní infekce. Vyřazující kritéria pro zařazení do studie obsahovala: hrozící chirurgický výkon (obstruktivní symptomatologie nebo významná stenóza trávicího ústrojí s dilatací tenkých kliček nad zúžením); přítomnost jiného infekčního onemocnění; střevní symptomy vyplývající z po-resekčního stavu nebo syndromu krátkého střeva; aktivní perianální formu CN; vytvořenou stomii; závažné srdeční, jaterní a renální onemocnění; terapii kortikosteroidy s denní dávkou vyšší než 20 mg prednisonu; nebo 9 mg budesonidu v posledních 15 dnech před screeningem; současné užívání antibiotik v době kratší než 15 dnů před screeningem do studie; používání rektální formy kortikoidů v době kratší než jeden týden před screeningem; podávání biologické léčby a (nebo) zavedení terapie imunosupresivy (azathioprin, methotrexat) v intervalu kratším než šest měsíců před zahájením studie.
Studijní látka
Rifaximin v podobě gastro-rezistentních granulí (Rifaximin EIR) bílé barvy (sachets) obsahující 800 mg léku byl podáván buďto v jedné (ranní) nebo dvou denních (ranní a večerní) dávkách. Placebo bylo aplikováno v identickém balení, vzhledu i chuti jako testovací látka.
Design studie
Studie navazovala na velký mezinárodní projekt, který je označen jako GRACE 01, což byla pilotní, multicentrická, dvojitě slepá, randomizovaná a placebem kontrolovaná studie hodnotící efektivitu a snášenlivost dvou dávek Rifaximinu EIR u 72 pacientů s mírnou nebo střední aktivitou CN. Studie GRACE 02 probíhala od října 2004 do srpna 2005 v gastroentreologickém centru VFN v Praze. Do zkoušky bylo zařazeno celkem 24 pacientů s mírnou až středně aktivní CN (CDAI 151–320), kteří byli randomizováni do dvou skupin s podáním dvou dávek aktivní látky, nebo jedné dávky aktivní látky a druhé dávky obsahující placebo po dobu 12 týdnů.
Skupina A zahrnovala podávání Rifaximinu EIR 800 mg ráno a placeba ve večerní davce; ve skupině B byli nemocní léčení Rifaximen EIR 2× 800 mg denně. Primárním cílem studie bylo posoudit a porovnat biologickou dostupnost Rifaximinu EIR ve dvou léčebných schématech (skupiny A a B). Sekundárními cíly bylo zjistit frekvenci dosažené klinické remise (CDAI < 150) po 12 týdnech léčby; frekvenci klinického zlepšení charakterizovaného snížením výchozí hodnoty CDAI o více než 70 bodů; frekvenci selhání léčby, charakterizovaného zvýšením CDAI o více než 100 bodů nad výchozí hodnotu, nebo nutností zahájit záchrannou terapii kortikosteroidy nebo nutnost chirurgické léčby.
Biologická dostupnost léčiva byla posouzena stanovením koncentrace léku v moči a v plazmě. První a poslední den studie byli nemocní přijati na lůžkové oddělení před aplikací ranní dávky léčiva. Pro farmakokinetické účely byly vzorky moče sbírány před ranní dávkou léku a dále v 0–2, 2–4, 4–8, 8–12 a 12–24hod intervalech po aplikaci léčiva. Z odebraných vzorků bylo stanoveno množství látky vyloučené močí jako farmakokinetický parametr. Aktivita CN byla hodnocena pomocí indexu CDAI v době randomizace a poté v týdnech 2, 4, 8 a 12. Ve stejných intervalech, vyjma druhého týdne, byla hodnocena kvalita života použitím validovaného dotazniku IBDQ (Inflammatory Bowel Disease Questionnaire). CDAI byl hodnocen na základě záznamů z pacientských deníků, vždy za posledních sedm dnů před návštěvou.
Laboratorní testy zahrnovaly hematologické parametry, biochemické hodnoty (glykemie, keratinin, AST, ALT, GMT, C-reaktivní protein) byly analyzovány v době screeningu a v týdnech 4, 8 a 12.
Sledování nemocných bylo uskutečněno za 2–4 týdny po poslední studijní návštěvě na základě telefonického rozhovoru.
Hodnocení bezpečnosti bylo založeno na fyzikálním vyšetření, laboratorních testech a byly zaznamenávány nežádoucí účinky, a to při každé studijní návštěvě. Nemocní byli hodnoceni jako adherentní k terapii, jestliže využívali více než 75 % vydané studijní medikace.
Souhlas s provedením studie byl vydán etickou komisí VFN v Praze v červnu roku 2004.
Statická analýza
Analýza účinnosti terapie byla provedena chí-kvadrátovým testem a Fisherovým exaktním testem na hladině významnosti 0,05. Změny hodnoty indexu aktivity CDAI a kvality života IBDQ byly analyzovány pro ITT (intention to treat) populaci (u všech nemocných, kteří dostali alespoň jednu dávku léku) i PP (per protocol) populaci (nemocní, kteří absolvovali celý protokol) užitím testu ANOVA. Změny výsledné hodnoty CDAI a IBDQ byly porovnány mezi oběma skupinami nemocných pomocí testu ANOVA.
Výsledky
Od října 2004 do června 2005 bylo celkem 24 pacientů s mírně až středně aktivní CN randomizováno do studie GRACE 02. Ve skupině A bylo celkem 12 pacientů (rifaximin 800 mg + placebo), ve skupině B rovněž 12 nemocných (rifaximin 800 mg 2× denně). Základní charakteristiky nemocných zařazených do studie jsou uvedeny v tab. 1. Pět nemocných z ITT skupiny (zahrnujících celkem 24 pacientů) bylo vyřazeno z PP analýzy. Dva nemocní byli původně zařazeni do skupiny B (rifaximin 800 mg 2× denně); jeden z nich odmítl dále ve studii pokračovat, druhý pacient měl prokazatelnou non-adherenci s nižším užíváním léčby než 75 % vydaného léčiva. Tři pacienti ze skupiny A předčasně ukončili léčbu, jeden z nich na základě známek selhávající terapie a dva další odmítli pokračovat ve studii.
Table 1. Demografická data a klinický profil nemocných. Tab. 1. Demographic data and clinical profile of patients. 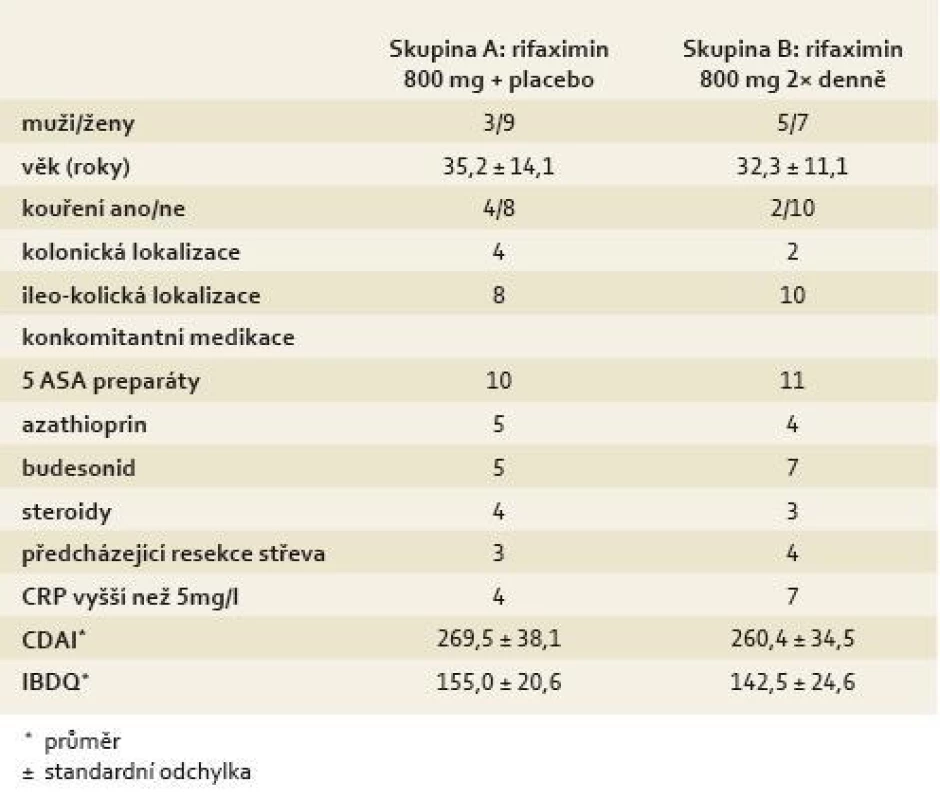
Farmakokinetika
Průměrná 24hod exkrece rifaximinu ve skupině A (800 mg) v prvním dnu podávání byla 655,7 mcg (0,082 % podané dávky) v porovnání s posledním dnem studie, kdy byla průměrná hodnota 396,8 mcg (0,050 %). Ve skupině B (800 mg 2× denně) byla průměrná 24hod exkrece rifaximinu v moči 833,2 mcg (0,052 %) první den léčby a 964,1 mcg (0,060 %) poslední den podávání.
Farmakokinetické údaje byly analyzovány pouze pro nemocné, kteří dokončili léčbu (PP populace).
Účinnost
Protizánětlivá efektivita léčby byla hodnocena u všech nemocných, kteří dostali alespoň jednu dávku léčby (ITT populace). Klinická remise ve 12. týdnu léčby byla dosažena u 33 % pacientů ve skupině A (Rifaximin EIR 800 mg denně) a u 58 % nemocných, kteří byli zařazeni do skupiny B (Rifaximin EIR 800 mg 2× denně). Klinická odpověď byla detekována u 67 % pacientů ve skupině A a u 75 % u nemocných ve skupině B. I když ve skupině B byl počet klinických remisí i klinických odpovědí ve 12. týdnu vyšší proti výsledkům dosažených ve skupině A, rozdíly nedosáhly statistické významnosti. Když byly porovnány výchozí hodnoty CDAI s hodnotami na konci studie, bylo zjištěno, že snížení hodnoty CDAI bylo, i když statisticky nesignifikantně, vyšší ve skupině B (800 mg 2× denně) než ve skupině A (graf 1 a 2). S ohledem na hodnotu kvality života (IBDQ) se zjištěné skóre v průběhu léčby postupně zvyšovalo, větší nárůst byl pozorován ve skupině s vyšším dávkováním rifaximinu, avšak opět bez statistické významnosti. Při hodnocení pacientů, kteří dokončili celou studii (PP populace) nenabyly rozdíly v hodnotách CDAI a IBDQ v obou skupinách statistické signifikace. Byl zaznamenán pouze staticky významný rozdíl ve snížení hodnot CDAI (p = 0,014) ve skupině s vyšším dávkováním rifixaminu. Selhání terapie bylo zjištěno pouze u jednoho pacienta, a to ve skupině s vyšším dávkováním rifaximinu.
Graph 1. Změna hodnoty CDAi v průběhu léčby. Graph 1. Changes in the level of CDAI during treatment. 
Graph 2. Rozdíl absolutní hodnoty CDAi v průběhu terapie. Graph 2. The difference in the absolute values of CDAI during treatment. 
Bezpečnost a adherence k léčbě
Celkově byly pozorovány pouze tři nežádoucí účinky terapie reportované u třech nemocných. Dva z nich se vyskytly ve skupině s nižším dávkováním – jeden pacient měl chřipkové příznaky a druhý bolesti hlavy. Jeden nemocný měl ve skupině s vyšším dávkováním infekci virem hepatitidy C. Žádný z vedlejších účinků nebyl v přímém vztahu k podávané studijní léčbě. Adherence k terapii byla velmi dobrá, pouze jeden nemocný musel být vyřazen ze studie pro prokazatelnou non-adherenci.
Diskuze
Prezentovaná studie (GRACE 02) navazovala na velký mezinárodní projekt označovaný jako GRACE 01 a hodnotila biologickou dostupnost a efektivitu dvou různých dávek gastro-rezistentních granulí rifaximinu u nemocných s mírně až středně aktivní CN. V této studii bylo potvrzeno, že vyšší dávkování rifaximinu 800 mg 2× denně podávané po dobu 12 týdnů je spojeno s vyšším počtem dosažených klinických odpovědí i remisí v porovnání s nižším dávkováním rifaximinu 800 mg 1× denně. Nemocní s CN, kteří dostávali vyšší dávku rifaximinu, dosáhli cca o 25 % více pozitivních klinických odpovědí a klinických remisí v porovnání se skupinou s nižším dávkováním. Rovněž změna hodnoty CDAI a nárůst hodnoty IBDQ v průběhu studie byly větší v porovnání se skupinou nemocných s nižším dávkováním rifaximinu. Zjištěné rozdíly v obou skupinách však nebyly staticky významné. Důvodem je pravděpodobně velmi malý počet zařazených pacientů.
Podobné výsledky byly zjištěny ve větší pilotní zkoušce GRACE 01. Výsledky obou projektů ukazují na to, že rifaximin je efektivní léčbou u mírné až středně aktivní CN s postižením terminálního ilea a/nebo tlustého střeva. Byl potvrzen zřetelný trend, že vyšší dávka rifaximinu 1 600 mg denně je spojena s vyšší efektivitou. Ve studii GRACE 01 se navíc potvrdilo, že vyšší dávkování rifaximinu (1 600 mg denně) bylo spojeno se statisticky nižším počtem pacientů, kteří selhali na podávané terapii [21]. V této studii došlo k předčasnému ukončení léčby z důvodu selhání terapie jen u jednoho pacienta, a to ve skupině s vyšším dávkováním. Původně byly v této studii plánovány další sub-analýzy hodnotící vliv výchozí hodnoty C-reaktivního proteinu, konkomitantní terapie mesalazinem, kouření, prodělané operace a lokalizace nemoci. Bohužel, pro malý počet zařazených pacientů do studie bylo od tohoto záměru upuštěno. Nicméně se ve zmíněné studii GRACE 01 ukázalo, že nemocní s vyšší výchozí hodnotou C-reaktivního proteinu měli statisticky signifikantně vyšší léčebnou odpověď a vyšší počet dosažených klinických remisí v porovnání s placebem [21]. Tento pozitivní prediktivní faktor byl pro příznivou terapeutickou odpověď verifikován také ve studii monitorující účinnost a bezpečnost biologické léčby u pacientů s CN [24].
I když jsou metronidazol a ciprofloxacin nejčastěji užívanými antimikrobiálními léčivy u nemocných se střevními záněty, jejich dlouhodobé používaní je značně limitováno. Důvodem je výskyt závažných nežádoucích účinků při protrahovaném podávání. Výhodou rifaximinu je jeho lokální, nesystémový efekt a minimální nebo žádná kumulace v organizmu. Prezentovaná pilotní studie potvrdila vysokou bezpečnost tohoto antibiotika při kontinuálním dvanáctitýdenním podávání. Podobně příznivé výsledky potvrdily i jiné studie s tímto antibiotikem prezentované v zahraničním písemnictví [22,23].
Ztráta imunitní tolerance ke komenzální střevní mikrobiální floře se zdá být v současné době vedoucím mechanizmem navozujícím chronicky zánětlivý proces ve sliznici trávicího ústrojí u nemocných s IBD [10].
V posledních deseti letech byla publikována řada studií, které se zabývaly účinností antibiotické terapie u pacientů s CN a UC [11–16]. Bylo zjištěno, že metronidazol je efektivní léčebnou modalitou a vede ke snížení aktivity zánětu demonstrované snížením hodnoty CDAI, především při postižení tlustého střeva [11]. Rutgeerts et al prokázali příznivý vliv metronidazolu a ornidazolu v profylaxi klinické a endoskopické recidivy CN po ileo-cékální resekci [13,14]. U pacientů s UC, kteří se podrobili pro nepříznivý průběh onemocnění proktokolektomii s vytvořením ileo-pouch-anální anastomózy, se objevuje akutní nebo chronický zánět sliznice ve vytvořeném rezervoáru tzv. pouchitida. Nejefektivnější terapií je v těchto případech krátkodobá terapie metronidazolem a ciprofloxacinem. V dlouhodobé profylaxi vzniku pouchitidy byl potvrzen velmi významný vliv probiotické léčby [17–20].
Výsledky této studie na malém souboru nemocných ukázaly, že rifaximin má velmi dobrou efektivitu u nemocných s CN ve fázi mírné až střední aktivity. Vysoký počet klinických remisí (33 % resp. 58 %) během 12týdenní terapie naznačil, že rifaximin ve vyšší dávce (1 600 mg denně) by u těchto pacientů mohl být možnou léčebnou alternativou. K ověření tohoto předpokladu by měly být provedeny větší klinické zkoušky.
Poděkování firmě Alfa Wassermann za podporu při přípravě a realizaci studie a dodání studijní medikace.
prof. MUDr. Milan Lukáš,CSc.
Klinické a výzkumné centrum pro střevní záněty ISCARE a. s. Lighthouse
Praha 7, 170 00
milan.lukas@email.cz
Sources
1. Darfeuille-Michaud A, Boudeau J, Bulois P et al. High Prevalence of Adherent-Invasive Escherichia coli Associated With Ileal Mucosa n Crohn´s Disease. Gastroenterology 2004; 127(2): 412–421.
2. Swidsinski A, Ladhoff A, Pernthaler A et al. Mucosal Flora in Inflammatory Bowel Disease. Gastroenterology 2002; 122(1): 44–54.
3. Schultsz C, Van Den Berg FM, Ten Kate FW et al. The Intestinal Mucus Layer From Paients With Inflammatory Bowel Disease Harbours High Numbers of Bacteria Compared With Controls. Gastrenterology 1999; 117 : 1089–1097.
4. Tamboli CP, Neut C, Desreumaux P et al. Dysbiosis in inlammatory bowel disease. Gut 2004; 53(1): 1–4.
5. D´Haens GR, Geboes K, Peeters M et al. Early Lesions of recurrent Crohn´s Disease Caused by Infusion of Intestinal Contents in Excluded Ileum. Gastroenterology 1998; 114 : 262–267.
6. Wehkamp J, Harder J, Weichenthal M et al. NOD2 (CARD 15) mutations in Crohn´s disease are associated with diminished mucosal α-defensin expression. Gut 2004; 53 : 1658–1664.
7. Wehkamp J, Schmid M, Stange EF. Defensins and other antimicrobial peptides in inflammatory bowel disease. Current Opinion in Gastroenterology 2007; 23(1): 370–378.
8. Perencevich M, Burakoff R. Use of Antibiotics in the Treatment of Inflammatory Bowel Disease. Inflamm Bowel Dis 2006; 12(7): 651–664.
9. Landers CJ, Cohavy O, Misra R. Selected Loss of Tolerance Evidenced by Crohn´s Disease-Associated Imune Responses to Auto and Microbial Antigens. Gastroenterology 2002; 123(3): 689–699.
10. Shanahan F. Probiotics in inflammatory bowel disease. Gut 2001; 48 : 609.
11. Sutherland L, Singleton J, Sessions J et al. Double blind, placebo controlled trial of metronidazole in Crohn´s disease. Gut 1991; 32(9): 1071–1075.
12. Steinhart AH, Feagan BG, Wong CJ et al. Combined Budesonide and Antibiotic Therapy for Active Crohn´s Disease: A Randomized Controlled Trial. Gastroenterology 2002; 123 : 33–40.
13. Rutgeerts P, Hiele M, Geboes K et al. Controlled Trial of Metronidazole Treatment for Prevention of Crohn´s Reccurence After Ileal Resection. Gastroenterology 1995; 108(6): 1617–1621.
14. Rutgeerts P, Van Assche G, Vermeire S et al. Ornidazole for Prophylaxis of postoperative Crohn´s Disease Recurrence. A Randomized, Double-Blind, Placebo-Controlled trial. Gastroenterology 2005; 128(4): 856–861.
15. Colombel JF, Lémann M, Cassagnou M et al. A Controlled trial comparing Ciprofloxacin With Mesalazine for the Treatment of Active Crohn´s Disease. Am J Gastroenterol 1999; 94(3): 674–678.
16. Turunen UM, Farkkila MA, Hakala K et al. Long-term Treatment of Ulcerative Colitis With Ciprofloxacin: A Prospective, Double-Blind, Placebo-Controlled Study. Gastroenterology 1998; 115 : 1072–1078.
17. Sandborn JW, Pardi DS. Clinical Management of Pouchitis. Gastroenterology 2004; 127 : 1809–1814.
18. Gionchetti P, Rizzelo F, Venturi A et al. Oral Bacteriotherapy as Maintenance Treatment in Patients With Chronic pouchitis: A Double-Blind, Placebo-Controlled Trial. Gastroenterology 2000; 119(2): 305–309.
19. Gionchetti P, Rizzelo F, Helwig U et al. Prophylaxis of Pouchitis Onset With Probiotic Therapy. A Double-Blind, Placebo-Controlled Trial. Gastroenterology 2003; 124(5): 1202–1209.
20. Mimura T, Rizzelo F, Helwig U et al. Once daily high dose probiotic therapy (VSL#^3) for maintaining remission in reccurent or refractory pouchitis. Gut 2004; 53(1): 108–114.
21. Prantera C, Lochs H, Campieri M et al. Antibiotic treatment of Crohn´s disease: results of a multicentre, double blind, randomized, placebo-controlled trial with rifaximin. Aliment Pharmacol Ther 2006; 23(8): 1117–1125.
22. Kornbluth A, Hunt M, George J. Efficacy and Safety in the Treatment of Mild-Moderate Crohn´s Disease: Results os An Open-Label pilot Study. Gastroenterology 2005; 128: A579.
23. Bosworth BP, Scherl EJ. A Novel Nonabsorbable Antibiotic (rifaximin) in the Treatment of Moderate To Severe Crohn´s Disease. Gastrenterology 2005; 128: A576.
24. Colombel JF, Sandborn WJ, Reinisch W et al: Infliximab, Azathioprine, or combination therapy for Crohn´s Disease. N Engl J Med 2010; 362(15): 1383–1395.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2010 Issue 3-
All articles in this issue
- Role protilátek anti-Saccharomyces cerevisiae v časné diagnostice Crohnovy choroby
- Endoskopické řešení stenózy hepatikojejunoanastomózy pomocí jednobalonkového enteroskopu zavedeného do Roux kličky
- Gastroprotekcia pri dlhodobom užívaní nesteroidných antireumatík, resp. nízkych dávok kyseliny acetylosalicylovej
- Histopatologická diagnóza a diferenciálna diagnóza céliakie: prehľad pre gastroenterológov
- Rifaximin v terapii Crohnovy nemoci. Výsledky studie GRACE 02
- VI. jarní diskuzní gastroenterologické dny, Kaprun
- Preventívna vakcinácia proti hereditárnemu nepolypóznemu kolorektálnemu karcinómu?
- Radiofrekvenční ablace Barrettova jícnu s dysplazií: Jak dlouho necháme naše pacienty čekat?
- Zamyšlení, spíše povzdech nad několika kongresy a jejich souvislostmi
- Instructions for Authors
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Role protilátek anti-Saccharomyces cerevisiae v časné diagnostice Crohnovy choroby
- Endoskopické řešení stenózy hepatikojejunoanastomózy pomocí jednobalonkového enteroskopu zavedeného do Roux kličky
- Histopatologická diagnóza a diferenciálna diagnóza céliakie: prehľad pre gastroenterológov
- Gastroprotekcia pri dlhodobom užívaní nesteroidných antireumatík, resp. nízkych dávok kyseliny acetylosalicylovej
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

