-
Medical journals
- Career
Role protilátek anti-Saccharomyces cerevisiae v časné diagnostice Crohnovy choroby
: V. Hrabovský 1; A. Mendlová 1; T. Posolda 2; H. Fikoczek 3; J. Dvořáčková 4; J. Ehrmann 4; M. Rydlo 5
: Metabolická JIP, Interní klinika, FN Ostrava2Chirurgická klinika, FN Ostrava3Radiodiagnostický ústav, FN Ostrava4Ústav patologie, FN Ostrava5Centrum digestivní endoskopie, FN Ostrava 1
: Gastroent Hepatol 2010; 64(3): 7-12
: Case Report
Crohnova choroba (CD) je chronické zánětlivé onemocnění zažívacího traktu, které může postihnout kteroukoli část trávicí trubice. Období akutního vzplanutí je obvykle spojeno s malnutricí a různě vyvinutými dyspeptickými příznaky. Etiologie choroby není známa, a proto neexistuje kauzální terapie. Základní diagnostika se opírá především o výsledky krevních, rentgenologických, endoskopických a histologických vyšetření. Imunologické vyšetření, které podporuje CD, je stanovení ASCA (Anti-Saccharomyces Cerevisiae Antibody). Aktivitu onemocnění je možno sledovat několika způsoby a využití CRP (C-reaktivní protein) je asi nejfrekventovanější.
Cílem tohoto sdělení je prezentovat kazuistiku mladé ženy, u které se po devítiletém sledování pro izolovanou a asymptomatickou lehkou elevaci CRP a ASCA rozvinula aktivní komplikovaná Crohnova choroba.Klíčová slova:
Crohnova choroba – nespecifické záněty střevní – protilátky proti Saccharomyces cerevisiaeÚvod
Crohnova choroba (CD) představuje společně s ulcerozní kolitidou (UC) dva hlavní představitele nespecifických zánětů střevních (NZS). CD je chronické zánětlivé onemocnění postihující trávicí trubici, pro jejíž průběh je typické střídání období inaktivity (remise) a zvýšené aktivity (exacerbace/relaps). Může se manifestovat intestinálními i extraintestinálními komplikacemi. Incidence v České republice se udává 1,7–2 případy na 100 000 obyvatel a prevalence 18–22 případů na 100 000 obyvatel. Příčina onemocnění nebyla dosud objasněna, terapie proto není kauzální a je zaměřená hlavně na dosažení klinické remise a stabilizaci endoskopického nálezu [1]. Léčba CD může být spojena s výskytem nežádoucích účinků, které mohou negativně ovlivnit morbiditu i mortalitu choroby [2]. Do základní léčby patří užití kortikoidů, 5-aminosalicylátů a antibiotik. Velké naděje se vkládají do vývoje nové imunosupresní terapie a biologické léčby [3]. Chirurgická léčba je v současné době indikována pouze pro nemocné s definovanými komplikacemi.
Závažnost a složitost onemocnění dokresluje skutečnost, že neexistuje žádný základní diagnostický test, který by CD jednoznačně, rychle a jednoduše potvrdil. V klinické praxi je nutné využívat široké spektrum vyšetření. Nezřídka zůstává diagnóza střevního zánětu i poté nejednoznačná. Mezi hlavní klinické projevy onemocnění patří průjmy s příměsí krve, nebo bez ní, bolesti břicha a anorexie s váhovým úbytkem. Pokles hmotnosti se manifestuje až v 65–75 % případů [4]. Je známo, že u pacientů s Crohnovou chorobou dochází ke zvýšení hladin zejména interleukinů IL-1 a IL-6 a tumor nekrosis faktoru alfa (TNF-a), které anorexii podporují [5]. Pro aktivní fázi nemoci je také charakteristická vodní, minerálová a metabolická dysbalance [6].
Zlatým standardem diagnostiky CD jsou endoskopická vyšetření. Výsledky histologických vyšetření jsou často nejednoznačné, ale hrají určitou úlohu ve sledování potenicálního nádorového rizika [8]. CT-enteroklýza, která pomalu vytlačuje klasickou rentgenovou enteroklýzu, je považována za klíčové vyšetření při hodnocení postižení tenkého střeva s vysokou specifitou [9,10]. Nevýhodou je relativně vysoká cena a radiační zátěž, proto se MR-enteroklýza jeví jako alternativa, která není spojena s rizikem radiace a dobře koreluje s aktivitou CD [11]. Scintigrafické metody mohou být vhodným způsobem neendoskopického sledování těchto nemocných [12]. Senzitivita kapslové enteroskopie je srovnatelná s CT-enteroklýzou, ale její specifita významně preferuje radiologickou metodu a nelze ji použít při podezření na stenózu trávicího traktu [9,13].
Stanovení přítomnosti autoprotilátek a antimikrobiálních protilátek v krevním séru představuje další test, který posiluje diagnózu NZS [14]. Protilátky proti membránovým proteinům Escherichia coli (anti-OmpC), Bacteroides caccae (anti-OmpW) nebo Pseudomonas fluorescens (anti-I2) nejsou v našich podmínkách běžně využívány. Naopak známé je stanovení perinukleárních antineutrofilních cytoplazmatických protilátek (pANCA), které jsou spojovány s diagnózou ulcerózní kolitidy a protilátek proti pivovarským kvasnicím Saccharomyces cerevisiae (ASCA), které svědčí spíše pro CD. Jejich senzitiva a specifita značně kolísá, zejména u ANCA [15]. Za senzitivní, ale ne specifický ukazatel CD je rovněž považován nález pozitivity protilátek proti acinárním buňkám pankreatu [16]. V poslední době jsou výše uvedené sérologické markery sledovány také v souvislosti s určením prognózy NZS [17].
Cílem léčby CD je navození remise a její udržení v co nejdelším intervalu. V první fázi se většinou doporučují 5-aminosalicyláty, ačkoli jejich účinek na dosažení a udržení remise je hodnocen nejednoznačně [18,19]. Kortikoidy zůstávají zlatým standardem léčby akutních vzplanutí CD. Výhodou moderní kortikoterapie je možnost jejich aplikace v topické podobě bez systémových účinků. Jejich vliv na dosaženou remisi však trvá pouze několik měsíců [21]. Na průběh onemocnění byl také prokázán příznivý vliv probiotik a některých antibiotik [20]. Imunosupresivní terapie je určena pro nemocné s kortikodependencí, s opakovanými exacerbacemi a fistulující formou CD. Biologická léčba CD je efektivní v dosažení i udržení remise u nemocných, kde klasická léčba selhala, a dále u komplikovaných forem onemocnění [3].
Popis případu
Pacientka IM narozená v roce 1982 byla na konci roku 2000 přijata do „okresní nemocnice“ na teritoriu Moravskoslezského kraje pro bolesti břicha s teplotami až 39 °C. Měřila 160 cm a vážila 54 kg. Laboratorně byla detekována anemie s trombocytózou, elevace C-reaktivního proteinu (CRP) přes 50 mg/l a sedimentace erytrocytů (FW) v rozmezí 58–82/hod. Negativní byly testy na tuberkulózu, chlamydie, Yersinie, Leptospiry, infekční hepatitidy, CMV a EBV infekci i vyšetření stolice. Negativní byl také sonografický břišní nález, koloskopie a rentgenová enteroklýza, stejně jako gynekologické vyšetření a rozbor kostní dřeně. Pozitivní ale byla kumulace 99 mTc (technecium) značených monoklonálních protilátek proti granulocytům v oblasti levého mesogastria a pravého hypochondria. Stav byl uzavřen jako suspektní CD, byla zahájena léčba mesalazinem 3× denně 1 g a pacientka byla předána do ambulantní péče Fakultní nemocnice v Ostravě (FNO).
V letech 2001 až 2008 byla nemocná bez potíží a vážila 60 kg. Kontrolní koloskopie a CT břicha byly negativní. Laboratorní testy včetně FW a CRP byly v normě. Přetrvávala pozitivita imunologických markerů (tab. 1). Léčba mesalazinem byla ukončena hned v roce 2001. Opakované pokusy o odnětí kortikoterapie vedly k okamžité elevaci CRP. Proto pokračovala nepřetržitě léčba 4 mg methylprednisolonu obden. Stav byl diagnosticky uzavřen jako: imunopatologický stav nejasné povahy, suspektní CD.
1. Vývoj zánětlivých a imunologických ukazatelů v čase. Tab. 1. The development of inflammatory and immunological indicators over time. 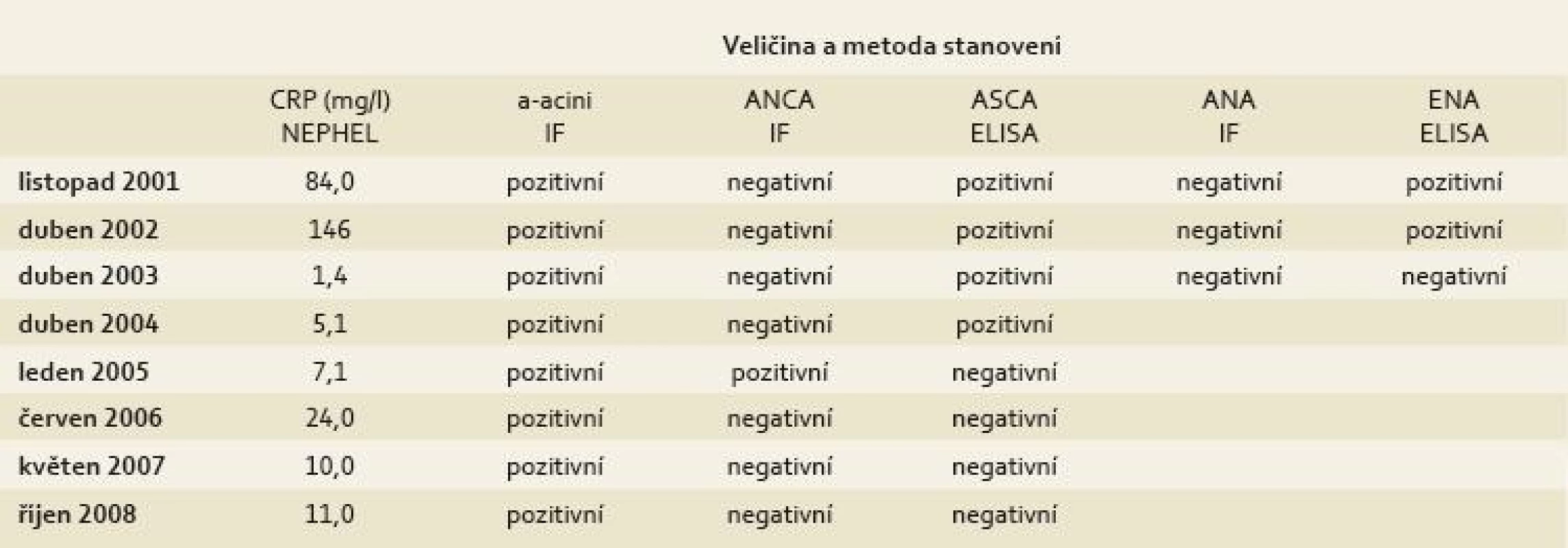
CRP: C-reaktivní protein, a-acini: protilátky proti acinárním buňkám pankreatu, ANCA: anti-neutrofilní cytoplazmatické protilátky, ASCA: anti-Saccharomyces cerevisiae protilátky, ANA: anti-nukleární protilátky, ENA: extrahovatelné nukleární antigeny, NEPHEL: nefelometrie, IF: nepřímá imunofluorescenční mikroskopie, ELISA: enzymová imunoanalýza s imunoadsorbentem V květnu 2008 pacientka porodila po nekomplikované graviditě zdravé dítě. V únoru 2009 si začala stěžovat na bolesti břicha a zhubla 5 kg. Byla obnovena léčba mesalazinem. Sonografické vyšetření břicha, endoskopické vyšetření horního GITu i koloskopie včetně vyšetření terminálního ilea a histologie z této oblasti byly negativní. Následná rentgenová enteroklýza (obr. 1) však prokázala výraznou distenzi jejuna a konverzí do CT-enteroklýzy byla objektivizována dilatace jejuna s minimálně třemi stenotickými úseky tenkého střeva (obr. 2–4). Navrhovanou hospitalizaci pacientka z důvodu péče o dítě opakovaně odmítla. Až v květnu 2009 byla přijata na Metabolickou JIP Interní kliniky FNO s hmotností jen 40 kg. Proběhla předoperační příprava a následně byla provedena resekce postiženého tenkého střeva. Histologické vyšetření operačního resekátu potvrdilo diagnózu CD (obr. 5). V pooperačním období se navzdory významné malnutrici nevyskytly žádné komplikace. V následné ambulantní péči byl konstatován dobrý stav nemocné, jejíž hmotnost dosáhla postupně hodnoty až 55 kg. V současnosti je léčena kombinací budesonidu a mesalazinu.
1. RtG-enteroklýza: distenze jejuna se zachovalým reliéfem, bez peristaltiky. Fig. 1. Barium small bowel follow-through: dilatation of proximal jejunum with normal mucosa, but without intestinal activity. 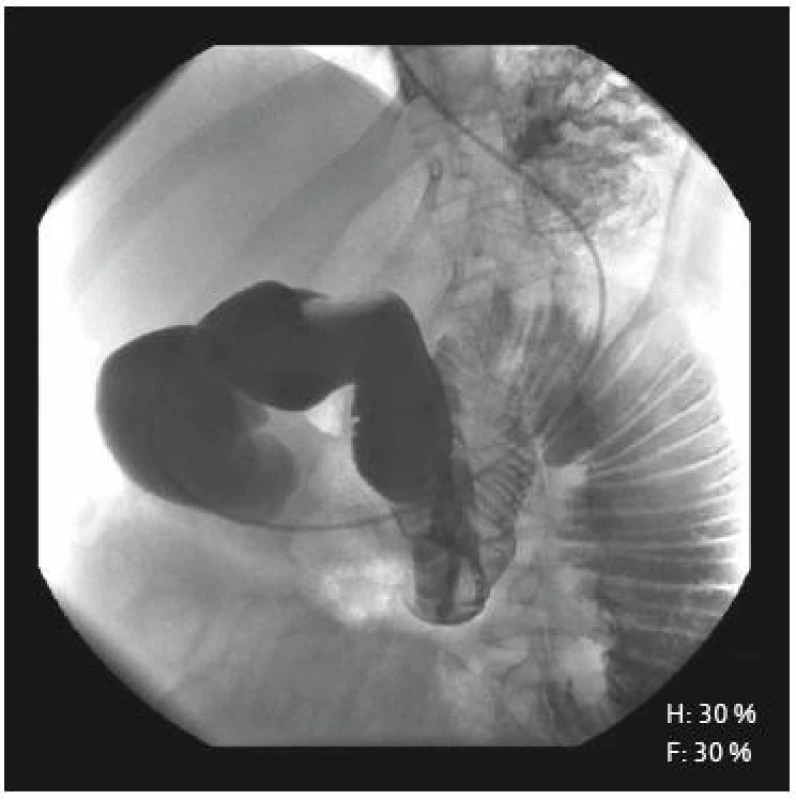
2. Ct-enteroklýza: vstupní toposcan zobrazující distenzi kliček jejuna. Fig. 2. Computed tomography enterography: entry toposcan with dilatation of jejunum. 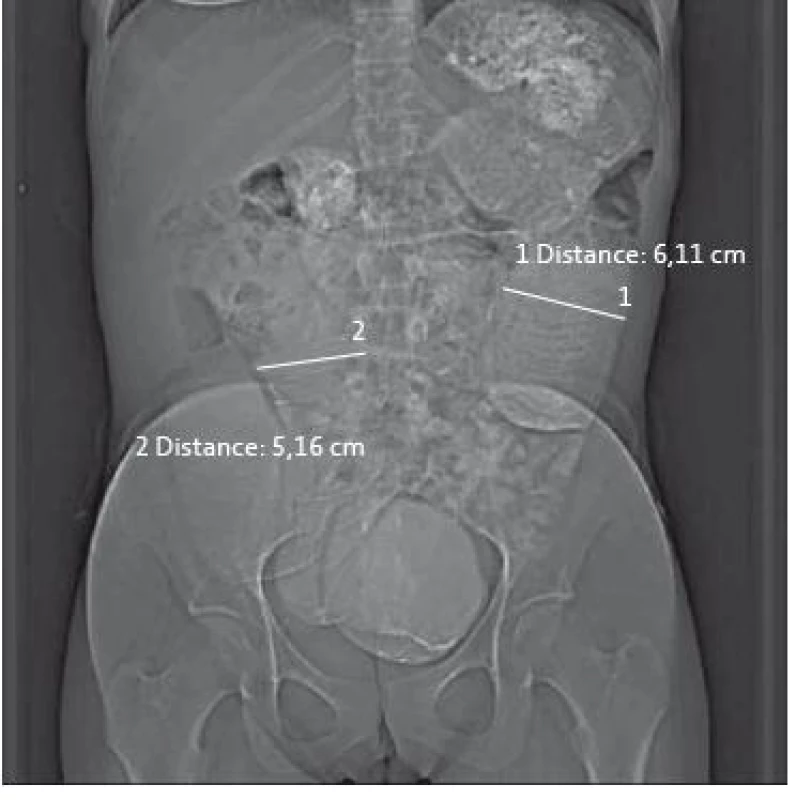
3. Ct-enteroklýza: dilatace kliček jejuna, gracilní kličky ilea a zánětlivé změny reliéfu. Fig. 3. Computed tomography enterography: dilatation of jejunal loops and fragile intestinal wall with signs of inflammation. 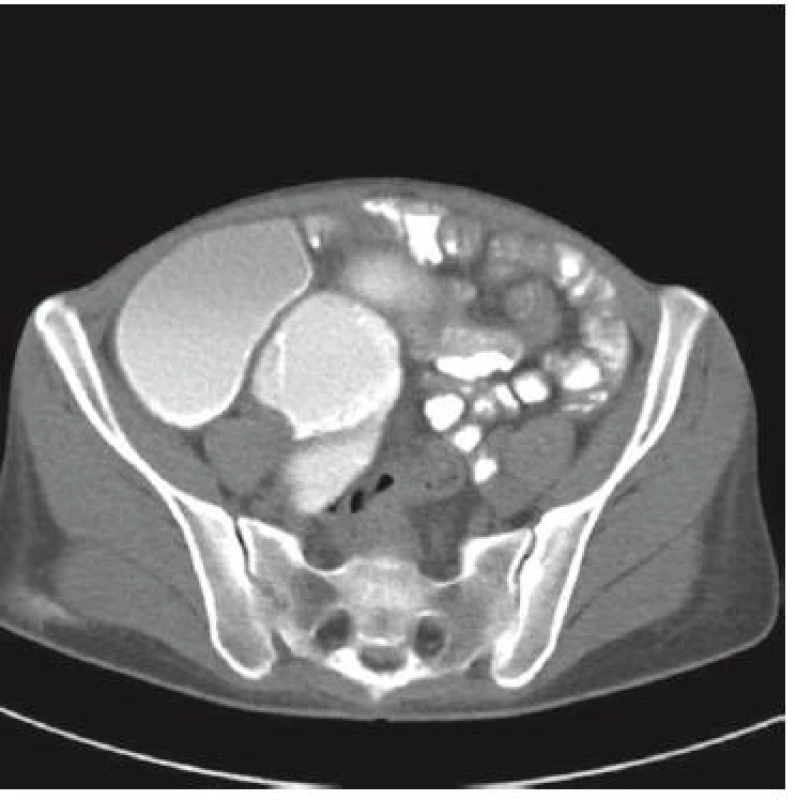
4. Ct-enteroklýza: těsná stenóza tenké kličky, edém střevní stěny, vymizení slizničního reliéfu a pre-stenotická dilatace střeva. Fig. 4. Computed tomography enterography: tight stenosis of ileum with prestenotic dilatation, oedema of intestinal wall with reduction of mucosal relief. 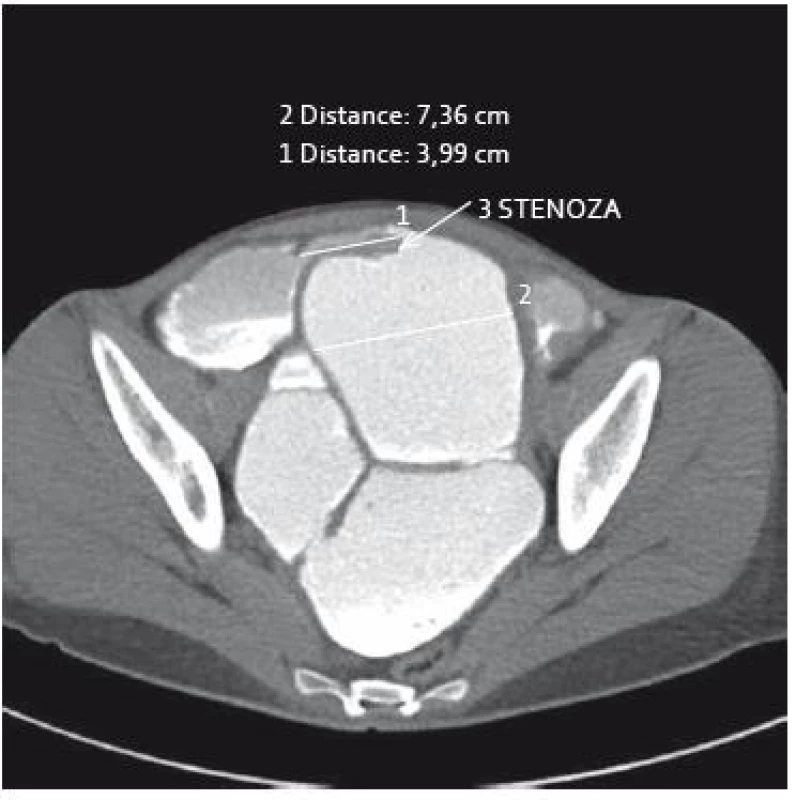
5. Resekát ilea: sliznice ilea s polypoidně zhrubělými řasami a stenózami. Fig. 5. Resected ileum: polypoidal changes of ileum mucosa with stenoses. 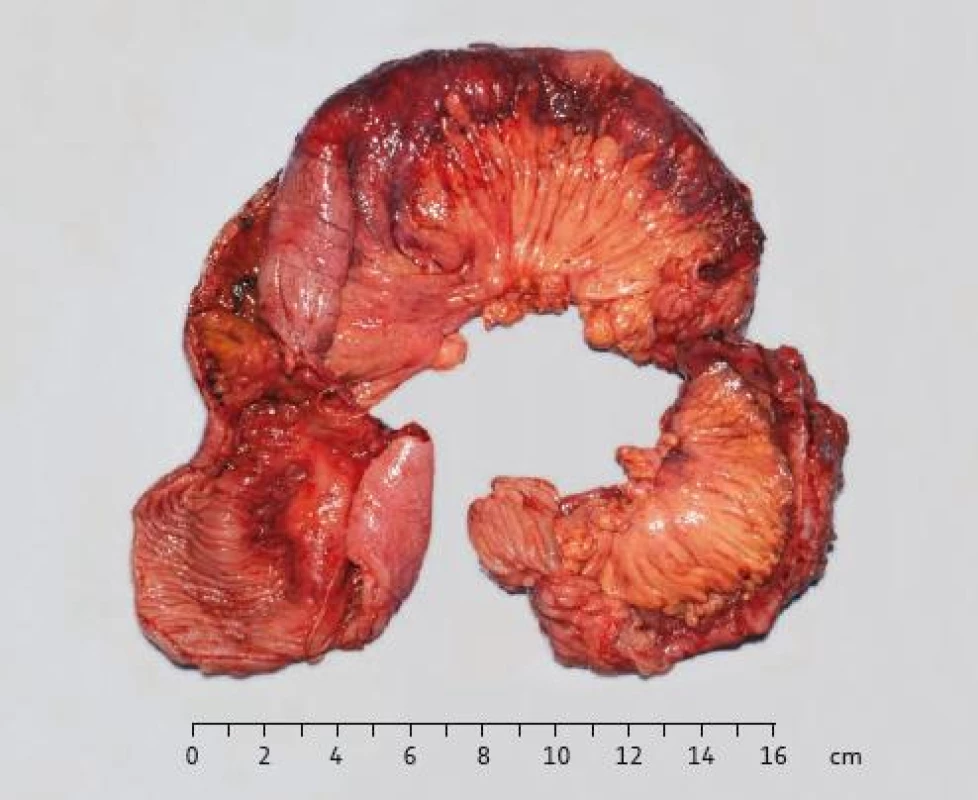
Diskuze
Klinický význam CD spočívá nejen ve zvyšující se incidenci a prevalenci, ale také v komplikovaném průběhu a léčbě. Toto onemocnění pacienty invalidizuje již v časném, produktivním věku.
Diagnostika choroby se opírá především o výsledky radiologických, endoskopických a histologických vyšetření, v případě negativního výsledku je diagnóza NZS dubiozní. Pokud jsou tato vyšetření pro stanovení finální diagnózy nepřínosná, lze využít také sérologická vyšetření. Mezi nejznámější patří stanovení protilátek anti-Saccharomyces cerevisiae (ASCA), které jsou považovány za typické pro CD. Perinukleární anti-neutrofilní cytoplazmatické protilátky (pANCA) jsou charakteristické spíše pro UC. Peeters et al ve své práci na 407 pacientech s CD uvádí, že ASCA u nemocných s CD má senzitivitu 60 %, specifitu 91 %, pozitivní prognostickou hodnotu 88 % a negativní prognostickou hodnotu 68 %. Pozitivní/negativní prognostická hodnota odráží pravděpodobnost propuknutí nemoci při pozitivitě testu, resp. její nepropuknutí při negativním testu. Tato charakteristika odráží také prevalenci nemoci v populaci [22]. Koutroubakis na homogenním souboru 56 Řeků s CD udává velmi nízkou, pouze 39% prevalenci ASCA v populaci [23], což se vysvětluje zejména odlišností řecké populace od ostatních populací, zejména v severní Evropě. Současně prokázal vztah mezi detekovanými výsledky a stupněm poškození střeva, ale výsledek nebyl statisticky významný. Srovnání pANCA negativní/ASCA pozitivní ale na rozdíl od solitárního využití ASCA zvýšilo pozitivní prediktivní hodnotu u CD z 54 % na 77 %. Oba citovaní autoři se shodují v tom, že stanovení ASCA není vhodné pro široký screening CD v populaci. Interpretace výsledků ASCA je tedy složitá a nelze ji oddělovat od ostatních klinických nálezů a také prevalence onemocnění. Proto rovněž Austin et al ve své práci doporučují využívat jako vhodnější ukazatel hodnocení testu pozitivní/negativní prognostickou hodnotu, což demonstruje na názorné kazuistice [17]. Současně uvádí, že pro posuzování přítomnosti CD je výhodnější použití poměru ANCA negativní/ASCA pozitivní se senzitivitou 30–64 % a specifitou 92–97 %.
Dostupná data považují pozitivitu pANCA jako typický laboratorní nález pro ulcerozní kolitidu. Ve vztahu k CD je ale známo, že až 25 % pacientů s CD má ANCA pozitivitu. Tito nemocní jsou označováni též jako ”UC-like“ a průběh nemoci bývá spíše nekomplikovaný [24]. Na druhé straně pozitivita ASCA u nemocných s CD představuje zvýšené riziko komplikací v dalším průběhu CD [25], a to včetně pediatrických pacientů [26]. Stejně tak Dubinsky et al ve své studii prokázali, že u dětských pacientů je doba do vypuknutí komplikací kratší, pokud je přítomna imunologická odpověď na mikrobiální antigeny [27].
V naší kazuistice jsme uvedli případ, kdy u mladé ženy byla devět let před plným vypuknutím nemoci detekována pozitivita ASCA. Výrobce námi použitého testu nepřímé imunofluorescence (Euroimmun) udává, že diagnostická senzitivita/specificita vyšetření pro CD pacienty je 59 %, respektive 98 % při předpokládané prevelanci ASCA v populaci 63 %. Pacientka měla současně negativní ANCA test. Perinukleární forma ANCA (pANCA) nebyla standardně stanovována, protože v imunologické laboratoři, která spolupracuje s naším pracovištěm, je další konfirmace a určení typu ANCA (pANCA, cANCA, aANCA) podmíněno pozitivitou základního imunofluorescenčního ANCA testu.
U naší nemocné nebyly přítomny žádné jednoznačné klinické známky CD. Koloskopie a další zobrazovací metody byly negativní. Laboratorně verifikovaná trombocytóza, anemie i elevace CRP jsou jistě časté, nikoli však diagnostické příznaky nemoci. Pacientka v době prvních potíží dobře zareagovala na léčbu kortikoidy a mesalazinem a domníváme se, že následné přerušení léčby mesalazinem po odeznění dyspeptických příznaků nebylo chybou. Bylo zjevné, že udávané potíže jsou nespecifické a v danou chvíli bylo stanovení diagnózy NZS na základě dostupných výsledků provedených vyšetření nemožné. V souladu s výše uvedeným je tedy pochopitelné, že izolovaná přetrvávající pozitivita ASCA nebyla odůvodněním pro další pokračování léčby, která by ex post odpovídala snaze o udržení remise NZS. Navíc od roku 2005 do plného propuknutí nemoci byl ASCA test již negativní.
Na druhou stranu je nutno uvést, že protilátky proti acinárním buňkám pankreatu byly po celou dobu sledování pozitivní. Ty jsou považovány za senzitivní ukazatel CD a Koutrobakis et al popisují, že antipankreatické protilátky korelují se zvýšenou prevalencí nemocných s CD a zejména jeho stenózující formou [28]. Z popisu našeho případu bohužel vyplývá, že naše nemocná byla po devíti letech sledování při pozitivitě těchto protilátek nucena podstoupit akutní chirurgický zákrok právě pro stenozující komplikaci akutní formy CD. Diagnóza přitom byla celých devět let suspektní a její definitivní potvrzení přineslo až histologické zpracování operačního resekátu.
Bylo tedy stanovení diagnózy a následná léčba nesprávná? Ve světle předchozích sdělení a z důvodu zjevné obavy z atypického průběhu CD bylo dlouhodobé pokračování v léčbě kortikoidy pochopitelné. Tuto strategii podporoval fakt, že po jejím přerušení došlo okamžitě k vzestupu sérové hladiny CRP a topické kortikoidy v supresi zánětlivé aktivity selhaly. Proto byla zvolena velmi nízká dávka systémových steroidů, která efektivně tlumila laboratorní projevy zánětu a současně minimalizovala výskyt nežádoucích účinků kortikoterapie. Připustíme-li skutečnost, že při znalosti konce celého případu byla epizoda dyspepsie v roce 2000 první manifestací CD, pak je velmi obtížné predikovat, zda by intenzivnější a/nebo kombinovaná udržovací léčba zabránila závažnému průběhu v roce 2009. Jak bylo uvedeno, konzervativní léčba pro udržení remise má spornou účinnost [18,19,21]. Podle našeho názoru je vysoce pravděpodobné, že spouštěcím mechanizmem akutního vzplanutí nemoci v roce 2009 byla předchozí gravidita. Je známo, že těhotenství a následná laktace představuje významný faktor pro vzplanutí CD [29].
Závěr
Prezentovali jsme nemocnou, u níž po devítiletém asymptomatickém sledování pro podezření na CD došlo k rozvoji těžkého komplikovaného průběhu onemocnění. Jediným signifikantním nálezem byla izolovaná pozitivita ASCA protilátek, která však dle našeho soudu nebyla důvodem pro intenzifikovanou udržovací léčbu. CD představuje závažný nejen medicínský, ale také socioekonomický problém. Ve světle známých informací o častém atypickém průběhu CD této nemoci autoři konstatují, že jejich prezentace tuto skutečnost podpořila.
MUDr. Vladimír Hrabovský
Metabolická JIP, Interní klinika Fakultní nemocnice Ostrava
vladimir.hrabovsky@fnspo.cz
Sources
1. Regueiro MD. Update in Medical Treatment of Crohn´s Disease. J Clin Gastroenterol 2000; 31 : 282–291.
2. Myrelid P, Olaison G, Sjödahl R et al. Thiopurine therapy is associated with postoperative intra-abdominal septic complications in abdominal surgery for Crohn´s disease. Dis Colon Rectum 2009; 52(8): 1387–1394.
3. Sandborn WJ, Hanauer SB, Rutgeerts P et al. Adalimumab for maintenance treatment of Crohn‘s disease: results of the CLASSIC II trial. Gut 2007; 56(9): 1232–1239.
4. Lochs H. Nutritional support in inflammatory bowel disease. In: Sobotka L.: Basics in clinical nutrition, Edited for ESPEN courses, second edition. Galen 2000 : 300.
5. Pizarro TT, De La Rue SA, Cominelli F. Role of interleukin 6 in a murine model of Crohn‘s ileitis: are cytokine/anticytokine strategies the future for IBD therapies? Gut 2006; 55(9): 1226–1227.
6. Winter TA, Lemmer ER, O´Keefe SJ et al. The effect of severe undernutrition, and subsequent refeeding on digestive function in human patients. Eur J Gastroenterol Hepatol 2000; 12(2): 191–196.
7. Rothfuss KS, Stange EF, Herrlinger KR. Extraintestinal manifestation and complications in inflammatory bowel diseases. World J Gastroenterol 2006; 12(30): 4819–4831.
8. Lukáš M. Idiopatické střevní záněty a kolorektální karcinom. Nové souvislosti a další perspektivy. Čes a Slov Gastroenterol Hepatol 2006; 60 : 113–118.
9. Solem CA, Loftus EV Jr, Fletcher JG et al. Small-bowel imaging in Crohn‘s disease: a prospective, blinded, 4-way comparison trial. Gastrointest Endosc 2008; 68(2): 255–266.
10. Colombel JF, Solem CA, Sandborn WJ et al. Quantitative measurement and visual assessment of ileal Crohn´s disease activity by computed tomography enterography: correlation with endoscopic severity and C reactive protein. Gut 2006; 55(11): 1561–1567.
11. Florie J, Horsthuis K, Hommes DW et al. Magnetis resonance imaging compared with ileocolonoscopy is evaluating disease severity in Crohn´s disease. Clin Gastroenterol Hepatol 2005; 3(12): 1221–1228.
12. Stathaki MI, Koukouraki SI, Karkavitsas NS et al. Role of scintigraphy in inflammatory bowel disease. World J Gastroenterol 2009; 15(22): 2693–2700.
13. Bruining DH, Loftus EV Jr. Crohn disease clinical issues and treatment: what the radiologist need to know and what the gastroenterologist want to know. Abdom Imaging 2009; 34(3): 297–302.
14. Ksiądzyna D, Semianów-Wejchert J, Nawrot U et al. Anti-Saccharomyces cerevisiae antibodies, anti-mannan Candida antibodies and fungal colonization of the gastrointestinal tract in patients with ulcerative colitis, Crohn´s disease and irritable bowel syndrome. Čes a Slov Gastroenterol Hepatol 2009; 63 : 6–13.
15. Sandborn WJ, Loftus EV Jr, Colombel JF et al. Evaluation of serologic disease markers in a population – based cohort of patients with ulcerative colitis and Crohn´s disease. Inflamm Bowel Dis 2001; 7(3): 192–201.
16. Sýkora J, Varvařovská J, Stožický F et al. Orgánově specifické protilátky u dětí s idiopatickými střevními záněty a jejich užití v klinické praxi. Čas Lék Čes 2000; 139(23): 735–737.
17. Austin GL, Shaheen NJ, Sandler RS. Positive and negative predictive values: use of inflammatory bowel disease serologic markers. Am J Gastroenterol 2006; 101(3): 413–416.
18. Hanauer SB, Strömberg U. Oral Pentasa in the treatment of active Crohn‘s disease: A meta-analysis of double-blind, placebo-controlled trials. Clin Gastroenterol Hepatol 2004; 2(5): 379–388.
19. Akobeng AK, Gardener E. Oral 5-aminosalicylic acid for maintenance of medically-induced remission in Crohn‘s Disease. Cochrane Database Syst Rev 2005; 25(1): CD003715.
20. Prantera C, Scribano ML. Antibiotics and probiotics in inflammatory bowel disease: why, when and how. Curr Opin Gastroenterol 2009; 25(4): 329–333.
21. Sandborn WJ, Löfberg R, Feagan BG et al. Budesonide for maintenance of remission in patients with Crohn‘s disease in medically induced remission: a predetermined pooled analysis of four randomized, double-blind, placebo-controlled trials. Am J Gastroenterol 2005; 100(8): 1780–1787.
22. Peeters M, Joossens S, Vermeire S et al. Diagnostic Value of anti-Saccharomyces cerevisiae and antineutrophil cytoplasmic autoantibodies in inflammatory bowel disease. Am J Gastroenterol 2001; 96(3): 730–734.
23. Koutroubakis IE, Petinaki E, Mouzas IA et al. Anti-Saccharomyces cerevisiae mannan antibodies and antineutrophil cytoplasmic autoantibodies in Greek patients with inflammatory bowel disease. Am J Gastroenterol 2001; 96(2): 449–454.
24. Vasiliauskas EA, Kam LY, Karp LC et al. Marker antibody expression stratifies Crohn´s disease into immunologically homogenous subgroups with distinct clinical characteristics. Gut 2000; 47 : 487–496.
25. Forcione DG, Rosen MJ, Kisiel JB, Sands BE. Anti-Saccharomyces cerevisiae antibody (ASCA) positivity is associated with increased risk for early surgery in Crohn´s disease. Gut 2004; 53 : 1117–1122.
26. Desir B, Amre DK, Lu SE et al. Utility of serum antibodies in determining clinical course in pediatric Crohn´s disease. Clin Gastroenterol Hepatol 2004; 2(2): 139–146.
27. Dubinsky MC, Lin YC, Dutridge D et al. Serum immune responses predict rapid disease progression among children with Crohn´s disease: immune responses predict disease progression. Am J Gastroenterol 2006; 101(2): 360–367.
28. Koutroubakis IE, Drygiannakis D, Karmiris K et al. Pancreatic autoantibodies in Greek patients with inflammatory bowel disease. Dig Dis Sci 2005; 50(12): 2330–2334.
29. Mottet C, Juillerat P, Pittet V et al. Pregnancy and breastfeeding in patients with Crohn‘s disease. Digestion 2007; 76(2): 149–160.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2010 Issue 3-
All articles in this issue
- The role of anti-Saccharomyces cerevisiae antibody in early diagnosis of Crohn’s disease
- Therapeutic single balloon enteroscopy used for treatment of stenosis of hepatico-jejunoanastomosis on Roux-en-Y Loop
- Gastroprotection in long-term use of non-steroidal antirheumatic drugs and low-dose acetylosalicylic acid
- Histopathological diagnosis and differential diagnosis of celiac disease: a review for gastroenterologists
- Rifaximin in the treatment of Crohn’s disease. Results of the GRACE 02 study
- VI spring gastroenterology conference in Kaprun
- Cancer preventive vaccination against hereditary non-polyposis colorectal cancer?
- Radiofrequency ablation of Barrett’s esophagus accompanied by dysplasia. How long will we let these patients wait?
- Thoughts and insight concerning several congresses and their relevance
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The role of anti-Saccharomyces cerevisiae antibody in early diagnosis of Crohn’s disease
- Therapeutic single balloon enteroscopy used for treatment of stenosis of hepatico-jejunoanastomosis on Roux-en-Y Loop
- Histopathological diagnosis and differential diagnosis of celiac disease: a review for gastroenterologists
- Gastroprotection in long-term use of non-steroidal antirheumatic drugs and low-dose acetylosalicylic acid
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

