-
Medical journals
- Career
Manažment osteoporózy u diabetika
Authors: Peter Jackuliak; Magdaléna Kovářová; Martin Kužma; Zdenko Killinger; Juraj Payer
Authors‘ workplace: V. interná klinika LF UK a UNB, Nemocnica Ružinov, Bratislava
Published in: Forum Diab 2021; 10(1): 17-24
Category:
Overview
Diabetes mellitus (DM) a osteoporóza predstavujú dve závažné civilizačné ochorenia, ktorých incidencia narastá. Osteoporóza a osteoporotické zlomeniny sú už akceptovanou závažnou komorbiditou a komplikáciou diabetes mellitus. V rámci manažmentu diabetika je nutné cielene po riziku osteoporózy a zlomenín pátrať, ako aj následne prijať adekvátne preventívne a liečebné opatrenia. V liečbe osteoporózy u DM sa využívajú dostupné antiresorpčné a osteoanabolické preparáty. Väčšina údajov o ich efekte pochádza len z klinickej praxe. Z diabetologického hľadiska je nutné dosiahnuť optimálnu glykemickú kompenzáciu, avšak s ohľadom na efekt antidiabetík na kosť. V uvedenom prehľade sú uvedené údaje z klinických štúdií o efekte antiporotík u diabetikov, ako aj efekte antidiabetík na kosť.
Klíčová slova:
antidiabetická terapia – antiresorpčná terapia – diabetes mellitus – osteoporotická fraktúra
Úvod
V posledných rokoch sa závažným problémom u diabetes mellitus (DM) 1. typu aj 2. typu (DM1T, DM2T) stala fragilita kostí, riziko osteoporózy a osteoporotických fraktúr (tab. 1) [1]. U pacientov s DM1T je 2 - až 6-násobne vyššie riziko osteoporotickej fraktúry než u nediabetickej populácie [2]. Podľa jednej recentnej analýzy, skoro polovica pacientov s DM1T malo aspoň 1 faktúru po diagnostikovaní DM [3]. Výskyt bol vyšší pri dlhšom trvaní DM, diagnóze DM pred 20. rokom života, rodinnej anamnéze osteoporózy. Pacienti s DM2T majú 1,2 - až 3-násobne vyššie riziko fraktúry v porovnaní s nediabetickou populáciou, čiastočne ide o fraktúry bedra, ale hlavne o zlomeniny horných končatín a členka [4,5]. Väčšie riziko fraktúr je hlavne u pacientov s BMI < 30 kg/m2 v porovnaní s obéznymi jedincami [6], u pacientov s trvaním DM2T < 10 rokov, nízkou fyzickou aktivitou, vyšším vekom, na liečbe inzulínom [5]. Dôležitým rizikovým faktorom je zvýšené riziko pádov [7,8].
Patogenéza kostných zmien u diabetikov je komplexná. Diabetes ovplyvňuje kostný metabolizmus viacerými mechanizmami [9]. Diabetici majú znížený počet a alterované funkcie osteoblastov. Taktiež je prítomná porucha diferenciácie osteoblastov – kmeňové bunky (MSC – Mesenchymal Stem Cells) sa diferencujú na adipocyty, čo vedie k adipozite kostnej drene, v ktorej adipocyty produkujú zápalové cytokíny a chemokíny. V dôsledku toho sa v kostnej dreni akumulujú proinflamačné makrofágy M1. Porucha osteocytov vedie k zvýšenej expresii sklerostínu, inhibítoru osteoblastov a RANKL. Je tiež zvýšený fibroblastový rastový faktor 23 (Fibroblast Growth Factor 23 – FGF23), čo podmieňuje aj tvorbu aktívneho D-hormónu. Zníženie počtu endoteliálnych progenitorových buniek (Endothelial Progenitor Cells – EPC) vedie k zníženej permeabilite ciev, čo podmieňuje mikrohypoxiu kosti. Zvýšenie počtu koncových produktov pokročilej glykácie (Advanced glycation end products – AGEs) v dôsledku metabolickej (de)kompenzácie tiež negatívne alteruje kostnú matrix, čo vyúsťuje ku väčšej kortikálnej porozite.
Table 1. Vplyv DM a prediabetes na kosť. Upravené podľa [1] ![Vplyv DM a prediabetes na kosť. Upravené podľa [1]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/39b69da758a522088f8fab3168154be3.jpeg)
AGEs – koncové produkty pokročilej (neenzymatickej) glykácie/Advanced Glycation Endproducts ↑ – zvýšenie ↓ – zníženie ↔ – bez zmeny (oproti kontrole), ? – neznáme zmeny Osteoporotické fraktúry sú akceptované v medzinárodných odporúčaniach ako komorbidita DM, a teda pri komplexnom manažmente diabetika musíme myslieť aj na prevenciu a liečbu osteoporózy [10]. Na druhej strane najmä starší pacienti s DM2T majú zvýšené riziko zlomenín (bedra, proximálneho humeru a členku) aj v dôsledku komorbidít a diabetických komplikácií [11–14].
Diagnostika osteoporózy u diabetikov
V rámci diagnostiky osteoporózy u pacientov s diabetes mellitus sú dnes už vypracované algoritmy (schéma 1), ktoré sú zosumarizovaním súčasných poznatkov o tzv. diaporóze. Jeden z posledných a teda najaktuálnejších je odporúčanie tzv. Bone and Diabetes Working Group pri Medzinárodnej nadácii osteoporózy (International Osteoporosis Foundation – IOF), ktorá pod vedením prof. S. Ferrariho vypracovala guidelines Diagnosis and management of bone fragility in diabetes: an emerging challenge. [15]
Schéma 1. Algoritmus manažmentu osteoporózy u pacienta s diabetes mellitus. Upravené podľa [15] ![Schéma 1. Algoritmus manažmentu osteoporózy u pacienta s diabetes mellitus. Upravené podľa [15]](https://pl-master.mdcdn.cz/media/image_pdf/4b3f00ca1e4b6eb3dac6334a33966273.jpeg?version=1628588462)
DXA – denzitometria, FRAX – nástroj pre výpočet rizika zlomenín/Fracture Risk Assessment Tool, TBS – trabekulárne kostné skóre/Trabecular Bone Score, VFA – hodnotenie vertebrálnych fraktúr/Vertebral Fracture Assessment
Pre diabetes špecifické rizikové faktory: trvanie DM > 5 rokov; liečba DM: inzulín, glitazóny, gliflozíny; HbA1c > 7 %; mikrovaskulárne komplikácie: periférna a autonómna neuropatia, retinopatia, nefropatiaV rámci diagnostiky osteoporózy, najmä diabetikov s DM2T je dôležité okrem hodnotenia kvantity kostnej hmoty hodnotiť aj jej kvalitu, najmä využitím nových modalít, ako je trabekulárne kostné skóre (Trabecular Bone Score – TBS) [16–18]. Pri hodnotení len hustoty kostného minerálu (Bone Mineral Density – BMD) sa diskutuje o znížení prahu T-skóre na -2,0 SD ako hodnoty, kedy treba iniciovať antiporotickú terapiu [19]. Pri využití nástroja FRAX (Fracture Risk Assessment Tool) je riziko hlavne u DM2T podhodnotené (v dotazníku nie je vôbec uvedený ako rizikový faktor), a preto sa odporúča uviesť rizikový faktor „9. reumatoidná artritída“, pretože riziko pri DM2T a pri reumatoidnej artritíde je porovnateľné [20,21].
Manažment osteoporózy u diabetikov
Pri liečbe diabetika z osteologického hľadiska je nutné brať do úvahy dva základné pohľady: akú antiporotickú liečbu treba zvoliť a ako liečiť samotný diabetes mellitus. O efekte antiporotík u diabetikov sa vie len málo. Väčšina údajov pochádza len z reálnej klinickej praxe. V klinických štúdiách je málo prác, ktoré cielene porovnávali efekt antiporotík u diabetikov. Väčšinou sa jedná len o post-hoc analýzy hlavných štúdií pre daný liek. Prehľad používaných antiabetík a údajov o ich efekte u pacientov s DM uvádza tab. 2.
Table 2. Liečba osteoporózy u pacientov s diabetes mellitus 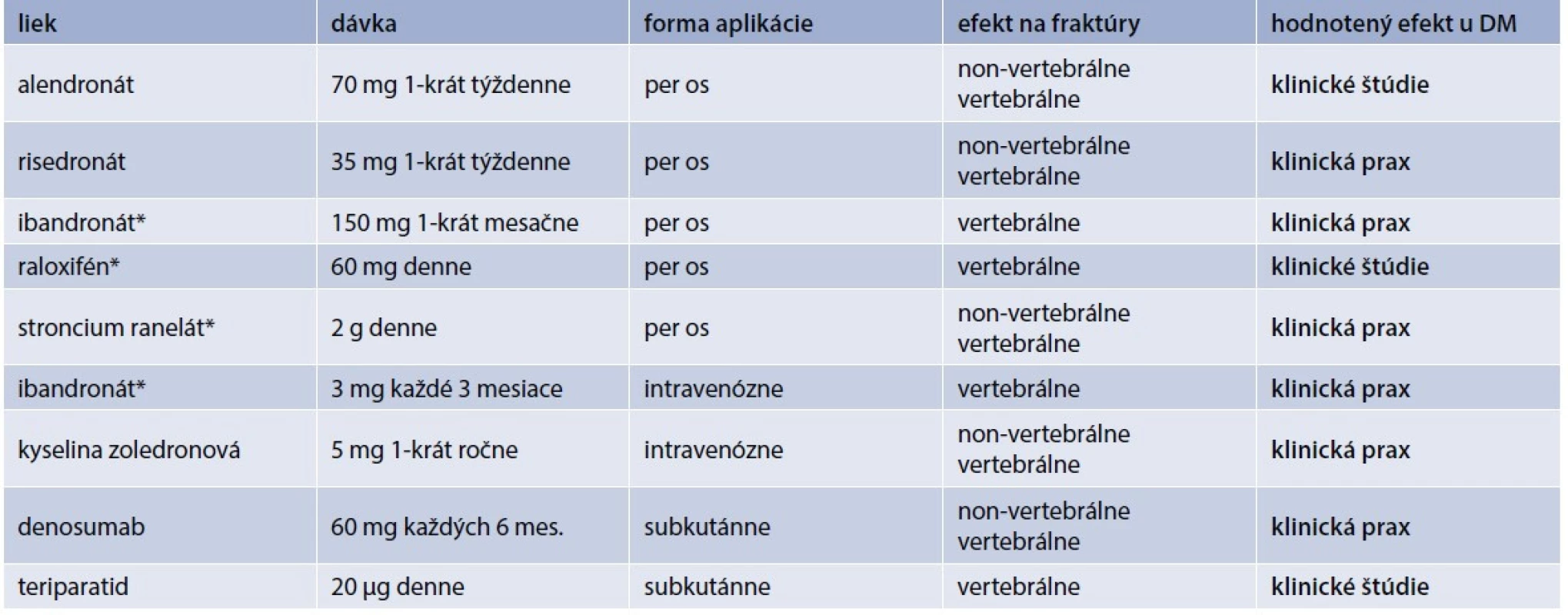
* len u postmenopauzálnych žien Alendronát zvyšuje kostnú denzitu (Bone Mineral Density – BMD) u rozličných skupín postmenopauzálnych žien. Efekt alendronátu u diabetikov sledovala štúdia kolektívu Keegan T et al [22]. Využili údaje zo štúdie FIT (Fracture Intervention Trial), čo bola randomizovaná, dvojito zaslepená, placebom kontrolovaná štúdia, ktorá potvrdila redukciu osteoporotických fraktúr u postmenopauzálnych žien s osteoporózou [23]. Retrospektívna analýza podskupiny pacientok s DM2T (n = 297), u ktorých bola prítomnosť DM zisťovaná na základe anamnézy (anamnestický údaj, liečba inzulínom alebo perorálnym antidiabetikom), alebo ako glykémia nalačno ≥ 7 mmol/l. 3-ročná liečba alendronátom bola u týchto pacientok spojená so zvýšením BMD o 6,6 % v lumbo-sakrálnej (LS) oblasti, 2,4 % v oblasti bedra (hip). V skupine liečenej placebom došlo naopak k poklesu BMD (teda s výnimkou oblasti LS, v ktorej nebola žiadna zmena). Liečba alendronátom bola dobre tolerovaná [22]. Tým sa potvrdil rovnaký efekt alendronátu u diabetickej aj nediabetickej populácie.
Na druhej strane existujú aj štúdie, ktoré efekt alendronátu na zmenu BMD nepreukázali. Jednalo sa ale len o malú kohortu postmenopauzálnych žien (vek 67,6 ± 7,3 rokov) s dlhším trvaním DM2T (12,8 ± 6,8 rokov) [24].
Efekt risedronátu u diabetikov bol analyzovaný z kombinovaných údajov 3 klinických štúdií III. fázy. Jednalo sa o kohortu 885 pacientov, z ktorých DM malo 53 pacientov (vs 832 pacientov bez DM). Efekt risedronátu na BMD nebol rozdielny u diabetikov oproti nediabetickej populácii. Pokles kostných markerov (NTX, CTX, BAP) bol u diabetikov o niečo menší, ale štatistickú významnosť nedosiahol. Čiže aj risedronát je u pacientov s DM rovnako efektívny pri liečbe osteoporózy [25].
Efekt raloxifénu u diabetikov bol nepriamo sledovaný univariatnou analýzou 30 rizikových faktorov vertebrálnych zlomenín v štúdii MORE (Multiple Outcomes of Raloxifene Evaluation). Napriek menšiemu množstvu pacientov bol raloxifén efektívnejší u pacientov s DM2T vs bez DM (p = 0,04). Zaujímavým zistením bolo, že u pacientov s vyššou hladinou triacylglycerolov, najmä u mladších a s nižšou hodnotou BMD v LS-oblasti bol väčší efekt raloxifénu na redukciu vertebrálnych fraktúr [26]. A práve pacienti s DM2T majú typickú aterogénnu dyslipidémiu s vysokými hodnotami triacylglycerolov, čo nepriamo môže svedčiť na benefitný efekt raloxifénu u diabetikov [27,28].
Efekt teriparatidu sledovala štúdia DANCE (Direct Analysis of Nonvertebral Fracture in the Community Experience Study), ktorá zahŕňala 4 092 pacientov (291 pacientov s DM2T vs 3 751 bez DM). Podobne ako v nediabetikej populácii aj u pacientov s DM došlo v priebehu liečby k redukcii incidencie non-vertebrálnych fraktúr, vzostupu BMD a zníženiu bolestí chrbta. Tento efekt bol prítomný už po 6 mesiacoch a pretrvával celých 24 mesiacov liečby [29]. Podobné efekty teriparatidu na klinické fraktúry u diabetikov po 6 mesiacoch liečby potvrdila aj štúdia Real-World Effectiveness of Teriparatide. U diabetickej populácie (n = 527) došlo k redukcii vertebrálnych fraktúr (o 86 %, p < 0,0001), nonvertebrálnych fraktúr (o 68 %, p = 0,0018) a všetkých klinických fraktúr (o 77 %, p < 0,0001). Efekt redukcie fraktúr bol vyšší než v nediabetickej populácii [30].
Vzhľadom na patofyziológiu osteoporózy u diabetikov, u ktorej sa zdôrazňuje inhibícia formácie, aktivity a prežívania osteoklastov, by vzhľadom na svoj mechanizmus mal byť účinný aj denosumab. Štúdie venujúce sa efektu denusomabu u diabetikov ale chýbajú. Práve prebieha intervenčná štúdia (ClinicalTrials.gov Identifier: NCT03457818) na efekt denosumabu u pacientov s DM2T. Výsledky by mohli byť známe v lete 2021. Primárnym cieľom je dokázať pozitívny efekt na zníženie kortikálnej porozity pomocou HR-pQCT (High Resolution peripheral Quantitative Computed Tomography) u diabetikov liečeným denosumabom. Vychádza z poznatkov a záverov QCT imaging substudy, podskupiny zo štúdie FREEDOM (Fracture Reduction Evaluation of Denosumab in Osteoporosis) [31], ktorá preukázala u 58 pacientov s osteoporózou (n = 32 denosumab, n = 26 placebo) zníženie porozity proximálneho femuru pri liečbe denosumabom [32].
V literatúre sa dokonca stretneme aj s prvými údajmi o tom, že blokáda RANKL by mohla mať aj pozitívny efekt na glukózový metabolizmus. Napoli et al preukázali, že liečba denosumabom u pacientok s DM2T bez antidibetickej liečby mala vplyv na pokles glykémie nalačno v porovnaní s placebovým ramenom (o -0,4 mmol/l; 95%CI -0,7 až -0,1; p = 0,02) [33].
Spočiatku bola teória, že nekarboxylovaný osteokalcín (Undercarboxylated OsteoCalcin – ucOC) pôsobí u animálnych modelov hlodavcov ako hormón, ktorý stimuluje inzulínovú senzitivitu a sekréciu [34]. Ak teda ucOC má podobnú úlohu u ľudí, potom by antiresorpčná terapia, ktorá redukuje ucOC, mohla zvyšovať riziko inzulínovej rezistencie a DM. Ale post-hoc analýza 3 štúdií FIT (Fracture Intervention Trial) s alendronátom (N = 6151), HORIZON-PFT (Health Outcomes and Reduced Incidence with Zoledronic Acid Once Yearly Pivotal Fracture Trial; N = 7 113) s kyselinou zoledrónovou a FREEDOM (Fracture Reduction Evaluation of Denosumab in Osteoporosis Every 6 Months; N = 7 076) s denosumabom preukázala, že antiresorpčná terapia nemá klinicky významný vplyv na glykémiu nalačno, telesnú hmotnosť, či riziko DM u postmenopauzálnych žien [35]. Dokonca recentne bola publikovaná práca, ktorá preukázala, že 70 mg alendronátu 1-krát ročne zlepšuje glykémiu nalačno, glykovaný hemoglobín a inzulinémiu [36]. Bolo to potvrdené na kohorte 60 postmenopauzálnych žien vo veku 45 až 60 rokov, ktoré boli rozdelené na intervenčné a placebové rameno. V skupine liečenej alendronátu došlo k výraznejšiemu poklesu glykémie nalačno (-0,5 mmol/l vs -0,1 mmol/l; p = 0,002), HbA1c (-0,2 % vs -0,09 %; p = 0,015). Samozrejme sú potrebné ďalšie práce preukazujúce eventuálny prídatný benefitný efekt antiresorpčnej terapie na glykémiu.
Základom manažmentu diabetických komplikácií a teda aj kostných diabetických komplikácií je dosiahnutie optimálnej glykemickej kompenzácie. Mnohé účinné antidiabetiká môžu ale ovplyvňovať kostný metabolizmus, a to pozitívne ale aj negatívne [37,38]. Za posledné roky narastá počet údajov o vplyve antidiabetík na kostnú hustotu a riziko fraktúr (tab. 3) [39–41]. Problémom klinickej praxe na hodnotenie efektu antidiabetík na kosť je fakt, že veľká väčšina pacientov má kombinovanú antidiabetickú liečbu [4]. Avšak pri manažmente diabetika z osteologického hľadiska by sa mal brať do úvahy aj efekt antidiabetík na kostný metabolizmus. Yavropoulou et al v retrospektívnej analýze potvrdili, že práve antidiabetiká majú signifikantný vplyv na výskyt osteoporotických fraktúr (F = 4,260; p = 0,042), ako aj vplyv na 10-ročné riziko vzniku osteoporotickej fraktúry hodnotenej pomocou FRAX [42,43].
Table 3. Efekt antidiabetík na kostný metabolizmus. Upravené podľa [44–46] ![Efekt antidiabetík na kostný metabolizmus. Upravené podľa [44–46]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/48ed469a892e9aa4a4a4a022739df5ad.jpeg)
?? – neznámy efekt ↑ – zvýšenie ↓ – zníženie ↔ – neutrálny vplyv (nevedie k zmene) Schéma 2. Algoritmus liečby diabetika s osteoporózou 
Metformín, ako základný liek manažmentu DM2T, má dokázané, že zvyšuje proliferáciu a diferenciáciu osteoblastov a potencuje tvorbu kolagénu typu 1. Na druhej strane inhibuje diferenciáciu adipocitov [47,48]. Početné štúdie preukázali benefitný proosteogénny vplyv metformínu in vitro. Liečba metformínom dokáže in vitro znížiť vystimulovanú osteoformáciu v dôsledku AGEs [49,50]. Analýza kohorty Rochester potvrdila, že metformín dokáže znížiť riziko fraktúr u pacientov s DM2T (HR 0,7) [49]. Výsledky štúdií vplyvu metformínu na kostný metabolizmus sú stále nejednoznačné [51], avšak sumárne môžeme tvrdiť, že zlepšuje kostnú hustotu a negatívne neovplyvňuje riziko fraktúr. Zároveň pri jeho komplexnom pôsobení pozitívne ovplyvňuje iné diabetické komplikácie, a tým prispieva aj k redukcii iných rizikových faktorov vzniku osteoporotických fraktúr.
Sulfonylureové preparáty účinne znižujú glykémiu a sú často používané ako druholíniová terapia (po metformíne). Samozrejme dosiahnutie optimálnej glykemickej kompenzácie bude mať pozitívny efekt aj na kostný metabolizmus, najmä cez zvýšenie sekrécie IGF1 [52]. Mehta et al na kongrese ADA 2014 prezentovali ale prvé údaje o tom, že liečba sulfonylureovými preparátmi zvyšuje riziko fraktúr. Retrospektívne analyzoval údaje z registra MORE (Medical Outcomes for Effectiveness and Economics), pričom výskyt fraktúr bol u 6,8 % všetkých pacientov užívajúcich metformín, u 10,9 % pacientov užívajúcich glitazóny a u 9,7 % pacientov užívajúcich sulfonylureové preparáty. V porovnaní s metformínom mali glitazóny (HR 1,40; p < 0,0001) ale aj sulfonylureové preparáty (HR 1,09; p = 0,0054) zvýšené riziko fraktúr [53,54].
Glitazóny (tiazolidíndióny) zvyšujú inzulínovú senzitivitu, pretože pôsobia ako aktivátory PPARã (Peroxisome Proliferator-Activated Receptor gamma). PPARã sú tiež exprimované v kostnej dreni, na osteoblastoch i osteoklastoch a majú dôležitú úlohu v procese diferenciácie prekurzorových buniek na osteoblasty [55]. Glitazóny zvyšujú adipozitu kosti, znižujú aromatázovú aktivitu, potencujú diferenciáciu osteoklastov, čo všetko vedie k zvýšenému odbúravaniu kostnej hmoty [56,57]. Metaanalýza dlhodobého efektu glitazónov na kosť potvrdila zníženie kostnej hustoty u žien (ale nie u mužov) tak u rosiglitazónu, ako aj u pioglitazónu [57]. Vyvíjajú sa ale nové analógy tiazolidíndiónov s nízkou afinitou k PPARã, ktoré by mohli mať neutrálny vplyv z pohľadu kostného metabolizmu [58].
Inkretínová liečba zahŕňa dve skupiny antidiabetík – receptorové agonisty GLP1 (GLP1 RA) a inhibítory dipeptidylpeptidázy 4 (DPP4i, gliptíny). Štúdie preukázali že GLP1 RA, ale aj iné inkretíny (GIP a GLP2) môžu mať pozitívny efekt – antiresorpčný a osteoanabolický. Mechanizmus zahŕňa rôzne metabolické cesty – Wnt/beta-catenin, OPG/RANKL (Osteoprotegerin/Receptor activator of nuclear factor kappa-B ligand) či pôsobenie sklerostínu [59]. Metaanalýza 28 štúdií o efekte DPP4i na kosť preukázala 40% redukciu fraktúr u pacientov liečených DPP4i v porovnaní s placebom či inými antidiabetikami [60]. Z klinického pohľadu používanie GLP1 RA a DPP4i má benefitný vplyv na kostnú hustotu a minimálne neutrálny vplyv na riziko fraktúr.
Inhibícia nátrium-glukózového kotransportéra 2 je nová účinná modalita liečby. Vzhľadom na ovplyvnenie tubulárnych mechanizmov je predpoklad, že zasiahnu aj do kalcium-fosfátového metabolizmu. Prvé štúdie s dapagliflozínom nepreukázali zmeny hladín sérového kalcia či vitamínu D, avšak mierny vzostup hladín magnézia, fosfátov a parathormónu [61,62]. Dapagliflozín nemal žiadny vplyv na zmeny markerov kostného obratu u postmenopauzálnych žien [63]. Avšak nedávno publikované práce preukázali zvýšený výskyt fraktúr pri užívaní dapagliflozínu a kanagliflozínu [64,65]. Americká lieková agentúra FDA (Food and Drug Administration) vydala v novembri 2015 varovanie ohľadne zvýšeného rizika fraktúr pri liečbe kanagliflozínom. Preto použitie tejto skupiny u rizikových skupín z osteologického hľadiska by sa malo zvažovať.
Liečba inzulínom u nedostatočne glykemicky kompenzovaných pacientov s DM1T viedla aj k zlepšeniu kostnej hustoty a markerov kostného obratu [66]. V priebehu posledných rokov bol dokázaný vplyv inzulínu a IGF1 v procese diferenciáce osteoblastov [67,68]. Inzulín ale zasahuje aj do mnohých iných metabolických cyklov, ktoré súvisia s kostným metabolizmom, napr. Wnt/β-katenin signalizácia či metabolizmus BMP2 [67]. Avšak niektoré štúdie potvrdili zvýšený výskyt vertebrálnych fraktúr u pacientov s DM2T liečených inzulínom [69]. Treba si ale uvedomiť, že pacienti s DM2T liečení inzulínom sú väčšinou pacienti s dlhším trvaním DM alebo s diabetickými komplikáciami. Inzulínová terapia je asociovaná aj s vyšším výskytom hypoglykemických epizód, ktoré zvyšujú riziko pádov, a tým prispievajú k zvýšenému riziku fraktúr [70,71]. Na druhej strane zlepšenie glykemickej kompenzácie dosiahnutej inzulínovou terapiou viedlo k zlepšeniu diabetických komplikácií a k redukcii pádov [72].
Záver
Osteoporóza a osteoporotické fraktúry sú závažným problémom diabetikov. V rámci komplexného manažmentu diabetes mellitus treba cielene po rizikových pacientoch pátrať, včas ich identifikovať a následne správne manažovať (schéma 2). Z hľadiska diabetológie je nutné dosiahnuť optimálnu glykemickú kompenzáciu, pričom volíme antidiabetiká s pozitívnym či neutrálnym efektom na kosť (metformín, gliptíny a GLP1 RA). Z pohľadu osteológie sú glitazóny a sulfonylureové preparáty rizikové, podobne aj pri gliflozínoch je riziko fraktúr zvýšené. Inzulínová terapia je benefitná hlavne u diabetikov s DM1T, pri ktorom prevažuje pozitívny osteoanabolický efekt inzulínu. U diabetikov s DM2T má význam hlavne s cieľom dosiahnuť optimálnu glykemickú kompenzáciu avšak s ohľadom na riziko hypoglykémií, ktoré môžu zvyšovať riziko pádov. Pri manažmente osteoporózy je základom adekvátna suplementácia kalcia a vitamínu D. Z bežných antiporotík sú u diabetikov efektívne bisfosfonáty a denosumab. Taktiež u závažnej osteoporózy je možné použiť osteoanabolickú liečbu teriparatidom, ktorý je aj u diabetikov efektívny.
Autori prehlasujú, že nemajú konflikt záujmov.
doc. MUDr. Peter Jackuliak, PhD., MPH | peter.jackuliak@fmed.uniba.sk | www.fmed.uniba.sk
Doručené do redakcie 13. 4. 2021
Prijaté po recenzii 28. 4. 2021
Sources
- Costantini S, Conte C. Bone health in diabetes and prediabetes. World J Diabetes 2019; 10(8): 421–445. Dostupné z DOI: <http://dx.doi.org/10.4239/wjd.v10.i8..
- Shah VN, Shah CS, Snell-Bergeon JK. Type 1 diabetes and risk of fracture: meta-analysis and review of the literature. Diabet Med 2015; 32(9): 1134–1142. Dostupné z DOI: <http://dx.doi.org/10.1111/dme.12734>.
- Dhaliwal R, Foster NC, Boyle C et al. Determinants of fracture in adults with type 1 diabetes in the USA: Results from the T1D Exchange Clinic Registry. J Diabetes Complications 2018; 32(11): 1006–1011. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jdiacomp.2018.08.016>.
- Vestergaard P, Rejnmark L, Mosekilde L. Relative fracture risk in patients with diabetes mellitus, and the impact of insulin and oral antidiabetic medication on relative fracture risk. Diabetologia 2005; 48(7): 1292–1299. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–005–1786–3>.
- Wang H, Ba Y, Xing Q et al. Diabetes mellitus and the risk of fractures at specific sites: a meta-analysis. BMJ Open 2019; 9(1): e024067. Dostupné z DOI: <http://dx.doi.org/10.1136/bmjopen-2018–024067>.
- Moayeri A, Mohamadpour M, Mousavi SF et al. Fracture risk in patients with type 2 diabetes mellitus and possible risk factors: a systematic review and meta-analysis. Ther Clin Risk Manag 2017; 13 : 455–468. Dostupné z DOI: <http://dx.doi.org/10.2147/TCRM.S131945>.
- Maurer MS, Burcham J, Cheng H. Diabetes mellitus is associated with an increased risk of falls in elderly residents of a long-term care facility. J Gerontol A Biol Sci Med Sci 2005; 60(9): 1157–1162. Dostupné z DOI: <http://dx.doi.org/10.1093/gerona/60.9.1157>.
- Patel S, Hyer S, Tweed K et al. Risk factors for fractures and falls in older women with type 2 diabetes mellitus. Calcif Tissue Int 2008; 82(2): 87–91. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–007–9082–5>.
- Picke A-K, Campbell G, Napoli N et al. Update on the impact of type 2 diabetes mellitus on bone metabolism and material properties. Endocr Connect 2019; 8(3): R55-R70. Dostupné z DOI: <http://dx.doi.org/10.1530/EC-18–0456>.
- [American Diabetes Association]. 4. Comprehensive Medical Evaluation and Assessment of Comorbidities: Standards of Medical Care in Diabetes 2020. Diabetes Care 2020; 43(Suppl 1): S37-S47. Dostupné z DOI: <http://dx.doi.org/10.2337/dc20-S004>.
- Cummings SR, Nevitt MC, Browner WS et al. Risk factors for hip fracture in white women. Study of Osteoporotic Fractures Research Group. N Engl J Med 1995; 332(12): 767–773. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM199503233321202>.
- Schwartz AV, Sellmeyer DE, Ensrud KE et al. Older women with diabetes have an increased risk of fracture: a prospective study. J Clin Endocrinol Metab 2001; 86(1): 32–38. Dostupné z DOI: <http://dx.doi.org/10.1210/jcem.86.1.7139>.
- Forsén L, Meyer HE, Midthjell K et al. Diabetes mellitus and the incidence of hip fracture: results from the Nord-Trondelag Health Survey. Diabetologia 1999; 42(8): 920–925. Dostupné z DOI: <http://dx.doi.org/10.1007/s001250051248>.
- Michaelsson K, Holmberg L, Mallmin H et al. Diet and hip fracture risk: a case-control study. Study Group of the Multiple Risk Survey on Swedish Women for Eating Assessment. Int J Epidemiol 1995; 24(4): 771–782. Dostupné z DOI: <http://dx.doi.org/10.1093/ije/24.4.771>.
- Ferrari SL, Abrahamsen B, Napoli N et al. Diagnosis and management of bone fragility in diabetes: an emerging challenge. Osteoporos Int 2018; 29(12): 2585–2596. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–018–4650–2>.
- Leslie WD, Aubry-Rozier B, Lamy O et al. TBS (trabecular bone score) and diabetes-related fracture risk. J Clin Endocrinol Metab 2013; 98(2): 602–609. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2012–3118>.
- Ebrahimpur M, Sharifi F, Nezhad FA et al. Effect of diabetes on BMD and TBS values as determinants of bone health in the elderly: Bushehr Elderly Health program. J Diabetes Metab Disord 2019; 18(1): 99–106. Dostupné z DOI: <http://dx.doi.org/10.1007/s40200–019–00395–1>.
- Jackuliak P, Kužma M, Killinger Z et al. Good long-term glycemic compensation is associated with better trabecular bone score in postmenopausal women with type 2 diabetes. Physiol Res 2019; 68(Suppl 2): S149-S156. Dostupné z DOI: <http://dx.doi.org/10.33549/physiolres.934304>.
- Schwartz AV, Vittinghoff E, Bauer DC et al. Association of BMD and FRAX score with risk of fracture in older adults with type 2 diabetes. JAMA 2011; 305(21): 2184–2192. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2011.715>.
- Leslie WD, Rubin MR, Schwartz AV et al. Type 2 diabetes and bone. J Bone Miner Res 2012; 27(11): 2231–2237. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.1759>.
- Giangregorio LM, Leslie WD, Lix LM et al. FRAX underestimates fracture risk in patients with diabetes. J Bone Miner Res 2012; 27(2): 301–308. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.556>.
- Keegan TH, Schwartz AV, Bauer DC et al. Effect of alendronate on bone mineral density and biochemical markers of bone turnover in type 2 diabetic women: the fracture intervention trial. Diabetes Care 2004; 27(7): 1547–1553. Dostupné z DOI: <http://dx.doi.org/10.2337/diacare.27.7.1547>.
- Cummings SR, Black DM, Thompson DE et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: results from the Fracture Intervention Trial. JAMA 1998; 280(24): 2077–2082. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.280.24.2077>.
- Dagdelen S, Sener D, Bayraktar M. Influence of type 2 diabetes mellitus on bone mineral density response to bisphosphonates in late postmenopausal osteoporosis. Adv Ther 2007; 24(6): 1314–1320. Dostupné z DOI: <http://dx.doi.org/10.1007/BF02877778>.
- Inoue D, Muraoka R, Okazaki R et al. Efficacy and Safety of Risedronate in Osteoporosis Subjects with Comorbid Diabetes, Hypertension, and/or Dyslipidemia: A Post Hoc Analysis of Phase III Trials Conducted in Japan. Calcif Tissue Int 2016; 98(2): 114–122. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–015–0071–9>.
- Johnell O, Kanis JA , Black DM et al. Associations Between Baseline Risk Factors and Vertebral Fracture Risk in the Multiple Outcomes of Raloxifene Evaluation (MORE) Study. J Bone Miner Res 2004; 19(5): 764–772. Dostupné z DOI: <http://dx.doi.org/10.1359/JBMR.040211>.
- Hirano T. Pathophysiology of Diabetic Dyslipidemia. J Atheroscler Thromb 2018; 25(9): 771–782. Dostupné z DOI: <http://dx.doi.org/10.5551/jat.RV17023>.
- Jialal I, Singh G. Management of diabetic dyslipidemia: An update. World J Diabetes 2019; 10(5): 280–290. Dostupné z DOI: <http://dx.doi.org/10.4239/wjd.v10.i5.280>.
- Schwartz AV, Pavo I, Jahangir Alam J et al. Teriparatide in patients with osteoporosis and type 2 diabetes. Bone 2016; 91 : 152–158. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2016.06.017>.
- Langdahl BL, Silverman S, Fujiwara S et al. Real-world effectiveness of teriparatide on fracture reduction in patients with osteoporosis and comorbidities or risk factors for fractures: Integrated analysis of 4 prospective observational studies. Bone 2018; 116 : 58–66. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2018.07.013>.
- Cummings SR, San Martin J, McClung MR et al. Denosumab for Prevention of Fractures in Postmenopausal Women with Osteoporosis. N Engl J Med 2009; 361(8): 756–765. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0809493>.
- Zebaze R, Libanati C, McClunget MR al. Denosumab Reduces Cortical Porosity of the Proximal Femoral Shaft in Postmenopausal Women With Osteoporosis. J Bone Miner Res 2016; 31(10): 1827–1834. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr..
- Napoli N, Pannacciulli N, Vittinghoff E et al. Effect of denosumab on fasting glucose in women with diabetes or prediabetes from the FREEDOM trial. Diabetes Metab Res Rev 2018; 34(4): e2991. Dostupné z DOI: <http://dx.doi.org/10.1002/dmrr.2991>.
- Ferron M, Wei J, Yoshizawa T et al. Insulin signaling in osteoblasts integrates bone remodeling and energy metabolism. Cell 2010; 142(2): 296–308. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cell.2010.06.003>.
- Schwartz AV, Schafer AL, Greyet A et al. Effects of antiresorptive therapies on glucose metabolism: results from the FIT, HORIZON-PFT, and FREEDOM trials. J Bone Miner Res 2013; 28(6): 1348–1354. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.1865>.
- Fard MK, Aminorroaya A, Kachuei A et al. Alendronate improves fasting plasma glucose and insulin sensitivity, and decreases insulin resistance in prediabetic osteopenic postmenopausal women: A randomized triple-blind clinical trial. J Diabetes Investig 2019; 10(3): 731–737. Dostupné z DOI: <http://dx.doi.org/10.1111/jdi.12944>.
- Hayakawa N, Suzuki A. Diabetes mellitus and osteoporosis. Effect of antidiabetic medicine on osteoporotic fracture. Clin Calcium 2012; 22(9): 1383–1390.
- Jackuliak P, Kuzma M, Payer J. Effect of antidiabetic treatment on bone. Physiol Res 2019; 68(Suppl 2): S107-S120. Dostupné z DOI: <http://dx.doi.org/10.33549/physiolres.934297>.
- Paul TV, Thomas N. Impact of oral antidiabetic agents on bone metabolism. Indian J Med Res 2015; 141(4): 385–388. Dostupné z DOI: <http://dx.doi.org/10.4103/0971–5916.159244>.
- McCarthy AD, Cortizo AM Sedlinsky C. Metformin revisited: Does this regulator of AMP-activated protein kinase secondarily affect bone metabolism and prevent diabetic osteopathy. World J Diabetes 2016; 7(6): 122–133. Dostupné z DOI: <http://dx.doi.org/10.4239/wjd.v7.i6.122>.
- Gilbert MP, Pratley RE. The Impact of Diabetes and Diabetes Medications on Bone Health. Endocr Rev 2015; 36(2): 194–213. Dostupné z DOI: <http://dx.doi.org/10.1210/er.2012–1042>.
- Majumdar SR, Leslie WD, Lix LM et al. Longer Duration of Diabetes Strongly Impacts Fracture Risk Assessment: The Manitoba BMD Cohort. J Clin Endocrinol Metab 2016; 101(11): 4489–4496. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2016–2569>.
- Yavropoulou M, Mousiolis A, Kolokouri V et al. Anti-diabetic treatment as an additional factor in a FRAX based evaluation of osteoporotic fracture risk. Endocrine Abstracts 2015; 37: EP300. Dostupné z DOI: <http://dx.doi.org/10.1530/endoabs.37.EP300>.
- Schwartz AV. Diabetes and Metabolism of Bone. In: Danoff A (ed). ENDO 2017: Meet-The-Professor Endocrine Case Management. Endocrine Society: Washington, DC 2017 : 63–65. ISBN 978–1879225329.
- Palermo A, D‘Onofrio L, Eastell R et al. Oral anti-diabetic drugs and fracture risk, cut to the bone: safe or dangerous? A narrative review. Osteoporos Int 2015; 26(8): 2073–2089. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–015–3123–0>.
- Lecka-Czernik B. Safety of Anti-Diabetic Therapies on Bone. Clinical Rev Bone Miner Metab 2013; 11(1): 49–58. Dostupné z DOI: <http://dx.doi.org/10.1007/s12018–012–9129–7>.
- Molinuevo MS, SchurmanL, McCarthy AD et al. Effect of metformin on bone marrow progenitor cell differentiation: In vivo and in vitro studies. J Bone Miner Res 2010; 25(2): 211–221. Dostupné z DOI: <http://dx.doi.org/10.1359/jbmr.090732>.
- Sundararaghavan V, Mazur MM, Evans B et al. Diabetes and bone health: latest evidence and clinical implications. Ther Adv Musculoskelet Dis 2017; 9(3): 67–74. Dostupné z DOI: <http://dx.doi.org/10.1177/1759720X16687480>.
- Melton LJ, Leibson CL, Achenbach SJ et al. Fracture risk in type 2 diabetes: update of a population-based study. J Bone Miner Res 2008; 23(8): 1334–1342. Dostupné z DOI: <http://dx.doi.org/10.1359/jbmr.080323>.
- Russo GT, Giandalia A, Romeo EL et al. Fracture Risk in Type 2 Diabetes: Current Perspectives and Gender Differences. Int J Endocrinol 2016; 2016 : 1615735. Dostupné z DOI: <http://dx.doi.org/10.1155/2016/1615735>.
- Monami M, Cresci B, Colombini A et al. Bone fractures and hypoglycemic treatment in type 2 diabetic patients: a case-control study. Diabetes Care 2008; 31(2): 199–203. Dostupné z DOI: <http://dx.doi.org/10.2337/dc07–1736>.
- Lapane KL, Yang S, Brown MJ et al. Sulfonylureas and risk of falls and fractures: a systematic review. Drugs Aging 2013; 30(7): 527–547. Dostupné z DOI: <http://dx.doi.org/10.1007/s40266–013–0081–0>.
- Mehta S, Teigland C, Kfuri A et al. Comparative Safety of Oral Antidiabetic Therapy on Risk of Fracture in Patients with Diabetes. In: American Diabetes Association Scientific Sessions 2014; 165-OR. Dostupné z WWW: <https://professional.diabetes.org/meeting/scientific-sessions/74th-scientific-sessions-2014>.
- TuckerME. Medscape Sulfonylureas May Up Fracture Risk in Diabetes, Along With TZDs. 2014. Dostupné z WWW: <https://www.medscape.com/viewarticle/826774>.
- Berberoglu Z, Yazici AC, Demirag NG. Effects of rosiglitazone on bone mineral density and remodelling parameters in Postmenopausal diabetic women: a 2-year follow-up study. Clin Endocrinol (Oxf) 2010; 73(3): 305–312. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2265.2010.03784.x>.
- Mieczkowska A, Baslé MF, Chappard D et al. Thiazolidinediones induce osteocyte apoptosis by a G protein-coupled receptor 40-dependent mechanism. J Biol Chem 2012; 287(28): 23517–23526. Dostupné z DOI: <http://dx.doi.org/10.1074/jbc.M111.324814>.
- Loke YK, Singh S, Furberg CD. Long-term use of thiazolidinediones and fractures in type 2 diabetes: a meta-analysis. CMAJ 2009; 180(1): 32–39. Dostupné z DOI: <http://dx.doi.org/10.1503/cmaj.080486>.
- Fukunaga T, Zou W, Rohatgi N et al. An Insulin-Sensitizing Thiazolidinedione, Which Minimally Activates PPARγ, Does Not Cause Bone Loss. J Bone Miner Res 2015; 30(3): 481–488. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.2364>.
- Ceccarelli E, Guarino EG, Merlotti D et al. Beyond Glycemic Control in Diabetes Mellitus: Effects of Incretin-Based Therapies on Bone Metabolism. Front Endocrinol (Lausanne) 2013; 4(73). Dostupné z DOI: <http://dx.doi.org/10.3389/fendo.2013.00073>.
- Monami M, Dicembrini I, Antenore A et al. Dipeptidyl peptidase-4 inhibitors and bone fractures: a meta-analysis of randomized clinical trials. Diabetes Care 2011; 34(11): 2474–2476. Dostupné z DOI: <http://dx.doi.org/10.2337/dc11–1099>.
- Nauck MA, Del Prato S, Meier JJ et al. Dapagliflozin Versus Glipizide as Add-on Therapy in Patients With Type 2 Diabetes Who Have Inadequate Glycemic Control With Metformin: A randomized, 52-week, double-blind, active-controlled noninferiority trial. Diabetes Care 2011; 34(9): 2015–2022. Dostupné z DOI: <http://dx.doi.org/10.2337/dc11–0606>.
- List JF, Woo V, Morales E et al. Sodium-Glucose Cotransport Inhibition with Dapagliflozin in Type 2 Diabetes. Diabetes Care 2009; 32(4): 650–657. Dostupné z DOI: <http://dx.doi.org/10.2337/dc08–1863>.
- Ljunggren Ö, Bolinder J, Johansson L et al. Dapagliflozin has no effect on markers of bone formation and resorption or bone mineral density in patients with inadequately controlled type 2 diabetes mellitus on metformin. Diabetes Obes Metab 2012; 14(11): 990–999. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1463–1326.2012.01630.x>.
- Kohan DE, Fioretto P, Tang W et al. Long-term study of patients with type 2 diabetes and moderate renal impairment shows that dapagliflozin reduces weight and blood pressure but does not improve glycemic control. Kidney Int 2014; 85(4): 962–971. Dostupné z DOI: <http://dx.doi.org/10.1038/ki.2013.356>.
- Watts NB, Bilezikian JP, Usiskin K et al. Effects of Canagliflozin on Fracture Risk in Patients With Type 2 Diabetes Mellitus. J Clin Endocrinol Metab 2016; 101(1): 157–166. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2015–3167>.
- Campos Pastor MM, López-Ibarra PJ, Escobar-Jiménez F et al. Intensive insulin therapy and bone mineral density in type 1 diabetes mellitus: a prospective study. Osteoporos Int 2000; 11(5): 455–459. Dostupné z DOI: <http://dx.doi.org/10.1007/s001980070114>.
- Fowlkes JL, Clay Bunn R, Thrailkill KM. Contributions of the Insulin/Insulin-Like Growth Factor-1 Axis to Diabetic Osteopathy. J Diabetes Metab 2011; 1(Suppl). Dostupné z DOI: <http://dx.doi.org/10.4172/2155–6156.S1–003>.
- Zhukouskaya VV, Shepelkevich AP, Chiodini I. Bone Health in Type 1 Diabetes: Where We Are Now and How We Should Proceed. Adv Endocrin 2014; 2014: ID 982129. Dostupné z DOI: <https://doi.org/10.1155/2014/982129>.
- Kanazawa I, Yamaguchi T, Yamamoto M et al. Relationships between serum adiponectin levels versus bone mineral density, bone metabolic markers, and vertebral fractures in type 2 diabetes mellitus. Eur J Endocrinol 2009; 160(2): 265–273. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-08–0642>.
- Chandran M. Diabetes Drug Effects on the Skeleton. Calcif Tissue Int 2017; 100(2):133–149. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–016–0203-x>.
- Ferrari S. Diabetes and Bone. Calcif Tissue Int 2017; 100(2): 107–108. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–017–0234-y>.
- Quandt SA, Stafford JM, Bell RA et al. Predictors of Falls in a Multiethnic Population of Older Rural Adults With Diabetes. J Gerontol A Biol Sci Med Sci 2006; 61(4): 394–398. Dostupné z DOI: <http://dx.doi.org/10.1093/gerona/61.4.394>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inForum Diabetologicum

-
All articles in this issue
- Osteoporóza pri endokrinopatiách
- Hodnotenie rizika osteoporózy u pacienta s diabetes mellitus 2. typu – keď meranie kostnej hustoty nepostačuje
- Manažment osteoporózy u diabetika
- Prínos liečby metformínom v liekových formách s predľženým uvoľňovaním
- Deintenzifikácia liečby pacienta s diabetes mellitus 2. typu môže mať benefitný účinok
- Populačné rozdiely v prevalencii diabetes mellitus, jeho rizikových faktorov a komplikácií
- Bazálne analógy inzulínu 2. generácie v klinických štúdiách s využitím kontinuálneho monitorovania koncentrácie glukózy
- Skúsenosti z praxe potvrdzujú výsledky štúdií RCT a RWE s empagliflozínom: kazuistiky
- Liečba diabetického edému makuly intravitreálnym dexametazónom: kazuistika
- Forum Diabetologicum
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Osteoporóza pri endokrinopatiách
- Bazálne analógy inzulínu 2. generácie v klinických štúdiách s využitím kontinuálneho monitorovania koncentrácie glukózy
- Deintenzifikácia liečby pacienta s diabetes mellitus 2. typu môže mať benefitný účinok
- Populačné rozdiely v prevalencii diabetes mellitus, jeho rizikových faktorov a komplikácií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

