-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Manažment osteoporózy u diabetika
Osteoporosis management in diabetic patient
Diabetes mellitus and osteoporosis are two serious civilization diseases with increasing incidence. Osteoporosis and osteoporotic fractures are already accepted as a severe co-morbidity and complications of diabetes mellitus. In management of diabetic patients is necessary to identify the high-risk group for osteoporosis and fractures, and to take appropriate preventive and therapeutic options. Available antiresorptive and osteoanabolic drug agents, which are used to treat osteoporosis, are effective also in diabetes patients. Most of the data of their effects in diabetics come only from clinical practice. But it is also necessary to achieve optimal glycemic control, with regard to the effect of antidiabetics on bone. This review provides data from clinical studies on the effect of antiporotics in diabetics as well as the effect of antidiabetics on bone.
Keywords:
antidiabetic therapy – antiresorptive therapy – diabetes mellitus – osteoporotic fracture
Autoři: Peter Jackuliak; Magdaléna Kovářová; Martin Kužma; Zdenko Killinger; Juraj Payer
Působiště autorů: V. interná klinika LF UK a UNB, Nemocnica Ružinov, Bratislava
Vyšlo v časopise: Forum Diab 2021; 10(1): 17-24
Kategorie: Prehľadové práce
Souhrn
Diabetes mellitus (DM) a osteoporóza predstavujú dve závažné civilizačné ochorenia, ktorých incidencia narastá. Osteoporóza a osteoporotické zlomeniny sú už akceptovanou závažnou komorbiditou a komplikáciou diabetes mellitus. V rámci manažmentu diabetika je nutné cielene po riziku osteoporózy a zlomenín pátrať, ako aj následne prijať adekvátne preventívne a liečebné opatrenia. V liečbe osteoporózy u DM sa využívajú dostupné antiresorpčné a osteoanabolické preparáty. Väčšina údajov o ich efekte pochádza len z klinickej praxe. Z diabetologického hľadiska je nutné dosiahnuť optimálnu glykemickú kompenzáciu, avšak s ohľadom na efekt antidiabetík na kosť. V uvedenom prehľade sú uvedené údaje z klinických štúdií o efekte antiporotík u diabetikov, ako aj efekte antidiabetík na kosť.
Klíčová slova:
antidiabetická terapia – antiresorpčná terapia – diabetes mellitus – osteoporotická fraktúra
Úvod
V posledných rokoch sa závažným problémom u diabetes mellitus (DM) 1. typu aj 2. typu (DM1T, DM2T) stala fragilita kostí, riziko osteoporózy a osteoporotických fraktúr (tab. 1) [1]. U pacientov s DM1T je 2 - až 6-násobne vyššie riziko osteoporotickej fraktúry než u nediabetickej populácie [2]. Podľa jednej recentnej analýzy, skoro polovica pacientov s DM1T malo aspoň 1 faktúru po diagnostikovaní DM [3]. Výskyt bol vyšší pri dlhšom trvaní DM, diagnóze DM pred 20. rokom života, rodinnej anamnéze osteoporózy. Pacienti s DM2T majú 1,2 - až 3-násobne vyššie riziko fraktúry v porovnaní s nediabetickou populáciou, čiastočne ide o fraktúry bedra, ale hlavne o zlomeniny horných končatín a členka [4,5]. Väčšie riziko fraktúr je hlavne u pacientov s BMI < 30 kg/m2 v porovnaní s obéznymi jedincami [6], u pacientov s trvaním DM2T < 10 rokov, nízkou fyzickou aktivitou, vyšším vekom, na liečbe inzulínom [5]. Dôležitým rizikovým faktorom je zvýšené riziko pádov [7,8].
Patogenéza kostných zmien u diabetikov je komplexná. Diabetes ovplyvňuje kostný metabolizmus viacerými mechanizmami [9]. Diabetici majú znížený počet a alterované funkcie osteoblastov. Taktiež je prítomná porucha diferenciácie osteoblastov – kmeňové bunky (MSC – Mesenchymal Stem Cells) sa diferencujú na adipocyty, čo vedie k adipozite kostnej drene, v ktorej adipocyty produkujú zápalové cytokíny a chemokíny. V dôsledku toho sa v kostnej dreni akumulujú proinflamačné makrofágy M1. Porucha osteocytov vedie k zvýšenej expresii sklerostínu, inhibítoru osteoblastov a RANKL. Je tiež zvýšený fibroblastový rastový faktor 23 (Fibroblast Growth Factor 23 – FGF23), čo podmieňuje aj tvorbu aktívneho D-hormónu. Zníženie počtu endoteliálnych progenitorových buniek (Endothelial Progenitor Cells – EPC) vedie k zníženej permeabilite ciev, čo podmieňuje mikrohypoxiu kosti. Zvýšenie počtu koncových produktov pokročilej glykácie (Advanced glycation end products – AGEs) v dôsledku metabolickej (de)kompenzácie tiež negatívne alteruje kostnú matrix, čo vyúsťuje ku väčšej kortikálnej porozite.
Tab. 1. Vplyv DM a prediabetes na kosť. Upravené podľa [1] ![Vplyv DM a prediabetes na kosť. Upravené podľa [1]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/39b69da758a522088f8fab3168154be3.jpeg)
AGEs – koncové produkty pokročilej (neenzymatickej) glykácie/Advanced Glycation Endproducts ↑ – zvýšenie ↓ – zníženie ↔ – bez zmeny (oproti kontrole), ? – neznáme zmeny Osteoporotické fraktúry sú akceptované v medzinárodných odporúčaniach ako komorbidita DM, a teda pri komplexnom manažmente diabetika musíme myslieť aj na prevenciu a liečbu osteoporózy [10]. Na druhej strane najmä starší pacienti s DM2T majú zvýšené riziko zlomenín (bedra, proximálneho humeru a členku) aj v dôsledku komorbidít a diabetických komplikácií [11–14].
Diagnostika osteoporózy u diabetikov
V rámci diagnostiky osteoporózy u pacientov s diabetes mellitus sú dnes už vypracované algoritmy (schéma 1), ktoré sú zosumarizovaním súčasných poznatkov o tzv. diaporóze. Jeden z posledných a teda najaktuálnejších je odporúčanie tzv. Bone and Diabetes Working Group pri Medzinárodnej nadácii osteoporózy (International Osteoporosis Foundation – IOF), ktorá pod vedením prof. S. Ferrariho vypracovala guidelines Diagnosis and management of bone fragility in diabetes: an emerging challenge. [15]
Schéma 1. Algoritmus manažmentu osteoporózy u pacienta s diabetes mellitus. Upravené podľa [15] ![Schéma 1. Algoritmus manažmentu osteoporózy u pacienta s diabetes mellitus. Upravené podľa [15]](https://pl-master.mdcdn.cz/media/image_pdf/4b3f00ca1e4b6eb3dac6334a33966273.jpeg?version=1628588462)
DXA – denzitometria, FRAX – nástroj pre výpočet rizika zlomenín/Fracture Risk Assessment Tool, TBS – trabekulárne kostné skóre/Trabecular Bone Score, VFA – hodnotenie vertebrálnych fraktúr/Vertebral Fracture Assessment
Pre diabetes špecifické rizikové faktory: trvanie DM > 5 rokov; liečba DM: inzulín, glitazóny, gliflozíny; HbA1c > 7 %; mikrovaskulárne komplikácie: periférna a autonómna neuropatia, retinopatia, nefropatiaV rámci diagnostiky osteoporózy, najmä diabetikov s DM2T je dôležité okrem hodnotenia kvantity kostnej hmoty hodnotiť aj jej kvalitu, najmä využitím nových modalít, ako je trabekulárne kostné skóre (Trabecular Bone Score – TBS) [16–18]. Pri hodnotení len hustoty kostného minerálu (Bone Mineral Density – BMD) sa diskutuje o znížení prahu T-skóre na -2,0 SD ako hodnoty, kedy treba iniciovať antiporotickú terapiu [19]. Pri využití nástroja FRAX (Fracture Risk Assessment Tool) je riziko hlavne u DM2T podhodnotené (v dotazníku nie je vôbec uvedený ako rizikový faktor), a preto sa odporúča uviesť rizikový faktor „9. reumatoidná artritída“, pretože riziko pri DM2T a pri reumatoidnej artritíde je porovnateľné [20,21].
Manažment osteoporózy u diabetikov
Pri liečbe diabetika z osteologického hľadiska je nutné brať do úvahy dva základné pohľady: akú antiporotickú liečbu treba zvoliť a ako liečiť samotný diabetes mellitus. O efekte antiporotík u diabetikov sa vie len málo. Väčšina údajov pochádza len z reálnej klinickej praxe. V klinických štúdiách je málo prác, ktoré cielene porovnávali efekt antiporotík u diabetikov. Väčšinou sa jedná len o post-hoc analýzy hlavných štúdií pre daný liek. Prehľad používaných antiabetík a údajov o ich efekte u pacientov s DM uvádza tab. 2.
Tab. 2. Liečba osteoporózy u pacientov s diabetes mellitus 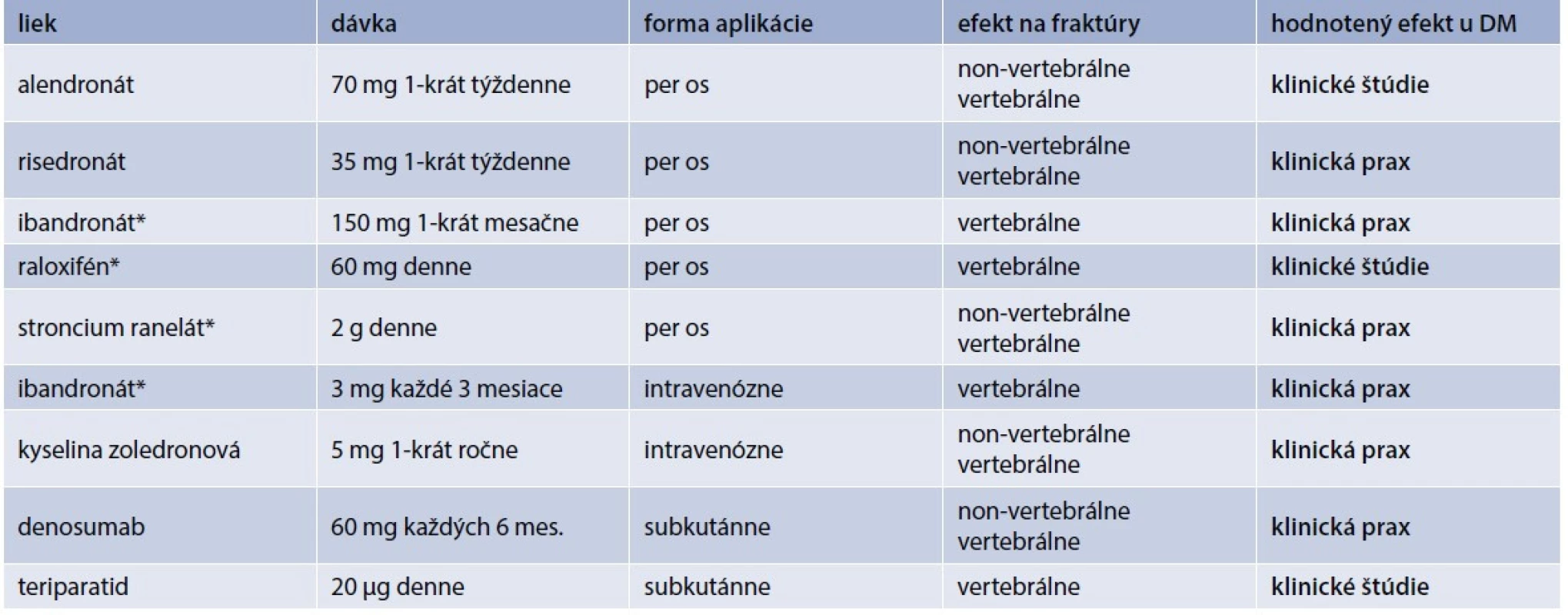
* len u postmenopauzálnych žien Alendronát zvyšuje kostnú denzitu (Bone Mineral Density – BMD) u rozličných skupín postmenopauzálnych žien. Efekt alendronátu u diabetikov sledovala štúdia kolektívu Keegan T et al [22]. Využili údaje zo štúdie FIT (Fracture Intervention Trial), čo bola randomizovaná, dvojito zaslepená, placebom kontrolovaná štúdia, ktorá potvrdila redukciu osteoporotických fraktúr u postmenopauzálnych žien s osteoporózou [23]. Retrospektívna analýza podskupiny pacientok s DM2T (n = 297), u ktorých bola prítomnosť DM zisťovaná na základe anamnézy (anamnestický údaj, liečba inzulínom alebo perorálnym antidiabetikom), alebo ako glykémia nalačno ≥ 7 mmol/l. 3-ročná liečba alendronátom bola u týchto pacientok spojená so zvýšením BMD o 6,6 % v lumbo-sakrálnej (LS) oblasti, 2,4 % v oblasti bedra (hip). V skupine liečenej placebom došlo naopak k poklesu BMD (teda s výnimkou oblasti LS, v ktorej nebola žiadna zmena). Liečba alendronátom bola dobre tolerovaná [22]. Tým sa potvrdil rovnaký efekt alendronátu u diabetickej aj nediabetickej populácie.
Na druhej strane existujú aj štúdie, ktoré efekt alendronátu na zmenu BMD nepreukázali. Jednalo sa ale len o malú kohortu postmenopauzálnych žien (vek 67,6 ± 7,3 rokov) s dlhším trvaním DM2T (12,8 ± 6,8 rokov) [24].
Efekt risedronátu u diabetikov bol analyzovaný z kombinovaných údajov 3 klinických štúdií III. fázy. Jednalo sa o kohortu 885 pacientov, z ktorých DM malo 53 pacientov (vs 832 pacientov bez DM). Efekt risedronátu na BMD nebol rozdielny u diabetikov oproti nediabetickej populácii. Pokles kostných markerov (NTX, CTX, BAP) bol u diabetikov o niečo menší, ale štatistickú významnosť nedosiahol. Čiže aj risedronát je u pacientov s DM rovnako efektívny pri liečbe osteoporózy [25].
Efekt raloxifénu u diabetikov bol nepriamo sledovaný univariatnou analýzou 30 rizikových faktorov vertebrálnych zlomenín v štúdii MORE (Multiple Outcomes of Raloxifene Evaluation). Napriek menšiemu množstvu pacientov bol raloxifén efektívnejší u pacientov s DM2T vs bez DM (p = 0,04). Zaujímavým zistením bolo, že u pacientov s vyššou hladinou triacylglycerolov, najmä u mladších a s nižšou hodnotou BMD v LS-oblasti bol väčší efekt raloxifénu na redukciu vertebrálnych fraktúr [26]. A práve pacienti s DM2T majú typickú aterogénnu dyslipidémiu s vysokými hodnotami triacylglycerolov, čo nepriamo môže svedčiť na benefitný efekt raloxifénu u diabetikov [27,28].
Efekt teriparatidu sledovala štúdia DANCE (Direct Analysis of Nonvertebral Fracture in the Community Experience Study), ktorá zahŕňala 4 092 pacientov (291 pacientov s DM2T vs 3 751 bez DM). Podobne ako v nediabetikej populácii aj u pacientov s DM došlo v priebehu liečby k redukcii incidencie non-vertebrálnych fraktúr, vzostupu BMD a zníženiu bolestí chrbta. Tento efekt bol prítomný už po 6 mesiacoch a pretrvával celých 24 mesiacov liečby [29]. Podobné efekty teriparatidu na klinické fraktúry u diabetikov po 6 mesiacoch liečby potvrdila aj štúdia Real-World Effectiveness of Teriparatide. U diabetickej populácie (n = 527) došlo k redukcii vertebrálnych fraktúr (o 86 %, p < 0,0001), nonvertebrálnych fraktúr (o 68 %, p = 0,0018) a všetkých klinických fraktúr (o 77 %, p < 0,0001). Efekt redukcie fraktúr bol vyšší než v nediabetickej populácii [30].
Vzhľadom na patofyziológiu osteoporózy u diabetikov, u ktorej sa zdôrazňuje inhibícia formácie, aktivity a prežívania osteoklastov, by vzhľadom na svoj mechanizmus mal byť účinný aj denosumab. Štúdie venujúce sa efektu denusomabu u diabetikov ale chýbajú. Práve prebieha intervenčná štúdia (ClinicalTrials.gov Identifier: NCT03457818) na efekt denosumabu u pacientov s DM2T. Výsledky by mohli byť známe v lete 2021. Primárnym cieľom je dokázať pozitívny efekt na zníženie kortikálnej porozity pomocou HR-pQCT (High Resolution peripheral Quantitative Computed Tomography) u diabetikov liečeným denosumabom. Vychádza z poznatkov a záverov QCT imaging substudy, podskupiny zo štúdie FREEDOM (Fracture Reduction Evaluation of Denosumab in Osteoporosis) [31], ktorá preukázala u 58 pacientov s osteoporózou (n = 32 denosumab, n = 26 placebo) zníženie porozity proximálneho femuru pri liečbe denosumabom [32].
V literatúre sa dokonca stretneme aj s prvými údajmi o tom, že blokáda RANKL by mohla mať aj pozitívny efekt na glukózový metabolizmus. Napoli et al preukázali, že liečba denosumabom u pacientok s DM2T bez antidibetickej liečby mala vplyv na pokles glykémie nalačno v porovnaní s placebovým ramenom (o -0,4 mmol/l; 95%CI -0,7 až -0,1; p = 0,02) [33].
Spočiatku bola teória, že nekarboxylovaný osteokalcín (Undercarboxylated OsteoCalcin – ucOC) pôsobí u animálnych modelov hlodavcov ako hormón, ktorý stimuluje inzulínovú senzitivitu a sekréciu [34]. Ak teda ucOC má podobnú úlohu u ľudí, potom by antiresorpčná terapia, ktorá redukuje ucOC, mohla zvyšovať riziko inzulínovej rezistencie a DM. Ale post-hoc analýza 3 štúdií FIT (Fracture Intervention Trial) s alendronátom (N = 6151), HORIZON-PFT (Health Outcomes and Reduced Incidence with Zoledronic Acid Once Yearly Pivotal Fracture Trial; N = 7 113) s kyselinou zoledrónovou a FREEDOM (Fracture Reduction Evaluation of Denosumab in Osteoporosis Every 6 Months; N = 7 076) s denosumabom preukázala, že antiresorpčná terapia nemá klinicky významný vplyv na glykémiu nalačno, telesnú hmotnosť, či riziko DM u postmenopauzálnych žien [35]. Dokonca recentne bola publikovaná práca, ktorá preukázala, že 70 mg alendronátu 1-krát ročne zlepšuje glykémiu nalačno, glykovaný hemoglobín a inzulinémiu [36]. Bolo to potvrdené na kohorte 60 postmenopauzálnych žien vo veku 45 až 60 rokov, ktoré boli rozdelené na intervenčné a placebové rameno. V skupine liečenej alendronátu došlo k výraznejšiemu poklesu glykémie nalačno (-0,5 mmol/l vs -0,1 mmol/l; p = 0,002), HbA1c (-0,2 % vs -0,09 %; p = 0,015). Samozrejme sú potrebné ďalšie práce preukazujúce eventuálny prídatný benefitný efekt antiresorpčnej terapie na glykémiu.
Základom manažmentu diabetických komplikácií a teda aj kostných diabetických komplikácií je dosiahnutie optimálnej glykemickej kompenzácie. Mnohé účinné antidiabetiká môžu ale ovplyvňovať kostný metabolizmus, a to pozitívne ale aj negatívne [37,38]. Za posledné roky narastá počet údajov o vplyve antidiabetík na kostnú hustotu a riziko fraktúr (tab. 3) [39–41]. Problémom klinickej praxe na hodnotenie efektu antidiabetík na kosť je fakt, že veľká väčšina pacientov má kombinovanú antidiabetickú liečbu [4]. Avšak pri manažmente diabetika z osteologického hľadiska by sa mal brať do úvahy aj efekt antidiabetík na kostný metabolizmus. Yavropoulou et al v retrospektívnej analýze potvrdili, že práve antidiabetiká majú signifikantný vplyv na výskyt osteoporotických fraktúr (F = 4,260; p = 0,042), ako aj vplyv na 10-ročné riziko vzniku osteoporotickej fraktúry hodnotenej pomocou FRAX [42,43].
Tab. 3. Efekt antidiabetík na kostný metabolizmus. Upravené podľa [44–46] ![Efekt antidiabetík na kostný metabolizmus. Upravené podľa [44–46]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/48ed469a892e9aa4a4a4a022739df5ad.jpeg)
?? – neznámy efekt ↑ – zvýšenie ↓ – zníženie ↔ – neutrálny vplyv (nevedie k zmene) Schéma 2. Algoritmus liečby diabetika s osteoporózou 
Metformín, ako základný liek manažmentu DM2T, má dokázané, že zvyšuje proliferáciu a diferenciáciu osteoblastov a potencuje tvorbu kolagénu typu 1. Na druhej strane inhibuje diferenciáciu adipocitov [47,48]. Početné štúdie preukázali benefitný proosteogénny vplyv metformínu in vitro. Liečba metformínom dokáže in vitro znížiť vystimulovanú osteoformáciu v dôsledku AGEs [49,50]. Analýza kohorty Rochester potvrdila, že metformín dokáže znížiť riziko fraktúr u pacientov s DM2T (HR 0,7) [49]. Výsledky štúdií vplyvu metformínu na kostný metabolizmus sú stále nejednoznačné [51], avšak sumárne môžeme tvrdiť, že zlepšuje kostnú hustotu a negatívne neovplyvňuje riziko fraktúr. Zároveň pri jeho komplexnom pôsobení pozitívne ovplyvňuje iné diabetické komplikácie, a tým prispieva aj k redukcii iných rizikových faktorov vzniku osteoporotických fraktúr.
Sulfonylureové preparáty účinne znižujú glykémiu a sú často používané ako druholíniová terapia (po metformíne). Samozrejme dosiahnutie optimálnej glykemickej kompenzácie bude mať pozitívny efekt aj na kostný metabolizmus, najmä cez zvýšenie sekrécie IGF1 [52]. Mehta et al na kongrese ADA 2014 prezentovali ale prvé údaje o tom, že liečba sulfonylureovými preparátmi zvyšuje riziko fraktúr. Retrospektívne analyzoval údaje z registra MORE (Medical Outcomes for Effectiveness and Economics), pričom výskyt fraktúr bol u 6,8 % všetkých pacientov užívajúcich metformín, u 10,9 % pacientov užívajúcich glitazóny a u 9,7 % pacientov užívajúcich sulfonylureové preparáty. V porovnaní s metformínom mali glitazóny (HR 1,40; p < 0,0001) ale aj sulfonylureové preparáty (HR 1,09; p = 0,0054) zvýšené riziko fraktúr [53,54].
Glitazóny (tiazolidíndióny) zvyšujú inzulínovú senzitivitu, pretože pôsobia ako aktivátory PPARã (Peroxisome Proliferator-Activated Receptor gamma). PPARã sú tiež exprimované v kostnej dreni, na osteoblastoch i osteoklastoch a majú dôležitú úlohu v procese diferenciácie prekurzorových buniek na osteoblasty [55]. Glitazóny zvyšujú adipozitu kosti, znižujú aromatázovú aktivitu, potencujú diferenciáciu osteoklastov, čo všetko vedie k zvýšenému odbúravaniu kostnej hmoty [56,57]. Metaanalýza dlhodobého efektu glitazónov na kosť potvrdila zníženie kostnej hustoty u žien (ale nie u mužov) tak u rosiglitazónu, ako aj u pioglitazónu [57]. Vyvíjajú sa ale nové analógy tiazolidíndiónov s nízkou afinitou k PPARã, ktoré by mohli mať neutrálny vplyv z pohľadu kostného metabolizmu [58].
Inkretínová liečba zahŕňa dve skupiny antidiabetík – receptorové agonisty GLP1 (GLP1 RA) a inhibítory dipeptidylpeptidázy 4 (DPP4i, gliptíny). Štúdie preukázali že GLP1 RA, ale aj iné inkretíny (GIP a GLP2) môžu mať pozitívny efekt – antiresorpčný a osteoanabolický. Mechanizmus zahŕňa rôzne metabolické cesty – Wnt/beta-catenin, OPG/RANKL (Osteoprotegerin/Receptor activator of nuclear factor kappa-B ligand) či pôsobenie sklerostínu [59]. Metaanalýza 28 štúdií o efekte DPP4i na kosť preukázala 40% redukciu fraktúr u pacientov liečených DPP4i v porovnaní s placebom či inými antidiabetikami [60]. Z klinického pohľadu používanie GLP1 RA a DPP4i má benefitný vplyv na kostnú hustotu a minimálne neutrálny vplyv na riziko fraktúr.
Inhibícia nátrium-glukózového kotransportéra 2 je nová účinná modalita liečby. Vzhľadom na ovplyvnenie tubulárnych mechanizmov je predpoklad, že zasiahnu aj do kalcium-fosfátového metabolizmu. Prvé štúdie s dapagliflozínom nepreukázali zmeny hladín sérového kalcia či vitamínu D, avšak mierny vzostup hladín magnézia, fosfátov a parathormónu [61,62]. Dapagliflozín nemal žiadny vplyv na zmeny markerov kostného obratu u postmenopauzálnych žien [63]. Avšak nedávno publikované práce preukázali zvýšený výskyt fraktúr pri užívaní dapagliflozínu a kanagliflozínu [64,65]. Americká lieková agentúra FDA (Food and Drug Administration) vydala v novembri 2015 varovanie ohľadne zvýšeného rizika fraktúr pri liečbe kanagliflozínom. Preto použitie tejto skupiny u rizikových skupín z osteologického hľadiska by sa malo zvažovať.
Liečba inzulínom u nedostatočne glykemicky kompenzovaných pacientov s DM1T viedla aj k zlepšeniu kostnej hustoty a markerov kostného obratu [66]. V priebehu posledných rokov bol dokázaný vplyv inzulínu a IGF1 v procese diferenciáce osteoblastov [67,68]. Inzulín ale zasahuje aj do mnohých iných metabolických cyklov, ktoré súvisia s kostným metabolizmom, napr. Wnt/β-katenin signalizácia či metabolizmus BMP2 [67]. Avšak niektoré štúdie potvrdili zvýšený výskyt vertebrálnych fraktúr u pacientov s DM2T liečených inzulínom [69]. Treba si ale uvedomiť, že pacienti s DM2T liečení inzulínom sú väčšinou pacienti s dlhším trvaním DM alebo s diabetickými komplikáciami. Inzulínová terapia je asociovaná aj s vyšším výskytom hypoglykemických epizód, ktoré zvyšujú riziko pádov, a tým prispievajú k zvýšenému riziku fraktúr [70,71]. Na druhej strane zlepšenie glykemickej kompenzácie dosiahnutej inzulínovou terapiou viedlo k zlepšeniu diabetických komplikácií a k redukcii pádov [72].
Záver
Osteoporóza a osteoporotické fraktúry sú závažným problémom diabetikov. V rámci komplexného manažmentu diabetes mellitus treba cielene po rizikových pacientoch pátrať, včas ich identifikovať a následne správne manažovať (schéma 2). Z hľadiska diabetológie je nutné dosiahnuť optimálnu glykemickú kompenzáciu, pričom volíme antidiabetiká s pozitívnym či neutrálnym efektom na kosť (metformín, gliptíny a GLP1 RA). Z pohľadu osteológie sú glitazóny a sulfonylureové preparáty rizikové, podobne aj pri gliflozínoch je riziko fraktúr zvýšené. Inzulínová terapia je benefitná hlavne u diabetikov s DM1T, pri ktorom prevažuje pozitívny osteoanabolický efekt inzulínu. U diabetikov s DM2T má význam hlavne s cieľom dosiahnuť optimálnu glykemickú kompenzáciu avšak s ohľadom na riziko hypoglykémií, ktoré môžu zvyšovať riziko pádov. Pri manažmente osteoporózy je základom adekvátna suplementácia kalcia a vitamínu D. Z bežných antiporotík sú u diabetikov efektívne bisfosfonáty a denosumab. Taktiež u závažnej osteoporózy je možné použiť osteoanabolickú liečbu teriparatidom, ktorý je aj u diabetikov efektívny.
Autori prehlasujú, že nemajú konflikt záujmov.
doc. MUDr. Peter Jackuliak, PhD., MPH | peter.jackuliak@fmed.uniba.sk | www.fmed.uniba.sk
Doručené do redakcie 13. 4. 2021
Prijaté po recenzii 28. 4. 2021
Zdroje
- Costantini S, Conte C. Bone health in diabetes and prediabetes. World J Diabetes 2019; 10(8): 421–445. Dostupné z DOI: <http://dx.doi.org/10.4239/wjd.v10.i8..
- Shah VN, Shah CS, Snell-Bergeon JK. Type 1 diabetes and risk of fracture: meta-analysis and review of the literature. Diabet Med 2015; 32(9): 1134–1142. Dostupné z DOI: <http://dx.doi.org/10.1111/dme.12734>.
- Dhaliwal R, Foster NC, Boyle C et al. Determinants of fracture in adults with type 1 diabetes in the USA: Results from the T1D Exchange Clinic Registry. J Diabetes Complications 2018; 32(11): 1006–1011. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jdiacomp.2018.08.016>.
- Vestergaard P, Rejnmark L, Mosekilde L. Relative fracture risk in patients with diabetes mellitus, and the impact of insulin and oral antidiabetic medication on relative fracture risk. Diabetologia 2005; 48(7): 1292–1299. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–005–1786–3>.
- Wang H, Ba Y, Xing Q et al. Diabetes mellitus and the risk of fractures at specific sites: a meta-analysis. BMJ Open 2019; 9(1): e024067. Dostupné z DOI: <http://dx.doi.org/10.1136/bmjopen-2018–024067>.
- Moayeri A, Mohamadpour M, Mousavi SF et al. Fracture risk in patients with type 2 diabetes mellitus and possible risk factors: a systematic review and meta-analysis. Ther Clin Risk Manag 2017; 13 : 455–468. Dostupné z DOI: <http://dx.doi.org/10.2147/TCRM.S131945>.
- Maurer MS, Burcham J, Cheng H. Diabetes mellitus is associated with an increased risk of falls in elderly residents of a long-term care facility. J Gerontol A Biol Sci Med Sci 2005; 60(9): 1157–1162. Dostupné z DOI: <http://dx.doi.org/10.1093/gerona/60.9.1157>.
- Patel S, Hyer S, Tweed K et al. Risk factors for fractures and falls in older women with type 2 diabetes mellitus. Calcif Tissue Int 2008; 82(2): 87–91. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–007–9082–5>.
- Picke A-K, Campbell G, Napoli N et al. Update on the impact of type 2 diabetes mellitus on bone metabolism and material properties. Endocr Connect 2019; 8(3): R55-R70. Dostupné z DOI: <http://dx.doi.org/10.1530/EC-18–0456>.
- [American Diabetes Association]. 4. Comprehensive Medical Evaluation and Assessment of Comorbidities: Standards of Medical Care in Diabetes 2020. Diabetes Care 2020; 43(Suppl 1): S37-S47. Dostupné z DOI: <http://dx.doi.org/10.2337/dc20-S004>.
- Cummings SR, Nevitt MC, Browner WS et al. Risk factors for hip fracture in white women. Study of Osteoporotic Fractures Research Group. N Engl J Med 1995; 332(12): 767–773. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM199503233321202>.
- Schwartz AV, Sellmeyer DE, Ensrud KE et al. Older women with diabetes have an increased risk of fracture: a prospective study. J Clin Endocrinol Metab 2001; 86(1): 32–38. Dostupné z DOI: <http://dx.doi.org/10.1210/jcem.86.1.7139>.
- Forsén L, Meyer HE, Midthjell K et al. Diabetes mellitus and the incidence of hip fracture: results from the Nord-Trondelag Health Survey. Diabetologia 1999; 42(8): 920–925. Dostupné z DOI: <http://dx.doi.org/10.1007/s001250051248>.
- Michaelsson K, Holmberg L, Mallmin H et al. Diet and hip fracture risk: a case-control study. Study Group of the Multiple Risk Survey on Swedish Women for Eating Assessment. Int J Epidemiol 1995; 24(4): 771–782. Dostupné z DOI: <http://dx.doi.org/10.1093/ije/24.4.771>.
- Ferrari SL, Abrahamsen B, Napoli N et al. Diagnosis and management of bone fragility in diabetes: an emerging challenge. Osteoporos Int 2018; 29(12): 2585–2596. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–018–4650–2>.
- Leslie WD, Aubry-Rozier B, Lamy O et al. TBS (trabecular bone score) and diabetes-related fracture risk. J Clin Endocrinol Metab 2013; 98(2): 602–609. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2012–3118>.
- Ebrahimpur M, Sharifi F, Nezhad FA et al. Effect of diabetes on BMD and TBS values as determinants of bone health in the elderly: Bushehr Elderly Health program. J Diabetes Metab Disord 2019; 18(1): 99–106. Dostupné z DOI: <http://dx.doi.org/10.1007/s40200–019–00395–1>.
- Jackuliak P, Kužma M, Killinger Z et al. Good long-term glycemic compensation is associated with better trabecular bone score in postmenopausal women with type 2 diabetes. Physiol Res 2019; 68(Suppl 2): S149-S156. Dostupné z DOI: <http://dx.doi.org/10.33549/physiolres.934304>.
- Schwartz AV, Vittinghoff E, Bauer DC et al. Association of BMD and FRAX score with risk of fracture in older adults with type 2 diabetes. JAMA 2011; 305(21): 2184–2192. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2011.715>.
- Leslie WD, Rubin MR, Schwartz AV et al. Type 2 diabetes and bone. J Bone Miner Res 2012; 27(11): 2231–2237. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.1759>.
- Giangregorio LM, Leslie WD, Lix LM et al. FRAX underestimates fracture risk in patients with diabetes. J Bone Miner Res 2012; 27(2): 301–308. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.556>.
- Keegan TH, Schwartz AV, Bauer DC et al. Effect of alendronate on bone mineral density and biochemical markers of bone turnover in type 2 diabetic women: the fracture intervention trial. Diabetes Care 2004; 27(7): 1547–1553. Dostupné z DOI: <http://dx.doi.org/10.2337/diacare.27.7.1547>.
- Cummings SR, Black DM, Thompson DE et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: results from the Fracture Intervention Trial. JAMA 1998; 280(24): 2077–2082. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.280.24.2077>.
- Dagdelen S, Sener D, Bayraktar M. Influence of type 2 diabetes mellitus on bone mineral density response to bisphosphonates in late postmenopausal osteoporosis. Adv Ther 2007; 24(6): 1314–1320. Dostupné z DOI: <http://dx.doi.org/10.1007/BF02877778>.
- Inoue D, Muraoka R, Okazaki R et al. Efficacy and Safety of Risedronate in Osteoporosis Subjects with Comorbid Diabetes, Hypertension, and/or Dyslipidemia: A Post Hoc Analysis of Phase III Trials Conducted in Japan. Calcif Tissue Int 2016; 98(2): 114–122. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–015–0071–9>.
- Johnell O, Kanis JA , Black DM et al. Associations Between Baseline Risk Factors and Vertebral Fracture Risk in the Multiple Outcomes of Raloxifene Evaluation (MORE) Study. J Bone Miner Res 2004; 19(5): 764–772. Dostupné z DOI: <http://dx.doi.org/10.1359/JBMR.040211>.
- Hirano T. Pathophysiology of Diabetic Dyslipidemia. J Atheroscler Thromb 2018; 25(9): 771–782. Dostupné z DOI: <http://dx.doi.org/10.5551/jat.RV17023>.
- Jialal I, Singh G. Management of diabetic dyslipidemia: An update. World J Diabetes 2019; 10(5): 280–290. Dostupné z DOI: <http://dx.doi.org/10.4239/wjd.v10.i5.280>.
- Schwartz AV, Pavo I, Jahangir Alam J et al. Teriparatide in patients with osteoporosis and type 2 diabetes. Bone 2016; 91 : 152–158. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2016.06.017>.
- Langdahl BL, Silverman S, Fujiwara S et al. Real-world effectiveness of teriparatide on fracture reduction in patients with osteoporosis and comorbidities or risk factors for fractures: Integrated analysis of 4 prospective observational studies. Bone 2018; 116 : 58–66. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2018.07.013>.
- Cummings SR, San Martin J, McClung MR et al. Denosumab for Prevention of Fractures in Postmenopausal Women with Osteoporosis. N Engl J Med 2009; 361(8): 756–765. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0809493>.
- Zebaze R, Libanati C, McClunget MR al. Denosumab Reduces Cortical Porosity of the Proximal Femoral Shaft in Postmenopausal Women With Osteoporosis. J Bone Miner Res 2016; 31(10): 1827–1834. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr..
- Napoli N, Pannacciulli N, Vittinghoff E et al. Effect of denosumab on fasting glucose in women with diabetes or prediabetes from the FREEDOM trial. Diabetes Metab Res Rev 2018; 34(4): e2991. Dostupné z DOI: <http://dx.doi.org/10.1002/dmrr.2991>.
- Ferron M, Wei J, Yoshizawa T et al. Insulin signaling in osteoblasts integrates bone remodeling and energy metabolism. Cell 2010; 142(2): 296–308. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cell.2010.06.003>.
- Schwartz AV, Schafer AL, Greyet A et al. Effects of antiresorptive therapies on glucose metabolism: results from the FIT, HORIZON-PFT, and FREEDOM trials. J Bone Miner Res 2013; 28(6): 1348–1354. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.1865>.
- Fard MK, Aminorroaya A, Kachuei A et al. Alendronate improves fasting plasma glucose and insulin sensitivity, and decreases insulin resistance in prediabetic osteopenic postmenopausal women: A randomized triple-blind clinical trial. J Diabetes Investig 2019; 10(3): 731–737. Dostupné z DOI: <http://dx.doi.org/10.1111/jdi.12944>.
- Hayakawa N, Suzuki A. Diabetes mellitus and osteoporosis. Effect of antidiabetic medicine on osteoporotic fracture. Clin Calcium 2012; 22(9): 1383–1390.
- Jackuliak P, Kuzma M, Payer J. Effect of antidiabetic treatment on bone. Physiol Res 2019; 68(Suppl 2): S107-S120. Dostupné z DOI: <http://dx.doi.org/10.33549/physiolres.934297>.
- Paul TV, Thomas N. Impact of oral antidiabetic agents on bone metabolism. Indian J Med Res 2015; 141(4): 385–388. Dostupné z DOI: <http://dx.doi.org/10.4103/0971–5916.159244>.
- McCarthy AD, Cortizo AM Sedlinsky C. Metformin revisited: Does this regulator of AMP-activated protein kinase secondarily affect bone metabolism and prevent diabetic osteopathy. World J Diabetes 2016; 7(6): 122–133. Dostupné z DOI: <http://dx.doi.org/10.4239/wjd.v7.i6.122>.
- Gilbert MP, Pratley RE. The Impact of Diabetes and Diabetes Medications on Bone Health. Endocr Rev 2015; 36(2): 194–213. Dostupné z DOI: <http://dx.doi.org/10.1210/er.2012–1042>.
- Majumdar SR, Leslie WD, Lix LM et al. Longer Duration of Diabetes Strongly Impacts Fracture Risk Assessment: The Manitoba BMD Cohort. J Clin Endocrinol Metab 2016; 101(11): 4489–4496. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2016–2569>.
- Yavropoulou M, Mousiolis A, Kolokouri V et al. Anti-diabetic treatment as an additional factor in a FRAX based evaluation of osteoporotic fracture risk. Endocrine Abstracts 2015; 37: EP300. Dostupné z DOI: <http://dx.doi.org/10.1530/endoabs.37.EP300>.
- Schwartz AV. Diabetes and Metabolism of Bone. In: Danoff A (ed). ENDO 2017: Meet-The-Professor Endocrine Case Management. Endocrine Society: Washington, DC 2017 : 63–65. ISBN 978–1879225329.
- Palermo A, D‘Onofrio L, Eastell R et al. Oral anti-diabetic drugs and fracture risk, cut to the bone: safe or dangerous? A narrative review. Osteoporos Int 2015; 26(8): 2073–2089. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–015–3123–0>.
- Lecka-Czernik B. Safety of Anti-Diabetic Therapies on Bone. Clinical Rev Bone Miner Metab 2013; 11(1): 49–58. Dostupné z DOI: <http://dx.doi.org/10.1007/s12018–012–9129–7>.
- Molinuevo MS, SchurmanL, McCarthy AD et al. Effect of metformin on bone marrow progenitor cell differentiation: In vivo and in vitro studies. J Bone Miner Res 2010; 25(2): 211–221. Dostupné z DOI: <http://dx.doi.org/10.1359/jbmr.090732>.
- Sundararaghavan V, Mazur MM, Evans B et al. Diabetes and bone health: latest evidence and clinical implications. Ther Adv Musculoskelet Dis 2017; 9(3): 67–74. Dostupné z DOI: <http://dx.doi.org/10.1177/1759720X16687480>.
- Melton LJ, Leibson CL, Achenbach SJ et al. Fracture risk in type 2 diabetes: update of a population-based study. J Bone Miner Res 2008; 23(8): 1334–1342. Dostupné z DOI: <http://dx.doi.org/10.1359/jbmr.080323>.
- Russo GT, Giandalia A, Romeo EL et al. Fracture Risk in Type 2 Diabetes: Current Perspectives and Gender Differences. Int J Endocrinol 2016; 2016 : 1615735. Dostupné z DOI: <http://dx.doi.org/10.1155/2016/1615735>.
- Monami M, Cresci B, Colombini A et al. Bone fractures and hypoglycemic treatment in type 2 diabetic patients: a case-control study. Diabetes Care 2008; 31(2): 199–203. Dostupné z DOI: <http://dx.doi.org/10.2337/dc07–1736>.
- Lapane KL, Yang S, Brown MJ et al. Sulfonylureas and risk of falls and fractures: a systematic review. Drugs Aging 2013; 30(7): 527–547. Dostupné z DOI: <http://dx.doi.org/10.1007/s40266–013–0081–0>.
- Mehta S, Teigland C, Kfuri A et al. Comparative Safety of Oral Antidiabetic Therapy on Risk of Fracture in Patients with Diabetes. In: American Diabetes Association Scientific Sessions 2014; 165-OR. Dostupné z WWW: <https://professional.diabetes.org/meeting/scientific-sessions/74th-scientific-sessions-2014>.
- TuckerME. Medscape Sulfonylureas May Up Fracture Risk in Diabetes, Along With TZDs. 2014. Dostupné z WWW: <https://www.medscape.com/viewarticle/826774>.
- Berberoglu Z, Yazici AC, Demirag NG. Effects of rosiglitazone on bone mineral density and remodelling parameters in Postmenopausal diabetic women: a 2-year follow-up study. Clin Endocrinol (Oxf) 2010; 73(3): 305–312. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2265.2010.03784.x>.
- Mieczkowska A, Baslé MF, Chappard D et al. Thiazolidinediones induce osteocyte apoptosis by a G protein-coupled receptor 40-dependent mechanism. J Biol Chem 2012; 287(28): 23517–23526. Dostupné z DOI: <http://dx.doi.org/10.1074/jbc.M111.324814>.
- Loke YK, Singh S, Furberg CD. Long-term use of thiazolidinediones and fractures in type 2 diabetes: a meta-analysis. CMAJ 2009; 180(1): 32–39. Dostupné z DOI: <http://dx.doi.org/10.1503/cmaj.080486>.
- Fukunaga T, Zou W, Rohatgi N et al. An Insulin-Sensitizing Thiazolidinedione, Which Minimally Activates PPARγ, Does Not Cause Bone Loss. J Bone Miner Res 2015; 30(3): 481–488. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.2364>.
- Ceccarelli E, Guarino EG, Merlotti D et al. Beyond Glycemic Control in Diabetes Mellitus: Effects of Incretin-Based Therapies on Bone Metabolism. Front Endocrinol (Lausanne) 2013; 4(73). Dostupné z DOI: <http://dx.doi.org/10.3389/fendo.2013.00073>.
- Monami M, Dicembrini I, Antenore A et al. Dipeptidyl peptidase-4 inhibitors and bone fractures: a meta-analysis of randomized clinical trials. Diabetes Care 2011; 34(11): 2474–2476. Dostupné z DOI: <http://dx.doi.org/10.2337/dc11–1099>.
- Nauck MA, Del Prato S, Meier JJ et al. Dapagliflozin Versus Glipizide as Add-on Therapy in Patients With Type 2 Diabetes Who Have Inadequate Glycemic Control With Metformin: A randomized, 52-week, double-blind, active-controlled noninferiority trial. Diabetes Care 2011; 34(9): 2015–2022. Dostupné z DOI: <http://dx.doi.org/10.2337/dc11–0606>.
- List JF, Woo V, Morales E et al. Sodium-Glucose Cotransport Inhibition with Dapagliflozin in Type 2 Diabetes. Diabetes Care 2009; 32(4): 650–657. Dostupné z DOI: <http://dx.doi.org/10.2337/dc08–1863>.
- Ljunggren Ö, Bolinder J, Johansson L et al. Dapagliflozin has no effect on markers of bone formation and resorption or bone mineral density in patients with inadequately controlled type 2 diabetes mellitus on metformin. Diabetes Obes Metab 2012; 14(11): 990–999. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1463–1326.2012.01630.x>.
- Kohan DE, Fioretto P, Tang W et al. Long-term study of patients with type 2 diabetes and moderate renal impairment shows that dapagliflozin reduces weight and blood pressure but does not improve glycemic control. Kidney Int 2014; 85(4): 962–971. Dostupné z DOI: <http://dx.doi.org/10.1038/ki.2013.356>.
- Watts NB, Bilezikian JP, Usiskin K et al. Effects of Canagliflozin on Fracture Risk in Patients With Type 2 Diabetes Mellitus. J Clin Endocrinol Metab 2016; 101(1): 157–166. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2015–3167>.
- Campos Pastor MM, López-Ibarra PJ, Escobar-Jiménez F et al. Intensive insulin therapy and bone mineral density in type 1 diabetes mellitus: a prospective study. Osteoporos Int 2000; 11(5): 455–459. Dostupné z DOI: <http://dx.doi.org/10.1007/s001980070114>.
- Fowlkes JL, Clay Bunn R, Thrailkill KM. Contributions of the Insulin/Insulin-Like Growth Factor-1 Axis to Diabetic Osteopathy. J Diabetes Metab 2011; 1(Suppl). Dostupné z DOI: <http://dx.doi.org/10.4172/2155–6156.S1–003>.
- Zhukouskaya VV, Shepelkevich AP, Chiodini I. Bone Health in Type 1 Diabetes: Where We Are Now and How We Should Proceed. Adv Endocrin 2014; 2014: ID 982129. Dostupné z DOI: <https://doi.org/10.1155/2014/982129>.
- Kanazawa I, Yamaguchi T, Yamamoto M et al. Relationships between serum adiponectin levels versus bone mineral density, bone metabolic markers, and vertebral fractures in type 2 diabetes mellitus. Eur J Endocrinol 2009; 160(2): 265–273. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-08–0642>.
- Chandran M. Diabetes Drug Effects on the Skeleton. Calcif Tissue Int 2017; 100(2):133–149. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–016–0203-x>.
- Ferrari S. Diabetes and Bone. Calcif Tissue Int 2017; 100(2): 107–108. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–017–0234-y>.
- Quandt SA, Stafford JM, Bell RA et al. Predictors of Falls in a Multiethnic Population of Older Rural Adults With Diabetes. J Gerontol A Biol Sci Med Sci 2006; 61(4): 394–398. Dostupné z DOI: <http://dx.doi.org/10.1093/gerona/61.4.394>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseForum Diabetologicum
Nejčtenější tento týden
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Hodnotenie rizika osteoporózy u pacienta s diabetes mellitus 2. typu – keď meranie kostnej hustoty nepostačuje
- Manažment osteoporózy u diabetika
- Prínos liečby metformínom v liekových formách s predľženým uvoľňovaním
- Deintenzifikácia liečby pacienta s diabetes mellitus 2. typu môže mať benefitný účinok
- Populačné rozdiely v prevalencii diabetes mellitus, jeho rizikových faktorov a komplikácií
- Osteoporóza pri endokrinopatiách
- Bazálne analógy inzulínu 2. generácie v klinických štúdiách s využitím kontinuálneho monitorovania koncentrácie glukózy
- Skúsenosti z praxe potvrdzujú výsledky štúdií RCT a RWE s empagliflozínom: kazuistiky
- Liečba diabetického edému makuly intravitreálnym dexametazónom: kazuistika
- Forum Diabetologicum
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Osteoporóza pri endokrinopatiách
- Bazálne analógy inzulínu 2. generácie v klinických štúdiách s využitím kontinuálneho monitorovania koncentrácie glukózy
- Deintenzifikácia liečby pacienta s diabetes mellitus 2. typu môže mať benefitný účinok
- Populačné rozdiely v prevalencii diabetes mellitus, jeho rizikových faktorov a komplikácií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



