-
Medical journals
- Career
Výsledky genotypizace, laboratorní diagnostika a epidemiologie viru příušnic cirkulujícího v České republice v roce 2012
Authors: R. Limberková; P. Lexová
Authors‘ workplace: Státní zdravotní ústav, Centrum epidemiologie a mikrobiologie, Praha
Published in: Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 1, s. 36-42
Category: Review articles, original papers, case report
Overview
Cíl práce:
Cílem práce bylo rozšíření současné rutinní sérologické laboratorní diagnostiky příušnic o metody přímého průkazu infekčního vyvolavatele a následná genotypizace izolovaných virů, ve snaze získat podrobnější informace o recentních virech příušnic cirkulujících na území České republiky. Dílčím cílem pak bylo poukázat na specifika laboratorního vyšetření u vysoce proočkované populace a zhodnocení současné epidemiologické situace.Materiál a metody:
Do studie bylo zahrnuto 47 stěrů z bukálních sliznic od pacientů s podezřením na onemocnění příušnicemi. Klinické materiály byly odebrány v počátku klinické manifestace. Sběr vzorků probíhal od února do prosince 2012 a zahrnoval pět krajů ČR. Pro izolaci viru byly použity buněčné kultury Vero buněk, izoláty byly identifikovány pomocí RT-qPCR. Genotypizaci provedla WHO Regionální referenční laboratoř pro spalničky, zarděnky a příušnice, Institut Roberta Kocha v Berlíně (RRL MMR). Jako zdroj epidemiologických údajů byl využit systém EPIDAT.Výsledky:
Ze 47 bukálních stěrů byl ve 20 případech na Vero buňkách izolován virus příušnic, v dalších sedmi vzorcích byla metodou RT-qPCR prokázána pouze přítomnost virové RNA bez pozitivní izolace. Ke genotypizaci bylo zasláno 19 izolátů, genetickou analýzou SH genu byla prokázána jejich fylogenetická příslušnost ke genotypu G, a to ve čtyřech variantách. V roce 2011 i 2012 tvořili převážnou část nemocných očkovaní jedinci (80 %); nejpostiženější věkovou skupinou byli dospívající ve věku 15–19 let. Nejčastější komplikací byla orchitida a druhou nejčastější komplikací byla meningitida. Komplikacemi byli více postiženi neočkovaní jedinci.Závěry:
Na zvýšeném výskytu příušnic v České republice v roce 2012 se významně podílel genotyp G, který je v největší míře zodpovědný za zvýšenou nemocnost ve většině evropských zemí již od roku 2005. U nás byl výskyt genotypu G poprvé prokázán v roce 2006. S ohledem na nepříznivý epidemiologický vývoj se provádění molekulárně epidemiologických studií zahrnujících genotypizaci recentních příušnicových kmenů jeví jako nezbytné. Detailní monitorování by mohlo napomoci k objasnění vzorce cirkulace viru a k vytvoření strategie kontroly nad vznikajícími epidemiemi. Účinnost vakcinace ve vztahu ke genotypu, ale i možnost přispění vyvanutí imunity ke zvýšenému výskytu onemocnění jsou otázkami, které by měly být dořešeny.Klíčová slova:
virus příušnic – laboratorní diagnostika - genotypy – epidemiologieÚVOD
Zahájením pravidelného očkování v roce 1987 se snížil výskyt onemocnění a od roku 1997 se u nás příušnice vyskytovaly pouze sporadicky nebo jen v menších lokálních epidemiích. Přesto je v posledních letech v České republice pozorován nárůst onemocnění příušnicemi odpovídající epidemickému výskytu.
Příušnice jsou akutním generalizovaným virovým onemocněním převážně dětského věku a představují celosvětově důležitý zdravotní problém. Virus příušnic se na vnímavého hostitele přenáší kapénkovou infekcí. Inkubační doba je obvykle 16–18 dní od expozice. Po pomnožení viru v nosohltanu a regionálních lymfatických uzlinách dochází k primární virémii, při níž se virus šíří do příušní žlázy a slinných žláz. Během sekundární virémie je pomnožený virus distribuován do dalších orgánů, jako např. do centrálního nervového systému, pankreatu, varlat i ovarií. Virus je vylučován slinami a močí a jeho přítomnost je možné prokázat v příušní slinné žláze již týden před vznikem otoku slinné žlázy a až devět dní po něm. Největší pravděpodobnost záchytu viru je mezi 1–2 dny před objevením klinických příznaků a 5 dnů po jejich objevení. Virus je možné získat i od pacientů s asymptomatickou infekcí [1]. Inaparentně probíhá asi čtvrtina až třetina všech případů, většina klinicky manifestních případů probíhá mírně, pod obrazem horečnatého onemocnění s jedno - nebo oboustranným bolestivým zduřením příušní slinné žlázy. Nejčastějšími komplikacemi příušnic jsou aseptická meningitida a orchitida, méně časté jsou encefalitida, ooforitida a pankreatitida. Se stoupajícím věkem nemocných stoupá i riziko komplikovaného průběhu onemocnění. Onemocnění příušnicemi v prvním trimestru gravidity může vést k intrauterinní infekci a úmrtí plodu; ke spontánnímu potratu pak dochází do 2 týdnů od začátku infekce [2].
Virus příušnic patří do čeledi Paramyxoviridae, podčeledi Paramyxovirinae, rodu Rubulavirus. Vysoce pleiomorfní obalené viriony s helikální symetrií kapsidy mají průměr 100–600 nm a obsahují jednovláknitou nesegmentovanou 15,3 kb dlouhou RNA negativní polarity. Genom je složený ze 7 transkripčních jednotek (genů) kódujících následující strukturálně a funkčně odlišné proteiny. Dva povrchové glykoproteiny, hemaglutinin-neuraminidáza (HN) a fúzní protein (F), odpovídají nejen za virové pohlcování a splynutí virionu s hostitelskou buněčnou membránou, ale také za virovou rekonstrukci a uvolnění z hostitelské buňky. Oba proteiny jsou schopny stimulovat imunitní systém za tvorby neutralizačních protilátek snižujících až eliminujících nakažlivost příušnicového viru. Zbývajících pět strukturálních proteinů není imunogenně významných. RNA je obalena spirálově symetrickým nukleokapsidovým proteinem (NP). Fosfoprotein (P) a velký protein (L) mají funkci RNA transkriptázy. Virionová obálka je doplněna matrixovým proteinem (M) a integrálním membránovým malým hydrofobním proteinem (SH), jehož funkce není zatím známá. Mimo strukturálních proteinů byly identifikovány také nestrukturální proteiny V a I, které jsou kódovány ze stejného úseku genu jako fosfoprotein P a spoluúčastní se na korekci m-RNA [3].
SH gen (mRNA z 316 kb, 57 aminokyselin) je nejvariabilnější částí genomu viru příušnic a porovnání jeho sekvencí je základem pro rozlišení jednotlivých genotypů viru příušnic podle doporučení Mezinárodní komise pro taxonomii virů (International Committee on Taxonomy of Viruses – ICTV) a Světové zdravotnické organizace (WHO). Aktuální modifikace původní nomenklatury (13 genotypů A–M) v současné době uznává 12 genotypů označených A–N kromě genotypů E a M. Tyto byly na základě důkladnější analýzy překlasifikovány: genotyp M na K a genotyp E na C [4]. V rámci jednotlivých genotypů existují dále různé varianty. Jednotlivé genotypy vykazují rozdílnou geografickou distribuci a v určitém geografickém regionu může cirkulovat současně genotypů více. Byla rovněž zaznamenána závislost mezi určitými genotypy a neurovirulencí a také nedostatečná zkřížená protekce virus neutralizačních protilátek před reinfekcí jiným genotypem.
MATERIÁL A METODY
V období od února do prosince 2012 bylo do Národní referenční laboratoře pro zarděnky, spalničky, příušnice a parvovirus B 19 Státního zdravotního ústavu v Praze (NRL ZSP, SZÚ) zasláno 47 stěrů z bukální sliznice od pacientů s klinickou diagnózou parotitis epidemica bez komplikací (B269). Jednalo se zejména o ambulantní pacienty infekčních klinik či ordinací praktických lékařů ze 6 míst České republiky. Stěry z bukální sliznice byly odebrány do 2,5 ml odběrového virového média, uchovány a transportovány byly při chladničkové teplotě. Odběr byl proveden průměrně do 2,5 dne od začátku klinické manifestace (minimum 1 den, maximum 9 dní) a do laboratoře byly vzorky doručeny průměrně do 1,6 dnů od provedení odběru (minimum 1, maximum 7 dní).
Pro izolaci viru na tkáňových kulturách byly použity Vero buňky (kontinuální linie ledvinných buněk kočkodana zeleného) a jako růstové médium práškové médium pro tkáňové kultury MEM (Gibco) se 2 % bovinního séra pro tkáňové kultury (Bioveta). Po tří - až šestidenní kultivaci byla provedena druhá pasáž. Množení viru v napadených buňkách se projevilo cytopatickým efektem, který byl charakterizován zakulacenými buňkami a tvorbou syncycií s následnou buněčnou degradací. První projevy množení viru byly obvykle pozorovány již v počátečních dnech první pasáže. Vzhledem k velmi dobrým růstovým vlastnostem viru bylo zvoleno vyšetřovací schéma, jehož prvním krokem byl izolační pokus na Vero buňkách ve dvou pasážích. Následně byly vyšetřovány metodou RT-qPCR (Mumps Virus RT-PCR kit, Shanghai ZJ Bio-Tech Co.) bukální stěry od vzorků bakteriálně kontaminovaných, kultivačně negativních a od vzorků s atypickým cytopatickým efektem. Izolace nukleové kyseliny byla prováděna pomocí komerčního izolačního kitu (Invitec RTP DNA/RNA Virus Mini kit). Metoda RT-qPCR byla použita rovněž pro identifikaci virových izolátů.
VÝSLEDKY
Z celkového počtu 47 bukálních stěrů byl ve 20 případech na Vero buňkách izolován a následně v RT-qPCR identifikován virus příušnic (20/47; 42,6%). Převážná většina těchto stěrů byla odebrána do třetího dne od klinické manifestace onemocnění a známky množení viru se téměř u všech pozitivních vzorků objevily v počátečních dnech první pasáže. Do třetího dne první pasáže byl pozorován cytopatický efekt u 90 % všech virových izolátů (18/20). Zbývajících 27 stěrů, které byly buď bakteriálně kontaminované (8/47), nebo u nich byl zaznamenán atypický (4/47) či žádný (15/47) cytopatický efekt, bylo testováno metodou RT-qPCR. V sedmi z výše zmíněných 27 problematických vzorcích byla prokázána přítomnost RNA viru příušnic, a to ve třech bakteriálně kontaminovaných vzorcích, v jednom vzorku s atypickým cytopatickým efektem a ve třech vzorcích, kde virová nálož byla zřejmě natolik nízká (CT > 29,6), že izolace na tkáňových kulturách nebyla úspěšná. Přímým průkazem infekčního vyvolavatele, tzn. izolací viru či průkazem virové RNA, byla dosažena celková záchytnost 57,44 % (27/47). Ke genotypizaci do RRL MMR bylo na FTA elučních mikrokartách zasláno 19 příušnicových izolátů z druhé pasáže na Vero buňkách. Izoláty pocházely ze šesti měst pěti krajů České republiky – Karlovarského, Pardubického, Ústeckého, Libereckého a Prahy; jmenovitě 2 z Karlových Varů, 7 z Pardubic, 1 z Teplic a 4 z Děčína, 3 z České Lípy a 2 z Prahy. Průměrný věk pacientů byl 15 let a pohyboval se v rozmezí mezi 6 a 31 roky, žen bylo 8 a mužů 11. Kromě dvou pacientů byli všichni očkováni dvěma dávkami vakcíny (tab. 1). V RRL MMR byla z FTA karet extrahována MuV RNA a následně byl sekvenován kompletní SH gen (316 nukleotidů). Na základě provedené genetické analýzy byla prokázána příslušnost všech zaslaných izolátů ke genotypu G. V rámci tohoto genotypu byly zjištěny čtyři varianty vzájemně se lišící bodovými záměnami nukleotidů SH genu na pozicích 165, 186 a 196. Jednotlivé varianty byly označené jako varianta G-Karlovy Vary, varianta G-Pardubice, varianta G-Teplice a varianta G-Česká Lípa. Ze srovnávací tabulky řazení nukleotidů těchto variant plyne, že s variantou Karlovy Vary byly totožné všechny vzorky z Děčína a vzorek z Prahy 5, varianta Pardubice se shodovala se vzorkem z Prahy 10 (tab. 2).
Table 1. Souhrnná tabulka genotypizovaných virů příušnic izolovaných v roce 2012 v ČR Table 1. Genotyping results for mumps viruses isolated in the Czech Republic in 2012 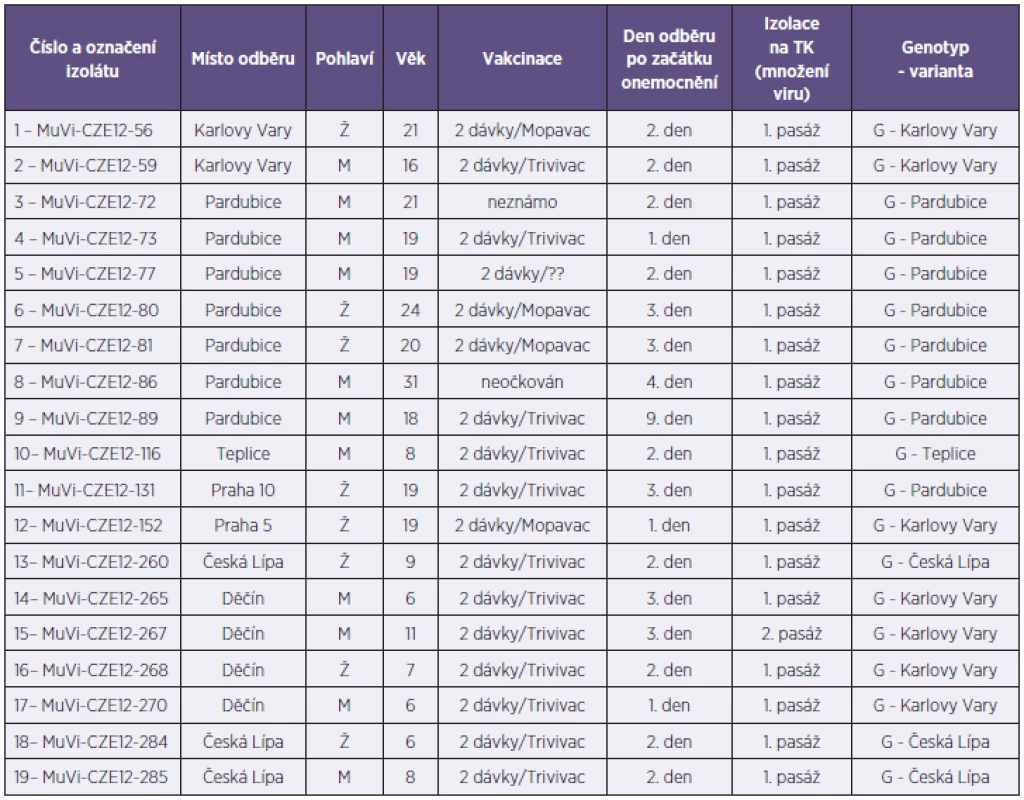
Table 2. Vzájemné porovnání řazení nukleotidů jednotlivých variant genotypu G (MuV-seq-SH-CZE) Table 2. Comparison of the nucleotide orders in various genotype G variants (MuV-seq-SH-CZE) 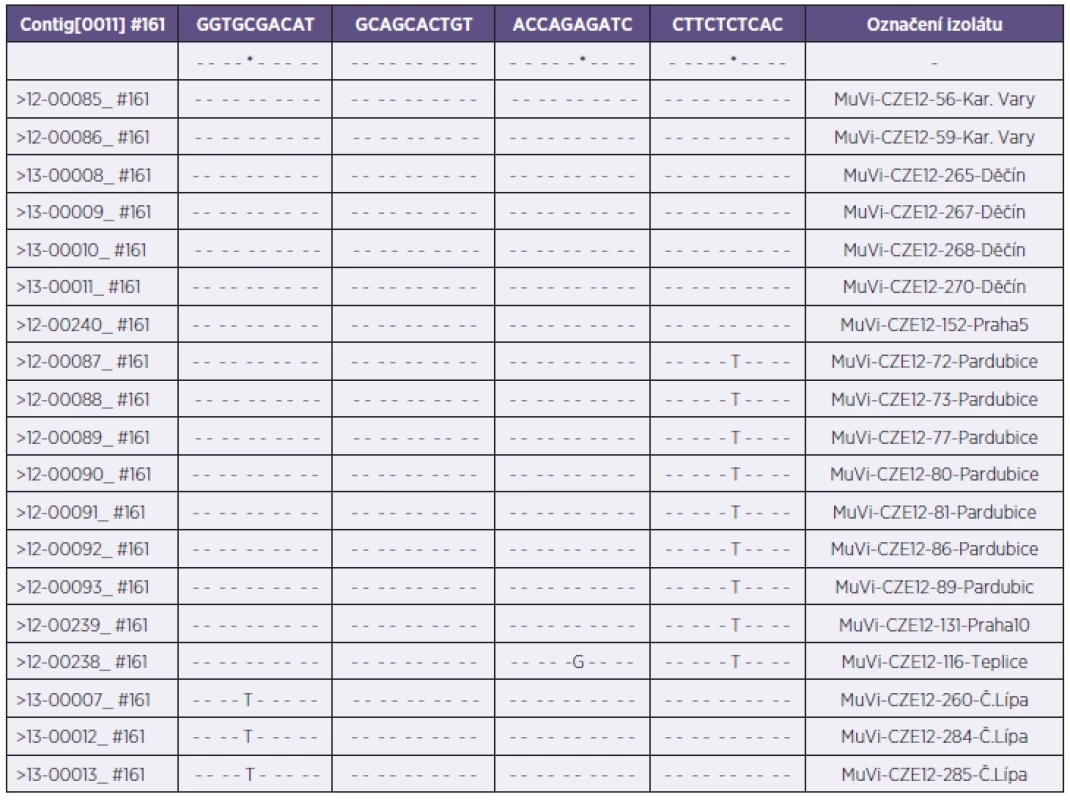
V letech 2011 a 2012 bylo v ČR hlášeno 2 885, respektive 3 902 případů onemocnění příušnicemi. Klinický průběh onemocnění byl v obou letech podobný, komplikace se objevily u 9 %, respektive 10 % všech případů. Nejčastější komplikací byla orchitida, která se vyskytla asi u 10 %, respektive 13 % všech mužů. Druhou nejčastější komplikací byla meningitida. Podstatným zjištěním je i fakt, že se více komplikací projevilo u neočkovaných jedinců, např. orchitida byla v roce 2012 diagnostikována téměř u 35 % neočkovaných mužů a jen u necelých 9 % mužů očkovaných. V roce 2011 i 2012 tvořili převážnou část nemocných očkovaní jedinci (80 %); nejpostiženější věkovou skupinou byli dospívající ve věku 15–19 let, kteří v roce 2012 představovali až 38 % všech nemocných, následovali 10–14letí a dále pak 20–24letí.
DISKUSE
Zahájením pravidelného očkování v roce 1987 se snížil výskyt onemocnění a od roku 1997 se u nás příušnice vyskytovaly pouze sporadicky nebo jen v menších lokálních epidemiích. Přesto je v posledních letech v České republice pozorován nárůst onemocnění příušnicemi. Poslední významná vlna zvýšeného počtu onemocnění byla u nás zaznamenána mezi roky 2005–2007. Po přechodném snížení počtu případů v letech 2008 a 2009, dochází od roku 2010 k soustavnému nárůstu počtu onemocnění naplňujícímu kritéria epidemického výskytu. Podobná situace ve výskytu příušnic, věkovém rozložení nemocných a vakcinačním statusu je i v řadě dalších evropských zemí [5, 6, 7, 8].
Hlavní příčinou současných epidemií je nízká kolektivní imunita, která není dostatečná pro přerušení epidemického šíření viru v populaci. Na nižší kolektivní imunitu proti příušnicím ve srovnání s imunitou proti spalničkám a zarděnkám bylo poukázáno již v roce 2001 po provedení posledních imunologických přehledů. Byl zjištěn nesoulad mezi proočkovaností, která se pohybovala mezi 97–100 % a zjištěnými hodnotami prevalujících protilátek, které byly dostatečné u 70–86 % vyšetřených [9]. Je rovněž nutné vzít v úvahu, že imunita je časově omezená – ochrana se předpokládá po dobu 10–15 let, avšak omezená cirkulace divokého viru příušnic způsobila i to, že se u očkovaných osob snížila možnost booster efektu. Takto může vznikat diskrepance mezi deklarovaným desetiletým přetrváváním protilátek a současným stavem ve výskytu příušnic. Onemocnění postihuje nejen neproočkované skupiny populace, ale ve značné míře také osoby vakcinované.
Laboratorními kritérii pro konfirmaci klinického případu příušnic jsou podle doporučení Centra pro kontrolu nemocí (CDC) v Atlantě z roku 2008 [10]: izolace viru příušnic z klinického materiálu nebo průkaz virové RNA, dále detekce specifických IgM protilátek či specifická protilátková odpověď – sérokonverze nebo signifikantní vzestup protilátek. Podle české legislativy [11] patří mezi laboratorní kritéria také ještě detekce nevakcinálního kmene pomocí monoklonálních protilátek.
Dosavadní strategie laboratorního vyšetřování příušnic v České republice je založena na stanovení IgM a IgG protilátek metodou ELISA v akutním vzorku séra. Tyto výsledky často neumožňují vyslovit jednoznačný laboratorní závěr kvůli falešně negativním nálezům. Do třetího dne od klinické manifestace onemocnění se IgM protilátky ještě nemusí vytvořit a až u 30 % vakcinovaných, kteří tvoří podstatnou část nemocných v ČR, se IgM protilátky nevytvoří vůbec. Situaci v sérologické diagnostice vakcinovaných osob navíc komplikuje fakt, že u nich velmi brzy po expozici nákaze dochází k rychlému vzestupu preexistujících IgG protilátek; vyšetřením párového vzorku séra proto nezískáme vždy obraz očekávaného signifikantního vzestupu titru protilátek či sérokonverze [12]. Jako vhodnější pro laboratorní diagnostiku příušnic se jeví doplnit stávající sérologii o metody přímého průkazu virové RNA či izolace viru na tkáňových kulturách z bukálních stěrů a slin, eventuálně moči nebo likvoru. Přínosem tohoto postupu je nejen rychlý a jednoznačný diagnostický závěr, ale také možnost získání vhodného materiálu pro studium antigenní diverzity cirkulujících kmenů. Klinický materiál pro přímý průkaz infekčního vyvolavatele musí být odebrán v počátku onemocnění, nejpozději do devátého dne od objevení klinických příznaků. Jako ideální se jeví provedení odběru do čtvrtého až pátého dne od začátku onemocnění, kdy je možnost záchytu viru nejvyšší, pravděpodobnost záchytu viru poté postupně klesá. Pro nezbytnost specifické laboratorní diagnostiky svědčí rovněž skutečnost, že dalšími možnými etiologickými vyvolavateli otoku slinných žláz jsou i některé bakterie a další viry. Nejčastěji se jedná o EBV, viry parainfluenzy a adenoviry, dále pak lidský parvovirus B19 a u dětí do 4 let to může být i herpetický virus HHV-6 [13]. Zejména u sporadických případů příušnic bez epidemiologické souvislosti může vhodné laboratorní vyšetření odhalit falešnou symptomatickou pozitivitu.
Virus příušnic existuje v jediném sérotypu, ale genotypově se jednotlivé kmeny liší. V současné době je definováno 12 genotypů viru příušnic (A–N, vyjma E a M), v jejich rámci existují ještě varianty. Za neurovirulentní se považují genotypy C, D, G, H, I, J. Jednotlivé genotypy vykazují rozdílnou geografickou distribuci. Například genotypy C, D, G, H, J a K se vyskytují na západní polokouli, zatímco genotypy B, F, G, I a L byly prokázány v asijských zemích [4, 14, 15]. Byl ovšem zaznamenán i současný výskyt různých genotypů na geograficky blízkém území, a to i v rámci jednoho státu, např. ve Španělsku byl v roce 2000 prokázán výskyt genotypu H odpovědného za ohniskový výskyt a současně také genotypu D, který vyvolával sporadické případy onemocnění [16]. Ve Velké Británii od konce osmdesátých let 20. století do roku 2004 současně cirkulovaly genotypy C, D, H, G a J a postupně začal převažovat genotyp G, fylogeneticky odlišný od genotypu A vakcinálního kmene, stejně jako v ostatních zemích s vysoce proočkovanou populací. Od roku 2005 cirkuluje po celém světě devět genotypů: B–D, F, G–K a často dochází k importům mezi jednotlivými státy [4]. Bylo prokázáno, že virus neutralizační protilátky neochránily před reinfekcí heterologním genotypem [17], nelze tedy vyloučit, že dochází k omezení zkřížené protekce mezi jednotlivými genotypy.
Světová zdravotnická organizace (WHO) doporučuje provádění molekulárně epidemiologických studií zahrnujících genotypizaci recentních příušnicových kmenů jako součást programu surveillance [18]. Monitorování by mohlo napomoci nejen k objasnění vzorce cirkulace viru a sledování jeho evoluce, ale mohlo by také přispět k vytvoření strategie kontroly nad vznikajícími epidemiemi, která je nezbytná pro naplnění aktuálního cíle WHO pro Euroregion – snížení roční incidence příušnic na 1 případ na 100 000 obyvatel [19]. K dosažení tohoto cíle je nutná aktivní spolupráce všech evropských států, aby bylo možné získat dostatek informací o výskytu jednotlivých genotypů v celé sledované oblasti.
ZÁVĚR
Specifika laboratorní diagnostiky vakcinovaných osob, které tvoří téměř 80 % všech nemocných, vede k nutnosti rozšíření rutinní sérologické diagnostiky o metody přímého průkazu infekčního vyvolavatele. Ve vakcinální éře jsou tyto metody nejen diagnosticky přínosné, ale umožňují také monitorování genotypové distribuce viru příušnic a zkoumání genotypově specifické imunity populace.
Je zdokumentováno, že již od roku 2005 je prevalujícím genotypem v Evropě genotyp G [4], který je fylogeneticky odlišný od genotypu A vakcinálních kmenů Jeryl Lynn (MMR-II), Jeryl Lynn Sevac (atenuovaný původní kmen složený ze subkmenů JL2 a JL5 v poměru 1 : 5, Trivivac) či RIT 4385 (genetický derivát subkmenu JL5, Priorix) [3]. V České republice byla poprvé provedena genetická analýza několika kmenů příušnic v roce 2006, na jejím základě byla zjištěna příslušnost těchto kmenů ke genotypu G [20], predominujícímu genotypu v zemích s vysokým vakcinačním pokrytím. Všechny viry izolované v ČR v roce 2012 k tomuto neurovirulentnímu genotypu rovněž patří.
Na zvýšeném výskytu onemocnění se pravděpodobně podílí několik faktorů. Jednak je to postupné slábnutí ochranného účinku vakcinace, které může být navíc ovlivněno nedostatečnou příležitostí pro setkání s přirozeně cirkulujícím virem v období mezi epidemiemi, což potlačuje booster efekt. Nelze ovšem ani vyloučit primární selhávání vakcinace v důsledku genotypové neshody mezi vakcinačním a cirkulujícím virem, i když zatím neexistují jednoznačné důkazy o tom, že by tato neshoda k selhávání vakcinace vedla či že by byla epidemiologicky významná [14, 21, 22, 23]. Přestože v některých případech vakcinace nezabránila vzniku onemocnění, nelze opominout skutečnost, že výskyt komplikací je u vakcinovaných významně nižší. Nicméně účinnost vakcinace ve vztahu ke genotypu, ale i možnost přispění vyvanutí imunity ke zvýšenému výskytu onemocnění, jsou stále otevřenými otázkami, které by měly být dořešeny.
Poděkování: Za spolupráci při sběru bukálních stěrů a poskytnutí epidemiologických údajů F. Sedláčkovi (Infekční oddělení Pardubické krajské nemocnice, a.s., Pardubice), J. Poustkové (Infekční oddělení Karlovarské krajské nemocnice, a. s., Karlovy Vary), O. Hégrové (KHS Pardubického kraje se sídlem v Pardubicích, protiepidemický odbor, Pardubice), J. Trmalovi (KHS Ústeckého kraje se sídlem v Ústí nad Labem, protiepidemický odbor, Ústí nad Labem), L. Šimůnkové (KHS Ústeckého kraje se sídlem v Ústí nad Labem, protiepidemický odbor, ÚP Děčín), E. Poláčkové (KHS Ústeckého kraje se sídlem v Ústí nad Labem, protiepidemický odbor, ÚP Teplice), H. Knížové (KHS Libereckého kraje se sídlem v Liberci, protiepidemický odbor, ÚP Česká Lípa), M. G. Schreinerové (KHS Karlovarského kraje se sídlem v Karlových Varech, protiepidemický odbor, Karlovy Vary), Z. Frajerové (HSHMP pobočka Západ, oddělení protiepidemické) a za provedení genotypizace A. Mankertz a S. Santibanez (WHO RRL MMR, Institut Roberta Kocha, Berlín).
Do redakce došlo dne 21. 8. 2013.
Adresa pro korespondenci:
MUDr. Radomíra Limberková
Státní zdravotní ústav
Šrobárova 48
100 42 Praha 10
email: limberkova@szu.cz
Sources
1. Lennette EH. Diagnostic procedures for viral, rickettsial, and chlamydia infections. Seventh edition, Washington: American public health association; 1995; 455–465 s. ISBN: 0-87553-220-9.
2. Liebert UG. Viruses and pregnancy. Intervirology, 1998(41):145–148.
3. Petráš M, Lesná IK. Manuál očkování 2010. 3.vyd., Praha 2010; 202 – 217 s. ISBN: 978-80-254-5419-0
4. WHO Mumps virus nomenclature update: 2012. Weekly Epidemiological Record, 2012;87 : 217–224.
5. Whelan J, van Binnendijk R, Greenland K, Fanoy E, et al. Ongoing mumps outbreak in student population with high vaccination coverage, Netherlands 2010. Euro Surveill, 2010;15(17):pii=19554. Dostupné na www:
http://www.eurosurveillance.org/ViewArticle.aspx?Articled = 19554.
6. Walker J, Huc S, Sinka K, Tissington A, et al. Ongoing outbreak of mumps infection in Oban, Scotland, November 2010 to January 2011. Euro Surveill. 2011;16(8):pii=19803. Dostupné na www: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19803
7. Otto W, Mankertz A, Santibanez S, Saygili H, et al. Ongoing outbreak of mumps affecting adolescents and young adults in Bavaria, Germany, August to October 2010. Euro Surveill, 2010;15(50):pii=19748. Dostupné na www:
http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19748
8. Kuzmanovska G, Polozhani A, Mikik V, Stavridis K, et al. Mumps outbreak in the former Yugoslav Republic of Macedonia, January 2008–June 2009: epidemiology and control measures. Euro Surveill, 2010;15(23): pii=19586. Dostupné na www:
http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19586.
9. Mrázová M, Smelhausová M, Sestáková Z, Svandová E, Benes C. The 2001 serological survey in the Czech Republic-mumps. Cent Eur J Public Health, 2003;11: Suppl.:S50-3.
10. Decision No 2008/426/EC amending Decision No 2002/253/EC laying down case definitions for reporting communicable diseases to Community network under Decision No 2119/98/EC of European Parliament and of the Council.
11. Vyhláška č. 473/2008 Sb., o systému epidemiologické bdělosti pro vybrané infekce, ve znění pozdějších předpisů.
12. Laboratory testing for mumps infection. Dostupné na www: http://www.cdc.gov/mumps/lab/index.html.
13. Davidkin I, Jokinen S, Paananen A et al. Etiology of mumps-like illness in children and adolescents vaccinated for measles, mumps and rubella. J Infect Dis, 2005;191 : 719–723.
14. Mühlemann K. The molecular epidemiology of mumps virus. Infect Genet Evol, 2004;4 : 215–219.
15. Cui A, Brown DWG, Xu W, Jin L (2013). Genetic variation in the HN and SH genes of mumps viruses: A comparison of strains from mumps cases with and without neurological symptoms. PloS ONE 8(4):e61791.doi:10.1371/journal.pone0061791.
16. Montes M, Cilla G, Artieda J, Vicente D, et al. Mumps outbreak in vaccinated children in Gipuzkoa (Basque Country), Spain. Epidemiol Infect, 2002;129 : 551–556.
17. Nöjd J, Tecle T, Samuelsson A, Örvell C. Mumps virus neutralizing antibodies do not protect against reinfection with a heterologous mumps virus genotype. Vaccine, 2001;19 : 1727–1731.
18. WHO. Global status of mumps immunization and surveillance. Weekly Epidemiological Record, 2005;80(48):418–424.
19. Galazka AM, Robertson SE, Kraiger A. Mumps and mumps vaccine: global review. Bulletin WHO, 1999;77 : 3–14.
20. Kubínyiová M, Beneš C, Príkazský V, Roubalová K, Cástková J. Mumps vaccination in the Czech Republic. Euro Surveill, 2008;13(27):pii=18920. Dostupné na www:
http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=18920.
21. Briss PA, Fehrs LJ, Parker RA, et al. Sustained transmission of mumps in a highly vaccinated population: assesment of primary vaccine failure and waning vaccine-induced imunity. J Infect Dis, 1994;169 : 77–82.
22. Kaaijk P, Zeijst BA, Boog MC, Hoitink CW: Increased mumps incidence in the Netherlands: Review on the possible role of vaccine strain and genotype. Euro, Surveill, 2008;13(26):pii=18914
Dostupné na www:
http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=18914.
23. Rubin SA, Qi L, Audet SA, Sullivan B, et al. Antibody induced by immunization with the Jeryl Lynn mumps vaccine strain effectively neutralizes a heterologous wild-type mumps virus associated with a large outbreak. J Infect Dis, 2008;198(4):508–515. doi: 10.1086/590115
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2014 Issue 1-
All articles in this issue
- Klinické a epidemiologické charakteristiky pacientů hospitalizovaných pro těžký průběh chřipky v sezoně 2012–2013
- Bakterie komplexu Burkholderia cepacia – epidemiologie a diagnostika infekcí u pacientů s cystickou fibrózou
- Výsledky genotypizace, laboratorní diagnostika a epidemiologie viru příušnic cirkulujícího v České republice v roce 2012
- Legionelové infekce – opomíjený problém
- Hodnocení profylaktických opatření po expozici biologickému materiálu
- Epidemiologické šetření v pěti ambulancích Kliniky zubního lékařství LF UP v Olomouci a FN Olomouc
- Sekvenační analýza antigenů zařazených v čtyřkomponentní vakcíně proti meningokoku B v českých izolátech Neisseria meningitidis v období 2007–2013
- Chřipka v sezonách 2009-2013 ve Fakultní nemocnici Hradec Králové, východní Čechy
- Epidemiologické faktory ovlivňující vznik rekurentní a těžké infekce Clostridium difficile
- Epidemiologie kmenů Cronobacter spp. izolovaných z hospitalizovaných pacientů FN Olomouc (Česká republika)
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Legionelové infekce – opomíjený problém
- Bakterie komplexu Burkholderia cepacia – epidemiologie a diagnostika infekcí u pacientů s cystickou fibrózou
- Epidemiologické šetření v pěti ambulancích Kliniky zubního lékařství LF UP v Olomouci a FN Olomouc
- Klinické a epidemiologické charakteristiky pacientů hospitalizovaných pro těžký průběh chřipky v sezoně 2012–2013
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

