-
Medical journals
- Career
Bakterie komplexu Burkholderia cepacia – epidemiologie a diagnostika infekcí u pacientů s cystickou fibrózou
Authors: P. Dřevínek
Authors‘ workplace: Ústav lékařské mikrobiologie 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice v Motole
Published in: Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 1, s. 18-26
Category: Review articles, original papers, case report
Overview
Bakterie komplexu Burkholderia cepacia vyvolávají závažné plicní infekce především u pacientů s cystickou fibrózou (CF). Nebezpečí epidemického šíření infekce v komunitě nemocných s touto diagnózou si vyžádalo zavést přísná izolační opatření a správně a včas mikrobiálního původce identifikovat. Tento souborný referát přibližuje taxonomii komplexu B. cepacia, možnosti laboratorní diagnostiky všech jeho zástupců a popisuje epidemiologickou situaci v komunitách nemocných CF u nás i ve světě.
Klíčová slova:
komplex Burkholderia cepacia – cystická fibróza – epidemický kmen – patogeneze infekce1. CYSTICKÁ FIBRÓZA A INFEKCE RESPIRAČNÍHO TRAKTU
Cystická fibróza (CF) se řadí mezi nejčastější monogenně podmíněná onemocnění. Pro kavkazskou populaci se obvykle udává frekvence výskytu CF 1 : 2 500–4 000 narozených dětí, i když předběžná data z celoplošného novorozeneckého screeningu, uvedeného v České republice do klinické praxe na podzim 2009, naznačují, že se incidence CF pohybuje u nás spíše kolem hranice 1 : 6.000 dětí ([1] a dále nepublikovaná data, Ústav biologie a genetiky FN v Motole). Národní registr nemocných CF u nás eviduje celkem 570 žijících pacientů, z nichž 354 patří do věkové kategorie 0–19 let (údaj k 1. 8. 2013).
Genetickým podkladem nemoci je mutace v genu CFTR, jehož proteinový produkt za normálních okolností funguje jako membránový transportér chloridových iontů. Narušená či nulová exprese tohoto iontového kanálu vede k elektrolytové a vodní dysbalanci sekretů epiteliálních buněk a z klinického hlediska k řadě příznaků, jejichž společným jmenovatelem je právě obstrukce dutých orgánů viskózním sekretem. CF má tak charakter multiorgánového onemocnění, jehož typický klinický obraz sestává z obstrukce dýchacích cest (cca 95 % pacientů), z postižení exokrinní funkce pankreatu (cca 85 % nemocných), z obstrukce žlučových cest a z ní vyplývajícího jaterního onemocnění (cca 25 % pacientů) a u mužů též z obliterace vas deferens, která má za následek obstruktivní azoospermii (cca 97 % mužů).
Postižení respiračního traktu je v rámci CF oprávněně považováno za nejvážnější projev onemocnění, a to nejen z důvodu vysoké četnosti jeho výskytu, ale především z pohledu jeho postupné, ireverzibilní progrese a limitovaných možností léčby [20]. Respirační selhání je nejčastější primární příčina úmrtí na CF. Významnou úlohu v progresi plicní nemoci přitom nehraje jen mechanická obstrukce vazkým hlenem, ale také doprovodné infekce, pro něž jsou nedostatečně ventilované plíce s narušenou schopností mukociliární clearance příhodným prostředím k dlouhodobé kolonizaci, respektive infekci.
Nemocní CF se nacházejí v celoživotním riziku rozvinutí chronické infekce dolních cest dýchacích, které způsobují jak bakterie obvyklé v komunitě (např. Staphylococcus aureus či Haemophilus influenzae), tak oportunně patogenní mikroorganismy [3]. Mezi ty se řadí především gramnegativní nefermentující tyčinky, zvláště Pseudomonas aeruginosa a bakterie komplexu Burkholderia cepacia (Bcc). Oba tyto patogeny dovedou způsobit dlouhodobé infekce, které poškozují plicní tkáň hostitele ať už přímo, či nepřímo přes vystupňovanou imunitní odpověď a prokazatelně zhoršují parametry plicních funkcí. Zprvu většinou asymptomatická infekce přechází do stadia s navracejícími se epizodami exacerbace plicní nemoci a ty v případě infekce Bcc mohou vyústit až ve fatální, fulminantně probíhající sepsi, označovanou jako cepacia syndrom [4].
Závažnost pseudomonádových infekcí i těch, které způsobují bakterie Bcc, je zdůrazněna dvěma dalšími okolnostmi:
- omezenými možnostmi antibiotické terapie,
- rizikem získání infekce od jiného pacienta s CF.
Oba mikroorganismy vykazují primární rezistenci k řadě antimikrobních látek a pravděpodobnost úspěšného terapeutického zásahu dále klesá s délkou infekce tak, jak se bakterie adaptují na dané mikroprostředí (růst v biofilmu, intracelulární přežívání v makrofágách, aktivace efluxových systémů k eliminaci antibiotik). Léčebná strategie je proto alespoň v případě P. aeruginosa založena na co možná nejčasnějším zahájení podávání antibiotik v inhalační formě s cílem eradikovat infekci v její počáteční fázi [5, 6]; analogické doporučené postupy pro zvažovanou eradikační léčbu infekce Bcc prozatím k dispozici nejsou. Do doby vyléčení infekce musí být každý takový pacient veden jako infekční a izolován od ostatních nemocných CF, neboť některé bakteriální kmeny se mezi pacienty prokazatelně šíří, a mohou tak způsobovat lokální epidemie. Ostatně o neblahém faktu možného epidemického šíření infekce se Centrum CF při FN Motol přesvědčilo v uplynulých dvou desetiletích, kdy se četná skupina pacientů infikovala stejným kmenem Bcc (více v části 3.1). Z tohoto důvodu každé specializované centrum CF uplatňuje v rámci svého provozu řadu přísných opatření, jimiž minimalizuje riziko dalšího šíření infekce. Základní pravidlo spočívá v rozdělení pacientů podle aktuálního mikrobiologického nálezu do izolačních skupin, jež se vzájemně nesmějí setkávat na žádném oddělení nebo na ambulanci (příklad rozdělení pacientů v Centru CF ve FN Motol – tabulka 1). Ani uvnitř takto definovaných skupin však nelze přestat pamatovat na vyšší náchylnost pacientů k získání respiračních infekcí, a proto by měl být každý pacient nakonec vnímán jako samostatná izolační skupina, která nepřijde do kontaktu s žádným jiným pacientem s CF.
Table 1. Přehled izolačních skupin, do nichž jsou pacienti s CF rozděleni podle protiepidemického režimu Centra CF ve FN Motol Tabulka 1. Overview of isolation groups in patients of the CF Centre of the Motol Hospital, Prague 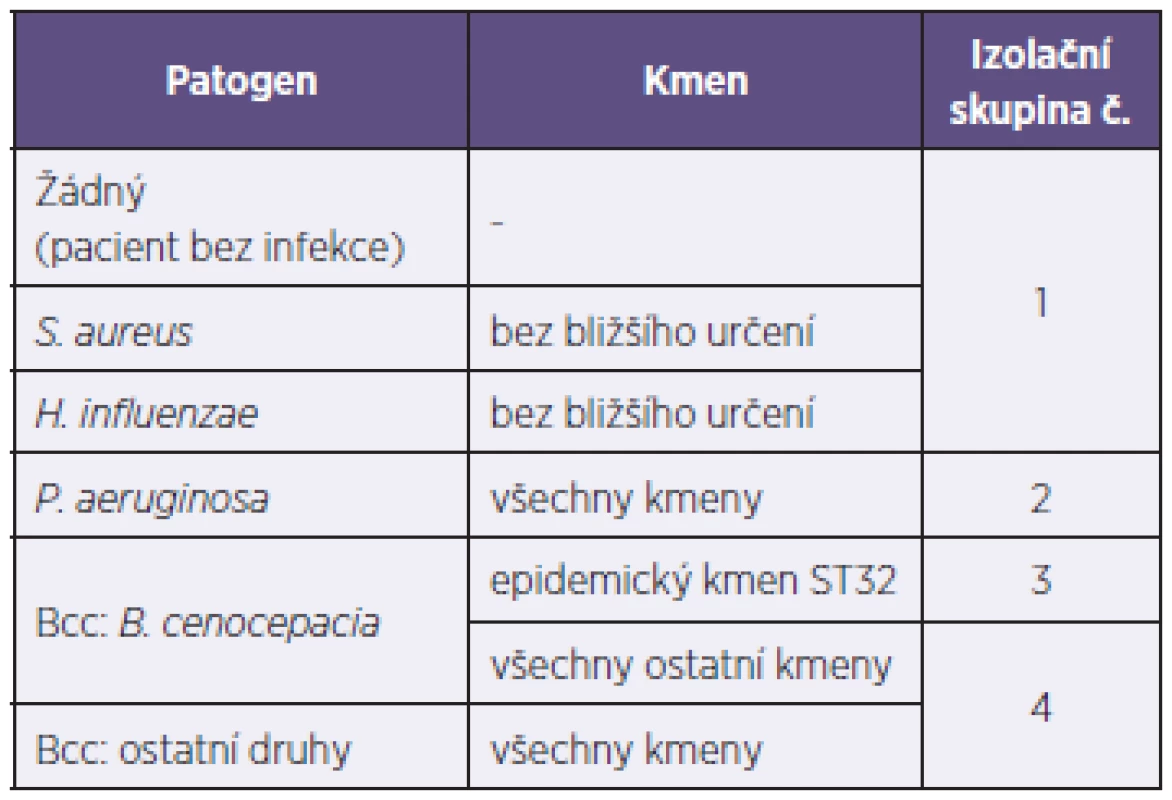
Výše zmíněné atributy infekcí P. aeruginosa a Bcc, tj. jejich negativní vliv na průběh základního onemocnění, nejistý výsledek antibiotické terapie a možný epidemický charakter infekce, podávají jasné vysvětlení, proč se tato problematika dostává do popředí zájmu celé profesní a vědecké komunity, která se zabývá nemocí CF.
2. TAXONOMIE A IDENTIFIKACE Bcc
Bakterie Bcc vytvářejí asi jeden z největších problémů mikrobiologické diagnostiky patogenů CF. Překážkou pro kultivační techniky se stala zvláště jejich složitá taxonomie. Názvu celé skupiny Bcc dominuje termín komplex, který napovídá, že se v ní ukrývá více samostatných bakteriálních druhů, rozpoznaných a popsaných až na základě molekulárně genetických testů [8]. Ty také potvrdily blízkou genetickou příbuznost mezi druhy, kterou lze demonstrovat vyšší než 98% podobností v nukleotidové sekvenci genu pro 16S rRNA nebo 94–95% podobností v genu recA.
V současnosti tato skupina obsahuje 17 bakteriálních druhů (tab. 2). Identifikace jednotlivých druhů stále závisí na použití metod, které jsou založeny na detekci polymorfismů DNA. Některé členy skupiny je možné určit pomocí druhově specifických PCR [9–11], ale míra a spolehlivost použití tohoto přístupu klesá s dalším poznáváním genetické heterogenity Bcc, která se odráží v popisování stále nových druhů uvnitř Bcc [12, 13]. Přesné identifikace všech členů Bcc lze tak s nejvyšší mírou pravděpodobnosti dosáhnout pomocí sekvenční analýzy několika genů [14].
Table 2. Současná taxonomie komplexu B. cepacia Tabulka 2. Current taxatomy of the BCC 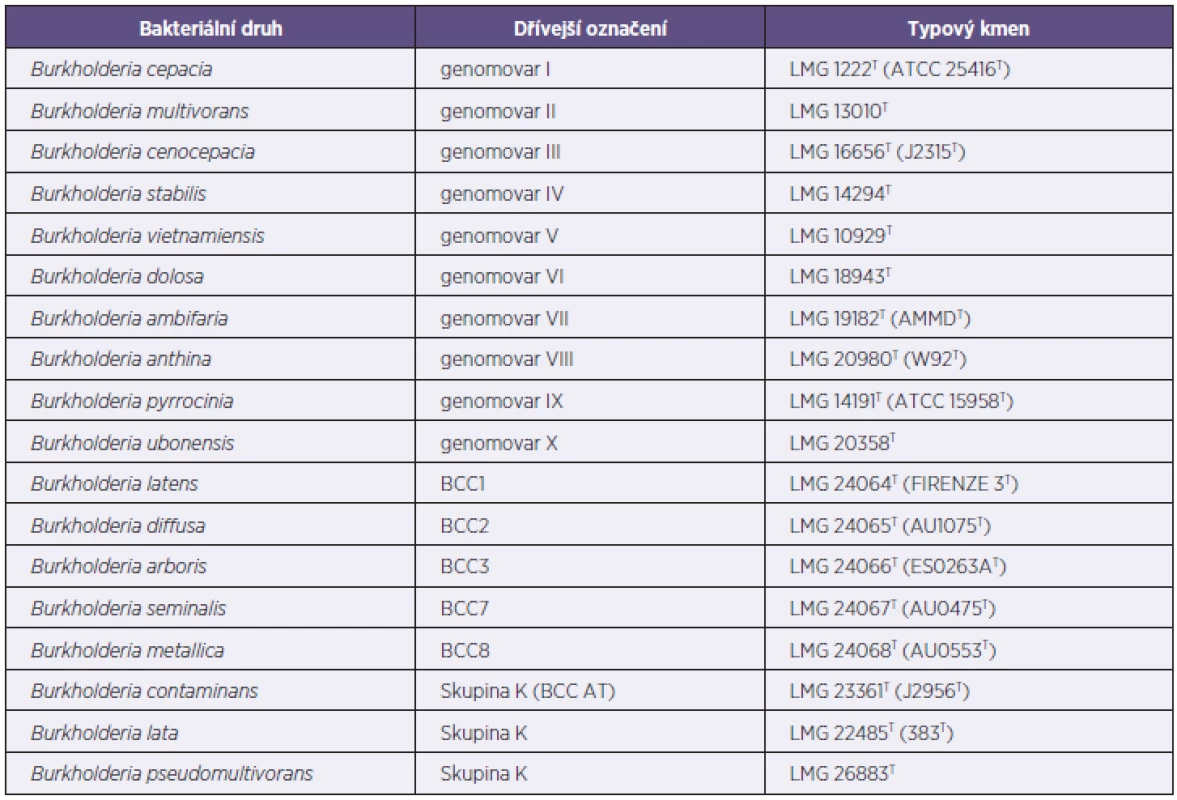
Převzato z publikace [15]. Taken from the publication [15]. Dnes se za zlatý standard detekce Bcc jakožto celku pokládá PCR, jehož cílovou oblastí je část genu recA o délce 1040 bp [10]. Pro konečné určení izolátu Bcc na úroveň bakteriálního druhu se doporučuje využít metody multilokusové sekvenční typizace (MLST), pomocí níž se analyzuje nukleotidová sekvence sedmi genů [16, 17]. Ta umožní většinou nejen spolehlivě zařadit izolát do jednoho z 18 druhů, ale také označí jeho sekvenční typ (ST), čímž dokonce řeší i otázku identifikace kmene.
Infekci je možné díky metodám založeným na detekci DNA diagnostikovat také přímo z klinického materiálu [9, 18]. Rovnou z vyšetřovaného vzorku lze zjistit druh i kmen, pokud využijeme typizační techniky MLST [19]. Podle našich zkušeností se tento zrychlený diagnostický postup vyplatí aplikovat zvláště na vzorky dosud negativních pacientů, neboť vysoká senzitivita PCR dovolí upozornit na počínající infekce u těch osob, které mají ještě negativní kultivační nález. Dřívější záchyt Bcc znamená pro takového jedince vyšší šanci na úspěch v eradikační léčbě a pro celou populaci CF vyšší ochranu před infekcí, je-li tento pacient okamžitě přeřazen do odpovídající izolační skupiny. Za období let 2001–2010 jsme zaznamenali 12 nových případů infekce Bcc s falešně negativním kultivačním výsledkem, který přetrvával 1–22 měsíců od diagnózy, stanovené jenom díky PCR [20].
3. EPIDEMIOLOGIE INFEKCE U PACIENTŮ S CF
3. 1. Situace v ČR
Obecně se bakterie Bcc vyskytují u pacientů s CF v neporovnatelně menším počtu než bakterie P. aeruginosa (např. ve Velké Británii se jedná o 3,8 % pacientů s Bcc vs. 54,9 % pacientů s P. aeruginosa, v USA tento rozdíl činí 2,5 % Bcc vs. 51,2 % P. aeruginosa; data získaná z odpovídajících národních registrů pro rok 2010 či 2011). Přesto však existují veliké rozdíly v prevalenci na úrovni jednotlivých léčebných center CF. Zprávy z některých zahraničních pracovišť poukazovaly v určitém období až na 25% výskyt infekce Bcc (např. centrum CF v Torontu [21]), což průkazně souviselo s přítomností epidemického kmene a s existencí příhodných podmínek pro jeho šíření v tamní populaci.
Epidemiologická situace v Centru CF při FN Motol, které má ve své péči zhruba 2/3 všech pacientů z České republiky, byla na sklonku 90. let minulého století do značné míry neznámá. Ačkoli tehdejší mikrobiologická diagnostika, založená na kultivaci, upozorňovala na určitý, nikoliv zanedbatelný výskyt Bcc v populaci, nebylo zřejmé, o jak zásadní nález se fakticky jedná. Epidemický rozsev infekce přitom reálně hrozil, vezmeme-li v potaz například tu skutečnost, že pacienti se mohli účastnit rekondičních táborů, které se pro ně pravidelně organizovaly až do roku 1998 (byť ti nemocní, u nichž byla infekce Bcc diagnostikována, měli vstup na takovéto akce už tehdy zapovězen).
V roce 2001 jsme do mikrobiologického vyšetřovacího postupu zavedli novou metodu PCR [9]. Ta řešila problém nízké citlivosti i specificity kultivačního vyšetření a navíc umožňovala zařadit bakteriální agens do jednoho ze sedmi druhů, které v té době tvořily čerstvě ustanovený taxonomický komplex B. cepacia. Pomocí PCR jsme infekci Bcc diagnostikovali či potvrdili zhruba u 30 % nemocných, z nichž naprostá většina nesla druh Burkholderia cenocepacia (dříve označovaný jako genomovar III, podskupina IIIA definovaná podle polymorfismů genu recA).
Odpověď na otázku, zdali uniformita na úrovni bakteriálního druhu je důsledek výskytu jediného kmene se schopností šířit se mezi pacienty, mohla poskytnout jedině detailnější molekulárně genetická analýza, spočívající v genotypizaci klinických izolátů. V době provedení první epidemiologické práce na souboru našich pacientů se k použití nabízely pouze ty genotypizační techniky, jejichž princip byl založen na porovnávání fingerprintových profilů na gelu. Použité metody RAPD (random amplified polymorphic DNA) i PFGE (pulsed field gel electrophoresis) naznačovaly klonalitu většiny klinických izolátů, což bylo možné považovat za důkaz epidemického rozsevu infekce v české komunitě CF [22]. S určitou úlevou molekulárně epidemiologická analýza vyloučila shodu českých izolátů s nechvalně proslulou epidemickou linií ET12, která způsobovala velmi agresivní infekce u pacientů v Kanadě a Velké Británii (kapitola 3. 2. 1).
Náš epidemický kmen byl zpočátku označen jako CZ1, ačkoli výrazná podobnost jeho genotypizačního profilu s profilem kanadského kmene RAPD01 již tehdy naznačovala, že CZ1 nejspíše nebude kmen lokálního významu. Tento předpoklad také potvrdily výsledky typizační metody MLST, založené na sekvenaci. Dodatečná analýza zkoumaných izolátů potvrdila shodu mezi CZ1 a RAPD01 a oba dva klony zařadila do téhož sekvenčního typu ST32. Důkaz o globálním výskytu ST32 poté přinesla data z centrální databáze MLST (www.pubmlst.org/bcc), podle níž se ST32 nachází nejen v Kanadě a ČR, ale také ve Francii, Itálii, Belgii a Velké Británii [23].
Následný vývoj epidemiologické situace infekce Bcc u nás lze hodnotit jako příznivý. Zatímco až do konce roku 1999 byla každá infekce vyvolána epidemickým kmenem ST32, v dalších letech se začaly jako původci infekce objevovat jiné kmeny, a to často jiných bakteriálních druhů než B. cenocepacia (konkrétně B. multivorans, B. stabilis a B. contaminans) [20]. Žádný z těchto nově zachycených kmenů nebyl nalezen u většího počtu pacientů zároveň, což upozorňuje na jejich pravděpodobnou akvizici ze zevního prostředí, nikoli od jiného pacienta.
I přes stále vysoký počet pacientů s infekcí epidemickým kmenem ST32 (k 31. 12. 2010 jich bylo evidováno na 27), jsme za období let 2004–2010 zaznamenali pouze dva nové případy této obávané infekce [20] – obrázek 1. Přitom poslední dokumentovaný případ z roku 2007 náleží pacientce, která přestoupila z jiného centra CF a již při první kontrole ve FN v Motole měla pozitivní nález ST32. Nelze jej tak hodnotit jako epidemiologicky významný. Poslední interhumánní přenos, který může být asociován s endemickou situací v Centru CF při FN Motol, lze tak datovat do roku 2004. Zdá se, že nastavená protiepidemická opatření centra CF jsou dnes adekvátní a efektivně brání přenosu infekce mezi pacienty.
Image 1. Výskyt infekcí Bcc v Centru CF při FN Motol v období 1994–2010 Levý sloupec pro každý jednotlivý rok označuje incidenci, pravý sloupec prevalenci infekce. Případy s infekcí kmenem ST32 jsou označeny černě, infekce způsobené ostatními kmeny a druhy jsou zvýrazněny šedivě. Upraveno podle publikace [20]. Fig. 1 The occurence of infections caused by the Burkholderia cepacia complex in patients of the CF Centre of the Motol Hospital, Prague from 1994 to 2010 Left column: incidence of Bcc infection in the respective year. Right column: prevalence of Bcc infection. Cases caused by strain ST32 are highlighted in black and those caused by other strains and species are highlighted in grey. Adapted from the publication [20]. ![Výskyt infekcí Bcc v Centru CF při FN Motol v období 1994–2010 Levý sloupec pro každý jednotlivý rok označuje incidenci, pravý sloupec prevalenci infekce. Případy s infekcí kmenem ST32 jsou označeny černě, infekce způsobené ostatními kmeny a druhy jsou zvýrazněny šedivě.
Upraveno podle publikace [20].
Fig. 1 The occurence of infections caused by the Burkholderia cepacia complex in patients of the CF Centre of the Motol Hospital, Prague from 1994 to 2010 Left column: incidence of Bcc infection in the respective year. Right column: prevalence of Bcc infection. Cases caused by strain ST32 are highlighted in black and those caused by other strains and species are highlighted in grey.
Adapted from the publication [20].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/93dd407c83e72886c5bd9ef4f766db99.jpg)
3. 2. Situace ve světě
3. 2. 1. Epidemické kmeny
Kmen, který se nachází u českých pacientů s CF nejběžněji, nese označení ST32. Ačkoli nyní je patrné, že se jedná o jeden ze tří nejrozšířenějších epidemických kmenů druhu B. cenocepacia, dlouho mu nebyla věnována taková pozornost jako druhým dvěma přenosným klonům ET12 a PHDC.
Existence epidemické linie ET12, která se rozšířila v centrech CF v Kanadě a poté i ve Velké Británii, byla potvrzena již v 90. letech 20. století [24, 25]. V souvislosti s ní byl také poprvé popsán terapeuticky nezvladatelný, rychle progredující stav, charakterizovaný bakteriémií, akutním respiračním selháním a výrazným poškozením plicní tkáně (cepacia syndrom [4]). Reprezentativním vzorkem linie se stal klinický izolát J2315, který byl jakožto první zástupce B. cenocepacia kompletně sekvenován v Sangerově institutu v letech 2000–2003 [26].
Druhý epidemiologicky významný kmen nese označení PHDC podle měst, odkud pocházejí první pacienti s tímto kmenem (Philadelphia a Washington, DC) [27]. Výskyt PHDC však nezůstal omezen jen na východní pobřeží USA, ale o tři roky později byl hlášen už i z Evropy [28]. Etabloval se tak jako další transatlantická linie, ačkoli na rozdíl od ET12 nenáleží k fylogenetické skupině IIIA, nýbrž ke skupině IIIB. PHDC tedy není úzce příbuzný s kmenem ET12 a například v MLST se liší ve všech vyšetřovaných alelách. Pro zajímavost uveďme, že záhy po popsání klinického izolátu PHDC (izolát s označením AU1054) byl nalezen environmentální protějšek s nerozlišitelným genetickým profilem (označení HI2424) [29]. Objev PHDC v přírodě přinesl důležitý důkaz v neprospěch hypotézy, kterou kdysi prosazovali zastánci využití Bcc jako biopesticidů v zemědělství, totiž že klinické a environmentální kmeny Bcc jsou dvě distinktní, neprolínající se množiny [30]. Nález naopak poukázal na to, že zdrojem Bcc nemusí být pouze nemocný jedinec s infekcí, ale také prostředí v blízkosti pacienta, a otevřel stále aktuální otázku bez známé odpovědi, tj. zda a jak se mohou pacienti vyvarovat získání infekce ze zevního prostředí.
Konečně třetí v pořadí je již několikrát zmíněný epidemický kmen ST32. Stejně jako ET12 patří do recA skupiny IIIA a lze jej také považovat za kmen, který je linii ET12 geneticky blízký. Například podle schématu MLST se tyto dva kmeny od sebe liší jen ve třech alelách ze sedmi vyšetřovaných. Oba kmeny se podobají i z hlediska klinických příznaků, kterými se manifestuje jimi způsobená infekce dolních cest dýchacích. Vyvíjí se chronická infekce, která může v obou případech vyústit ve shora popsaný cepacia syndrom. Pozoruhodná je však rozdílná délka v trvání infekce, tedy od okamžiku stanovení její diagnózy až po terminální stadium nemoci. Zatímco výsledky z centra CF v Manchesteru, kde se vyskytuje kmen ET12, ukazují, že třetina pacientů nepřežije déle než pět let od získání infekce [31], údaje z motolského centra CF, kde se vyskytuje kmen ST32, vyznívají o něco optimističtěji. Pětiletý interval přežívá více než 90 % nemocných ([23], Libor Fila, Centrum CF při FN Motol, nepublikovaná data).
Kmen ST32 někdy nese označení CZ1 [22, 32], RAPD01 [21] nebo B&B či ADA klon (francouzské pojmenování, Christine Segonds, nepublikovaná data), což vypovídá o tom, že kmen byl identifikován v různých zemích světa bez patrné epidemiologické souvislosti na nadnárodní úrovni. Jeho přítomnost v mnoha zemích světa tak vyvolává otazníky. Možná k nepozorovanému rozsevu infekce došlo někdy v minulosti během konání společných setkání pro pacienty inkriminovaných států. Pro takové tvrzení ovšem chybí jednoznačné důkazy v podobě nějaké epidemiologické studie. Přenos infekce v mezinárodním měřítku je zdokumentován pouze u epidemického kmene ET12, jemuž příznivé podmínky pro přestup z Kanady na Starý kontinent vytvořilo organizování mezinárodních táborů pro CF [24, 25].
3. 2. 2. Distribuce druhů Bcc
Všechny druhy s výjimkou B. ubonensis byly izolovány ze vzorků dýchacích cest pacientů s CF. Zdaleka nejčastěji však bývá ve sputu přítomen druh B. cenocepacia nebo B. multivorans, které společně zodpovídají za 70–90 % všech infekcí Bcc (tab. 3) [23, 32]. První z nich bezkonkurenčně vévodil nálezům v 90. letech 20. století, což do značné míry odráželo tehdejší obtíže se zvládáním epidemií. Nastavením pravidel kontroly infekce se počet nových případů nákazy B. cenocepacia začal v mnoha centrech CF snižovat a na přelomu tisíciletí byl již pozorován trend v nárůstu výskytu ostatních druhů, jmenovitě B. multivorans. Předpokládá se, že zdrojem infekce je v těchto nových případech většinou zevní prostředí, případně kontaminované pomůcky a průmyslové výrobky, s kterými nemocní přijdou do kontaktu [33, 34]. Výmluvnými příklady jsou dezinfekční ubrousky nebo nosní spreje, které byly v USA staženy z distribuce právě z důvodu kontaminace Bcc [35, 36].
Nejnovější kapitolu v epidemiologii infekcí píše B. contaminans, která byla uvnitř Bcc vyčleněna jako samostatný druh teprve v roce 2009 [12]. Ačkoli v zastoupení mezi klinickými izoláty většinou nedosahuje hodnot srovnatelných s B. cenocepacia a B. multivorans, např. v populaci pacientů s CF v Argentině si získala jasné prvenství s ojediněle vysokým podílem, překračujícím hranici 50 %. Recentní epidemiologická studie tamní populace [37] znovu poukazuje na riziko získání této infekce z kontaminovaných pomůcek. Výběr druhového názvu pro tuto burkholderii je tak velice výstižný. Ostatně samotný objev B. contaminans pravděpodobně provázela kontaminace vyšetřovaného materiálu. Domnělý nález nové burkholderie (coby její DNA) v metagenomu Sargasového moře [38] se totiž nikdy nepodařilo doplnit o nález živého izolátu v moři a dodatečné pokusy ani nepotvrdily schopnost burkholderií růst v mořské vodě [39].
4. FAKTORY VIRULENCE
Patogeneze infekce, stejně jako například příčiny prudkých změn v klinickém stavu pacienta s chronickou infekcí Bcc, nejsou stále uspokojivě popsány. Není zřejmé, proč u někoho infekce probíhá asymptomaticky a proč naopak jiný pacient vyvine krátce po získání infekce smrtelný septický stav. Intenzivně vedený výzkum na poli patogenity přinesl mnoho důležitých poznatků o patogenním chování bakterie, ale povětšinou se omezil pouze na popis jednotlivých faktorů patogenity. Přesah do jejich vzájemné interakce, regulace a pochopení dynamiky celého procesu umožnily až v posledních letech rychle se rozvíjející metody pro analýzu celého genomu a transkriptomu [40].
Mezi klasické patogenní faktory, nalezené u Bcc, se řadí systém quorum sensing, jenž zprostředkovává vzájemnou komunikaci bakterií na vnitrodruhové i mezidruhové úrovni, povrchové struktury, ať už se jedná o lipopolysacharid, kapsulární exopolysacharidy asociované s růstem v biofilmu, adhezivní vlákna nebo bičík, dále procesy pro získávání volného železa, jež zahrnují siderofory ornibactin a pyochelin, nebo mechanismy vedoucí k rezistenci na antimikrobní látky, zvláště v podobě efluxových systémů. K získání zevrubnějších informací lze čtenáře odkázat na zahraniční přehledové práce, jež se tomuto tématu detailně věnují [41, 42].
Bohatou plejádu faktorů virulence si burkholderie zajišťují nadprůměrně velkým genomem (až 9 Mb), který je rozdělen do tří chromozomů a který si zachovává schopnost přijímat a uchovávat cizí DNA. O tom svědčí početná přítomnost genomických ostrovů, transpozonů a inzerčních sekvencí, které dohromady způsobují značnou tvárnost genomu a v konečném důsledku bakterii propůjčují vysokou míru adaptability na nejrůznější životní podmínky [43, 44]. Jeden z nejlépe prostudovaných genomických ostrovů je tzv. B. cenocepacia island (cci), k jehož objevu ještě před znalostí celého genomu kmene J2315 navedla přítomnost neobvyklé DNA [45]. Jednalo se o DNA marker bez zjevné funkce označovaný jako BCESM, který byl společný epidemickým kmenům B. cenocepacia IIIA a u jiných kmenů chyběl. Detailní analýza širší oblasti v okolí BCESM odhalila, že tento marker je součástí většího úseku, který svým uspořádáním odpovídá ostrovu patogenity. Obsahuje na 43 genů, mezi nimiž se nachází i dvojice genů pro systém quorum sensing. Právě nálezy typu tohoto genomického ostrova, vlastního jen těm kmenům B. cenocepacia, které v minulosti prokázaly schopnost epidemicky se šířit a infikovat mnoho pacientů, přispívají k pochopení rozdílného biologického chování mezi kmeny téhož druhu.
5. ZÁVĚR
I přes složitou nomenklaturu komplexu bakterií B. cepacia lze všech 18 druhů identifikovat a stanovit případnou příslušnost vyšetřovaného izolátu k některému ze známých epidemických kmenů. Klíčem ke správné laboratorní diagnostice je PCR zaměřené na gen recA a multilokusová sekvenční analýza. V České republice přetrvává vysoké procento pacientů s CF, kteří trpí chronickou infekcí způsobenou epidemickým kmenem B. cenocepacia ST32. Nicméně dnešní obraz epidemiologické situace, která je výsledkem efektivního skloubení možností moderní mikrobiologie a zodpovědného přístupu klinických pracovníků i pacientů k dodržování protiepidemických pravidel, ukazuje, že epidemii ST32 se podařilo zastavit a pacienti bez infekce Bcc jsou účinně před touto hrozbou chráněni.
Poděkování: Autor děkuje všem svým kolegům z Centra CF při FN Motol a Laboratoře molekulární genetiky při Pediatrické klinice 2. LF UK, kteří se aktivně podílejí na péči o nemocné CF nebo zajišťují jejich molekulárně mikrobiologické testování. Místní projekty laboratoře mohly být realizovány díky finanční podpoře MŠMT LD11029, MZČR IGA NT12405-5 a MZ ČR - RVO, FN v Motole 00064203.
Do redakce došlo dne 23. 8. 2013.
Corresponding author:
Doc. MUDr. Pavel Dřevínek, Ph.D.
Ústav lékařské mikrobiologie UK 2. LF a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: pavel.drevinek@Lfmotol.cuni.cz
Sources
1. Balascakova M, Holubova A, Skalicka V, Zemkova D, et al. Pilot newborn screening project for cystic fibrosis in the Czech Republic: defining role of the delay in its symptomatic diagnosis and influence of ultrasound-based prenatal diagnosis on the incidence of the disease. J Cyst Fibros, 2009;8 : 224–227.
2. Gibson RL, Burns JL, Ramsey BW. Pathophysiology and management of pulmonary infections in cystic fibrosis. Am J Respir Crit Care Med, 2003;168 : 918–951.
3. Hauser AR, Jain M, Bar-Meir M, McColley SA. Clinical significance of microbial infection and adaptation in cystic fibrosis. Clin Microbiol Rev, 2011;24 : 29–70.
4. Isles A, Maclusky I, Corey M, Gold R, et al. Pseudomonas cepacia infection in cystic fibrosis: an emerging problem. J Pediatr, 1984;104 : 206–210.
5. Ratjen F, Munck A, Kho P, Angyalosi G. Treatment of early Pseudomonas aeruginosa infection in patients with cystic fibrosis: the ELITE trial. Thorax, 2010;65 : 286–291.
6. Taccetti G, Bianchini E, Cariani L, Buzzetti R et al. Early antibiotic treatment for Pseudomonas aeruginosa eradication in patients with cystic fibrosis: a randomised multicentre study comparing two different protocols. Thorax, 2012;67 : 853–859.
7. Dřevínek P, Fila L. Role moderní mikrobiologické diagnostiky v péči o pacienty s cystickou fibrózou. Česko-slovenská pediatrie, 2008;63 : 84–90.
8. Vandamme P, Dawyndt P. Classification and identification of the Burkholderia cepacia complex: Past, present and future. Syst Appl Microbiol, 2011;34 : 87–95.
9. Drevinek P, Hrbackova H, Cinek O, Bartosova J, et al. Direct PCR detection of Burkholderia cepacia complex and identification of its genomovars by using sputum as source of DNA. J Clin Microbiol, 2002;40 : 3485–3488.
10. Mahenthiralingam E, Bischof J, Byrne SK, Radomski C et al. DNA-Based diagnostic approaches for identification of Burkholderia cepacia complex, Burkholderia vietnamiensis, Burkholderia multivorans, Burkholderia stabilis, and Burkholderia cepacia genomovars I and III. J Clin Microbiol, 2000;38 : 3165-3173.
11. Drevinek P, Baldwin A, Dowson CG, Mahenthiralingam E. Diversity of the parB and repA genes of the Burkholderia cepacia complex and their utility for rapid identification of Burkholderia cenocepacia. BMC Microbiol, 2008;8 : 44.
12. Vanlaere E, Baldwin A, Gevers D, Henry D et al. Taxon K, a complex within the Burkholderia cepacia complex, comprises at least two novel species, Burkholderia contaminans sp. nov. and Burkholderia lata sp. nov. Int J Syst Evol Microbiol, 2009;59 : 102–111.
13. Vanlaere E, Lipuma JJ, Baldwin A, Henry D et al. Burkholderia latens sp. nov., Burkholderia diffusa sp. nov., Burkholderia arboris sp. nov., Burkholderia seminalis sp. nov. and Burkholderia metallica sp. nov., novel species within the Burkholderia cepacia complex. Int J Syst Evol Microbiol, 2008;58 : 1580–1590.
14. Cesarini S, Bevivino A, Tabacchioni S, Chiarini L et al. RecA gene sequence and Multilocus Sequence Typing for species-level resolution of Burkholderia cepacia complex isolates. Lett Appl Microbiol, 2009;49 : 580–588.
15. Drevinek P, Mahenthiralingam E. Burkholderia. In: Fillipis de I, McKee M. Molecular Typing in Bacterial Infections. Humana Press: NY, 2013. s. 301–308.
16. Baldwin A, Mahenthiralingam E, Thickett KM, Honeybourne D, et al. Multilocus sequence typing scheme that provides both species and strain differentiation for the Burkholderia cepacia complex. J Clin Microbiol, 2005;43 : 4665–4673.
17. Spilker T, Baldwin A, Bumford A, Dowson CG, et al. Expanded multilocus sequence typing for Burkholderia species. J Clin Microbiol, 2009;47 : 2607–2610.
18. McDowell A, Mahenthiralingam E, Moore JE, Dunbar KE et al. PCR-based detection and identification of Burkholderia cepacia complex pathogens in sputum from cystic fibrosis patients. J Clin Microbiol, 2001;39 : 4247–4255.
19. Drevinek P, Vosahlikova S, Dedeckova K, Cinek O et al. Direct culture independent strain typing of Burkholderia cepacia complex from cystic fibrosis sputum. J Clin Microbiol, 2010;48 : 1888–1891.
20. Dedeckova K, Fila L, Skalicka V, Bartosova J et al. PCR detection of Burkholderia cepacia complex as one of key factors to handle a long-term outbreak. J Cyst Fibros, 2012;11 : 440–445.
21. Speert DP, Henry D, Vandamme P, Corey M, et al. Epidemiology of Burkholderia cepacia complex in patients with cystic fibrosis, Canada. Emerg Infect Dis, 2002;8 : 181–187.
22. Drevinek P, Vosahlikova S, Cinek O, Vavrova V et al. Widespread clone of Burkholderia cenocepacia in cystic fibrosis patients in the Czech Republic. J Med Microbiol, 2005;54 : 655–659.
23. Drevinek P, Mahenthiralingam E. Burkholderia cenocepacia in cystic fibrosis: epidemiology and molecular mechanisms of virulence. Clin Microbiol Infect, 2010;16 : 821–830.
24. Govan JR, Brown PH, Maddison J, Doherty CJ et al. Evidence for transmission of Pseudomonas cepacia by social contact in cystic fibrosis. Lancet, 1993;342 : 15–19.
25. Sun L, Jiang RZ, Steinbach S, Holmes A, et al. The emergence of a highly transmissible lineage of cbl+ Pseudomonas (Burkholderia) cepacia causing CF centre epidemics in North America and Britain. Nat Med, 1995;1 : 661–666.
26. Holden MT, Seth-Smith HM, Crossman LC, Sebaihia M, et al. The genome of Burkholderia cenocepacia J2315, an epidemic pathogen of cystic fibrosis patients. J Bacteriol, 2009;191 : 261–277.
27. Chen JS, Witzmann KA, Spilker T, Fink RJ, et al. Endemicity and inter-city spread of Burkholderia cepacia genomovar III in cystic fibrosis. J Pediatr, 2001;139 : 643–649.
28. Coenye T, Spilker T, Van Schoor A, LiPuma JJ et al. Recovery of Burkholderia cenocepacia strain PHDC from cystic fibrosis patients in Europe. Thorax, 2004;59 : 952–954.
29. LiPuma JJ, Spilker T, Coenye T, Gonzalez CF. An epidemic Burkholderia cepacia complex strain identified in soil. Lancet, 2002;359 : 2002–2003.
30. Parke JL, Gurian-Sherman D. Diversity of the Burkholderia cepacia complex and implications for risk assessment of biological control strains. Ann Rev Phytopathol, 2001;39 : 225–258.
31. Jones AM, Dodd ME, Govan JR, Barcus V et al. Burkholderia cenocepacia and Burkholderia multivorans: influence on survival in cystic fibrosis. Thorax, 2004;59 : 948–951.
32. Lipuma JJ. The changing microbial epidemiology in cystic fibrosis. Clin Microbiol Rev, 2010;23 : 299–323.
33. Baldwin A, Mahenthiralingam E, Drevinek P, Pope C, et al. Elucidating global epidemiology of Burkholderia multivorans in cases of cystic fibrosis by multilocus sequence typing. J Clin Microbiol, 2008;46 : 290–295.
34. Baldwin A, Mahenthiralingam E, Drevinek P, Vandamme P et al. Environmental Burkholderia cepacia complex isolates in human infections. Emerg Infect Dis, 2007;13 : 458–461.
35. Recalled wipes, swabs may contain B. cepacia. 2012. Dostupné na: http://aapnews.aappublications.org/content/early/2012/08/01/aapnews.20120801-2.full?sid=b0c5288e-3f2d-44cd-82d3-7d2e190f93d7.
36. Notice to readers: manufacturer's recall of nasal spray contaminated with Burkholderia cepacia complex. 2004. Dostupné na: http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5311a8.htm.
37. Martina P, Bettiol M, Vescina C, Montanaro P, et al. Genetic diversity of Burkholderia contaminans isolates from cystic fibrosis patients in Argentina. J Clin Microbiol, 2013;51 : 339–344.
38. Venter JC, Remington K, Heidelberg JF, Halpern AL, et al. Environmental genome shotgun sequencing of the Sargasso Sea. Science, 2004;304 : 66–74.
39. Mahenthiralingam E, Baldwin A, Drevinek P, Vanlaere E, et al. Multilocus sequence typing breathes life into a microbial metagenome. PLoS ONE, 2006;1:e17.
40. Sass A, Drevinek P, Sokol PA. Comparative Transcriptomics in Burkholderia. In: Coenye T, Mahenthiralingam E. Burkholderia: From Genomes to Function. Caister Academic Press; 2014, v tisku.
41. Loutet SA, Valvano MA. A decade of Burkholderia cenocepacia virulence determinant research. Infect Immun, 2010;78 : 4088–4100.
42. Mahenthiralingam E, Urban TA, Goldberg JB. The multifarious, multireplicon Burkholderia cepacia complex. Nat Rev Microbiol, 2005;3 : 144–156.
43. Hrabák J, Zemanová A, Chudáčková E. Mobilní genetické elementy v epidemiologii rezistence bakterií k antibiotikům. Epidemiol Mikrobiol Imunol, 2010;59 : 55–66.
44. Mahenthiralingam E, Drevinek P. Comparative genomics of Burkholderia species. In: Coenye T, Vandamme P. Burkholderia Molecular microbiology and genomics. Norfolk: Horizon Bioscience; 2007, s. 53–79.
45. Baldwin A, Sokol PA, Parkhill J, Mahenthiralingam E. The Burkholderia cepacia epidemic strain marker is part of a novel genomic island encoding both virulence and metabolism-associated genes in Burkholderia cenocepacia. Infect Immun, 2004;72 : 537–547.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2014 Issue 1-
All articles in this issue
- Klinické a epidemiologické charakteristiky pacientů hospitalizovaných pro těžký průběh chřipky v sezoně 2012–2013
- Bakterie komplexu Burkholderia cepacia – epidemiologie a diagnostika infekcí u pacientů s cystickou fibrózou
- Výsledky genotypizace, laboratorní diagnostika a epidemiologie viru příušnic cirkulujícího v České republice v roce 2012
- Legionelové infekce – opomíjený problém
- Hodnocení profylaktických opatření po expozici biologickému materiálu
- Epidemiologické šetření v pěti ambulancích Kliniky zubního lékařství LF UP v Olomouci a FN Olomouc
- Sekvenační analýza antigenů zařazených v čtyřkomponentní vakcíně proti meningokoku B v českých izolátech Neisseria meningitidis v období 2007–2013
- Chřipka v sezonách 2009-2013 ve Fakultní nemocnici Hradec Králové, východní Čechy
- Epidemiologické faktory ovlivňující vznik rekurentní a těžké infekce Clostridium difficile
- Epidemiologie kmenů Cronobacter spp. izolovaných z hospitalizovaných pacientů FN Olomouc (Česká republika)
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Legionelové infekce – opomíjený problém
- Bakterie komplexu Burkholderia cepacia – epidemiologie a diagnostika infekcí u pacientů s cystickou fibrózou
- Epidemiologické šetření v pěti ambulancích Kliniky zubního lékařství LF UP v Olomouci a FN Olomouc
- Klinické a epidemiologické charakteristiky pacientů hospitalizovaných pro těžký průběh chřipky v sezoně 2012–2013
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

