-
Medical journals
- Career
Kribriformně – morulární tyreoidální karcinom: vzácná jednotka
Authors: Ľudmila Michnová 1; Eva Traboulsi 1; Barbora Peková 2; Aleš Ryška 3
Authors‘ workplace: Oddělení patologie, Ústřední vojenská nemocnice – Vojenská fakultní nemocnice, Praha 1; Oddělení molekulární endokrinologie, Endokrinologický ústav, Praha 2; Fingerlandův ústav patologie, LF UK a FN, Hradec Králové 3
Published in: Čes.-slov. Patol., 58, 2022, No. 2, p. 107-110
Category: Original Articles
Overview
V kazuistice popisujeme případ 51-leté pacientky, která podstoupila totalizaci thyreoidektomie – resekci pravého laloku štítné žlázy pro růstovou progresi největšího uzlu. Z dominantního uzlu byla provedena aspirační biopsie tenkou jehlou (FNAB), která byla suspektní z malignity. V resekátu popsaný uzel odpovídal solidní, šedobělavé afekci, mikroskopicky s neobvyklou morfologií a imunoprofilem. Nález svědčil pro vzácný podtyp karcinomu štítné žlázy, tzv. kribriformně – morulární tyreoidální karcinom (CMTC). Nádor se většinou chová indolentně, je asociován s dobrou prognózou. Může se vyskytovat familiárně i sporadicky, převážně jako solitární léze, nebo multifokálně, často ve spojitosti s autozomálně dominantním syndromem familiární adenomatózní polypózy (FAP), proto je nutno při této diagnóze na něj cíleně poukázat. U pacientky byl vyloučen syndrom familiární polypózy, mutace genu APC byla somatická.
Klíčová slova:
štítná žláza – kribriformně-morulární tyreoidální karcinom – familiární adenomatózní polypóza
Dominantní malignitou štítné žlázy je papilární karcinom (PTC) představující 84 % všech případů zhoubných nádorů štítné žlázy (1). PTC se vyskytuje nejčastěji mezi 4. a 5. dekádou života, častěji u žen (2). Kribriformně-morulární tyreoidální karcinom (CMTC) je unikátní jednotkou nádorů štítné žlázy, typicky se vyskytuje u mladších pacientů (3. dekáda života) a zachycen je téměř výlučně u žen (3). Jeho prevalence je 0,16 % ze všech typů zhoubných nádorů štítné žlázy (4), v jedné z publikovaných studií z r. 2017 bylo popsáno pouze 129 případů uváděných v anglické literatuře v letech 1990-2016 (3).
V následujícím textu bude popsána kazuistika pacientky s kribriformně - morulárním tyroidálním karcinomem, včetně genetického vyšetření s nálezem patogenní varianty genu APC. Cílem článku je poukázat na zajímavý podtyp tyreoidální malignity a upozornit na jeho souvislost se syndromem familiární adenomatózní polypózy (FAP), u kterého je téměř 100 % riziko vzniku kolorektálního karcinomu (3,5).
KLINICKÝ NÁLEZ
Jedenapadesátiletá pacientka podstoupila v roce 1997 levostrannou hemithyreoidektomii s nálezem benigní strumy. Koncem roku 2019 byla provedena aspirační biopsie tenkou jehlou (FNAB) ze suspektního uzlu pravého laloku štítné žlázy, kde byly zastižené optimálně buněčné cytologické vzorky s nálezem papilomatoidně a trabekulárně uspořádaných skupin epitelií, které měly spíše světlá, místy protáhlá jádra s jemným chromatinem a cytoplazmu typu syncytia. Někde byly patrné drobné, netypické jaderné pseudoinkluze. Nález byl zařazen do kategorie Bethesda V s vyslovením vysoké suspekce na medulární karcinom. Vzhledem k růstové progresi uzlu a výsledku cytologického vyšetření byla pacientka přijata k totalizaci thyreoidektomie na Kliniku otorhinolaryngologie a maxilofaciální chirurgie 3. LF UK ÚVN v Praze. Kvůli podezření z medulárního karcinomu byly vyšetřeny hladiny sérového kalcitoninu, které byly v normě. V anamnéze pacientky je uvedená ulcerózní kolitida, se kterou se pacientka toho času léčí 14 let.
MATERIÁL A METODIKA
K vyšetření byl dodán nativní resekát pravého laloku štítné žlázy, na řezu s drobnými koloidními uzly a nádorovým ložiskem velikosti 15 x 12 x 10 mm, šedobělavé barvy, solidní struktury. Z nádoru byl odebrán vzorek ke genetickému vyšetření, odeslaný do Endokrinologického ústavu v Praze.
Mikroskopicky byla patrná drobně uzlovitá přestavba, v jednom bloku náhodně zastižený papilární mikrokarcinom průměru 2 mm, klasické úpravy. Makroskopicky patrný nádor byl obdán vazivovým pouzdrem a vykazoval solidní, místy kribriformní úpravu, s ojedinělými morulárními vírovitými strukturami (obr. 1A, 1B). Nádorové buňky byly s amfofilní cytoplazmou, většími, světlejšími, nepravidelnými jádry s jadérky, která neměla typický vzhled matnicových jader (obr. 2). Zastižena byla invaze do vazivového pouzdra, bez prorůstání celou jeho tloušťkou do okolního parenchymu žlázy, nádor byl omezen na tkáň štítné žlázy, bez nálezu nádorové angioinvaze či perineurálního šíření.
Image 1. Přítomnost morulárních formací v nádoru. Barveno hematoxylinem eozinem (A, zvětšení 200x). Přítomnost morulárních formací v nádoru. Barveno hematoxylinem eozinem (B, zvětšení 200x). 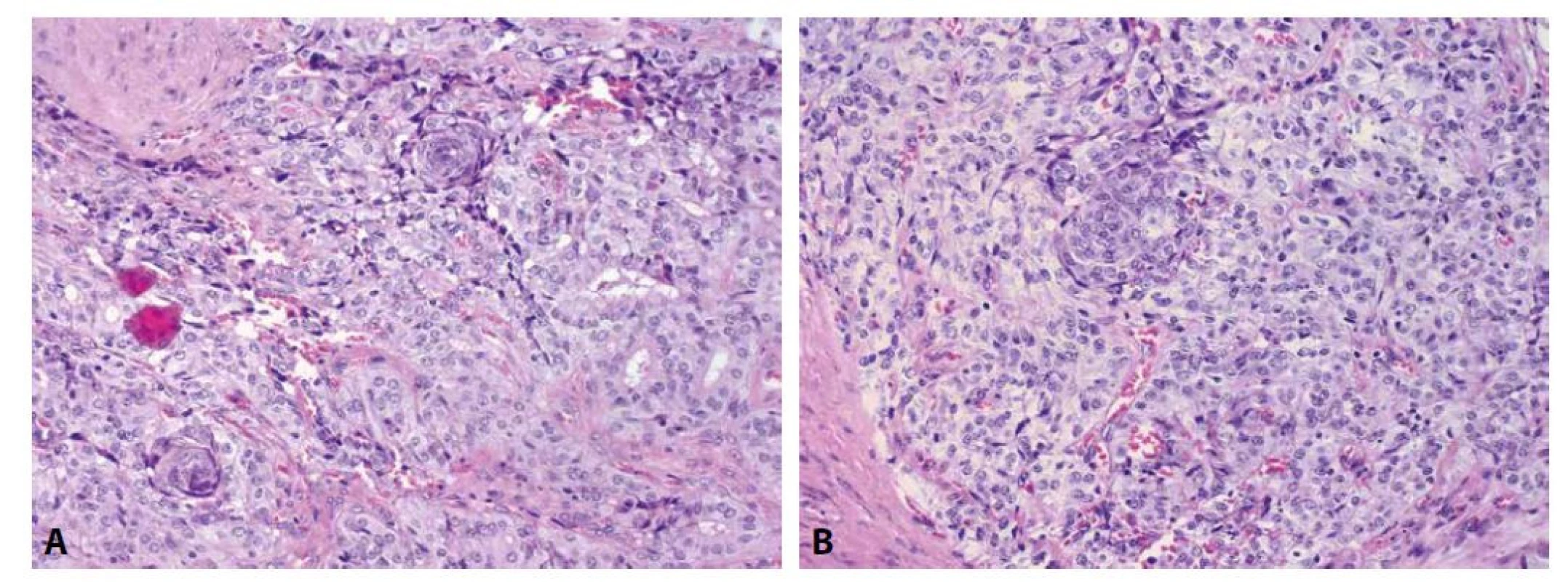
Image 2. Nádorové buňky mají větší, světlejší jádra s patrnými jadérky a lem amfofilní cytoplazmy. Barveno hematoxylinem eozinem (zvětšení 400x). 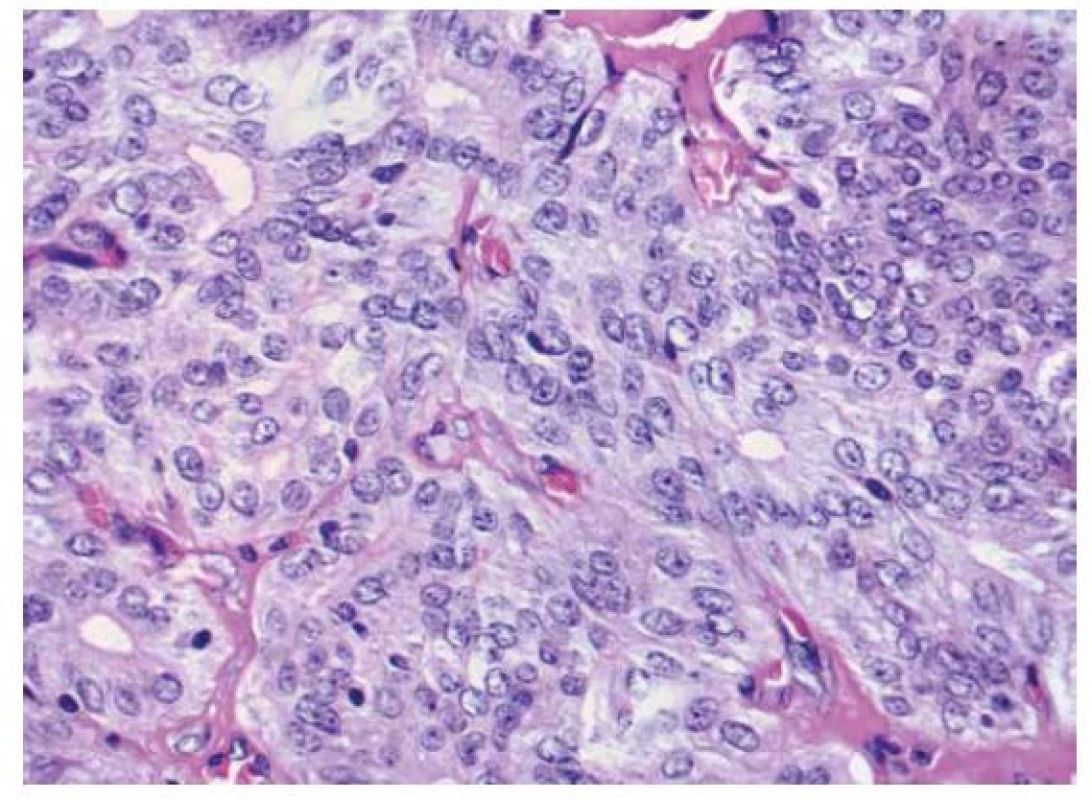
Imunohistochemicky byla prokázaná specifická (6) silná cytoplazmatická i nukleární exprese beta kateninu (obr. 3), silná difúzní exprese estrogenových receptorů (obr. 4) a pozitivita CK 7. CK 19 byl silně exprimován v non-morulárních nádorových buňkách a jenom slabě v morulárních strukturách. CD10 byl v nádoru pozitivní mapovitě. Slabá difúzní byla exprese TTF1 (obr. 5). HBME1 byl exprimován pouze v morulárních strukturách (obr. 6). Zcela negativní byl průkaz thyreoglobulinu, synaptofyzinu a chromograninu. Nádor byl dle TNM klasifikace zařazen do stádia pT1bNXMX.
Image 3. Imunohistochemický průkaz nukleární a cytoplazmatické pozitivity beta kateinu v nádorové afekci (zvětšení 400x). 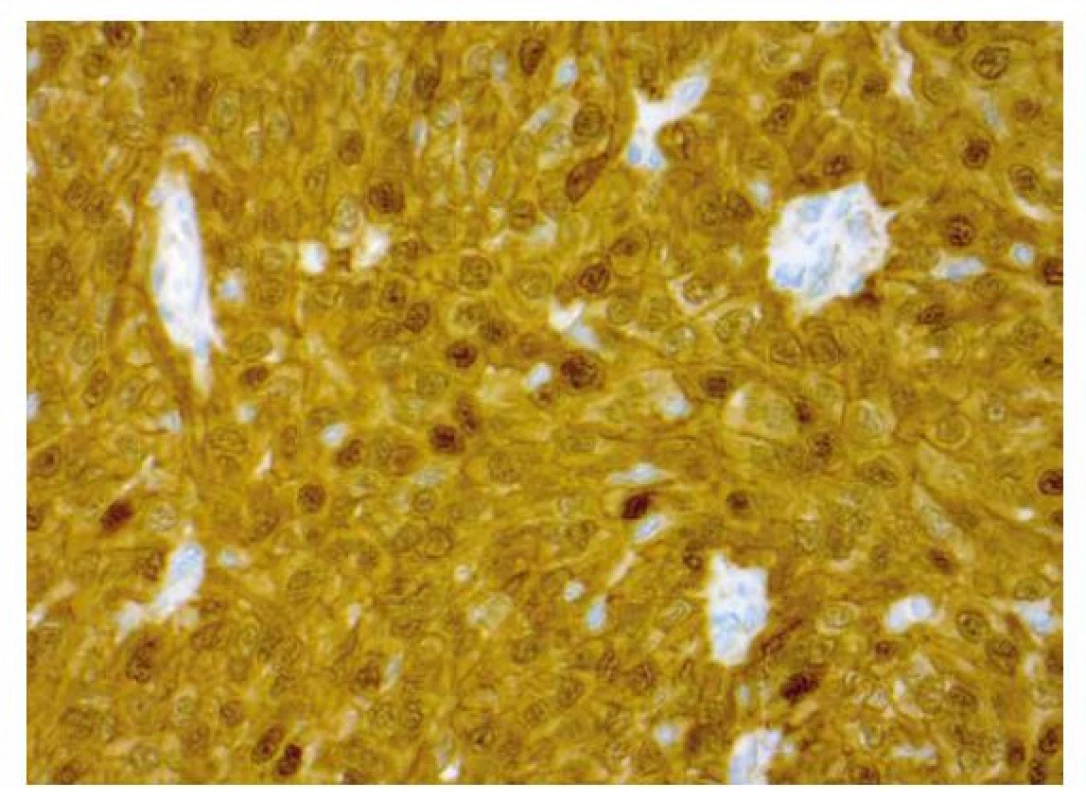
Image 4. Kribriformní úprava nádorových struktur, imunohistochemicky s průkazem silné exprese estrogenových receptorů (zvětšení 100x). 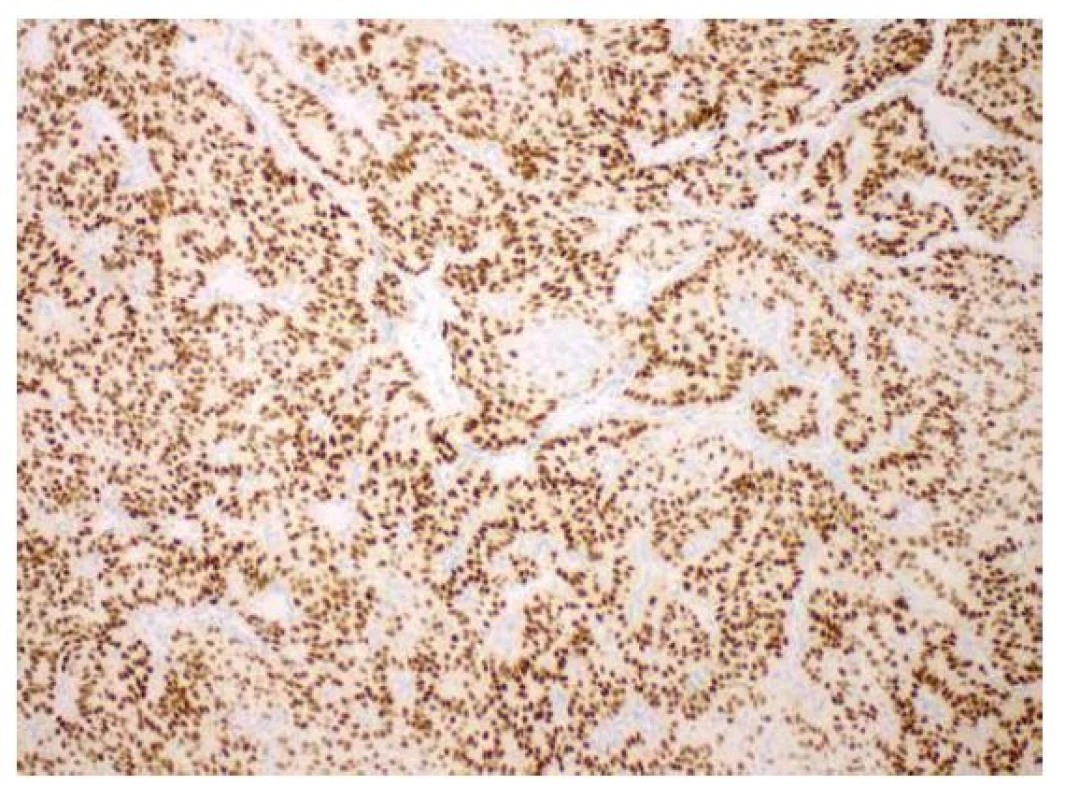
Image 5. Imunohistochemický průkaz slabé exprese TTF1 (vpravo) ve srovnání s normálními folikulárními buňkami (vlevo); (zvětšení 100x). 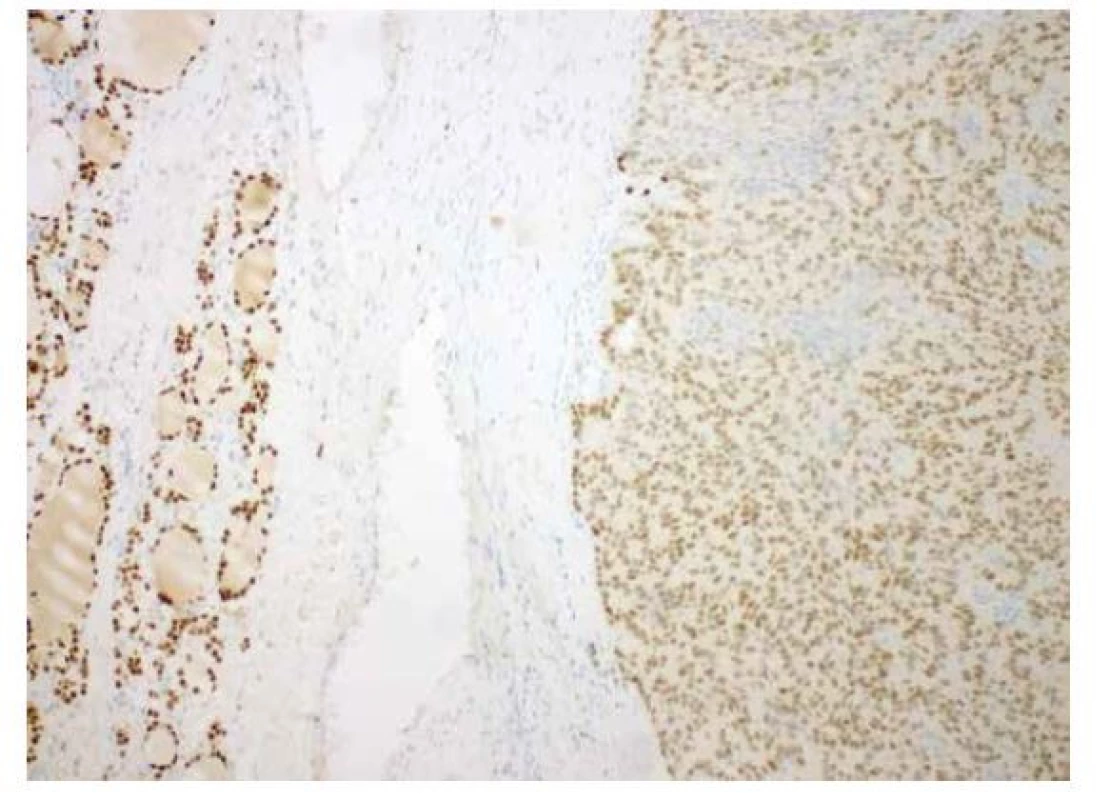
Image 6. Imunohistochemický průkaz HBME1 v morulárních formacích (zvětšení 100x). 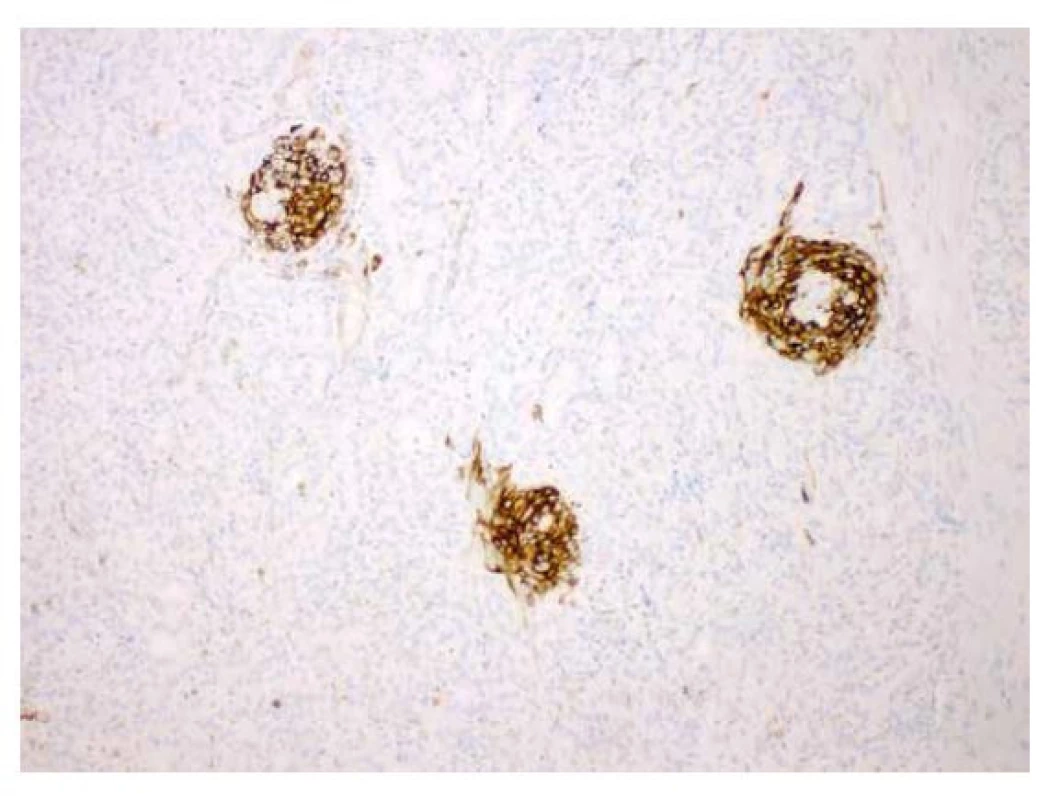
GENETICKÉ VYŠETŘENÍ A TUMORIGENEZE
U papilárních karcinomů štítné žlázy bývají na základě genetického vyšetření nejčastěji detekovány somatické mutace v genech BRAF, RAS, TERT nebo fúzní geny. V případě CMTC se však některé z těchto mutací vyskytují velice raritně a patogeneze této varianty je asociována hlavně s mutacemi v genech CTNNB1 (kódující protein beta katenin) a APC (2,7). APC je tumor supresorový gen, jehož mutace, zárodečná i somatická, reguluje cytoplazmatickou hladinu beta kateninu ve smyslu jeho snížené degradace. Beta katenin se následně hromadí v cytoplazmě buňky a poté je translokován do jádra. Akumulace beta kateninu v cytoplazmě a v jádře vede k aktivaci Wnt/ beta katenin signální dráhy (4,11).
DNA extrahovaná z odoperované nádorové tkáně pacientky byla nejprve analyzována pomocí VariantPlex Comprehensive Thyroid and Lung kitu (ArcherDx), jehož součástí byl i gen CTNNB1. V žádném z vyšetřovaných genů nebyla zachycena patogenní varianta. Následně byla provedena sekvenace části genu APC, ve kterém byla v 16. exonu detekována varianta Gln1041Ter (c.3121 C>T), která je dle databází uváděna jako patogenní a způsobuje předčasné zkrácení proteinu (obr. 7). Patogenní varianty v APC genu, pokud jsou zárodečné, jsou spojeny se syndromem FAP, který vede k výskytu dalších nádorů (8). K potvrzení ev. vyvrácení zárodečné povahy této patogenní varianty genu byla u pacientky vyšetřená periferní krev se zcela normálním nálezem, tudíž se jedná o somatickou mutaci.
Image 7. Obrázek zobrazující mutaci v APC genu detekovanou (v odoperovaném nádoru) pomocí sekvenování nové generace a vizualizovanou programem Integrative Genomics Viewer. 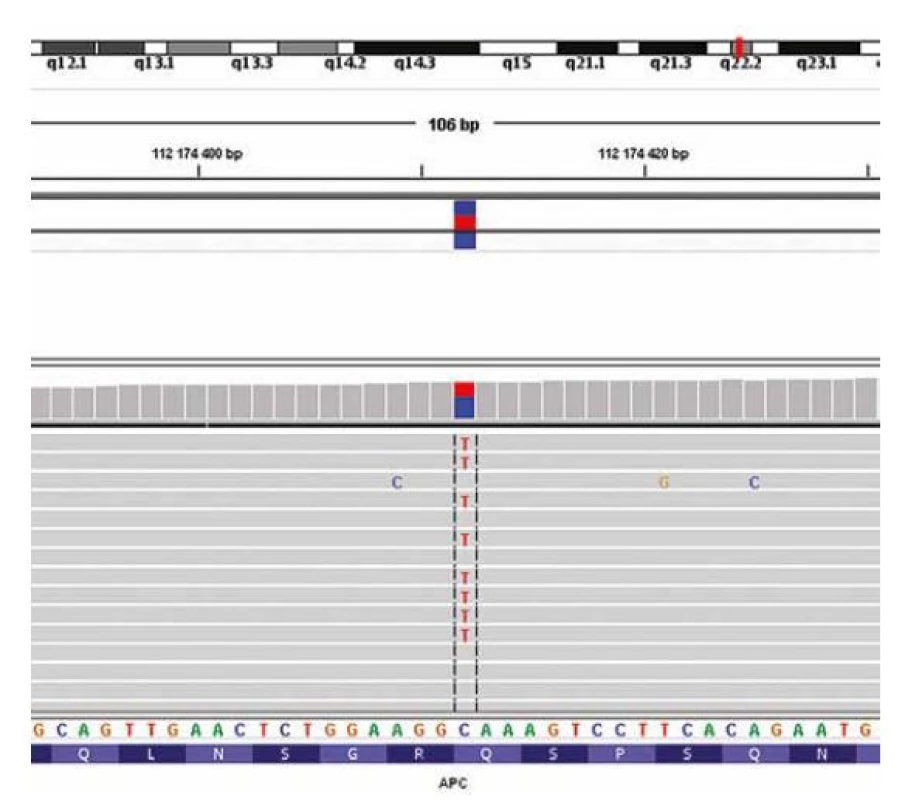
I přesto, že etiologie vzniku CMTC není přesvědčivě objasněna, zdá se, že aktivace Wnt/ beta katenin signální dráhy přes mutaci APC genu v kombinaci s hormonálními faktory (pozitivita estrogenu a/nebo progesteronu) se podílejí na vývoji této léze (11).
SOUVISLOST S FAP
FAP je autozomálně dominantní nemoc způsobená přítomností zárodečných patogenních variant v tumor supresorovém genu APC. Toto onemocnění se vyznačuje vysokým stupněm penetrance a je pro něj charakteristická přítomnost četných adenomů v tlustém střevě s variabilními extrakolonickými manifestacemi (2). V některých publikovaných studiích je popsaný 23–50 % výskyt FAP souběžně s nálezem CMTC (4,5,12). U pacientů bez souvislosti s FAP je typický výskyt jednoho ložiska CMTC. V případě multifokálního a bilaterálního výskytu v obou lalocích je nutno pomýšlet na velmi pravděpodobnou souvislost s FAP (3,11).
DIFERENCIÁLNÍ DIAGNOSTIKA
V rámci diferenciální diagnostiky je potřeba myslet na některé podtypy papilárního karcinomu štítné žlázy, zejména difúzní sklerózující (3), tall cell a columnar cell variantu papilárního karcinomu (13). Difúzní sklerózující varianta PTC se vyskytuje u mladých pacientů a mikroskopicky zde pozorujeme přítomnost denzní sklerotizace a prominentních skvamózních úseků, které mohou připomínat moruly, dále jsou pro ni charakteristická četná psamomatózní tělíska, přítomnost markantní lymfangioinvaze a výrazných jaderných polymorfií (3,9). Typické pro tall cell variantu PTC je výskyt u starších pacientů, nález vysokých, úzkých buněk s eozinofilní cytoplazmou a jader s typickými rysy PTC karcinomu, nenacházíme zde skvamózní moruly ani kribriformní formace (9,13). Columnar cell varianta PTC je specifická nálezem cylindrických buněk, místy s patrnou subnukleární vakuolizací, na rozdíl od tall cell varianty zde nenacházíme konvenční jaderné rysy typické pro PTC (9). V cytologickém obraze CMTC jsou zastižené papilárně formované buněčné shluky, které jsou složené z vysokých cylindrických buněk se světlými jádry, které nemají zcela obvyklý charakter matnicových jader. Dále je vhodné cíleně hledat kribriformně uspořádané úseky a shluky vírovitě upravených vřetenitých a oválných nádorových buněk charakteru morul, případně by mohlo být nápomocné imunocytochemické vyšetření pomocí beta kateninu (14).
DISKUZE
CMTC je maligní tyroidální tumor nejisté histogeneze, který se vyskytuje familiárně i sporadicky (9,11,15). Diagnostikovaný je převážně v Asii, téměř výhradně u žen, což patrně souvisí s expresí estrogenových receptorů (2,3). Protože tento tumor sdílí některé znaky papilárního karcinomu štítné žlázy byl v starší literatuře jeho podtypem, nicméně dle nové verze WHO klasifikace endokrinních a neuroendokrinních tumorů je řazený do samostatné kategorie tumorů nejisté histogeneze (15). Průběh nemoci je většinou indolentní, s velmi dobrou prognózou. V případech s vysokou proliferační aktivitou, četnými mitózami a/ nebo znaky nízké diferenciace, můžou být afekce vysoce agresivní (5,11). Přibližně ve 35 % případů má tato malignita souvislost s diagnózou FAP (4,5,12).
PODĚKOVÁNÍ
Práce byla podpořena grantem MZ ČR RVO 00023761.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Ľudmila Michnová
Oddělení patologie ÚVN Praha
U Vojenské nemocnice 1200
tel.: +420973203717
e-mail: ludmila.michnova@uvn.cz
Sources
1. Lim H, Devesa S, Sosa J, et al. Trends in Thyroid Cancer Incidence and Mortality in the United States 1974-2013. JAMA 2017; 317(13): 1338-1348.
2. Goldblum J, Lamps L, McKenney J, et al. Rosai and Ackerman´s Surgical Pathology (11th ed). Philadelphia, PA: Elsevier; 2018 : 297-676.
3. Lam A, Saremi N. Cribriform-morular variant of papillary thyroid carcinoma: a distinctive type of thyroid cancer. Endocr Relat Cancer 2017; R109-121.
4. Park J, Kim J, Park H, et al. Multifocality in a Patient with Cribriform-Morular Variant of Papillary Thyroid Carcinoma Is an Important Clu efor the Diagnosis of Familial Adenomatous Polyposis. Thyroid 2019; 29(11): 1606-1614.
5. Akaishi J, Kondo T, Sugino K, el al. Cribriform - Morular Variant of Papillary Thyroid Carcinoma: Clinical and Pathological Features of 30 Cases. World J Surg 2018; 42 (11): 3616 - 3623.
6. Perez A, Findeis S, Agarwal S, et al. Cribriform - Morular Variant of Papillary Thyroid Carcinoma: Two Cases of a Rare Thyroid Cancer ASsociated with Familial Adenomatous Polyposis. Proc (Bayl Univ Cent) 2019; 32 (3): 399-401.
7. Aydemirli M. et al. A unique case of two somatic APC mutations in an early onset cribriform - morular variant of papillary thyroid carcinoma and overview of the literature. Fam cancer 2020; 19(1): 15-21.
8. Oliveira J, Viana D, Zanardo C, et al. Genotype - phenotype correlation in 99 familial adenomatous polyposis patients : A prospective prevention protocol. Cancer Med 2019; 8(5): 2114-2122.
9. Rosai J, Albores Savedra J, Asioli S, et al. Papillary thyroid carcinoma. In: Lloyd RV, Osamura RY, Klöppel G, eds. World Health Organization Classification of Tumours. Pathology and genetics of tumours of endocrine organs (4th ed). Lyon: IARC Press; 2017 : 81–91.
10. Endomoto K et al. A rare case of the recurrent surgery for cribriform-morular variant of the papillary thyroid carcinoma. Int J Surg Case Rep 2020; 66 : 385-389.
11. Cameselle-Teijero J, Peteiro-González D, Caneiro-Gómez J, et al. Cribriform-morular variant of thyroid carcinoma: a neoplasm with distinctive phenotype associated with the activation of the WNT/β-catenin pathway. Modern Pathol 2018; 31(8): 1168-1179.
12. Fujimoto T, Hirokawa M, Ota H, et al. Characteristic sonographic features of cribriform papillary thyroid carcinoma for differentiation from other thyroid nodules. J Med Ultrason 2015; 42(1): 83-87.
13. Nosé V. et al. Diagnostic Pathology: Endocrine E-Book Pathology (2nd ed). Salt Lake City: Elsevier: 2018 : 211-215.
14. Hirokawa M. et al. Cribriform-morular variant of papillary thyroid carcinoma – cytological and immunocytochemical findings of 18 cases. Diagn Cytopathol 2010; 38(2): 890-896.
15. Erickson L. et al. Cribriform morular thyroid carcinoma. In: WHO Classification of Tumours Editorial Board. Endocrine and Neuroendocrine tumours (5th ed). Lyon; 2022: http://publications. iarc.fr/610.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2022 Issue 2-
All articles in this issue
- Histopatologická diagnostika nenádorových onemocnění trávicího traktu – 2. část
- Rozhodnutí stát se patoložkou nelituji
- 'PULMOPATOLOGIE
- 'PATOLOGIE ORL OBLASTI
- 'UROPATOLOGIE
- 'PATOLOGIE GIT
- 'PATOLOGIE CNS
- 'GYNEKOPATOLOGIE
- 'KARDIOPATOLOGIE
- 'HEPATOPATOLOGIE
- 'ORTOPEDICKÁ PATOLOGIE
- 'CYTODIAGNOSTIKA
- 'PATOLOGIE GIT
- 'HISTORIE PATOLOGIE
- 'HEMATOPATOLOGIE
- Pattern-based approach to gastritis and gastropathy
- Pattern-based approach to duodenitis and duodenopathy
- The role of endoscopy in non-oncologic gastrointestinal disorders in pediatric patients
- Cribriform – morular thyroid carcinoma: a rare entity
- Jaká je vaše diagnóza?
- Is obesity a risk factor for coronary atherosclerosis?
- Jaká je vaše diagnóza? Odpověď: Metastáza benigního pleomorfního adenomu příušní slinné žlázy do jater
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pattern-based approach to duodenitis and duodenopathy
- Pattern-based approach to gastritis and gastropathy
- Cribriform – morular thyroid carcinoma: a rare entity
- The role of endoscopy in non-oncologic gastrointestinal disorders in pediatric patients
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

