-
Medical journals
- Career
Inflamatorní myofibroblastický tumor dělohy – kazuistika
Authors: Zuzana Štiková 1; Nikola Ptáková 1; Markéta Horáková 1,3; Jan Kosťun 2; Ondrej Ondič 1,3
Authors‘ workplace: Bioptická laboratoř s. r. o., Plzeň 1; Gynekologicko-porodnická klinika, LF UK a FN Plzeň 2; Šiklův ústav patologie, LF UK a FN Plzeň 3
Published in: Čes.-slov. Patol., 55, 2019, No. 4, p. 239-243
Category: Original Articles
Overview
Inflamatorní myofibroblastický tumor (IMT) dělohy je vzácný, ale zřejmě poddiagnostikovaný nádor. Většinou se chová benigně, přesto menší část může lokálně recidivovat a výjimečně i metastazovat. V této práci prezentujeme případ uterinního IMT u 66leté pacientky, který byl původně diagnostikován jako děložní leiomyosarkom. Pacientka zemřela s odstupem několika měsíců v důsledku rozsáhlé lokální recidivy nádoru a metastáz do skeletu. Makroskopicky se jednalo o objemný tumor měkké konzistence a jílovité barvy. Nádor rostl lokálně agresivně s omezením na myometrium. Mikroskopicky byla léze tvořena polymorfní vřetenobuněčnou proliferací s výraznými jadernými atypiemi a početnými mitózami. Přítomny byly drobné geografické nekrózy. Ze znaků typických pro IMT byly zastiženy pouze fokální mírné lymfocytární infiltráty, myxoidní stroma zcela chybělo. Imunohistochemicky nádorové buňky silně a difúzně exprimovaly ALK (anaplastic lymphoma kinase). Molekulárně genetickými metodami byla prokázána genová fúze PPP1CB-ALK. Adekvátní diagnostika uterinních IMT je klíčová s ohledem na možnost léčit pacientky s agresivními tumory pomocí ALK inhibitorů. Nejnovější poznatky ukazují, že IMT dělohy představuje histomorfologicky poměrně heterogenní skupinu lézí ukrývajících se často mezi STUMP (hladkosvalové tumory nejistého maligního potenciálu) a leiomyosarkomy. Jediným spolehlivým diagnostickým znakem těchto nádorů se zdá být přítomnost přestavby genu ALK. Nabízí se tak vhodná screeningová metoda k detekci děložních IMT založená na imunohistochemickém a molekulárně genetickém průkazu alterace ALK genu.
Klíčová slova:
inflamatorní myofibroblastický tumor – IMT – STUMP – leiomyosarkom – děloha – mezenchymální tumory s ALK přestavbou – PPP1CB-ALK fúze – inhibitory tyrosinkinázy
Inflamatorní myofibroblastický tumor (IMT) je mezenchymální nádor, který se typicky vyskytuje v měkkých tkáních dutiny břišní, pánve či retroperitonea, dále v plicích a mediastinu, méně často v oblasti hlavy a krku (1). IMT dělohy poprvé popsal Gilks v roce 1987 (2), konzistentně byl však tento nádor popsán teprve v roce 2017 Bennettovou et al. (3). V anglicky psané literatuře bylo dosud publikováno okolo 70 případů tohoto vzácného tumoru. Děložní IMT postihuje pacientky různých věkových kategorií. Většina extrapulmonálních IMT se chová benigně, ale asi 25 % případů lokálně recidivuje, vzdálené metastázy se objevují u necelých 2 % (1). Velikost nádoru ≥ 8 cm je patrně jediným signifikantním prediktorem agresivního chování uterinního IMT. Spolehlivým znakem malignity se pak zdá být rozměr nad 10,5 cm (3). Makroskopicky jde obvykle o submukózně uložený nodulární nebo multilobulární tumor žlutohnědé, růžové či bílé barvy a měkké až myxoidní konzistence. Variabilně jsou popisovány hemoragie, nekrózy, vírovité struktury a cystické formace. Mikroskopicky je IMT vřetenobuněčnou myofibroblastickou lézí, k jejímž obecným histologickým znakům patří myxoidní stroma (stromální edém) a difúzní lymfoplasmocytární infiltrát. Bennettová popisuje tři základní histomorfologické varianty děložního IMT, které se obvykle kombinují – myxoidní, kompaktní a hyalinní (3). Nekrózy jsou přítomny přibližně u 60 % uterinních IMT, avšak nejsou omezeny jen na agresivní léze. Maligní IMT dělohy se histologicky vyznačují vysokou mitotickou aktivitou (≥ 18 mitóz / 10 HPF), výraznými jadernými atypiemi a lymfovaskulární invazí (3). Naprostá většina uterinních IMT je imunohistochemicky ALK pozitivní. Přibližně polovina IMT, nezávisle na lokalizaci léze, vykazuje alteraci genu ALK (anaplastic lymphoma kinase) (4). Na základě dostupných studií lze ALK přestavbu geneticky prokázat až u 80 % děložních IMT (3,5,6). Pacientky s agresivními IMT dělohy by tak potenciálně mohly profitovat z cílené léčby inhibitory tyrosinkinázy.
POPIS PŘÍPADU
66letá pacientka, která nebyla 13 let gynekologicky vyšetřena, navštívila v roce 2006 obvodního gynekologa pro postmenopauzální metroragii a váhový úbytek 9 kg v průběhu jednoho měsíce. Na spádovém pracovišti byla provedena kyretáž děložní dutiny, z níž byl histologicky diagnostikován leiomyosarkom dělohy. Tumor byl verifikován CT vyšetřením pánve, další zobrazovací metody (USG jater a žlučových cest, RTG plic) neprokázaly generalizaci onemocnění. Pacientka byla odeslána na gynekologicko-porodnickou kliniku FN Plzeň, kde podstoupila laparotomickou hysterektomii s pravostrannou adnexektomií (levostranná adnexektomie byla provedena již v minulosti).
Makroskopicky byla děloha velikosti 18 x 12 x 8 cm a hmotnosti 1020 g téměř spotřebována objemným tumorem o rozměrech 15 x 10,5 x 10 cm, měkké až rozbředlé konzistence a jílovité barvy. Nádor vycházel z přední stěny děložní, zasahoval těsně submukózně, na povrch dělohy neprorůstal. Mikroskopicky tumor sestával z převážně fascikulárně uspořádaných, polymorfních vřetenitých buněk s pleomorfními doutníkovitými jádry s vícečetnými jadérky. Přítomny byly výrazné jaderné atypie a vysoká mitotická aktivita (> 15 mitóz / 10 HPF) (obr. 1). Naprosto dominovaly kompaktní hypercelulární partie s poměrně četnými tenkostěnnými cévami. Fokálně byly zastiženy drobné geografické nekrózy (obr. 2). Místy byl tumor dobře ohraničený, místy byla dobře patrná invaze nádorových struktur do okolního myometria (obr. 3), ložiskově nádorová tkáň infiltrovala rovněž přiléhající endometrium. Invaze do krevních ani lymfatických cév nebyla zastižena. Na děložní povrch nádor neprorůstal, vzdálenost od perimetria však činila pouze 3 mm. Cervikální stroma, pravý vaječník i vejcovod byly bez nádorového postižení. Jako vedlejší nález byl v zadní stěně děložní zastižen benigní leiomyom o průměru 2 cm.
Image 1. Výrazně polymorfní vřetenité buňky s atypickými doutníkovitými jádry. Patrná je vysoká mitotická aktivita léze (HE, 400x). 
Image 2. Fokální geografická nekróza v kompaktní hypercelulární nádorové tkáni (HE, 100x). 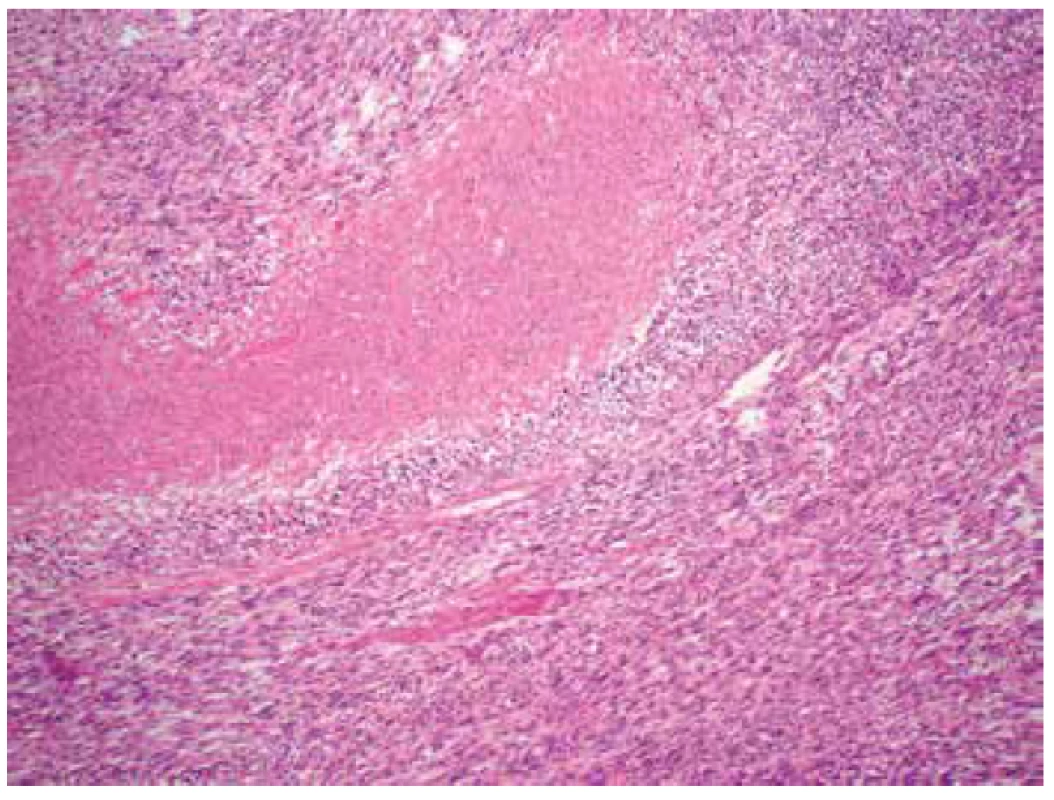
Image 3. Invaze fascikulárně uspořádaného tumoru mezi snopce okolního myometria (HE, 100x). 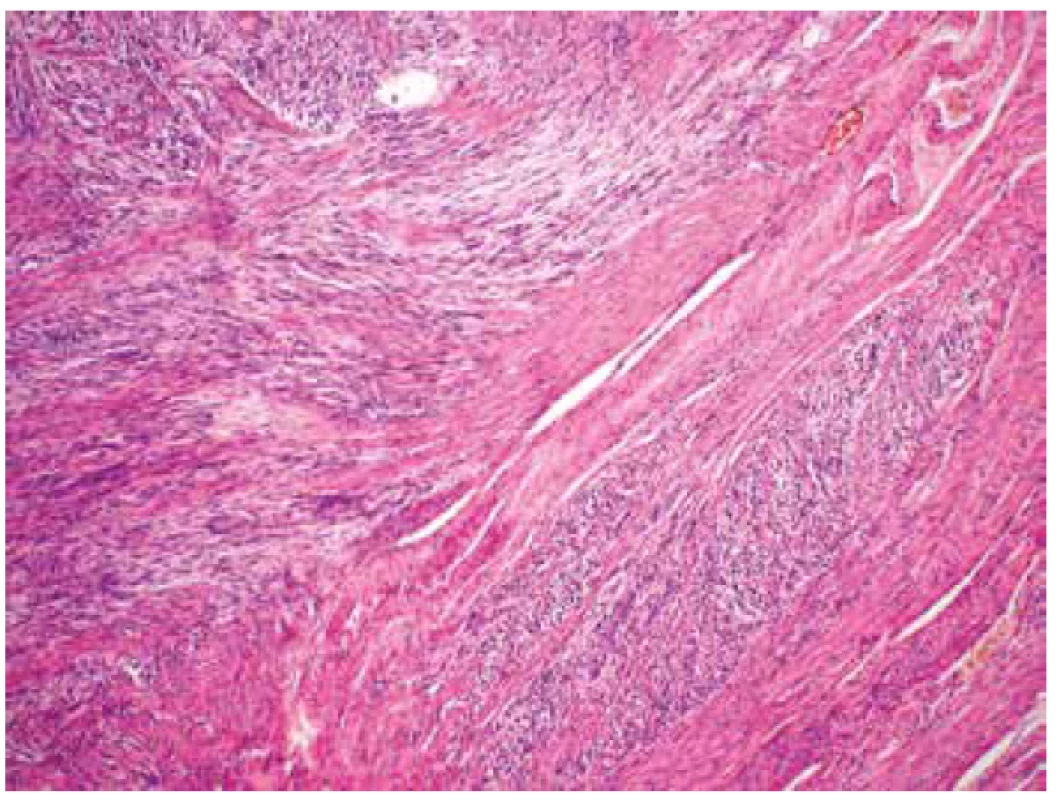
Původně byl tumor diagnostikován jako primární leiomyosarkom dělohy omezený na myometrium. Pacientka následně podstoupila aktinoterapii. Při kontrolním MR vyšetření pánve provedeném cca 1 rok od výkonu však byla zjištěna lokální recidiva tumoru v pánvi a v pravém hypogastriu o rozměrech 20 x 14 x 8 cm s prorůstáním do céka, přilehlé části vzestupného tračníku, terminální kličky ilea a stropu močového měchýře, dále pak 3 kostní metastázy velikosti 1,5 cm v sakrální kosti a v hlavici a krčku levého femuru. Pacientka zemřela 15 měsíců od výkonu.
V rámci studie byl případ v roce 2018 revidován se zaměřením na histomorfologické znaky IMT. V nádoru byla místy zastižena pouze mírná lymfocytární infiltrace (obr. 4). Myxoidní stroma ani stromální edém nebyly zjištěny. Imunohistochemicky tumor slabě multifokálně exprimoval desmin (klon D33, ředění 1 : 200, Dako) a h-caldesmon (klon E89, RTU, Ventana) a slabě fokálně CD10 (klon SP67, RTU, Ventana), hladkosvalový aktin (klon 1A4, ředění 1 : 500, Dako) byl negativní (obr. 5). Vyšetření s protilátkou anti-ALK (klon ALK-01, RTU, Ventana) vykazovalo silnou difúzní cytoplasmatickou pozitivitu v nádorových buňkách (obr. 6). Přestavba genu ALK, konkrétně PPP1CB-ALK fúze, byla následně potvrzena molekulárně genetickými metodami (tab. 1). Pomocí FISH (fluorescenční in situ hybridizace) byl nejprve zjištěn zlom s amplifikací v oblasti genu ALK a současně amplifikace lokusu PPP1CB (obr. 7, 8). Metodou NGS (next-generation paired-end RNA sekvenování) s algoritmickou detekcí fúze Archer analýzou byla následně prokázána existence funkčního PPP1CB-ALK transkriptu s klíčovou exonizací intronu 19 genu ALK, která v důsledku vedla k zachováni kinázové domény ALK genu. Toto potvrdila i RT-PCR (reverzně transkripční polymerázová řetězová reakce). Na základě těchto nových výsledků byl nádor reklasifikován na uterinní inflamatorní myofibroblastický tumor maligní biologické povahy.
Image 4. Ložisková mírná lymfocytární infiltrace nádorové tkáně (HE, 200x). 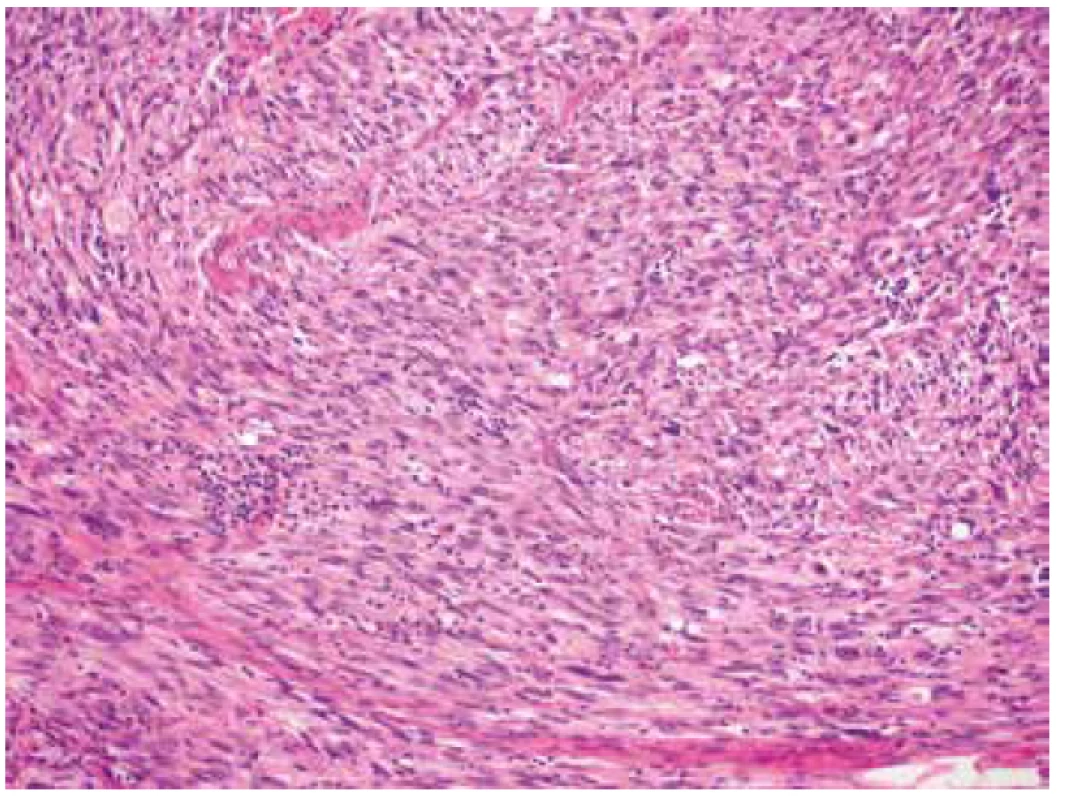
Image 5. Variabilní exprese desminu (A), h-caldesmonu (B), hladkosvalového aktinu (C) a CD10 (D) v nádorových buňkách (IHC, 400x). 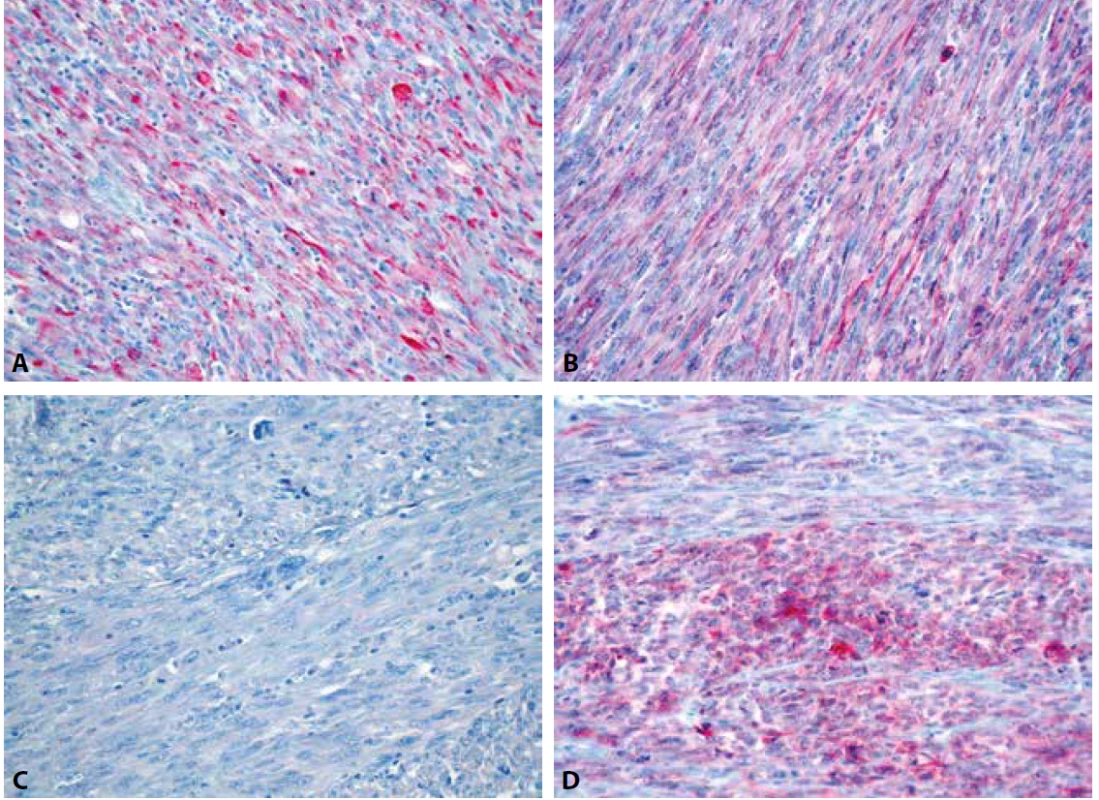
Image 6. Silná difúzní cytoplasmatická pozitivita ALK (IHC, 200x). 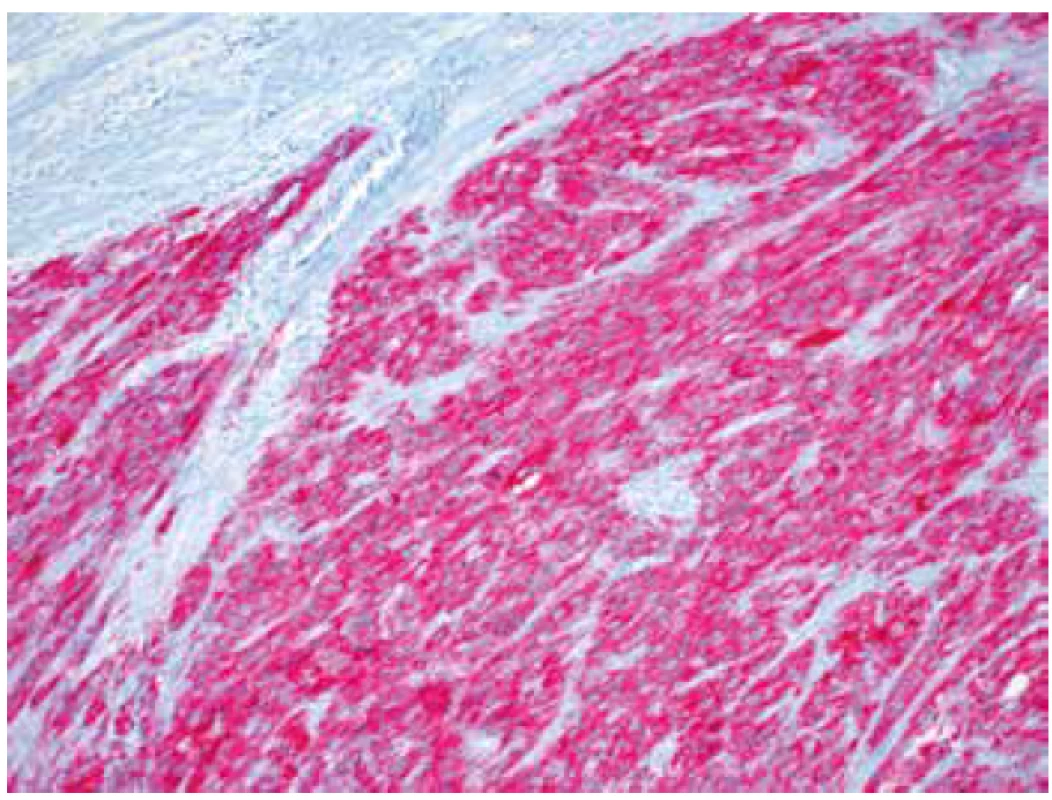
Image 7. FISH analýza s ALK break apart sondou (1000x). Ve žlutém rámečku je zvětšený detail jádra, kde žluté šipky znázorňují oranžovo-žluto-zelené fúzní signály intaktní kopie genu ALK. Zlom v oblasti genu ALK je patrný z přítomnosti samostatných nadpočetných oranžových signálů se současnou delecí zelených signálů. 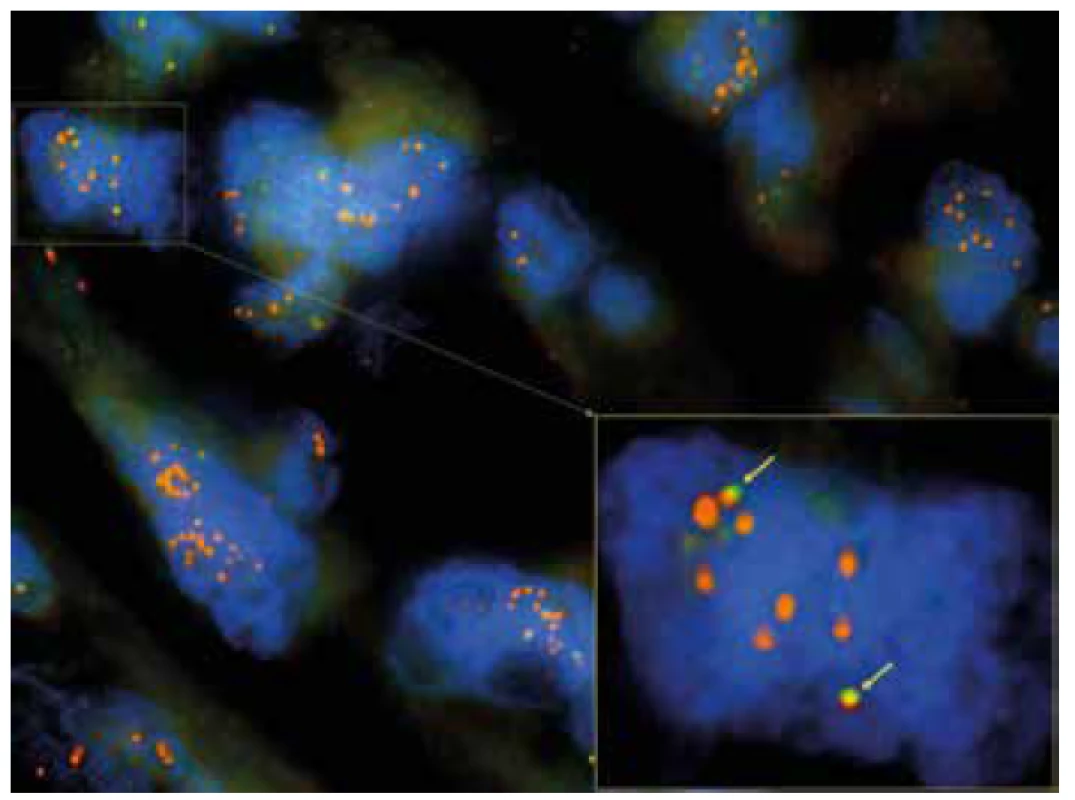
Table 1. Výsledky imunohistochemických a molekulárně genetických vyšetření děložního IMT z naší kazuistiky. 
3+ silná difúzní pozitivita, 2+ slabá multifokální pozitivita, 1+ slabá fokální pozitivita, 0 negativita; SMA hladkosvalový aktin, ALK anaplastic lymphoma kinase, FISH fluorescenční in situ hybridizace, NGS next-generation sekvenace, RT-PCR reverzně transkripční polymerázová řetězová reakce Image 8. FISH analýza s PPP1CB break apart sondou (1000x). Vícečetné žluté signály v jádrech demonstrují zmnožení lokusu PPP1CB bez zjevného zlomu v této oblasti. 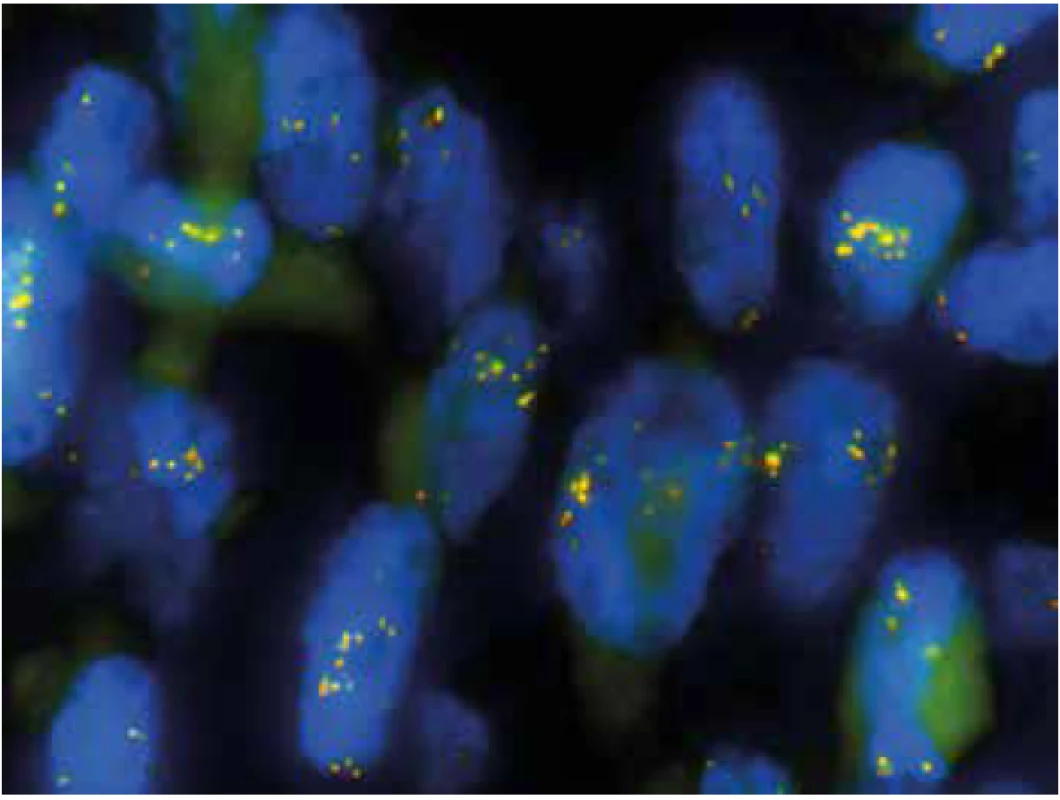
DISKUZE
V naší kazuistice upozorňujeme na fakt, že histologické znaky považované jako typické pro IMT dělohy mohou být velice diskrétní. Navíc myxoidní stroma a lymfocytární infiltráty se ukázaly jako nespecifické změny, které nekorelují s přítomností přestavby genu ALK v děložních mezenchymálních tumorech (7). IMT tedy mohou být histologicky neodlišitelné od hladkosvalových a endometriálních stromálních tumorů dělohy. V diagnostice není příliš nápomocné ani imunohistochemické vyšetření exprese hladkosvalových markerů (desmin, h-caldesmon, SMA) a CD10, protože tyto protilátky mohou být variabilně pozitivní i u IMT. Předpoklad, že IMT dělohy jsou zřejmě často poddiagnostikované, potvrzují i jiní autoři (3,8,9). Významné množství uterinních IMT se pravděpodobně skrývá pod diagnózou STUMP (hladkosvalový tumor nejistého maligního potenciálu) (8) a LMS (leiomyosarkom) (9). V rámci diferenciální diagnózy děložního IMT je potřeba vyloučit některé tumory myxoidního vzhledu jako jsou myxoidní leiomyosarkom (10) a nedávno popsaný high-grade endometriální stromální sarkom napodobující myxoidní leiomyosarkom (11) (tab. 2).
Table 2. Diferenciální diagnostika IMT dělohy. 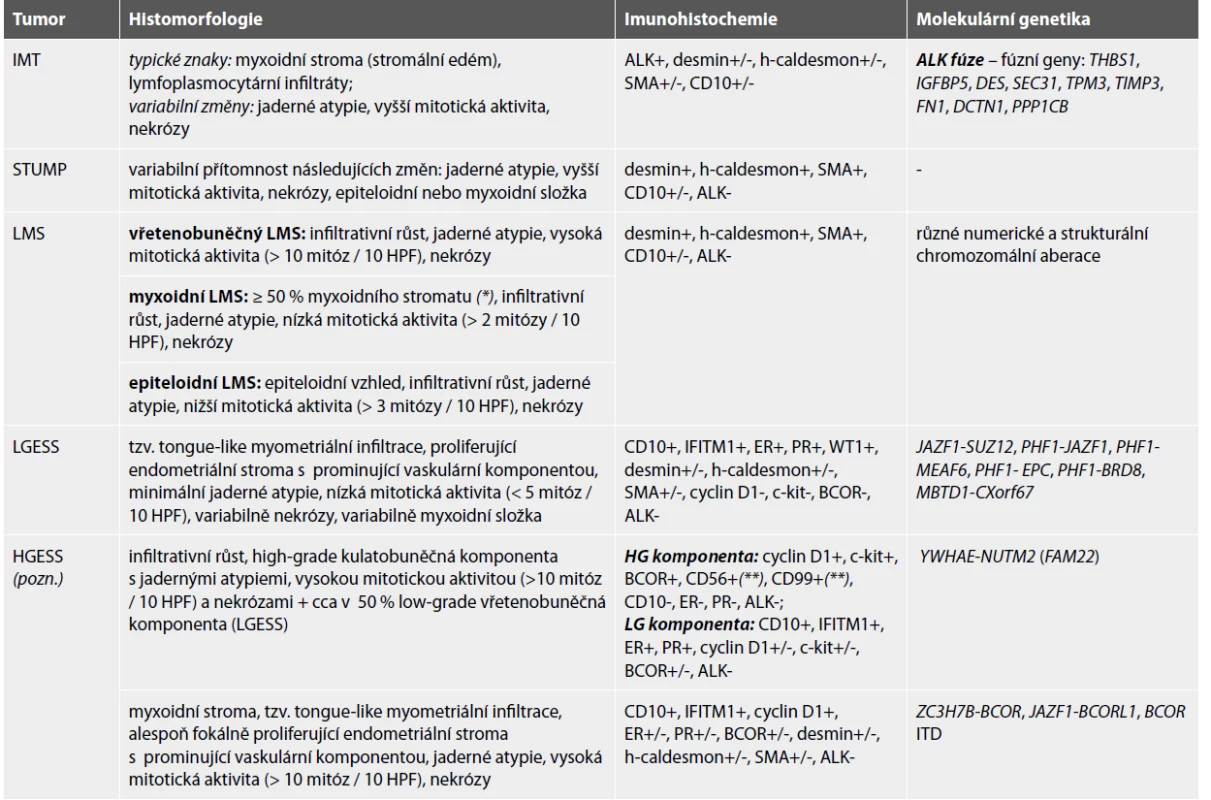
IMT inflamatorní myofibroblastický tumor, STUMP hladkosvalový tumor nejistého maligního potenciálu, LMS leiomyosarkom, LGESS low-grade endometriální stromální sarkom, HGESS high-grade endometriální stromální sarkom, SMA hladkosvalový aktin, ALK anaplastic lymphoma kinase, ER estrogenový receptor, PR progesteronový receptor, IDT interní tandemové duplikace
* převzato dle Parra-Herran (10)
** převzato dle McCluggage (16)
Pozn. Skupina high-grade endometriálních stromálních sarkomů se pravděpodobně do budoucna rozpadne na diagnostické podjednotky charakterizované a pojmenované podle specifické genetické alterace (15). S ohledem na aktuální stav v tabulce uvádíme YWHAE-NUTM2 rearanžovaný HGESS (popsaný již ve WHO klasifikaci z roku 2014) a nejlépe popsanou nově vznikající skupinu HGESS s alterací genu BCOR (11).Jediným spolehlivým diagnostickým nástrojem k detekci IMT dělohy se zdá být průkaz přestavby genu ALK. Ideální je použití kombinace imunohistochemického vyšetření exprese ALK a různých molekulárně genetických metod k potvrzení alterace ALK genu vzhledem k tomu, že již byly popsány případy uterinních IMT s falešně negativními výsledky vyšetření ALK přestavby pomocí imunohistochemie i FISH (7). ALK gen je u děložních IMT typicky alterován genovou fúzí. Doposud bylo identifikováno 8 fúzních partnerů - THBS1, IGFBP5, DES, SEC31, TPM3, TIMP3, FN1 a DCTN1 (3,12,13). Fúzní transkript PPP1CB-ALK prokázaný v našem IMT dělohy je velmi vzácný. Zatím byl popsán pouze u jednoho případu high-grade gliomu dítěte (14).
Je ke zvážení, zda tyto léze s ohledem k jejich nespecifické histomorfologii a naopak specifické genetické alteraci raději než “uterine inflammatory myofibroblastic tumors” nazývat termínem “uterine ALK-rearranged mesenchymal tumors”. Do budoucna je pravděpodobně nevyhnutelné vytvoření molekulárně genetické klasifikace mezenchymálních nádorů dělohy (15). Hlavní význam detekce děložních IMT spočívá v možnosti indikace cílené léčby. Dokumentovány již byly slibné výsledky u několika pacientek léčených ALK inhibitory (8,9,13). Možná by bylo vhodné zvážit rutinní screening ALK přestavby u všech děložních STUMP a LMS pomocí imunohistochemického vyšetření s následným ověřením metodami molekulární genetiky (7).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
MUDr. Zuzana Štiková
Bioptická laboratoř s.r.o.
Mikulášské náměstí 4, 326 00 Plzeň
tel.: +420 373 035 500
e-mail: stikova@biopticka.cz
Sources
1. Coffin CM, Fletcher JA. Inflammatory myofibroblastic tumor. In: Fletcher CDM, Bridge JA, Hogendoorn PCW, Mertens F, eds. World Health Organization Classification of Tumours of Soft Tissue and Bone (4th ed.). IARC Press: Lyon; 2013 : 83–84.
2. Gilks CB, Taylor GP, Clement PB. Inflammatory pseudotumor of the uterus. Int J Gynecol Pathol 1987; 6(3): 275–286.
3. Bennett JA, Nardi V, Rouzbahman M, Morales-Oyarvide V, Nielsen GP, Oliva E. Inflammatory myofibroblastic tumor of the uterus: a clinicopathological, immunohistochemical, and molecular analysis of 13 cases highlighting their broad morphologic spectrum. Mod Pathol 2017; 30(10): 1489–1503.
4. Coffin CM, Patel A, Perkins S, Elenitoba-Johnson KS, Perlman E, Griffin CA. ALK1 and p80 expression and chromosomal rearrangements involving 2p23 in inflammatory myofibroblastic tumor. Mod Pathol 2001; 14(6): 569–576.
5. Fuehrer NE, Keeney GL, Ketterling RP, et al. ALK-1 protein expression and ALK gene rearrangements aid in the diagnosis of inflammatory myofibroblastic tumors of the female genital tract. Arch Pathol Lab Med. 2012; 136(6): 623–626.
6. Parra-Herran C, Quick CM, Howitt BE, et al. Inflammatory myofibroblastic tumor of the uterus: clinical and pathologic review of 10 cases including a subset with aggressive clinical course. Am J Surg Pathol 2015; 39(2): 157–168.
7. Ptáková N, Miesbauerová M, Kosťun J, et al. Immunohistochemical and selected genetic reflex testing of all uterine leiomyosarcomas and STUMPs for ALK gene rearrangement may provide an effective screening tool in identifying uterine ALK-rearranged mesenchymal tumors. Virchows Arch 2018; 473(5): 583–590.
8. Devereaux KA, Kunder CA, Longacre TA. ALK-rearranged tumors are highly enriched in the STUMP subcategory of uterine tumors. Am J Surg Pathol 2019; 43(1): 64–74.
9. Pickett JL, Chou A, Andrici JA, et al. Inflammatory myofibroblastic tumors of the female genital tract are under-recognized: a low threshold for ALK immunohistochemistry is required. Am J Surg Pathol 2017; 41(10): 1433–1442.
10. Parra-Herran C, Schoolmeester JK, Yuan L, Dal Cin P, Fletcher CD, Quade BJ, Nucci MR. Myxoid leiomyosarcoma of the uterus: a clinicopathologic analysis of 30 cases and review of the literature with reappraisal of its distinction from other uterine myxoid mesenchymal neoplasms. Am J Surg Pathol 2016; 40(3): 285–301.
11. Hoang LN, Aneja A, Conlon N, et al. Novel high-grade endometrial stromal sarcoma: a morphologic mimicker of myxoid leiomyosarcoma. Am J Surg Pathol 2017; 41(1): 12–24.
12. Haimes JD, Stewart CJR, Kudlow BA, et al. Uterine inflammatory myofibroblastic tumors frequently harbor ALK fusions with IGFBP5 and THBS1. Am J Surg Pathol 2017; 41(6): 773–780.
13. Subbiah V, McMahon C, Patel S, et al. STUMP un „stumped“: anti-tumor response to anaplastic lymphoma kinase (ALK) inhibitor based targeted therapy in uterine inflammatory myofibroblastic tumor with myxoid features harboring DCTN1-ALK fusion. J Hematol Oncol 2015; 8 : 66.
14. Aghajan Y, Levy ML, Malicki DM, Crawford JR. Novel PPP1CB-ALK fusion protein in a high-grade glioma of infancy. BMJ Case Rep 2016; 2016: bcr2016217189.
15. Ferreira J, Félix A, Lennerz JK, Oliva E. Recent advances in the histological and molecular classification of endometrial stromal neoplasms. Virchows Arch 2018; 473(6): 665–678.
16. McCluggage WG, Lee CH. YWHAE-NUTM2A/B translocated high-grade endometrial stromal sarcoma commonly expresses CD56 and CD99. Int J Gynecol Pathol. 2019; 38(6): 528-532.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2019 Issue 4-
All articles in this issue
- Praktický přístup k pitvě srdce s vrozenou srdeční vadou
- Myokarditida a kardiomyopatie z pohledu kardiologa
- Histopatologická diagnostika myokarditid
- Nejnovější poznatky v mikroskopické diagnostice kardiomyopatií
- Lymfom z plášťové zóny diagnostikovaný z materiálu z radikální prostatektomie provedené pro adenokarcinom - kazuistika
- Incidentálna fokálna idiopatická sklerozujúca mezenteritída u 4-mesačného dieťaťa
- Inflamatorní myofibroblastický tumor dělohy – kazuistika
- Chondroidní melanom: kazuistika
- Novinky v kardiovaskulární patologii
- Nová učebnice PATOLOGIE je tady
- MONITOR, aneb nemělo by vám uniknout, že...
- MONITOR, aneb nemělo by vám uniknout, že...
- Spomienka na emeritného primára MUDr. Petra Kosseya, CSc.
- Dopis redakci
- Fumarát hydratáza deficientní karcinom z renálních buněk a jemu podobný karcinom z renálních buněk: Komparativní studie 23 geneticky testovaných případů
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Myokarditida a kardiomyopatie z pohledu kardiologa
- Fumarát hydratáza deficientní karcinom z renálních buněk a jemu podobný karcinom z renálních buněk: Komparativní studie 23 geneticky testovaných případů
- Inflamatorní myofibroblastický tumor dělohy – kazuistika
- Praktický přístup k pitvě srdce s vrozenou srdeční vadou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

