-
Medical journals
- Career
Zmeny WHO klasifikácie myeloidných neoplázií v kontexte revízie z roku 2016
: Juraj Marcinek 1,2; Tomáš Balhárek 1,2; Lukáš Plank 1,2
: Konzultačné centrum bioptickej diagnostiky ochorení krvotvorby v SR Ústav patologickej anatómie Jesseniovej lekárskej fakulty Univerzity Komenského a Univerzitnej nemocnice v Martine 1; Konzultačné centrum bioptickej diagnostiky ochorení krvotvorby v SR Martinské bioptické centrum, s. r. o. v Martine 2
: Čes.-slov. Patol., 53, 2017, No. 3, p. 118-121
: Reviews Article
Kontinuálny rozvoj nových poznatkov v hematopatológii a najmä genetike hematologických nádorov si vyžiadal aktualizáciu široko akceptovanej a dodnes používanej WHO klasifikácie myeloidných neoplázií, publikovanej pre 8 rokmi. Základné princípy tejto klasifikácie však ostávajú nezmenené a preto autori novej WHO klasifikácie nehovoria o vzniku novej, ale skôr o „revízií“ pôvodnej klasifikácie. Cieľom tejto práce je priblížiť širokej verejnosti patológov, hematológov resp. iných klinikov v Českej Republike a na Slovensku najdôležitejšie zmeny v diagnostike myeloidných neoplázií, ktoré boli nedávno publikované mienkotvorcami v tejto oblasti.
Kľúčové slová:
WHO klasifikácia – myeloidné neoplázie – diagnostické kritériá
Od posledného vydania WHO klasifikácie nádorov krvotvorných a lymfatických tkanív pred 8 rokmi (1) došlo v hematopatológii k značnému rozvoju poznatkov s následnou potrebou upraviť donedávna používané diagnostické kritériá myeloidných neoplázií (MN). Najdôležitejším dôvodom bola nutnosť implementovať nové diagnostické a prognostické markery do diagnostických kritérií týchto ochorení. Taktiež boli lepšie definované a štandardizované morfologické kritériá hematologických neoplázií, a to najmä v skupine myeloproliferatívnych neoplázií (MPN), ktoré sú teraz spoľahlivejšie, s lepšou reprodukovateľnosťou medzi hodnotiacimi patológmi. Klinické štúdie opakovane potvrdili nevyhnutnosť komplexného diagnostického prítupu k hematologickým neopláziám, v zmysle vzájomnej korelácie klinických a laboratórnych údajov s morfológiou nádorových buniek a výsledkami cytogenetických resp. molekulárno-genetických vyšetrení. Keďže všetky tieto prístupy sú implementované už v predchádzajúcej WHO klasifikácii hematologických neoplázií (1), aktuálne prezentované zmeny sú v zásade len upravenou a „vylepšenou“ formou predchádzajúcich diagnostických princípov a väčšina nozologických jednotiek, ako aj základy ich diagnostických kritérií ostávajú zachované. Cieľom tohto príspevku je len upozorniť na najdôležitejšie predpokladané zmeny doteraz používanej a všeobecne akceptovanej WHO klasifikácie MN, pričom vychádzame z komplexnej a prehľadnej práce uznávaných expertov v tejto problematike (2), z ktorých časť sú samotní tvorcovia predchádzajúcej, ako aj nadchádzajúcej WHO klasifikácie.
Myeloproliferatívne neoplázie (MPN) stále ostávajú rozdelené na skupinu Ph1+ (resp. BCR-ABL+) neoplázií, kde patrí chronická myeloidná leukémia (CML) a skupinu Ph1- MPN s troma základnými nozologickými jednotkami: pravá polycytémia (PV), esenciálna trombocytémia (ET) a primárna myelofibróza (PMF). Základom potvrdenia CML sú molekulárno-genetické analýzy, avšak k zmenám došlo v definícii akcelerovanej fázy (AF) ochorenia. V tejto oblasti doteraz chýbal všeobecne akceptovaný konsenzus a existovali rôzne diagnostické kritériá AF. Nová WHO klasifikácia preto dopĺňa doteraz používanú kombináciu hematologických, morfologických a cytogenetických kritérií pre diagnózu AF CML o faktory genetickej evolúcie ochorenia (3). Taktiež zavádza zatiaľ „provizórne“ kritériá AF v zmysle odpovede ochorenia na liečbu inhibítormi tyrozínových kináz, pričom efektivitu týchto kritérií preveria nasledujúce klinické štúdie. Definícia blastickej fázy CML ostáva nezmenená: 20% blastov v periférnej krvi (PK) resp. kostnej dreni (KD), alebo extramedulárna akumulácia blastov.
Princípom diagnostiky Ph1- MPN, podobne ako v predchádzajúcej WHO klasifikácii je kombinácia tzv. „veľkých“ a „malých“ diagnostických kritérií. Zásadne ich však obohatil objav nových genetických abnormalít asociovaných s Ph1- MNP, ktoré sa vyznačujú nielen diagnostickým, ale aj prognostickým významom, najmä mutácia calretikulínového génu (4). Tá dopĺňa doteraz identifikované kľúčové mutácie JAK2 a MPL, implementované do „veľkých“ diagnostických kritérií ET a PMF potvrdzujúcich klonalitu ochorení, čo umožňuje odlíšenie MPN od reaktívnych myeloproliferácii KD. Viacero prác potvrdilo význam morfológie KD pre diagnostiku Ph1- MPN (4,5). Obraz MPN v KD je však výrazne variabilný v závislosti na pokročilosti ochorenia a jeho hodnotenie do značnej miery subjektívne, ovplyvnené množstvom vedomostí a najmä skúseností vyšetrujúceho patológia. Preto nová WHO klasifikácia štandardizuje morfologické kritériá MPN, ktorých interpersonálna reproducibilita dnes dosahuje takmer 90% (6). Aj preto charakteristický morfologický obraz PV (tab. 1), ktorý v predchádzajúcej WHO klasifikácii figuroval ako „malé“ diagnostické kritérium, sa stal základným prvkom pre diagnózu ochorenia (5). Časť pacientov s PV bola „poddiagnostikovaná“ pre nedostatočne vysokú hladinu hemoglobínu v iniciálnych štádiách ohorenia. Nová WHO klasifikácia preto znižuje hladinu hemoglobínu potrebnú pre potvrdenie ochorenia a umožňuje stanoviť PV aj na základne zvýšeného hematokritu, ktorého údaje dopĺňajú „veľké“ diagnostické kritériá ochorenia. Naopak potvrdenie endogénnych formácii erytroidných kolónií in vitro už nie je súčasťou diagnostických kritérií PV.
1. WHO diagnostické kritériá pravej polycytémie. 
PMF je dynamické ochorenie, ktorého morfológia KD aj laboratórna a klinická manifestácia sa menia v závislosti na progresii myelofibrózy (MF) v KD a transformácie ochorenia z tzv. „prefibrotického“ do tzv. „fibrotického“ („rozvinutého“) štádia. Taktiež sa zdôrazňuje úloha morfológie KD pri rozlíšení prefibrotického štádia PMF od ET, keďže ich klinická manifestácia je identická a neumožňuje spoľahlivú diagnostiku týchto prípadov, ktorých prognóza je však diametrálne odlišná (7). Nová WHO klasifikácia samostatne uvádza diagnostické kritériá prefibrotickej a fibrotickej PMF (tab. 2, resp. tab. 3), kombinujúce morfológiu KD a výsledky molekulárno-genetických analýz („veľké“ diagnostické kritériá) s laboratórnou a klinickou manifestáciou ochorenia („malé“ diagnostické kritériá). Rozsah MF v KD ostáva hodnotený podľa zaužívaných 4 stupňov, aj keď nová WHO klasifikácia o niečo „precíznejšie“ definuje pokročilejšie stupne MF (tab. 4), keďže stupeň MF predstavuje významný prognostický marker.
2. WHO diagnostické kritériá prefibrotického štádia primárnej myelofibrózy. 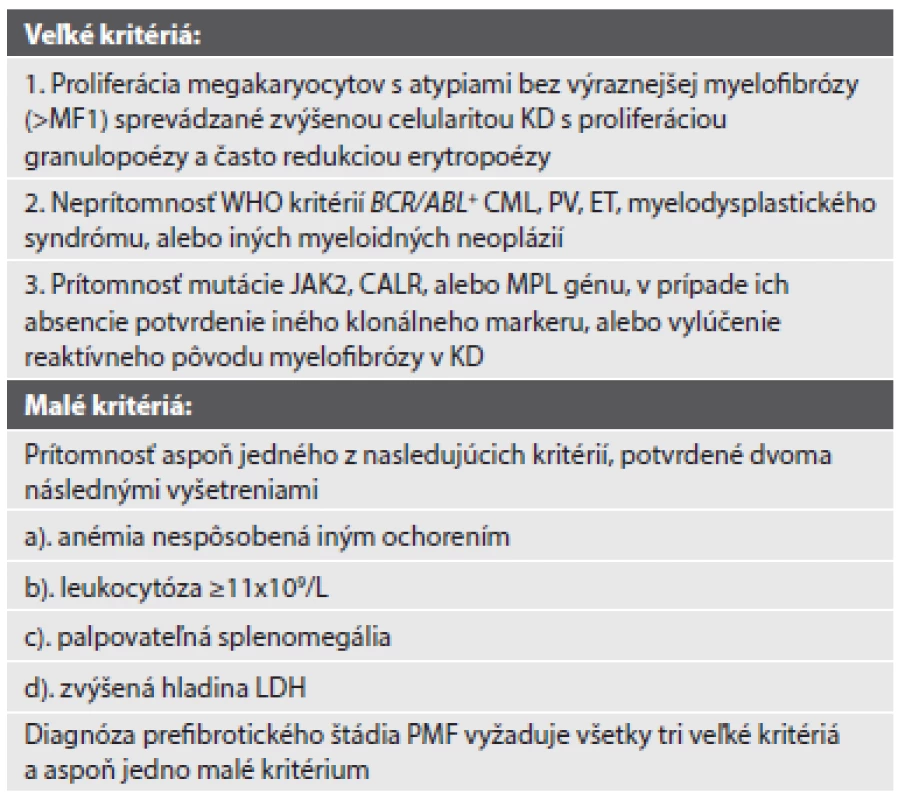
3. WHO diagnostické kritériá rozvinutého štádia primárnej myelofibrózy. 
Pri ET boli pôvodne rovnocenné diagnostické kritériá rozdelené na „veľké“ a „malé“, ktorých kombinácia vedie k potvrdeniu diagnózy (tab. 5). V lepšie zadefinovanom morfologickom obraze ET sa tiež uvádza zmienka o nízkom stupni myelofibrózy (MF1) v minoritnej časti prípadov. U zriedkavej MPN typu chronickej neutrofilnej leukémie (CNL) bola identifikovaná nová mutácia CSFR3 s vysokou diagnostickou senzitivitou aj špecificitou (8). Tá umožňuje nielen potvrdiť klonalitu nádorového procesu, ale aj odlíšiť CNL od prípadov BCR-ABL- CML (tzv. „atypickej“ chronickej myeloidnej leukémie - aCML) s podobnou klinickou manifestáciou, ako aj morfológiou KD. V prípadoch aCML sa mutácia CSFR3 vyskytuje veľmi zriedkavo, avšak u cca 1/3 pacientov možno identifikovať iné mutácie (9). V skupine zmiešaných myelodysplastických-myeloproliferatívnych neoplázií (MDS/MPN) došlo k identifikácii množstva genetických abnormalít, často identických ako v prípadoch MDS, ktoré umožňujú potvrdiť klonalitu ochorení a majú aj prognostický význam. Najmä u pacientov s chronickou myelomonocytovou leukémiu umožňuje spektrum rôznych mutácií potvdiť klonalitu ochorenia u viac ako 80% pacientov (10).
5. WHO diagnostické kritériá esenciálnej trombocytémie. 
K najzásadnejším zmenám došlo v oblasti MDS. Ich klasifikácia ostáva založená na výskyte dysplázií v jednotlivých radoch hemopoézy a množsve blastov v KD, zatiaľ čo cytopénia v PK má len minoritný význam pre ich typizáciu. Taktiež v klinickej praxi často výskyt dysplázií jednotlivých radov krvotvorby nekorešpodoval s cytopéniou v PK. Preto nová WHO klasifikácia nahrádza doteraz používaný a vzhľadom na klinickú manifestáciu často nevýstihujúci názov „refraktérna anémia“ resp. „refraktérna cytopénia“ všeobecne užívaným termínom „myelodysplastický syndróm“, ktorý je následne analogicky subtypizovaný na základe počtu postihnutých radov hemopoézy (MDS s monolineárnymi dyspláziami versus MDS s multilineárnymi dyspláziami), prítomnosti prstencových sideroblastov a množstva blastov, podobne ako v predchádzajúcej WHO klasifikácii (tab. 6). Termín „refraktérna cytopénia“ je zachovaný len v prípadoch MDS detského veku. Arbitrárnym kvantitatívnym kritériom množstva dysplázií pre potvrdenie MDS je naďalej 10 % buniek postihnutej línie hemopoézy. Zdôraznený je však konzervovaný prístup k interpretácií dysplázií hemopoézy, ktorých hodnotenie je značne subjektívne (11) a môžu v hojnom množstve sprevádzať aj prípady cytopénií nenádorového pôvodu, t.j. reaktívne zmeny hemopoézy (12). Nielen pre typizáciu, ale aj prognózu a menežment pacientov s MDS je dôležité precízne zhodnotenie množstva blastov v KD, realizované najmä kvantifikáciou blastov v aspiráte resp. odlačkových preparátoch KD, alebo náteroch PK. Problematické hodnotenie množsva blastov v trepanobioptických preparátoch KD neumožňuje potvrdenie 1% blastov, potrebných pre diagnózu osobitného, aktuálne zavedeného podtypu bližšie netypizovateľných MDS (MDS-U). Cielenou sekvenačnou analýzou DNA možno identifikovať mutácie vybraných génov až 90 % pacientov s MDS (13), umožňujúce odlíšenie nenádorových dysplázií KD od pravých prípadov MDS. Treba však brať do úvahy, že tieto MDS asociované genetické abnormality možno zriedkavo identifikovať v malom rozsahu aj u starších, avšak hematologicky zdravých pacientov bez zjavného MDS: tzv. „klonálna hemopoéza bližšie neurčeného potenciálu“ (14). Samostatná prítomnosť MDS asociovanej genetickej abnormality bez súčastnej cytopénie preto neumožňuje potvrdiť diagnózu MDS. Jediným typom MDS definovaným striktne na základe genetickej abnormality ostáva MDS s deléciou 5q. Bližší opis diagnostických kritérií jednotlivých podtypov MDS však pre ich početnosť a komplexnosť neuvádzame.
6. Schéma WHO klasifikácie Myelodysplastických syndrómov (MDS). 
Klasifikácia akútnych myeloidných leukémií spočíva v identifikácii klinicky a prognosticky významných cytogenetických a molekulárno-genetických abnormalít, ktorých objemné množstvo sa rozsahom vymyká limitom tejto práce a navyše je doménou genetikov, nie patológov resp. hematopatológov. Spomenieme len, že v skupine bližšie netypizovateľných AML (AML-U) s problematikou ktorých sa hematopatológovia stretávajú, došlo k zmene princípu hodnotenia množstva myeloblastov. Ich počet sa už udáva vo vzťahu k celkovému množstvu buniek KD, čo výrazne pozmenilo doterajšiu typizáciu akútnych erytroidných leukémií (AEL). Preto väčšina prípadov AEL diagnostikovaných podľa starej WHO klasifikácie (1) je t.č. klasifikovaná buď ako AML (ak myeloblasty predstavujú, ≥20% buniek KD), resp. prípady blastických MDS (ak myeloblasty predstavujú <20 % buniek KD). Skupinu AEL následne predstavuje len tzv. „pure erythroid leukemia“ (nezrelé erytroidné prekurzory v množstve ≥80 % buniek KD a myeloblasty <20% buniek KD).
Na záver by sme radi uviedli, že táto práca nemôže nahradiť norevidovanú WHO klasifikáciu ako takú, ale len upozorniť váženú verejnosť klinických patológov, hematológov, ale aj iných klinikov v Čechách a na Slovensku o pripravovaných zmenách v dotaraz zaužívanej WHO klasifikácii myeloidných neoplázií z roku 2008. Je pochopiteľné, že horeuvedené informácie sú len stručným abstraktom podstatne širšieho množstva nových informácii, ktoré sú rozvedené do detailov nielen v nami uvedených literárnych zdrojoch, ako aj v množstve iných publikovaných a voľne dostupných originálnych prác či prehľadných článkov. Ako bolo objasnené v úvodnom príspevku prof. MUDr. L. Planka, keďže samotná WHO klasifikácia napriek opakovaným avízam o jej príchode na trh stále nie je realitou, nemožno vylúčiť, že spektrum zmien bude ešte širšie, alebo sa naopak od niektorých nami spomínaných zmien upustí. V každom prípade je zrejmé, že novozistené poznatky sú natoľko významné pre diagnostiku aj klinický menežment pacientov s hematologickými neopláziami, že ich uvedenie do praxe prostredníctvom WHO klasifikácie či iných „guidelines“ je nutné v dohľadnej dobe očakávať.
PREHLASENIE
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikáciou tohto článku nie v konflikte záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlasenie sa týka i všetkých spoluautorov.
Adresa pre korešpondenciu:
MUDr. Juraj Marcinek
ÚPA JLF UK a UNM
Kollárova 2,
03659 Martin,
Slovensko
tel.: +421-43-4133002
fax: +421-43-4203370
e-mail: marcinek@jfmed.uniba.sk
Sources
1. Swerdlow SH, Campo E, Harris NL, et al. (Eds): World Health Organization classification of tumours of haematopoietic and lymphoid tissues. Lyon, IARC Press, 2008, 133 s.
2. Arber DA, Orazi A, Hasserjian R, et al. The updated WHO classification of hematological malignancies. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016; 127(20): 2391-2405.
3. Deininger MW. Diagnosing and managing advanced chronic myeloid leukemia. Am Soc Clin Oncol Educ Book, 2015; 35: e381-e388.
4. Tefferi A, Thiele J, Vannucchi AM, Barbui T. An overview on CALR and CSFR mutations and a proposal for revision of WHO diagnostic criteria for myeloproliferative neoplasms. Leukemia 2014; 28(7): 14078-1413.
5. Barbui T, Thiele J, Vannucchi AM, Tefferi A. Myeloproliferative neoplasms: Morphology and clinical practise. Am J Hematol 2016; 91(4): 430-433.
6. Madelung AB, Bondo H, Stamp I, et al. World Health Organization-defined classification of myeloproliferative neoplasms: morphological reproducibility and clinical correlations-the Danish experience. Am J Hematol 2013; 88(12): 1012-1016.
7. Thiele J, Kvasnicka HM, Müllauer L, Buxhofer-Ausch V, Gisslinger H. Essential thrombocythemia versus early primary myelofibrosis: a multicenter study to validate the WHO classification. Blood 2011; 117(21): 5710-5718.
8. Maxson JE, Gotlib J, Pollyea DA, et al. Oncogenic CSF3R mutation in chronic neutrophilic leukemia and atypical CML. N Engl J Med 2013; 368(19): 1781-1790.
9. Meggendorfer M, Bacher U, Alpermann T, et al. SETBP1 mutations occur in 9% of MDS/MPN and in 4% of MPN cases and are strongly associated with atypical CML, monosomy 7, iscochromosome i(17)(q10), ASXL1 and CBL mutations. Leukemia 2013; 27(9): 1852-1860.
10. Mughai TI, Cross NC, Padron E, et al. An international MDS/MPN Working Group´s perspective and recommendations on molecular pathogenesis, diagnosis and clinical characterization of myelodysplastic/myeloproliferative neoplasms. Haematologica 2015; 100(9): 1117-1130.
11. Font P, Loscertales J, Benavente C, et al. Interobserver variance with the diagnosis of myelodysplastic syndromes (MDS) following the 2008 WHO classification. Ann Hematol 2013; 92(1): 19-24.
12. Della Porta MG, Travaglino E, Boveli E, et al. Rate Ematologica Lombarda (REL) Clinical Network. Miminal morphological criteria for defining bone marrow dysplasia: a basis for clinical implementation of WHO classification of myelodysplastic syndrome. Leukemia 2015; 29(1): 66-75.
13. Papaemmanuil E, Gestung M, Malcovati L, et al. Chronic Myeloid Disorders Working Group of the international Cancer Genome Consortium. Clinical and biological implications of driver mutations in myelodysplastic syndromes. Blood 2013; 122(22): 3616-3627.
14. Steensma DP, Bejar R, Jaiswal S, et al. Clonal hematopoiesis of indeterminate potential and its distinction from myelodysplastic syndromes. Blood 2015; 126(1): 9-16.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2017 Issue 3-
All articles in this issue
- Lymph node metastasis of Merkel cell carcinoma without known cutaneous primary - case report
- Isolated infectious endocarditis of the pulmonary valve: a case report
- Changes of the WHO classification of myeloid neoplasms in the context of the 2016 revision
- Changes of the WHO classification of lymphoid neoplasms in the context of the 2016 revision
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lymph node metastasis of Merkel cell carcinoma without known cutaneous primary - case report
- Changes of the WHO classification of lymphoid neoplasms in the context of the 2016 revision
- Isolated infectious endocarditis of the pulmonary valve: a case report
- Changes of the WHO classification of myeloid neoplasms in the context of the 2016 revision
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


