-
Medical journals
- Career
Expresia markeru p57 v diferenciálnej diagnostike kompletnej a parciálnej moly – korelácia s DNA analýzou
: Z. Čierna 1; M. Palkovič 1; Ľ. Danihel ml. 1; Ľudovít Danihel 1; Vanda Repiská 2; J. Vojtaššák 2; M. Korbeľ 3
: Ústav patologickej anatómie LF UK a UNB, Bratislava 1; Ústav lekárskej biológie, genetiky a klinickej genetiky LF UK a UNB, Bratislava 2; I. gynekologicko-pôrodnícka klinika LF UK a UNB, Bratislava 3
: Čes.-slov. Patol., 48, 2012, No. 4, p. 218-221
: Original Articles
V súčasnosti platná WHO klasifikácia z roku 2003 rozlišuje tri skupiny gestačnej trofoblastovej choroby – molárne tehotnosti, nenádorové nonmolárne zmeny trofoblastu a nádory trofoblastu. Medzi molárne tehotnosti sa zaraďuje kompletná, parciálna, invazívna a metastatická hydatidózna mola. Vzhľadom na vyššie riziko možnej malígnej transformácie buniek trofoblastu pochádzajúcich z kompletnej hydatidóznej moly je potrebné v diferenciálnej diagnostike odlíšiť túto formu gestačnej trofoblastovej choroby od iných foriem. V retrospektívnej štúdii sme vyšetrili geneticky potvrdených 10 prípadov kompletnej a 10 prípadov parciálnej moly. Všetky prípady sme mikroskopicky vyšetrili základným farbením hematoxylínom a eozínom a imunohistochemicky s použitím protilátok proti ľudskému choriogonadotropnému hormónu, placentárnej alkalickej fosfatáze a proteínu p57. Vo všetkých prípadoch parciálnej hydatidóznej moly boli bunky vilózneho cytotrofoblastu, stromálne bunky klkov, bunky extravilózneho trofoblastu a deciduálne bunky p57 pozitívne. Pri vyšetrení kompletnej hydatidóznej moly boli vo všetkých 10 prípadoch stromálne bunky klkov a vilózny cytotrofoblast p57 negatívne. Proteín p57 je marker, ktorý odlíši kompletnú hydatidóznu molu od parciálnej moly.
Kľúčové slová:
gestačná trofoblastová choroba – kompletná hydatidózna mola – parciálna hydatidózna mola – proteín p57 – imunohistochémia
Gestačná trofoblastová choroba predstavuje skupinu chorôb, ktoré sú charakterizované rôznym stupňom proliferácie buniek trofoblastu. V súčasnosti je platná klasifikácia gestačnej trofoblastovej choroby Svetovej zdravotníckej organizácie (WHO) z roku 2003, ktorá rozlišuje tri skupiny – molárne tehotnosti, nádory trofoblastu a nenádorové zmeny trofoblastu (1).
Medzi molárne tehotnosti patrí kompletná, parciálna, invazívna a metastatická hydatidózna mola. Pri kompletnej hydatidóznej mole sú všetky klky hydropicky degenerované (2). Makroskopicky má placentárne tkanivo vzhľad strapca hrozna, tkanivá plodu väčšinou nie sú prítomné. V mikroskopickom obraze vidieť avaskulárne klky, acelulárne centrálne cisterny vo väčšine klkov, cirkumferentnú proliferáciu trofoblastu a atypiu buniek trofoblastu (3).
Cytogeneticky je pre kompletnú molu typický diploidný počet chromozómov, najčastejšie 46, XX, pričom všetky chromozómy sú otcovského pôvodu. Väčšina 46, XX kompletných mol pochádza z jednej spermie – homozygotná mola. Len malé percento vzniká oplodnením prázdneho vajíčka dvoma spermiami - heterozygotná kompletná mola. Určenie pôvodu jadrovej DNA kompletnej hydatidóznej moly má význam z hľadiska prognózy, pretože pri heterozygotnej mole je vyššie riziko prechodu do choriokarcinómu (4). Pri parciálnej hydatidóznej mole sú prítomné dve populácie choriových klkov. Jedna časť klkov je bez hydropickej degenerácie a hyperplázie trofoblastu. Druhá časť klkov je edematózne presiaknutá s rôzne výraznou proliferáciou buniek trofoblastu na povrchu klkov, ktorá je však väčšinou fokálna (5). Typický je zvlnený povrch klkov, invaginácie a trofoblastové inklúzie v stróme klkov (6). Ak je plod pri parciálnej mole prítomný, často vykazuje známky vrodených vývojových chýb (7). Karyotyp parciálnej moly je takmer vždy triploidný s 23 materskými a 46 otcovskými chromozómami (8).
Choriokarcinóm patrí medzi najagresívnejšie nádory u žien (9). Môže vzniknúť z ktorejkoľvek formy tehotnosti, najčastejšie vzniká z kompletnej hydatidóznej moly, zriedkavejšie po spontánnom potrate, normálnej tehotnosti a ojedinele po extrauterinnej tehotnosti (10,11).
Nie vždy je možné na základe mikroskopického obrazu jednoznačne odlíšiť parciálnu a kompletnú hydatidóznu molu. V diagnostike sa využívajú imunohistochemické metódy. Na rozlíšenie kompletnej a parciálnej hydatidóznej moly možno sledovať expresiu humánneho choriogonádotropného hormónu (hCG) a placentárnej alkalickej fosfatázy (PLAP). V súčasnosti je možné využiť pri diferenciálnej diagnostike aj ďalší marker, ktorý bol označený ako p57. Ide o inhibítor cyklín-dependentnej kinázy, gén podliehajúci paternálnemu genómovému imprintingu, exprimovaný materskými alelami (12), lokalizovaný na 11. chromozóme. Pomocou proteínu p57 je takto možné odlíšiť kompletnú hydatidóznu molu od iných foriem tehotnosti a tak výrazným spôsobom napomôcť diagnostike v sporných prípadoch. V prípade kompletnej hydatidóznej moly chýba expresia p57 vo vilóznom cytotrofoblaste a stromálnych bunkách klkov, pretože kompletná mola neobsahuje materské alely. V prípade možnosti cytogenetického vyšetrenia a analýzy DNA je výsledok samozrejme úplne jednoznačný (12).
Cieľom našej štúdie bolo porovnať expresiu proteínu p57 v rôznych typoch buniek pri kompletnej a parciálnej mole hydatidóze a porovnať ich s výsledkami DNA analýzy.
MATERIÁL A METODIKA
V retrospektívnej štúdii sme vyšetrili 10 prípadov geneticky potvrdenej triploidnej parciálnej moly a 10 prípadov geneticky potvrdenej diploidnej kompletnej moly, pričom 7 prípadov bolo homozygotných a 3 heterozygotné. Vo všetkých vzorkách bol karyotyp potvrdený cytogenetickou analýzou a rozlíšenie homo - a heteroformy DNA analýzou na Ústave lekárskej biológie, genetiky a klinickej genetiky LF UK a UN v Bratislave. Prípady boli vybrané z bioptických vzoriek zaslaných na Ústav patologickej anatómie Lekárskej fakulty Univerzity Komenského v Bratislave z I. gynekologicko-pôrodníckej kliniky LF UK a UN v Bratislave. Ide o pracoviská Centra pre gestačnú trofoblastovú chorobu Ministerstva zdravotníctva SR.
Vo všetkých prípadoch sme preparáty vyšetrili mikroskopicky v základnom farbení hematoxylínom a eozínom a imunohistochemicky s použitím protilátok proti hCG s polyklonálnou králičou protilátkou (A0231, Dako, Denmark, 1 : 400) a PLAP s monoklonálnou myšacou protilátkou (8A9, Dako, Denmark, 1 : 100). V oboch prípadoch bol použitý detekčný kit kombinovaný proti králičí / proti myšací polymér konjugovaný s chrenovou peroxidázou Envision+ (Dako Cytomation, Glostrup, Denmark). Vyšetrenie sme doplnili sledovaním expresie proteínu p57 vo vilóznom a extravilóznom trofoblaste, stromálnych bunkách klkov a deciduálnych bunkách. Formalínom fixované a v parafíne zaliate bioptické vzorky boli narezané na 5 μm hrubé rezy. Po deparafinizácii rezov štandardným postupom a vyblokovaní endogénnej peroxidázovej aktivity, boli rezy revitalizované v citrátovom pufri (10 mM, pH 6,0) v tlakovom hrnci 20 minút. Po revitalizácii, slúžiacej na odmaskovanie antigénnych epitopov, boli preparáty premyté vo fosfátmi pufrovanom fyziologickom roztoku (50 mM PBS;150 mM NaCl, 0,005% Tween, pH 7,4) 3x5 minút. Nasledovne sa rezy inkubovali s primárnou protilátkou riedenou 1 : 100 60 minút pri izbovej teplote. Na detekciu p57 proteínu bola použitá monoklonálna myšacia protilátka proti p57 (57P06, Diagnostic BioSystems, Pleasanton, CA). Po inkubácii boli vzorky opäť premyté v pufrovanom roztoku 3x5 minút. Na detekciu primárnej protilátky bol použitý kombinovaný proti králičí / proti myšací polymér konjugovaný s chrenovou peroxidázou Envision+ (Dako Cytomation, Glostrup, Denmark). Rezy sa inkubovali so sekundárnou protilátkou 30 minút pri izbovej teplote, následne boli premyté v PBS 3x5 minút. Na vizualizáciu reakcie bol použitý 3,3‘-diaminobenzidín (Dako Cytomation, Glostrup, Denmark). Rezy boli nakoniec krátko dofarbené hematoxylínom, zaliate do akrylového média a prikryté krycím sklíčkom. Intenzita jadrovej pozitivity p57 bola hodnotená semikvantitatívne svetelným mikroskopom.
DNA sme izolovali z choriových klkov, z periférnej krvi žien a ich partnerov. Na izoláciu DNA sme použili komerčnú izolačnú súpravu (Qiagen, QIAamp DNA Blood mini kit). Na analýzu pôvodu jadrovej DNA sme použili amplifikáciu troch rôznych polymorfných oblastí typu VNTR (variabilný počet tandemových opakovaní): ApoB, Col2A a MCT118 DNA pomocou polymerázovej reťazovej reakcie. Ako druhú DNA metódu sme použili analýzu DNA polymorfizmov v oblasti HLA. Amplifikáciu polymorfných oblastí génov HLA-DRB1 a - DQB1 sme uskutočňovali pomocou sekvenčne špecifických primerov (GenoVision Švédsko). Amplifikované alely sme detekovali pomocou elektroforézy v 1,5 % agarózovom géli pri napätí 6 V/cm. Na odčítanie veľkosti jednotlivých alel sme používali 100 bp a 50 bp marker. Jednotlivé alely sme vyhodnocovali podľa ich dĺžky.
VÝSLEDKY
Vo všetkých prípadoch parciálnej hydatidóznej moly bola expresia p57 v jadrách buniek vilózneho cytotrofoblastu, stromálnych buniek klkov, extravilóznom trofoblaste a deciduálnych bunkách (obr. 1,2). Všetkých 10 prípadov kompletnej hydatidóznej moly bolo p57 negatívnych vo vilóznom cytotrofoblaste a stromálnych bunkách klkov. Extravilózny trofoblast a deciduálne bunky vykazovali jadrovú p57 pozitivitu. Pozitivita týchto buniek slúži zároveň ako kontrola správnosti vykonania metódy (obr. 3,4).
1. Parciálna hydatidózna mola. Prítomné avaskulárne, edematózne zmenené klky s fokálnou proliferáciou buniek trofoblastu na povrchu klkov. Farbené hematoxylínom eozínom (zväčšenie 200x). 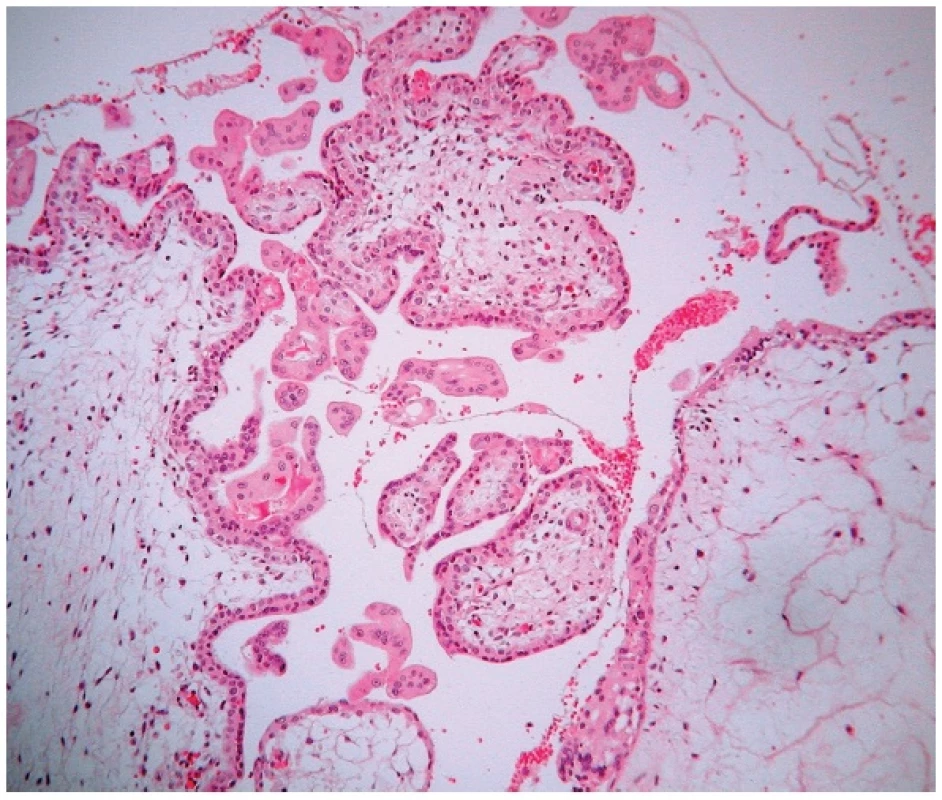
2. Expresia p57 v parciálnej hydatidóznej mole. Imunohistochemická reakcia s monoklonálnou protilátkou p57 (57P06). Silná jadrová pozitivita vilózneho cytotrofoblastu, extravilózneho trofoblastu a stromálnych buniek klkov. Vizualizácia DAB (zväčšenie 200x). 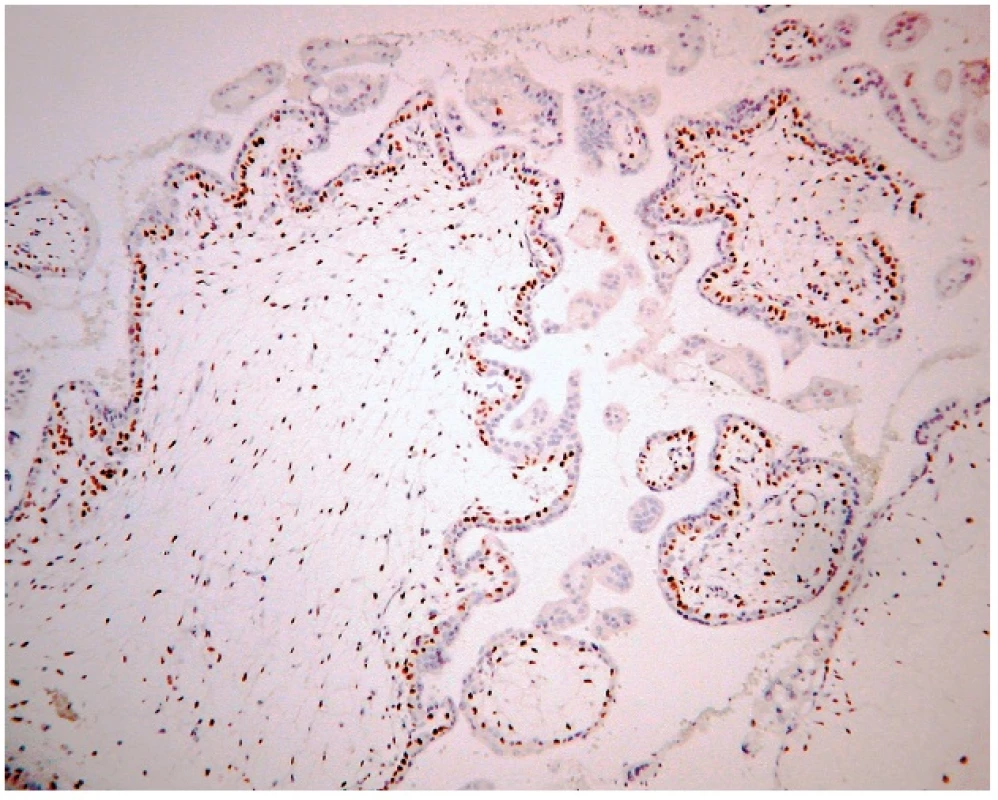
3. Kompletná hydatidózna mola. Prítomný avaskulárny, hydropicky degenerovaný klk s tvorbou centrálnej cisterny v stróme a difúznou proliferáciou buniek trofoblastu na povrchu klku. Farbené hematoxylínom eozínom (zväčšenie 200x). 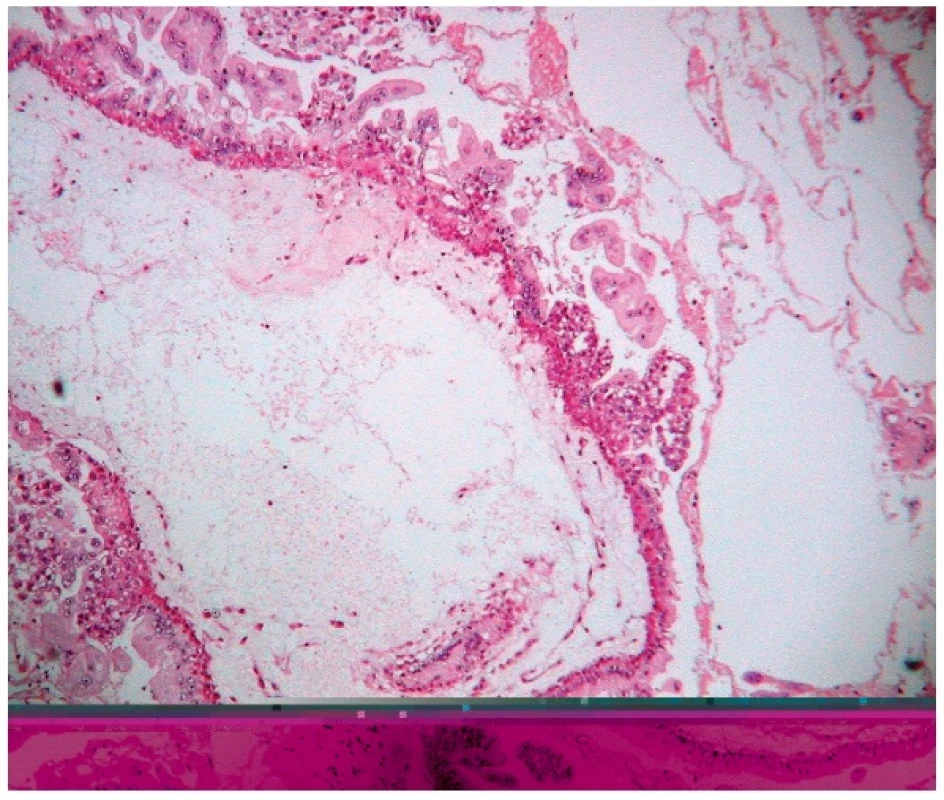
4. Expresia 57 v kompletnej hydatidóznej mole. Imunohistochemická reakcia s monoklonálnou protilátkou p57 (57P06). Silná jadrová pozitivita extravilózneho trofoblastu, negativita vilózneho cytotrofoblastu a stromálnych buniek klkov. Vizualizácia DAB (zväčšenie 200x). 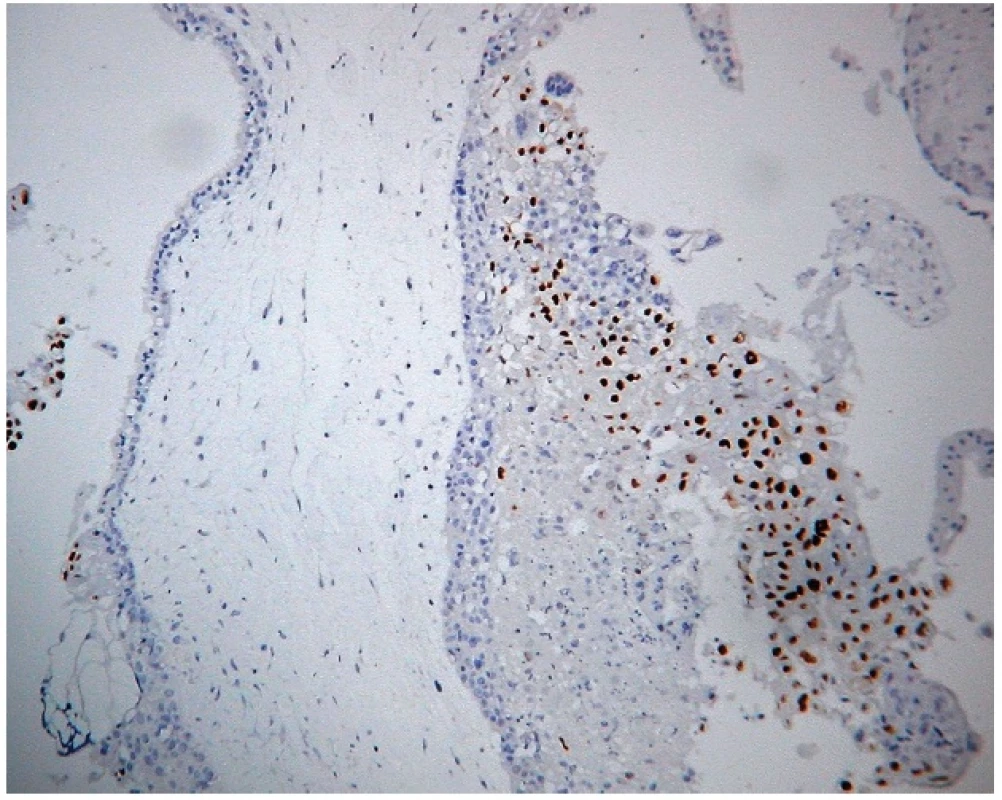
DISKUSIA
Vzhľadom na riziko prechodu hydatidóznej moly do invazívnej a metastatickej gestačnej trofoblastovej choroby a vzhľadom na vyššie riziko možnej malígnej transformácie buniek trofoblastu pochádzajúcich z kompletnej hydatidóznej moly je potrebné v diferenciálnej diagnostike odlíšiť túto formu gestačnej trofoblastovej choroby od iných foriem (13). Odlíšenie kompletnej moly od parciálnej môže byť problematické len na základe mikroskopického vyšetrenia v základnom farbení hematoxylínom a eozínom, najmä v skorých štádiách tehotnosti do 12. týždňa tehotnosti, tz. „early“ forma kompletnej alebo parciálnej hydatidóznej moly (8). Správna diagnostika typu molárnej tehotnosti je dôležitá pre pacientku z hľadiska prognózy, pretože parciálne moly zriedka prechádzajú do choriokarcinómu a perzistujúcej gestačnej trofoblastovej choroby. Základné histologické vyšetrenie je potrebné doplniť o imunohistochemické vyšetrenie s protilátkami proti hCG, PLAP a p57. Pri kompletnej hydatidóznej mole je v bunkách syncytiotrofoblastu najvýraznejšia expresia hCG a slabá expresia PLAP. V bunkách intermediárneho trofoblastu je slabá expresia PLAP a expresia hCG je výrazne znížená. Bunky cytotrofoblastu sú negatívne pre všetky vyšetrované parametre (14). Pri parciálnej hydatidóznej mole je najvýraznejšia expresia PLAP v bunkách syncytiotrofoblastu a intermediárneho trofoblastu a hCG sa exprimuje len fokálne. Bunky cytotrofoblastu podobne ako v predchádzajúcom prípade nevykazujú žiadnu expresiu (15). Proteín p57 je marker, ktorý odlíši kompletnú hydatidóznu molu od parciálnej moly (12). Riadi progresiu bunkového cyklu, transkripciu, procesy apoptózy, diferenciácie, vývoj a migráciu buniek. Podieľa sa na mnohých procesoch tumorigenézy, radí sa medzi tumor supresorové gény. Klinické štúdie ukazujú proteín p57 ako marker agresívneho fenotypu a prognózy tumorov (16).
Hladina p57 sa mení počas embryogenézy, počas dospelosti, aj počas rôznych fáz bunkového cyklu. Je exprimovaný vo všetkých veľkých orgánoch počas embryogenézy a vo vysokom množstve počas dôležitých štádií diferenciácie orgánov plodu. U dospelých ľudí je p57 exprimovaný najmä v kostrovom svalstve, srdci, mozgu, pľúcach, obličkách, pankrease, testes a placente (16). V placente po fyziologicky prebiehajúcom tehotenstve a pôrode je p57 exprimované vo vilóznom cytotrofoblaste, stromálnych bunkách klkov, v extravilóznom intermediárnom trofoblaste a v materskej decidui. Rovnaká situácia je aj v prípade spontánneho potratu, umelého prerušenia tehotnosti, po hydropickom potrate, alebo po parciálnej molárnej tehotnosti. V prípade kompletnej hydatidóznej moly chýba expresia proteínu p57 vo vilóznom cytotrofoblaste a stromálnych bunkách klkov, pretože kompletná mola je síce diploidná, ale iba paternálneho pôvodu a teda neobsahuje materské alely (17). Pozitivita p57 v deciduálnych bunkách pri kompletnej mole je interná pozitívna kontrola kvality imunohistochemického vyšetrenia. Expresia p57 v extravilóznom trofoblaste v prípade kompletnej moly nie je dostatočne objasnená a jej intenzita je rozdielna podľa výsledkov viacerých štúdií rôznych autorov. Syncytiotrofoblast je vždy p57 negatívny. p57 je marker, ktorý v prípade diagnostických pochybností môže výrazne prispieť k spresneniu diagnózy.
Výsledky našej prvotnej štúdie sú v súlade s literárnymi údajmi. V práci Chilosiho a kol. (18), Genesta a kol. (19) a Sebireho a kol. (20) sa udáva 100 % negativita p57 proteínu v prípadoch kompletnej hydatidóznej moly. Castrillon a kol. uvádza v 1 prípade z 59 kompletných mol pozitivitu p57 vo vilóznom cytotrofoblaste a stromálnych bunkách, hydropické spontánne potraty boli vo všetkých prípadoch p57 pozitívne (21). Crisp so spoluautormi zistil pozitivitu p57 v 2 z 22 prípadov kompletnej moly (22). Fukunaga vo svojich záveroch udáva pozitivitu p57 až v 7 zo 44 kompletných mol, ale vo všetkých prípadoch išlo o slabú expresiu (23). V spomínaných prácach boli všetky vyšetrované parciálne hydatidózne moly p57 pozitívne až na jednu v štúdii Fukunagu. Spontánne a umelo vyvolané potraty vyšetrované v rámci uvedených štúdií boli vo všetkých prípadoch p57 pozitívne. Sebire a kol. vo svojej práci sledoval rozdielnu expresiu p57 v choriokarcinóme a trofoblastovom tumore placentárneho lôžka vzniknutých z kompletnej hydatidóznej moly a z nonmolárnej tehotnosti. V závere konštatuje, že imunohistochemické vyšetrenie expresie p57 proteínu nie je schopné odlíšiť gestačné trofoblastové tumory vzniknuté z kompletnej moly a iných foriem tehotnosti (20).
Pozitivita p57 vo vilóznom cytotrofoblaste a stromálnych bunkách klkov svedčí pre parciálnu molu, no nie je možné jednoznačne vylúčiť kompletnú molu hydatidózu. V prácach Fisherovej a McConnella sú popisované prípady diploidnej androgénnej kompletnej hydatidóznej moly s expresiou proteínu p57 vo vilóznom cytotrofoblaste a stromálnych bunkách klkov. V oboch prípadoch bola dokázaná retencia materského 11. chromozómu (24,25). Negativita expresie p57 vo vilóznom trofoblaste a stromálnych bunkách klkov potvrdzuje diagnózu kompletnej moly, no taktiež nie so stopercentnou istotou. DeScipio popisuje prípad diandrickej triploidnej moly so stratou materského chromozómu 11 s chýbajúcou expresiou proteínu p57 vo vilóznom trofoblaste a stromálnych bunkách klkov (26). Všetky vyššie spomínané prípady boli doložené DNA analýzou. Publikované prípady sú síce veľmi raritné, no treba na ne v diferenciálnej diagnostike myslieť.
ZÁVER
Výsledky našej práce potvrdili nálezy viacerých autorov, že identifikácia p57 proteínu v tkanive placenty pomôže odlíšiť parciálnu a kompletnú formu hydatidóznej moly. Výsledky imunohistochemickej analýzy boli v absolútnej zhode s DNA analýzou. Obrovskou výhodou imunohistochémie je rýchlosť vyšetrenia, možnosť priameho použitia fixovaného materiálu a nižšia cena vyšetrenia v porovnaní s DNA analýzou. Naopak, nevýhody DNA analýzy sú samotná izolácia DNA a nutnosť vyšetrenia krvi oboch rodičov. Zdá sa, že vyšetrenie expresie proteínu p57 bez DNA analýzy je postačujúce na určenie typu molárnej tehotnosti a vo väčšine prípadov je možné ho použiť v každodennej praxi patológa.
POĎAKOVANIE
Chcela by som sa poďakovať pani Donárovej L., Uhnavej I. a Kollárovej E. za technickú spoluprácu pri laboratórnom spracovávaní vzoriek tkanív a imunohistochemickom vyšetrení.
Adresa pro korespondenci:
MUDr. Zuzana Čierna
Ústav patologickej anatómie LF UK
Sasinkova 4, 811 08 Bratislava
tel.: 0904/694368
email: ciernaz@gmail.com
Sources
1. Genest DR, Berkowitz RS, Fisher RA, Newlands ES, Fehr M. Gestational trophoblastic disease. In: Tavassoli, FA, Deville, P, eds. WHO classification of Tumors, Pathology and Genetics, Tumours of the Brest and Female Genital Organs. Tumours of the uterine corpus. Lyon: IARC Press; 2003 : 217–258.
2. Korbeľ M, Nižňanská Z, Redecha M, et al. Kompletná a parciálna mola hydatidóza – etiopatogenéza, diagnostika, liečba a dispenzarizácia. Gynekol prax 2007; 5 (2): 106–112.
3. Shih IeM. Gestational trophoblastic lesions. In: Nucci MR, Oliva E, eds. Gynecologic pathology. London: Churchill Livingstone; 2009 : 645–665.
4. Repiská V, Vojtaššák J, Korbeľ M, et al. DNA analýza gestačnej trofoblastovej choroby. Ces Gynek 2003; 68 (6): 442–448.
5. Zavadil M, Feyereisl j, Hejda V, Krofta L, Šafář P. Histologická diferenciální diagnostika hydatidóznych mol a hydropických abortů. Cesk Patol 2009; 45(1): 3–8.
6. Clement PB, Young RH. Atlas of gynecologic surgical pathology. W.B. Saunders Company; 2000 : 2211–2228.
7. Shih IeM, Mazur MT, Kurman RJ. Gestational trophoblastic tumors and related tumor-like lesions. In: Kurman RJ, eds. Blaustein’s Pathology of the Female Genital Tract (6th ed). New York: Springer – Verlag; 2011 : 1075–1135.
8. Fox H, Sebire NJ. Gestational trophoblastic disease. In: Pathology of the Placenta (3th ed). Saunders Elsevier; 2007 : 431–472.
9. Danihel Ľ, Černá A, Šišovský V, Palkovič M. Súčasná klasifikácia a morfologická charakteristika nádorov trofoblastu. Onkológia (Bratisl.) 2008; 3(4): 230–232.
10. Lage J. Gestational trophoblastic diseases. In: Robboy, SJ, Anderson, MC, Russel, P, eds. Pathology of the female reproductive tract. London: Churchill Livingstone; 2002 : 759–781.
11. Kaščák P, Lintner R. Choriokarcinóm. Gynekol prax 2005; 3(2): 123–125.
12. McCluggage WG. Immunohistochemistry in the differential diagnosis of female genital tract pathology. In: Nucci MR, Oliva E, eds. Gynecologic pathology. London: Churchill Livingstone; 2009 : 667–694.
13. Sharifi N, Sadeghian MH, Ayatollahi H, Daluei MK, Rezaea AR, Keramati MR. Validity of p57 immunohistochemical marker in differential diagnosis of molar pregnancy. J Turkish-German Gynecol Assoc 2009; 10 : 39–42.
14. Danihel Ľ, Porubský J, Zaviačič T, Vojtaššák J, Breitenecker G. Trofoblastická choroba. I. Využitie imunohistochémie pri diagnostike kompletnej hydatidóznej moly. Cesk Patol 1994; 30(3): 76–79.
15. Danihel Ľ, Porubský J, Vojtaššák J, Breitenecker G. Trofoblastická choroba. II. Imunohistochemické a cytogenetické parametre parciálnej hydatidóznej moly. Cesk Patol 1994; 30(3): 80–84.
16. Guo H, Tian T, Nan K, Wang W. p57: A multifunctional protein in cancer (Review). Int J Oncol 2010; 36 : 1321–1329.
17. Fisher RA, Hodges MD, Rees HC, et al. The maternally transcribed gene p57KIP2 (CDNK1C) is abnormally expressed in both androgenetic and biparental complete hydatidiform moles. Hum Molec Genet 2002; 26(11): 3267–3272.
18. Chilosi M, Piazzola E, Lestani M, et al. Differential expression of p57kip2, a maternally imprinted cdk inhibitor, in normal human placenta and gestational trophoblastic disease. Lab Invest 1998; 78(3): 269–276.
19. Genest DR, Dorfman DM, Castrillon DH. Ploidy and imprinting in hydatidiform moles. Complementary use of flow cytometry and immunohistochemistry of the imprinted gene product p57KIP2 to assist molar classification. J Reprod Med 2002; 47(5): 342–346.
20. Sebire NJ, Rees HC, Peston D, Seckl MJ, Newlands ES, Fisher RA. p57(KIP2) immunohistochemical staining of gestational trophoblastic tumours does not identify the type of the causative pregnancy. Histopathology 2004; 45(2): 135–141.
21. Castrillon DH, Sun D, Weremowicz S, Fisher RA, Crum CP, Genest DR. Discrimination of complete hydatidiform mole from its mimics by immunohistochemistry of the paternally imprinted gene product p57KIP2. Am J Surg Pathol 2001; 25(10): 1225–1230.
22. Crisp H, Burton JL, Stewart R, Wells M. Refining the diagnosis of hydatidiform mole: image ploidy analysis and p57KIP2 immunohistochemistry. Histopathology 2003; 43(4): 363–373.
23. Fukunaga M. Immunohistochemical characterization of p57(KIP2) expression in early hydatidiform moles. Hum Pathol 2002; 33(12): 1188–1192.
24. Fisher RA, Nucci MR, Harshwardhan MT, Weremowicz S, Genest DR, Castrillon DH. Complete hydatidiform mole retaining a chromosome 11 of maternal origin: molecular genetic analysis of a case. Modern Pathology 2004; 17 : 1156–1160.
25. McConnell TG, Norris-Kirby A, Hagenkord JM, Ronnett BM, Murphy KM. Complete hydatidiform mole with retained maternal chromosomes 6 and 11. Am J Surg Pathol 2009; 33(9): 1409–1415.
26. DeScipio C, Haley L, Bejerl K, Pandit AP, Murphy KM, Ronnett BM. Diandric triploid hydatidiform mole with loss of maternal chromosome 11. Am J Surg Pathol 2011; 35(10): 1586–1591.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2012 Issue 4-
All articles in this issue
- Pleomorphic adenoma of salivary glands: diagnostic pitfalls and mimickers of malignancy
- Pseudotumors of the central nervous system
- Histiocytic necrotizing lymphadenitis / Kikuchi-Fujimoto disease (HNL/K-F) and its differential diagnosis: analysis of 19 patients
- Expression of p57 marker in differential diagnosis of complete and partial mole – correlation with DNA analysis
- Pseudotumors and mimickers of malignancy of the head and neck pathology
- Gliosarcoma with alveolar rhabdomyosarcoma-like component: Report of a case with a hitherto undescribed sarcomatous component
- Perineural cell differentiation in ganglioneuromas. Report of 8 cases with immunohistochemical expression of perineural cell markers
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pleomorphic adenoma of salivary glands: diagnostic pitfalls and mimickers of malignancy
- Histiocytic necrotizing lymphadenitis / Kikuchi-Fujimoto disease (HNL/K-F) and its differential diagnosis: analysis of 19 patients
- Pseudotumors of the central nervous system
- Expression of p57 marker in differential diagnosis of complete and partial mole – correlation with DNA analysis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

