-
Medical journals
- Career
Lymfomy tenkého střeva
Authors: J. Mačák; I. Falková; J. Šmardová; L. Křen
Authors‘ workplace: Ústav patologie Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice, Brno
Published in: Čes.-slov. Patol., 46, 2010, No. 1, p. 20-24
Category: Original Article
Overview
V sérii osmi lymfomů tenkého střeva byly zjištěny dva případy folikulárního lymfomu (FL), jeden případ anaplastického velkobuněčného lymfomu (ALCL) ALK negativního a pět případů difuzního velkobuněčného B lymfomu (DLBCL). Lymfomy byly diagnostikovány na základě vyšetření hematoxylinem-eozinem, imunohistologie a FISH metodou na průkaz translokace t(14;18). Imunohistologické vyšetření neprokázalo, že difuzní velkobuněčný B lymfom vzniká v této lokalizaci z buněk zárodečného centra (jde tedy o non GC-DLBCL). Nádory většinou tvořily solidní ložisko nebo vedly k difuznímu ztluštění stěny střeva. V jednom případě folikulárního lymfomu se mikroskopicky zjistila infiltrace sliznice střeva, která se šířila na značnou vzdálenost od hlavní nádorové masy a pravděpodobně překročila hranici resekce. Je obtížné posoudit, jestli tato ložiska představují kolonizaci původně nenádorových folikulů lymfomem nebo jde od začátku o histohomologní šíření lymfomu. V tomto případě se ukazuje, že chirurgické odstranění lymfomu je problematické.
Klíčová slova:
lymfomy – tenké střevo – imunohistologie – FISHPrimární lymfomy gastrointestinálního traktu (GIT) se nejčastěji objevují v žaludku a méně často v tenkém a tlustém střevě. Ve frekvenci výskytu existují regionální rozdíly, např. na Blízkém Východě jsou lymfomy tenkého střeva častější než v žaludku. Častěji se v GIT objevují lymfomy senkundární než primární (1, 2). Podle některých údajů tvoří lymfomy tenkého střeva 20–40 % všech nádorových malignit (7, 14, 15). Ukazuje se, že lymfomy tenkého střeva se významně liší od lymfomů žaludku a tlustého střeva, a to jak po stránce klinické, tak i patologicko-anatomické. Prognóza některých lymfomů GIT je odlišná od nodálních systémových lymfomů.
Materiál a metodika
V archivu Ústavu patologie FN Brno jsme v letech 2000–2008 zjistili 8 nemocných s lymfomy tenkého střeva. Klinicky se onemocnění ve dvou případech manifestovalo perforací střevní stěny v místě nádoru. V ostatních případech byla zjištěna krev ve stolici nebo byl zjištěn stenozující nádorový proces. Histologické vyšetření bylo provedeno vždy z několika úseků nádorem postiženého střeva a z okolní střevní stěny bez nádoru. Kromě vyšetření hematoxylinem-eozinem jsme provedli imunohistologické vyšetření a vyšetření metodou FISH.
Imunohistologické vyšetření
Použili jsme sérii protilátek proti následujícím antigenům (v závorce je uvedený klon a ředění protilátky citrátovým pufrem): CD20 (L26, 1 : 500), CD79a (JCB117, 1 : 50), CD45RO (UCHL1, 1 : 500), Ki-67 (1 : 100), Bcl-2 (124, 1 : 25), CD43 (DF-T1, 1 : 100), Bcl-10 (151, 1 : 50), MUM1 (MUM1p, 1 : 50), vše od fy DAKO; CD3 (PS1, 1 : 100), CD5 (4C7, 1 : 100), CD23 (1B12, 1 : 50), CD10 (56C6, 1 : 50), cyclin D1 (P2D11F11, 1 : 20), CD30 (1G12, 1 : 20), ALK (5A4, 1 : 50), Bcl-6 (P1F6, 1 : 20) od fy Novocastra; Pu-1 (G148-74, 1 : 200) od fy Bioscience. Další postup imunohistologického vyšetření byl následovný: po odparafinování řezů bylo provedeno demaskování antigenů v mikrovlnné troubě v citrátovém pufru pH 6,5 dle návodu dodavatele a po aplikaci primární protilátky přes noc jsme použili sekundární protilátku EnVision Dual Link Systém (DAKO) značenou křenovou peroxidázou. Jako chromogen byl použit diaminobenzidin (DAB).
Vyšetření FISH (Fluorescence In-Situ Hybridization)
U dvou případů folikulárního lymfomu jsme použili vyšetření FISH. Parafinové řezy byly odparafinovány a přes noc při 56 oC permeabilizovány působením HCl, NaSCN a proteolytický natráveny pepsinem při 38 oC po dobu 30–35 minut. Před nanesením sondy byla cílová DNA denaturována působením 70 % formamidu při 74 oC po dobu 7 minut těsně před aplikací na tkáň. K hybridizaci byla užita sonda LSI-IGH/BCL2 dual fusion translocation probe. Hybridizace probíhala přes noc při 37 oC. Po vymytí sondy byla jádra dobarvena pomocí DAPI. Výsledek byl odečítán ve fluorescenčním mikroskopu.
Výsledky
Základní údaje o pacientech, lokalizaci lymfomu a diagnóze jsou v tabulce 1.
Table 1. 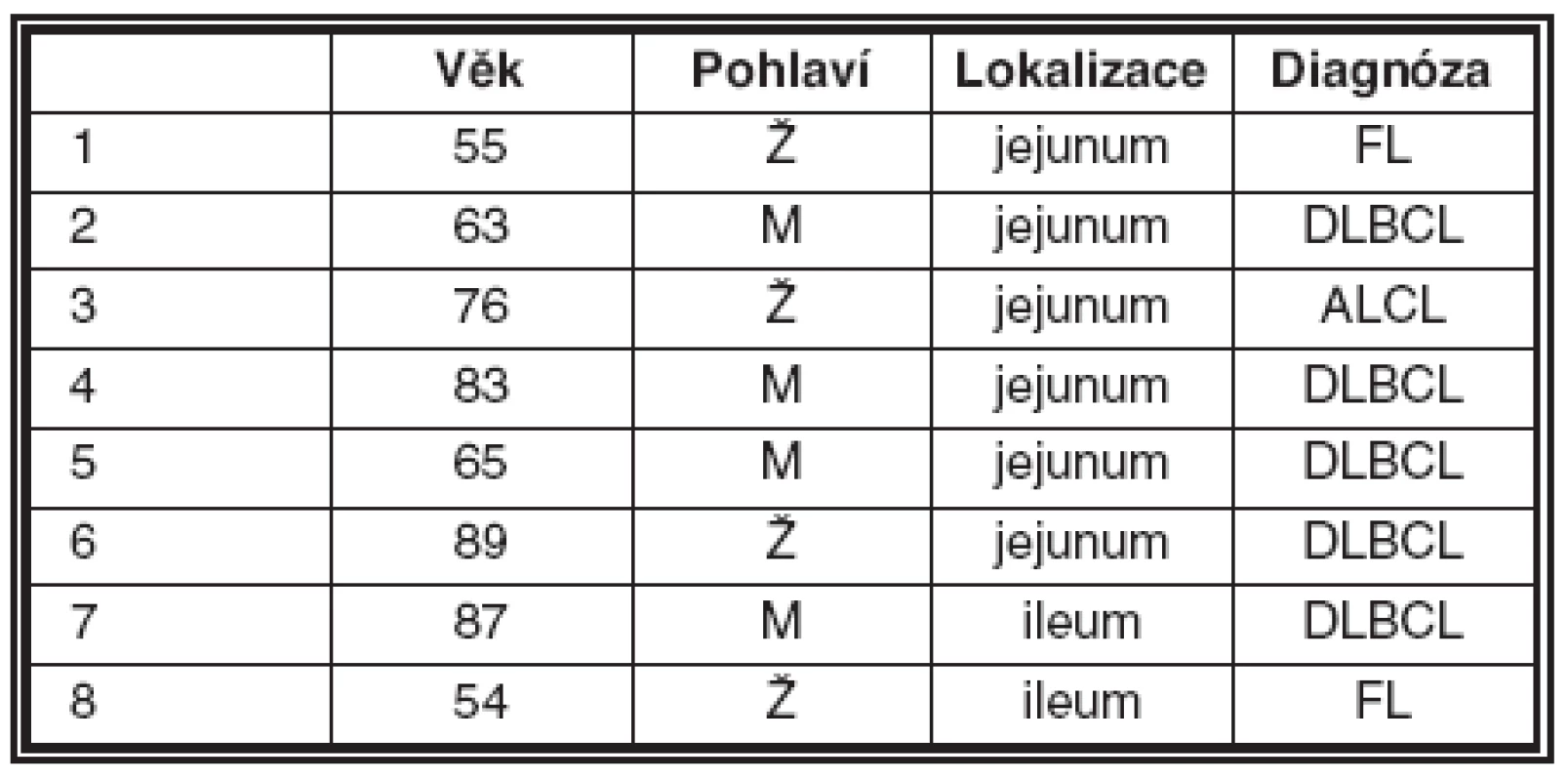
Vysvětlivky: FL – folikulární lymfom; DLBCL – difuzní velkobuněčný B lymfom; ALCL – anaplastický velkobuněčný lymfom Z celkové sestavy 8 lymfomů tenkého střeva byl zjištěn v pěti případech DLBCL, ve dvou případech folikulární lymfom a v jednom případě ALCL. V sedmi případech šlo o lymfomy B řady, které pozitivně reagovaly s protilátkami proti antigenům CD20 a CD79a. V jednom případě šlo o lymfom ALCL a nádorové buňky exprimovaly protilátky proti antigenům CD3, CD5, CD45RO. Klinicky ani morfologicky v resekátu střeva nebyly zjištěny známky celiakie. Nemocná zemřela čtyři roky po operaci a nebyla pitvaná.
FL (č. 1 a 8) byly grade 1. V prvním případě u 55leté ženy šlo o úsek jejuna postižený v délce 5 cm. Stěna střeva byla infiltrována cirkulárně ve všech vrstvách bez jeho zúžení. Uprostřed nádorové infiltrace byla zjištěna perforace nepravidelného tvaru přibližně průměru 0,5 cm. Lymfom měl do značné míry difuzní charakter růstu, místy v lymfatických uzlinách a v tukové tkáni z těsné blízkosti střeva byla zřetelná folikulární stavba nádoru (obr. 5). Imunofenotyp lymfomu: CD20+, CD79a+, CD10+, Bcl-2 +, CD5 neg. (obr. 2, 3, 4b). Síť dendritických retikulárních buněk byla potrhaná a samotné buňky byly odtlačeny na periferii nádorových folikulů (obr. 4a). Proliferační marker Ki-67 byl pozitivní u 30–40 % nádorových buněk. Vyšetření FISH na t(14;18) ukázalo pozitivní nález u 100 % buněk.
Image 1. Folikulární struktura FL v infiltraci tukové tkáně kolem střeva. (HE, 50krát) 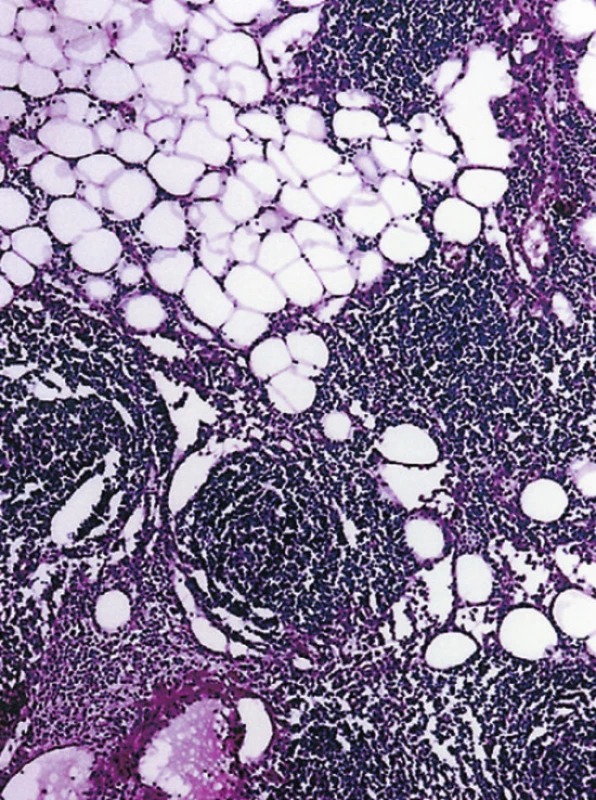
Image 2. Mikroskopická ložiska FL ve sliznici tenkého střeva jsou CD10 pozitivní. (50krát) 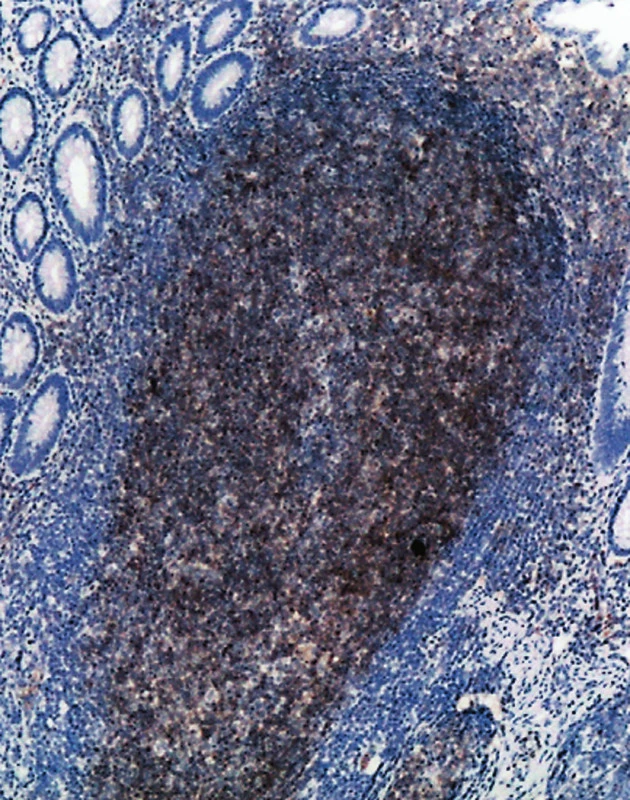
Image 3. Obdobné ložisko s Bcl-2 pozitivitou. (50krát) 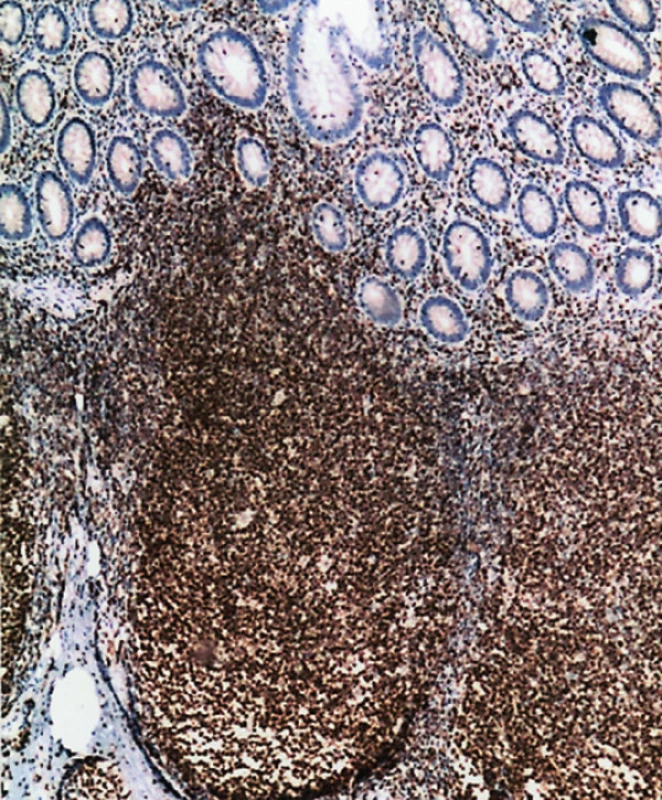
Image 4. (a). Rozložení dendritických retikulárních buněk v nádorovém folikulu. (CD23, 50krát) (b). V dolní části obrázku je pozitivní nález s protilátkou CD20 u FL. (400krát) 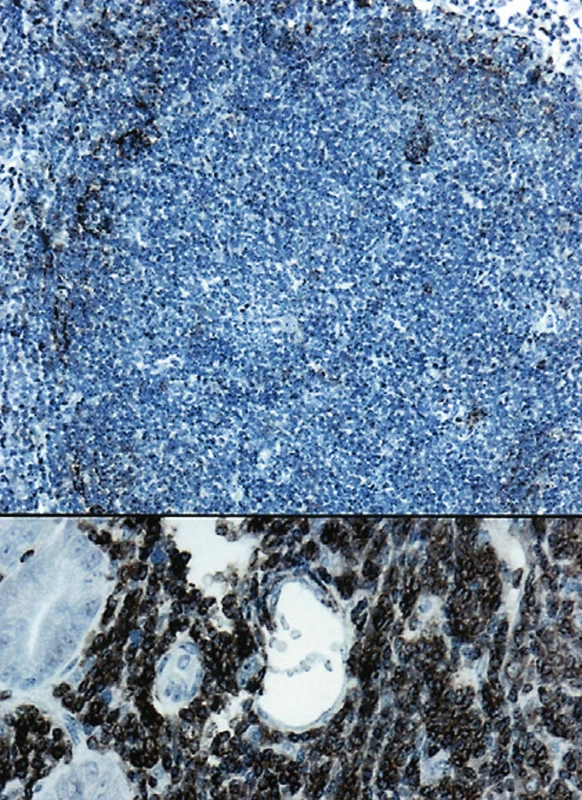
Ve druhém případě šlo o 54letou ženu. Byla zjištěna dvě nádorová ložiska. Jedno bylo v ileu velikosti 4x3,5x3,5 cm a druhé v oblasti ileocekální chlopně, kde byla stenóza. Obě ložiska spolu makroskopicky nesouvisela a byla od sebe vzdálena více než 17 cm. Na sliznici ilea v blízkosti ileocekální chlopně byly mnohočetné drobné polypovité útvary velikosti 2-3 mm histologicky tvořené jedním nebo více nádorovými folikuly (obr. 1a,b). Obě nádorová ložiska byla tvořena folikulárním lymfomem grade 1. Vyšetření FISH na t(14;18) ukázalo pozitivní výsledek u 100 % nádorových buněk. Metodu jsme aplikovali i na úseky střeva, kde byly přítomny ojedinělé nádorové folikuly. I zde byl zjištěn pozitivní výsledek a prokázána t(14;18).
Image 5. (a) Polypovité vyklenutí sliznice tenkého střeva se dvěma ložisky FL. (HE, 25krát) (b) V dolní části obrázku je patrné, že lymfom je složený ze středně velkých buněk s hyperchromními jádry. (HE, 400krát) 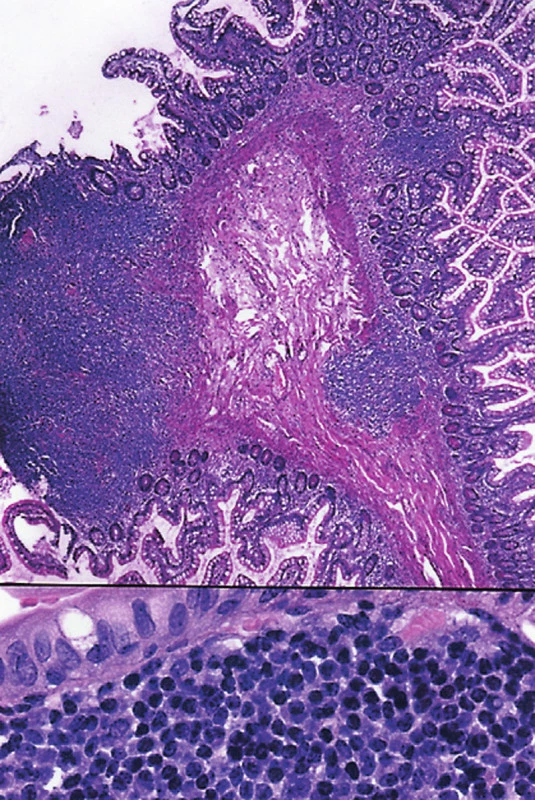
Obě pacientky s FL jsou tři roky po operaci, cítí se dobře a po klinické stránce jsou v remisi.
ALCL jsme zjistili v jednom případu 76leté ženy v jejunu. Lymfom difuzně infiltroval střevo po celém obvodu v rozsahu 6 cm. Postihoval i sestupnou část tlustého střeva. Imunohistologicky nádor exprimoval protilátky proti T antigenům, jak bylo uvedeno výše, a dále byl pozitivní s protilátkou proti CD30; ALK neg.; markery B řady negativní. U pacientky byl čtyři roky před touto biopsií diagnostikován dlaždicobuněčný karcinom vulvy bez generalizace a po roce po diagnóze lymfomu byl zjištěn malobuněčný karcinom plic. Nemocná zemřela čtyři roky po operaci lymfomu střeva a nebyla pitvána.
V pěti případech byl zjištěn DLBCL, většinou v jejunu. V jednom případě (č. 7) nádor infiltroval terminální ileum a současně cékum. Lymfomy byly tvořeny velkými buňkami vzhledu centroblastů nebo imunoblastů. V jednom případě šlo o anaplastickou variantu. Nízce maligní MALT lymfom v okolí DLBCL jsme nezjistili. Imunohistologicky: CD20+, CD79a+, CD45RO neg., CD3 neg., CD5 neg., CD10 neg. (obr. 6a,b). Ve dvou případech nádorové buňky reagovaly s protilátkou proti Bcl-6 u 50 %, resp. 80 % buněk. V jednom případě 50 % buněk reagovalo pozitivně s protilátkou proti MUM-1.
Image 6. (a). Difuzní velkobuněčný B lymfom, anaplastická varianta. (HE, 400krát) (b). Pozitivní nález s protilátkou CD20. (400krát) 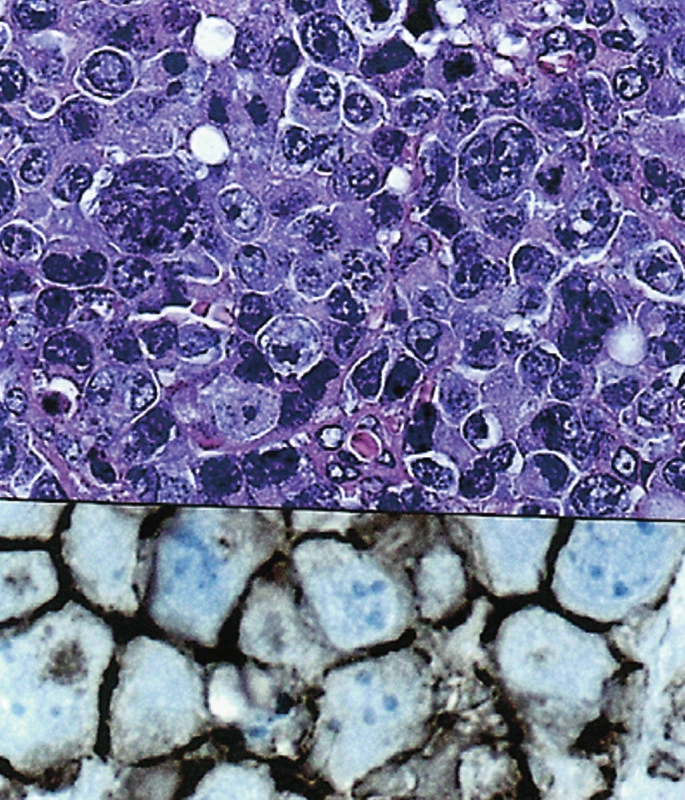
Po stanovení bioptické diagnózy byli všichni nemocní následně zevrubně vyšetřeni na hematoonkologické klinice, včetně vyšetření kostní dřeně. Tři pacienti zemřeli do jednoho roku po operaci. Pouze v jednom případě byla provedena pitva s nálezem nádorové infiltrace mezenteriálních, pánevních a paraaortálních lymfatických uzlin. Jeden nemocný není v onkologickém registru evidován a jeho další osud je neznámý; jeden nemocný je devět roků po operaci v remisi.
Diskuse
Přibližně 25–40 % ne-hodgkinských lymfomů vzniká extranodálně v místech sliznic, nejčastěji v GIT. Nejvíce lymfomů bývá v žaludku; 20–30 % vzniká v tenkém střevě (7, 8). Z větších sestav je patrné, že většina lymfomů patří k B řadě (asi dvě třetiny) a přibližně třetina patří do T řady. Většina lymfomů B řady je „high-grade“. B buněčné lymfomy se nejvíce objevují v distálních oblastech tenkého střeva a v ileocékální oblasti. T buněčné lymfomy často vznikají v proximálních oblastech tenkého střeva (7). Obecně mají T lymfomy horší prognózu než B lymfomy.
Klinicky se nádory projevují bolestmi břicha, ztrátou váhy; dochází k příznakům zúžení, uzávěru nebo perforace střeva. Perforace stěny žaludku a tlustého střeva je vzácná, v tenkém střevě se objevuje asi u 30 % případů (1, 3, 6). V naší sestavě došlo k perforaci ve dvou případech. Klinicky se projevovala náhlou bolestí břicha, na kterou bezprostředně navazovalo operační řešení.
Stejně tak jako v žaludku jsou v tenkém střevě nejčastější agresivní lymfomy typu DLBCL. Pouze velmi omezené množství těchto nádorů obsahuje původní „low-grade“ MALT lymfom, což ukazuje na postupnou transformaci nízce maligního lymfomu. Pokud jsou přítomny současně obě tyto složky, pak mluvíme o kompozitních nádorech. Takových lymfomů je však popsáno relativně velmi málo, častěji se objevují v žaludku. V našich případech nízce maligní MALT lymfomy nebyly zjištěny. Pokud se zjistí i malá ložiska „high-grade“ lymfomu, mělo by to být uvedeno v histologickém nálezu. Tyto údaje jsou významné pro stanovení stagingu (10). Vzájemný poměr mezi MALT lymfomy a ostatními lymfomy není znám (12).
DLBCL se na základě genetického profilu zjištěného pomocí „DNA microarray“ dělí na 3 typy:
- vychází z buněk zárodečného centra (GC-DLBCL),
- vzniká z aktivovaných B lymfocytů (non GC-DLBCL),
- mediastinální DLBCL.
Bylo zjištěno, že k rozlišení prvních dvou typů může pomoci imunohistologie. Exprese Bcl-6 proteinu, která je nezávislá na přeskupení genu bcl-6 a exprese CD10 mohou pomoci zařadit lymfom k GC-DLBCL. Kwon a spol. (12) zjistili, že exprese Bcl-6 proteinu musí být difuzní a nikoliv sporadická, aby se mohlo uvažovat o zařazení lymfomu do této skupiny. To v našich dvou případech nebylo, i když pozitivní nález s protilátkou proti Bcl-6 byl v jednom případě až u 80 % buněk. CD10 pozitivní buňky jsme zde nezjistili. Zařazení k GC-DLBCL je tedy málo pravděpodobné. Výše uvedené dělení DLBCL se v současné době zdá být pro klinickou praxi méně významné. Moderní terapie, zvláště pak zavedení Rituximabu, setřela hranice mezi nádorovými typy (11). Podle některých údajů (7) pět let přežívá až 50 % nemocných s „high grade“ lymfomy tenkého střeva. Tento údaj je příznivější než je tomu u obdobných lymfomů vznikajících v lymfatických uzlinách.
V sestavě jsou dva folikulární lymfomy. Ty tvoří 1–3 % ze všech lymfomů GIT (8,13). V jednom případě lymfom difuzně infiltroval všechny vrstvy stěny střeva v rozsahu 5cm. Ve druhém případě vedle hlavního ložiska byla v histologickém obraze zjištěna početná další ložiska různé velikosti. Ta měla místy polypovitý vzhled. V některých úsecích tvořila souvislé pruhy pod povrchovým slizničním epitelem, jinde šlo jednotlivé nádorové folikuly nebo ložiska, která do značné míry připomínala nenádorové lymfatické folikuly. Imunohistologické vyšetření a vyšetření metodou FISH na t(14;18) však i v těchto oblastech odpovídalo FL. Podle WHO klasifikace (18) mohou být tyto změny považovány za kolonizaci původních folikulů lymfomem nebo může jít o prekurzory lymfomu. Nelze vyloučit ani histohomologní způsob šíření tohoto lymfomu. Infiltrace pokračovala až za resekční linii. Proč dochází k tomuto způsobu šíření či nádorové proliferaci není zcela jasné. Faktem je, že FL v GIT exprimují integrin α4ß7, který se považuje za „homing receptor“ a je přítomný jak u normálních lymfocytů stěny střeva, tak i u buněk lymfomu. Tento integrin nebyl zjištěn u DLBCL a Burkittova lymfomu, i když vznikají v tenkém střevě (16). Bende a spol. (4) zjistili, že některé chemokiny, např. CXCR3 přítomný u nízce maligních MALT lymfomů nebyly zjištěny u nodálních FL ani u FL GIT.
Přítomnost integrinu α4ß7 a imunoglobulinová konfigurace (jsou obvykle IgA pozitivní) podporují názor na jejich vznik z B buněk, které se nacházejí běžně ve sliznici GIT. Imunofenotyp intestinálních a nodálních lymfomů je shodný. Rozdíl je právě jen v přítomnosti integrinu α4ß7 a v průkazu IgA u FL střeva.
V jednom případě jsme zjistili ALCL. Lymfom se vyskytuje v extranodální oblasti méně často. Nejčastěji se objevuje v kožní lokalizaci. Mimo kůži se objevuje vzácně např. v plicích, kostech, slezině, ledvinách a v GIT (5, 9, 17). Většinou se T buněčné lymfomy objevují v souvislosti s malabsorpčním syndromem a jsou označovány jako T buněčné lymfomy sdružené s enteropatií. Jsou tvořeny středně velkými buňkami, ale mohou se objevovat i anaplastické varianty s velkými či vícejadernými buňkami. V takových případech bývá odlišení od ALCL obtížné. Je nutné znát anamnézu a vyloučit enteropatii. Morfologicky je třeba vyšetřit sliznici střeva v okolí nádoru. V našem případě klinické ani morfologické známky enteropatie nebyly zjištěny. Nádorové buňky exprimují markery T řady a některé vykazují CD30 pozitivitu.
Většina případů ALCL exprimuje ALK protein. ALK negativní případy se častěji objevují u starších pacientů. V našem případě šlo o 76letou ženu, u které nádorové buňky neexprimovaly ALK protein. Zvláštností byl u této nemocné výskyt dalších dvou nádorů: dlaždicobuněčného karcinomu vulvy čtyři roky před objevením lymfomu a malobuněčného karcinomu plic, který byl diagnostikovaný za rok po nálezu lymfomu. Pacientka zemřela za další čtyři roky z neznámé příčiny. Pitva nebyla provedena.
Studie ukazuje, že lymfomy střeva se makroskopicky podobají karcinomům a mohou být odstraněny chirurgicky. U některých FL se však nacházejí nádorová ložiska mikroskopické velikosti, která jsou rozeseta daleko od hlavní nádorové masy a mohou překročit hranice resekce. V těchto případech je chirurgické řešení problematické.
Práce byla podpořena grantem IGA MZ ČR NR/9305-3
Prof. MUDr. J. Mačák
Ústav patologie LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: jmacak@fnbrno.cz
Sources
1. Al-Bahrani, Z.R., Al-Mondhiry, H., Bakir, F. et al.: Clinical and pathological subtypes of primary intestinal lymphoma. Experience with 132 patients over a 14-years period. Cancer 52, 1983, s. 1666–1672.
2. Al-Mondhiry, H.: Primary lymphomas of the small intestine: East-West contrast. Am. J. Hematol. 22, 1986, s. 89–105.
3. Auger, M.J., Allan, N.C.: Primary ileocaecal lymphoma. A study of 22 patients. Cancer 65, 1990, s. 358–361.
4. Bende, R.J., Smit, L.A., Bossenbroek, J.G.: Primary follicular lymphoma of the small intestine. α4ß7 expression and immunoglobulin configuration suggest an origin from local antigen-experienced B cell. Am. J. Pathol. 162, 2003, s. 105–113.
5. Carey, M.J., Medeiros, L.J., Roepke, J.E. et al.: Primary anaplastic large cell lymphoma of the small intestine. Am. J. Clin.Pathol. 112, 1999, s. 696–671.
6. Cooper, B.T., Read, A.E.: Small intestine lymphoma. World J.Surg. 9, 1985, s. 930–937.
7. Domizio, P., Owen, R.A., Shepard, N.A. et al.: Primary lymphoma of the small intestine. Am. J. Surg. Pathol. 17, 1993, s. 429–442.
8. Dragosics, B., Bauer, P., Radaszkiewicz, T.: Primary gastrointestinal non-Hodgkin’s lymphomas: a retrospective clinco-pathological study of 150 cases. Cancer 55, 1985, s. 1060–1073.
9. Griesser, H., Henry, M., Boie, C. et al.: Large-cell anaplastic lymphoma of the gastrointestinal tract: an immuno - and genotypic study on archival material. Hematol. Pathol. 8, 1994, s. 121–134.
10. Hamilton, S.R., Aaltonen, L.A.: Tumours of the digestive system. Pathology & Genetics, WHO classification, IARC Press, Lyon 2000, s. 84–85.
11. Held, G., Pfreundschuh, M.: Hematology: Germinal center or nongerminal center DLBCL? Nat. Rev. Clin. Oncol. 6, 2009, s. 188–190.
12. Kwon, M.S., Go, J.H., Choi, J.S. et al.: Critical evaluation of Bcl-6 protein expression in diffuse large B-cell lymphoma of the stomach and small intestine. Am. J. Surg. Pathol. 27, 2003, s. 790–798.
13. LeBrun, D.P., Kamel, O.W., Cleary, M.L. et al.: Follicular lymphomas of the gastrointestinal tract. Am. J. Pathol. 140, 1992, s. 1327–1335.
14. Levison, D.A., Hall, P.A., Blackshaw, A.J.: The gut-associated lymphoid tissue and its tumors. In: Williams, G.Z.: Current Topics in Gastrointestinal Pathology, Berlin, Springer Verlag, 1989, s. 134–175.
15. O’Rourke, M.G.E., Lancashire, R.P., Vattoune, J.R.: Lymphomas of the small intestine. Aus.N.Z.J.Surg. 56, 1986, s. 351–355.
16. Pals, S.T., de Gorter, D.J.J., Spaargaren, M.: Lymphoma dissemination: the other face of lymphocyte homing. Blood 110, 2007, s. 3102–3111.
17. Pearson, J.M., Borg-Grech, A.: Primary Ki-1 (CD30) - positive, large cell, anaplastic lymphoma of the esophagus. Cancer 68, 1991, s. 418–421.
18. Swerdlow, S.H., Campo, E., Harris, N.L.: WHO Classification of Tumours of Haematopoietic and Lymphoid tissue. WHO Press, Lyon, 2008, s. 439.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2010 Issue 1
Most read in this issue- Histopatologická klasifikace idiopatických intersticiálních pneumonií
- Lymfomy tenkého střeva
- Expresie a lokalizácie kaspázy 1, superoxiddismutázy (D-mutázy) a kalretinínu v placente a bazálnej decidue pri preeklampsii
- Analýza angiogeneze v kostní dřeni u plazmocytárního myelomu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

