-
Medical journals
- Career
Histopatologická klasifikace idiopatických intersticiálních pneumonií
: C. Povýšil
: Ústav patologie 1. LF UK a VFN a Katedra patologické anatomie IPVZ, Praha
: Čes.-slov. Patol., 46, 2010, No. 1, p. 3-7
: Reviews Article
Klasifikační schéma intersticiálních chorob plic prošlo opakovanými revizemi. Kritéria pro odlišení sedmi základních podtypů idiopatických intersticiálních pneumonií jsou nyní dobře definována na základě konsensuální recentně publikované klasifikace vydané Americkou hrudní a Evropskou respirační společností. V našem souhrnném článku jsou rozebrány histologické obrazy a principy diferenciální diagnostiky idiopatických intersticiálních pneumonií.
Bioptické vyšetření zůstává zlatým standardem v diagnostice intersticiálních pneumonií a pro jejich vyšetření je doporučen odběr alespoň dvou vzorků. Videoasistovaná torakoskopie je preferovanou metodou pro bioptický odběr plicní tkáně, neboť poskytuje podobné výsledky jako otevřená torakoskopie.
Nejčastějším podtypem chronické intersticiální plicní choroby je běžná intersticiální pneumonie, která tvoří 47–71 % z celkového počtu všech případů. Klíčovým histologickým obrazem je subpleurální a paraseptální distribuce přestavěných okrsků s denzní fibrózou, častou voštinovitou strukturou a velkými ložisky fibroblastické proliferace. Hlavním znakem je časová a prostorová heterogenita patologických změn.
Nespecifická intersticiální pneumonie se primárně vyskytuje u žen středního věku, které nikdy nekouřily, přičemž 5 let přežívá více než 80 % postižených. Hlavním rysem je uniformní ztluštění alveolárních sept v souvislosti s fibrotizací a zánětlivou celulizací.
Kardinálním histologickým znakem bronchiolitidy respiračních bronchiolů a deskvamativní pneumonie je zmnožení intraalveolárních histiocytů. U obou lézí je různě velká intersticiální fibróza, chronický zánět a prokazatelná souvislost s kouřením.
Organizující se pneumonie (idiopatická bronchiolitis obliterans-organizující se pneumonie) není striktně intersticiální proces, neboť alveoly a bronchioly jsou vyplněny intraluminálními polypy z fibroblastické tkáně a expanze procesu do intersticia je malá.
Lymfocytická intersticiální pneumonie je považována za difuzní reaktivní plicní lymfoidní hyperplazii spojenou v řadě případů s EB virózou, imunosupresí a kolagenózami. Maligní transformace v MALT lymfom se vyskytuje vzácně.
Difuzní alveolární poškození (DAD) z neznámých příčin je označováno jako akutní intersticiální pneumonie (AIP) a je synonymem pro případy Hammanovy-Richovy choroby. V exsudativní fázi se najdou hyalinní blanky a později i expanze intersticia.Klíčová slova:
klasifikace – histopatologie – diferenciální diagnostika – idiopatické intersticiální pneumonie1. Nespecifickou intersticiální pneumonii charakterizuje uniformní a rovnoměrně rozložené ztluštění alveolárních sept. HE, 120krát 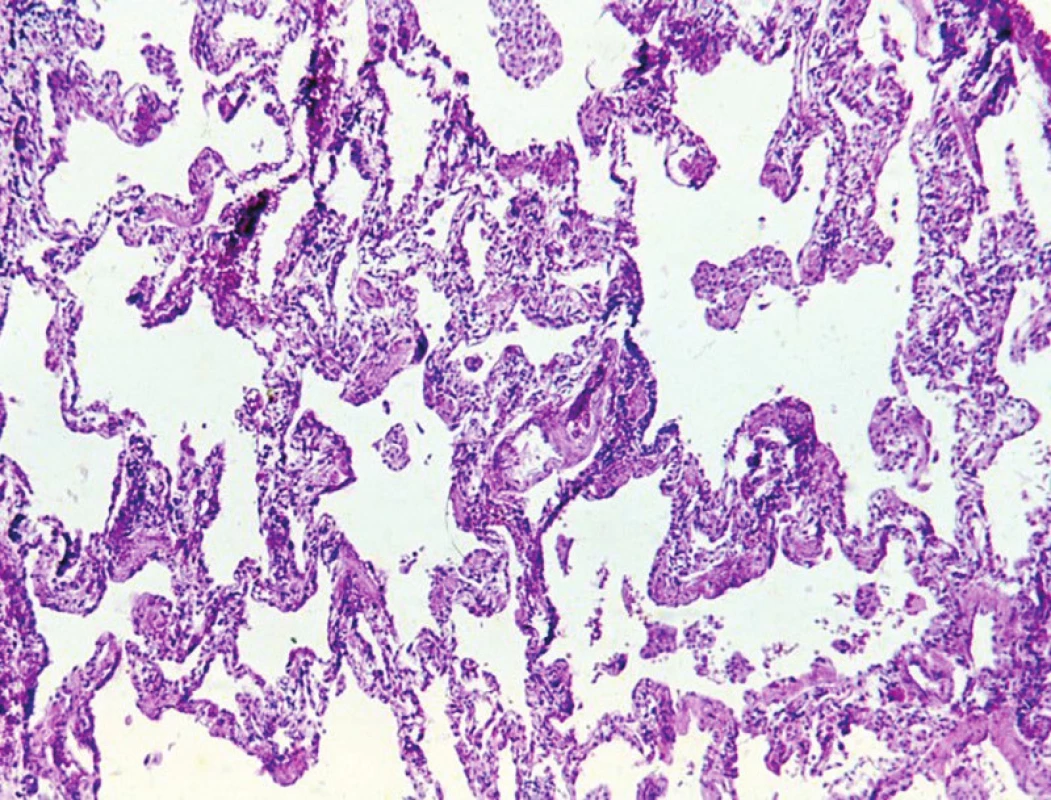
V etiopatogenezi se pravděpodobně uplatňují kolagenózy, expozice alergenům a někdy v anamnéze předchází akutní difuzní alveolární poškození.
Difuzní alveolární poškození
Difuzní alveolární poškození je projevem velice různorodých etiopatogenetických mechanismů, mj. šoku, virových infekcí včetně infekce coronavirerm vyvolávajícím SARS (3), poškození toxickými látkami, dlouhodobé inhalace čistého kyslíku nebo toxických plynů atd. (1, 9). Pokud etiopatogeneze zaznamenaného procesu je nejasná, potom se používá z klinického hlediska označení akutní intersticiální pneumonie, což je v podstatě synonymum pro Hammannovu-Richovu chorobu. Hlavním klinickým projevem je syndrom respirační tísně, který samozřejmě může vést v souvislosti s rychle progredující dušností ke smrti. V exsudativní fázi se projevuje tvorbou známých hyalinních blanek, zatímco v rámci regenerace a reparativní fáze dochází k proliferaci především pneumocytů II. řádů a fibroblastů alveolárních sept (obr. 4). Vrůstání granulační tkáně do hyalinních blanek má za následek deformaci základních plicních struktur. U přežívajících pacientů mohou být histologické nálezy v podstatě neodlišitelné od nespecifické intersticiální pneumonie, event. od organizující se pneumonie. Rozpoznání virové etiologie je většinou možné pouze prostřednictvím virologického vyšetření a elektronové mikroskopie.
2. Změny ve smyslu intersticiální fibrózy po proběhlém difúzním alveolárním poškození. Převažují pneumocyty II. řádu, které mají vysokou regenerační schopnost. HE, 120krát 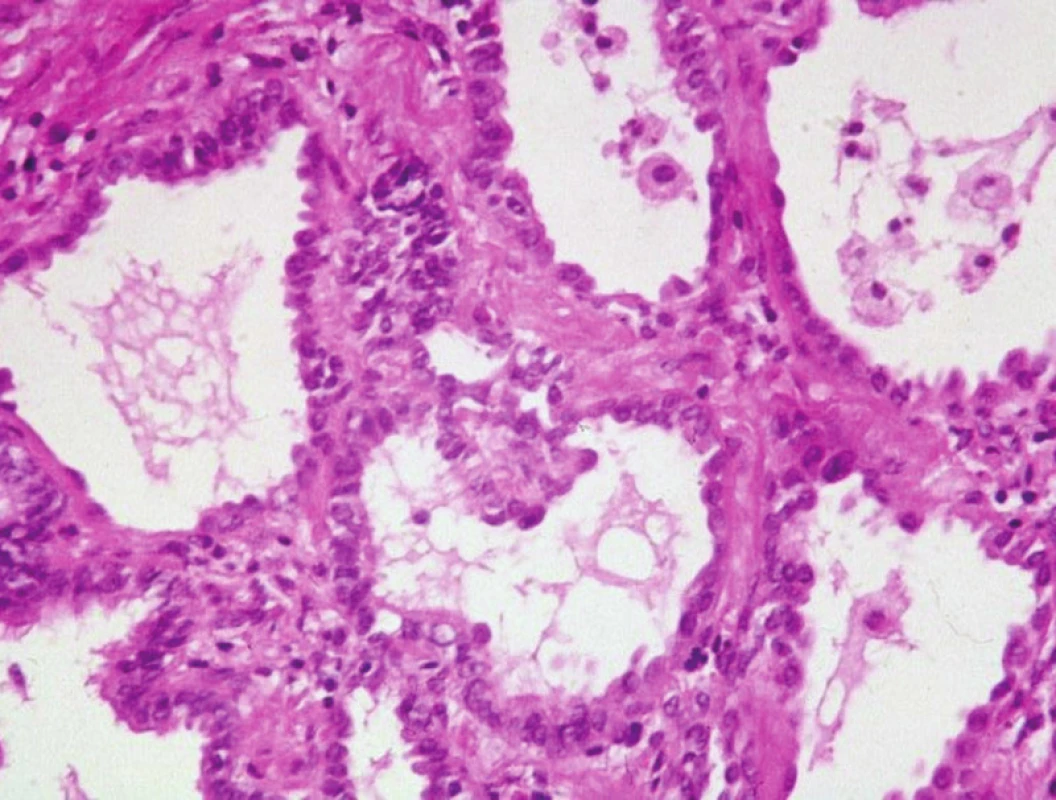
Organizující se pneumonie
Může být neznámého původu, nebo vzniká v souvislosti se známými příčinami. U případů s idiopatickou etiologií se používá termín kryptogenní organizující se pneumonie, přičemž synonymem je idiopatická bronchiolitis obliterans – organizující se pneumonie (1, 9). Vztah ke kouření zde nebyl prokázán. Začátky onemocnění někdy svojí symptomatologií připomínají virové onemocnění, avšak žádné infekční agens se nepodařilo dosud identifikovat. Onemocnění může recidivovat, na druhou stranu jsou však popisovány dobré účinky léčby kortikosteroidy. Chorobu charakterizují diagnosticky významné nálezy, a to přítomnost intraluminálně se nacházejících polypoidních útvarů, tvořených tkání blízkou tkáni granulační, a to nejen v alveolech ve formě tzv. Massonových tělísek (obr. 5), ale také v luminu bronchiolů (obr. 6). Rozšíření intersticiálních struktur je přitom vcelku malé. Přesto tato afekce činí určité problémy při diferenciální diagnostice oproti běžné intersticiální pneumonii.
3. Organizující se pneumonii charakterizuje nález intraalveolárních vazivových Massonových tělísek. HE, 120krát 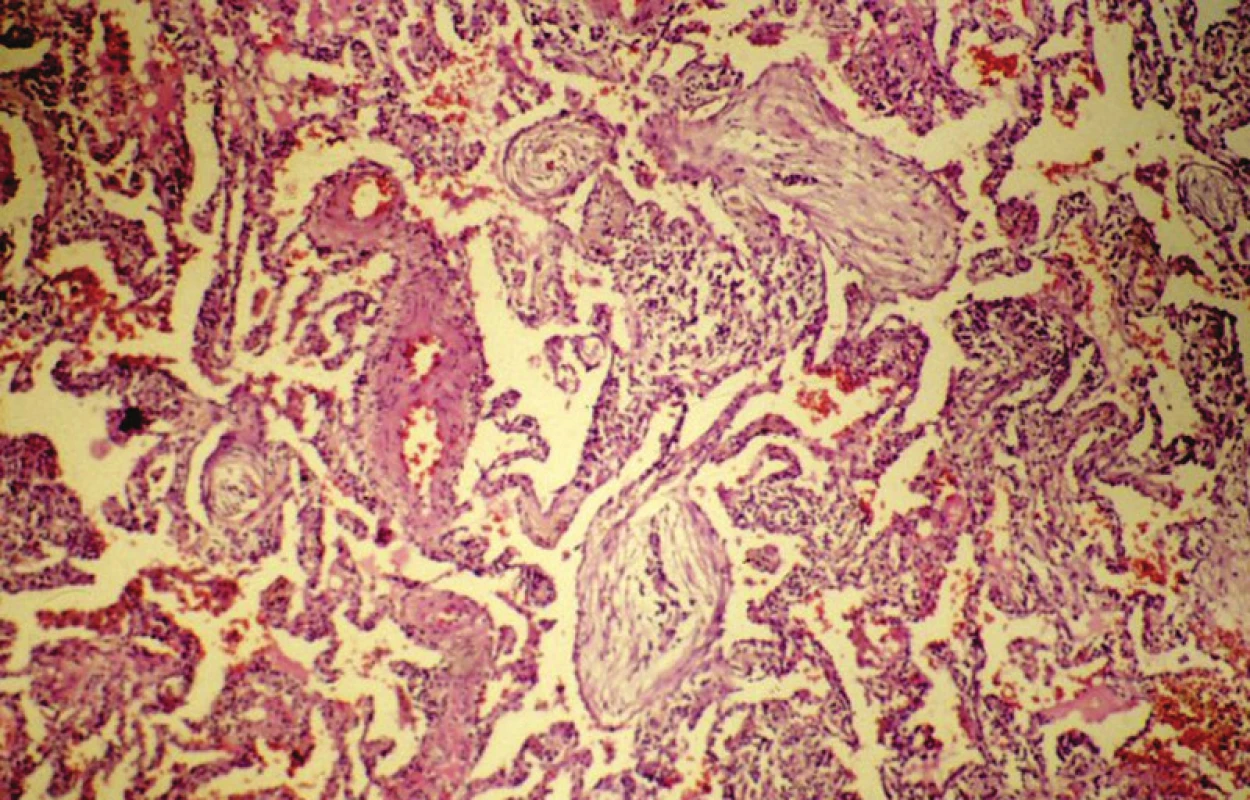
4. Bronchiolitis obliterans s polypoidním útvarem uvnitř lumina, jak byl zaznamenán u organizující se pneumonie. HE,240krát 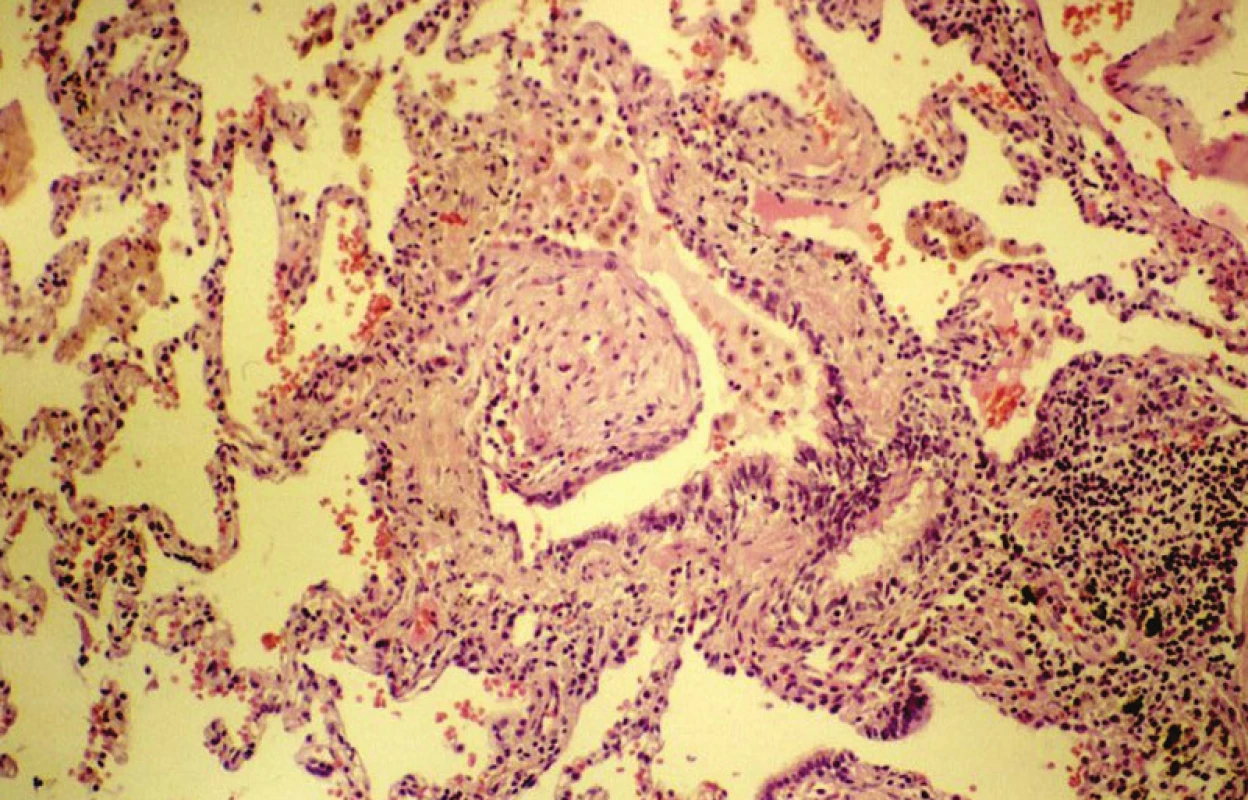
Etiopatogeneticky tyto změny velice často souvisejí s probíhající infekční chorobou, ale mohou se také vyvinout při užívání různých léků. Obliterující bronchiolitida je však zároveň projevem rejekční reakce po transplantaci plic.
Deskvamativní intersticiální pneumonie
Název této varianty je samozřejmě zavádějící, neboť alveoly nejsou vyplněny odloučenými pneumocyty, nýbrž makrofágy, což lze v současné době snadno ověřit při použití protilátek proti cytokeratinům a CD68. V mikroskopickém obraze dominuje nahromadění makrofágů v alveolárních prostorách, většinou s eozinofilní cytoplazmou (obr. 7). Základní alveolární struktury jsou přitom zachovány s minimální zánětlivou reakcí. Změny jsou obvykle difuzně distribuovány (1, 2, 9).
5. Deskvamativní intersticiální pneumonie s četnými makrofágy v alveolárním prostoru. HE, 160krát 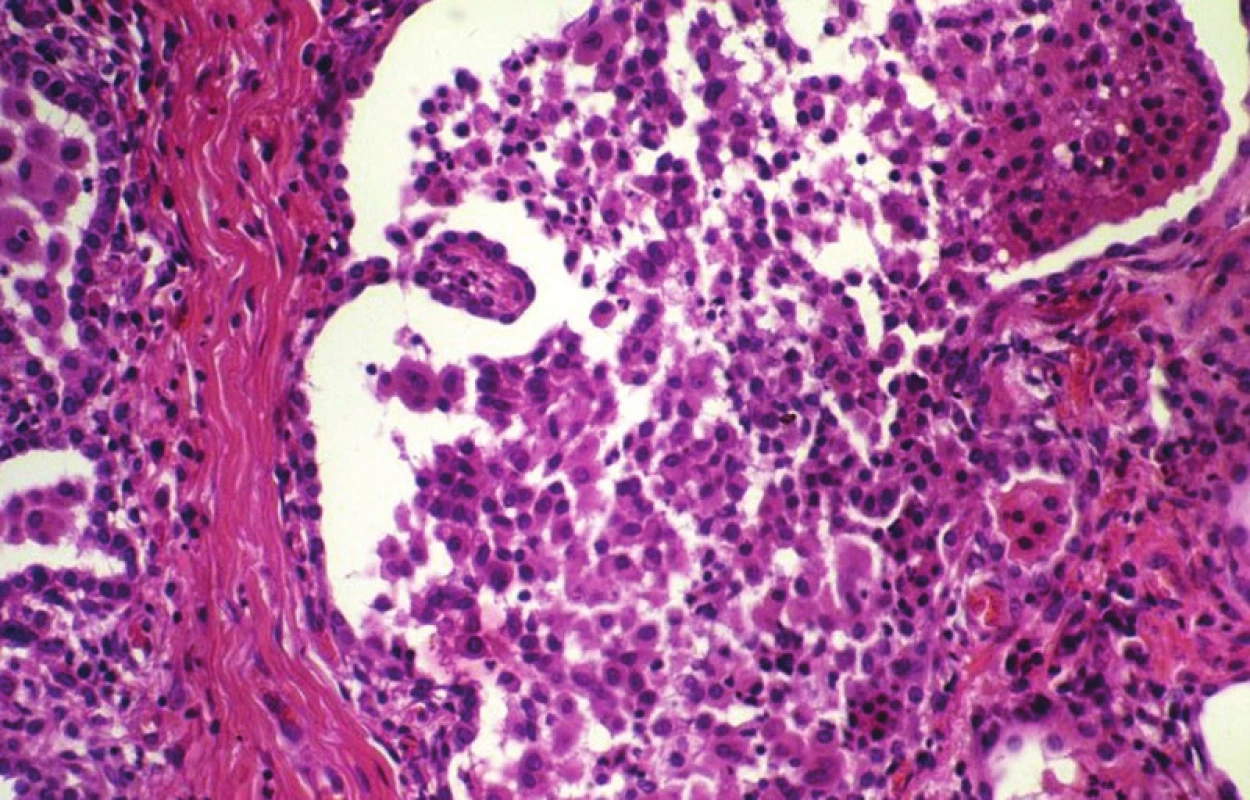
Z diferenciálně diagnostického hlediska je na prvém místě nutné odlišit Langerhansovu granulomatózu, což umožní imunohistochemické vyšetření s použitím protilátek proti CD1a. Nahromadění makrofágů v alveolech běžného typu se vyskytuje i v jiných situacích, např. při inhalaci prachu nebo v souvislosti s podáváním některých léků a u některých vrozených metabolických chorob. Někteří autoři (2) upozorňují na častý současný výskyt deskvamativní intersticiální pneumonie v kombinaci s bronchiolitidou respiratorních bronchů.
Intersticiální pneumonie spojená s bronchiolitidou respiračních bronchiolů
Tato forma se vyskytuje především u těžkých kuřáků, kteří trpí krátkým dechem a kašlem (1, 4, 9). Podobně jako u deskvamativní pneumonie dominuje v histologickém obraze nahromadění alveolárních makrofágů, a to jak v bronchiolech, tak i v sousedních alveolech. Distribuce má centroacinární charakter na rozdíl od difuzní distribuce makrofágů u deskvamativní pneumonie. Peribronchiální alveolární septa bývají ztluštělá, se zánětlivými infiltráty, známky přestavby ve voštinovitou plíci však chybí. Na rozdíl od deskvamativní intersticiální pneumonie je u této jednotky častější výskyt lymfoidních folikulů a rozsáhlejší intersticiální fibrózy. U deskvamativní intersticiální fibrózy je zastoupení kuřáků podstatně nižší ve srovnání s touto afekcí.
Lymfocytární (lymfoidní) intersticiální pneumonie (LIP)
Toto onemocnění je nyní považováno za difuzní reaktivní proces s hyperplazií lymfoidní tkáně (1, 4, 9). Ve většině případů se prokáže souvislost s některou z autoimunních chorob, s imunosupresí nebo s infekcí EB virem. Běžně se u pacientů s touto pneumonií zjistí abnormity ve spektru imunoglobulinů, s rysy monoklonální gamapatie, hypergamaglobulinémie nebo naopak hypogamaglobulinémie.
Hlavním histopatologickým nálezem jsou masivní intersticiální lymfoidní infiltráty sestávající z B i T lymfocytů, s příměsí plazmatických buněk. Tvorba lymfatických folikulů je běžnou součástí těchto infiltrátů (obr. 8). V převážné většině případů se jedná o polyklonální populaci lymfocytů. Diferenciálně diagnosticky je nezbytné odlišit nízce maligní lymfomy typu MALT za použití imunohistochemie a metod molekulární diagnostiky, které, jak se ukazuje v poslední době, jsou častější než idiopatické formy LIP.
6. Lymfocytární intersticiální pneumonie s tvorbou lymfatických folikulů. HE, 120krát 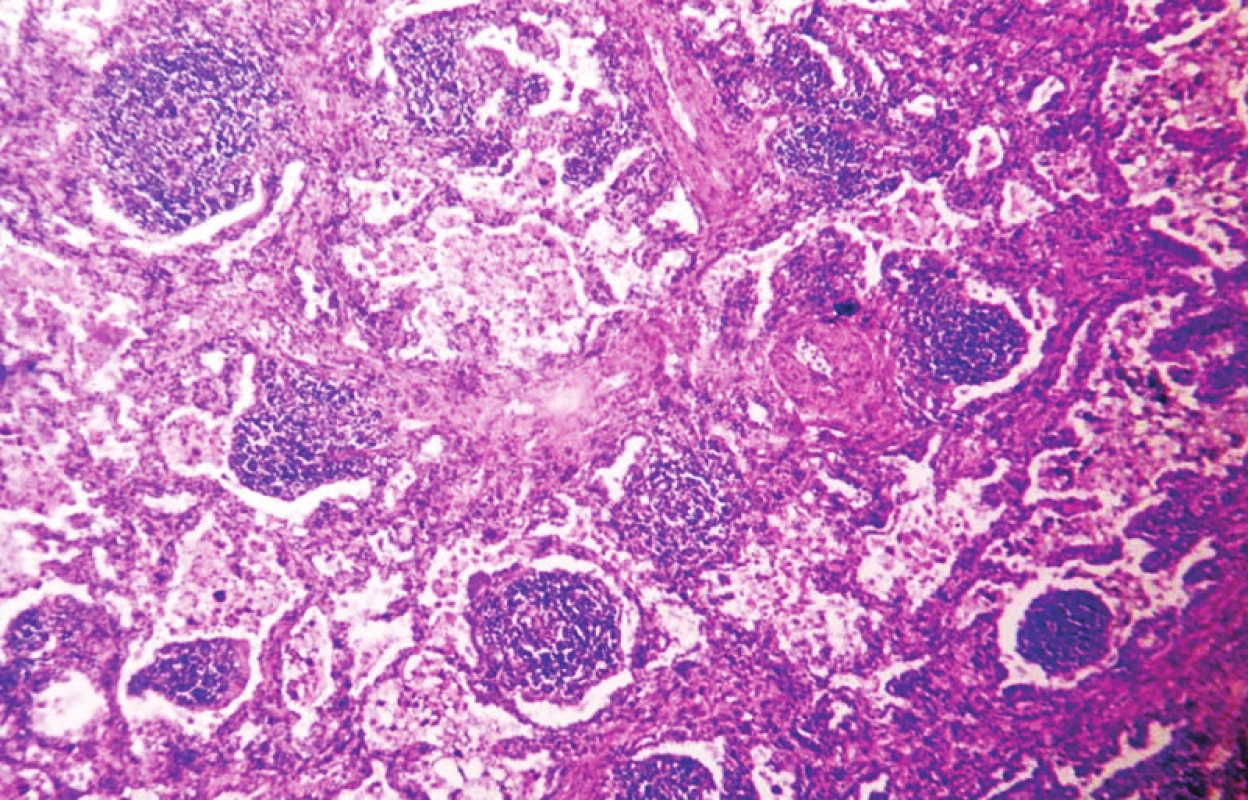
Diferenciální diagnostika
Úspěšná diagnostika intersticiální plicních pneumonií se neobejde bez úzké spolupráce s pneumology, kteří nejlépe znají anamnestická data jednotlivých pacientů. Druhou podmínkou dostatečně přesné diagnostiky této skupiny plicních onemocnění je kvalitní laboratorní zázemí. Kromě běžného barvení k průkazu vaziva a elastiky se v některých případech nelze obejít bez základních imunohistochemických reakcí. Pomocí průkazu cytokeratinů lze spolehlivě rozpoznat struktury alveolů, a to i v místech kolabované plicní tkáně či fibrózy (obr. 9).
7. Běžná intersticiální pneumonie. S protilátkou proti cytokeratinům se dobře znázorní pneumocyty vystýlající alveoly. 120krát 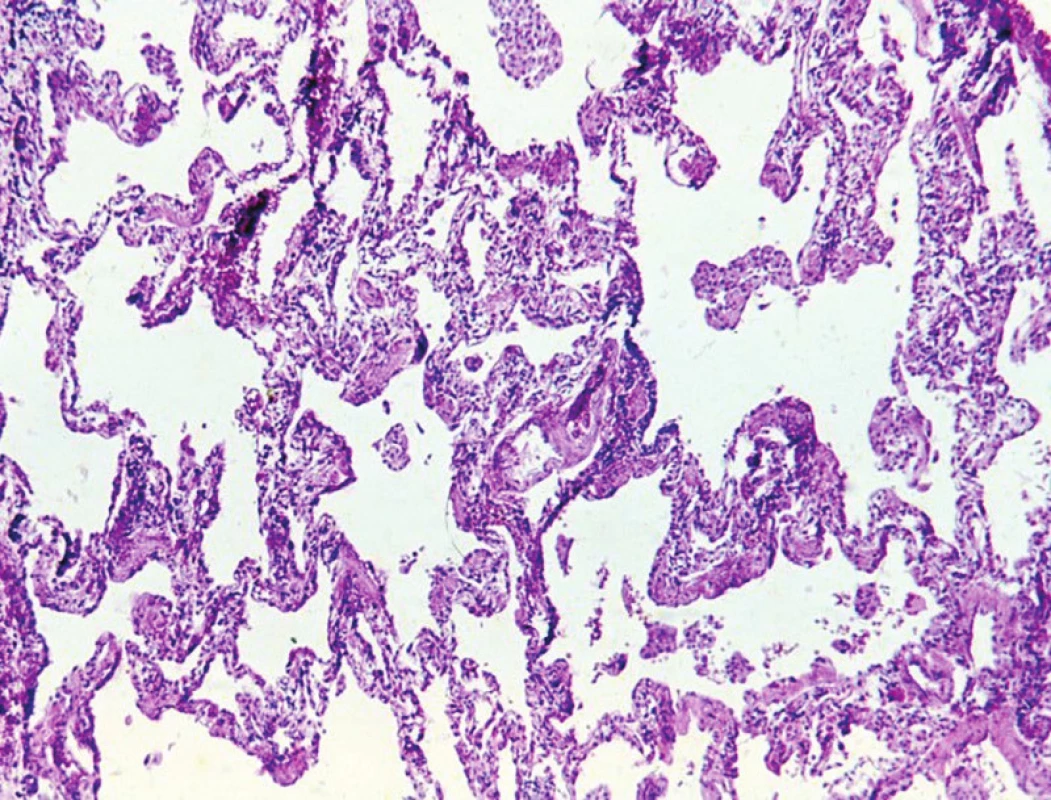
Reakce k průkazu CD68 a CD1a usnadní správné rozpoznání běžných histiocytů a histiocytů X. Nemělo by se zapomínat, že alveolární histiocyty se pozitivně znázorní i s protilátkou proti CD 31. V reakci s protilátkou proti hladkosvalovému aktinu je možno snadněji identifikovat hypertrofická svalová vlákna i okrsky fibroblastické proliferace s výskytem myofibroblastů.
Běžnou součástí je vyšetření vzorků plicní tkáně v polarizovaném světle, které pomocí dvojlomu dobře ozřejmí přítomnost cizorodých částí rostlinného původu či krystalky silikátů.
V rámci diferenciální diagnostiky je nutné počítat s možností výskytu extrinsické alergické alveolitidy, jejíž histopatologický obraz nemusí vždy obsahovat charakteristické struktury granulomatózního charakteru a naopak se může do značné míry blížit obrazu některé z výše zmíněných intersticiálních pneumonií. Jedná se o onemocnění rozvíjející se na imunitním podkladě, neboť se zde kombinuje ukládání komplexů antigen-protilátka s buněčnou přecitlivělostí. Zánětlivé změny jsou vázány především na okolí bronchiolů a bývají rovněž provázeny fibrózou alveolárních sept a jejich masivní lymfocytární zánětlivou celulizací. Významným histopatologickým nálezem je granulomatózní reakce na organické látky, především v peribronchiální lokalizaci. Granulomy jsou při tom menší než u sarkoidózy a mnohdy jejich buňky obsahují cizorodý materiál. Průkaz přítomnosti tohoto materiálu usnadňuje vyšetření v polarizovaném světle (obr. 10), aniž by bylo možné blíže specifikovat jeho původ. Také u této formy alveolitidy bývá v bronchiolech i v alveolárních prostorách granulační tkáň s fibroblasty.
8. Extrinsická alergická alveolitida s drobným granulomem v sousedství bronchiolu. Jedna z obrovských vícejaderných buněk obsahuje ve své cytoplazmě dvojlomný cizorodý materiál. Polarizované světlo, 160krát 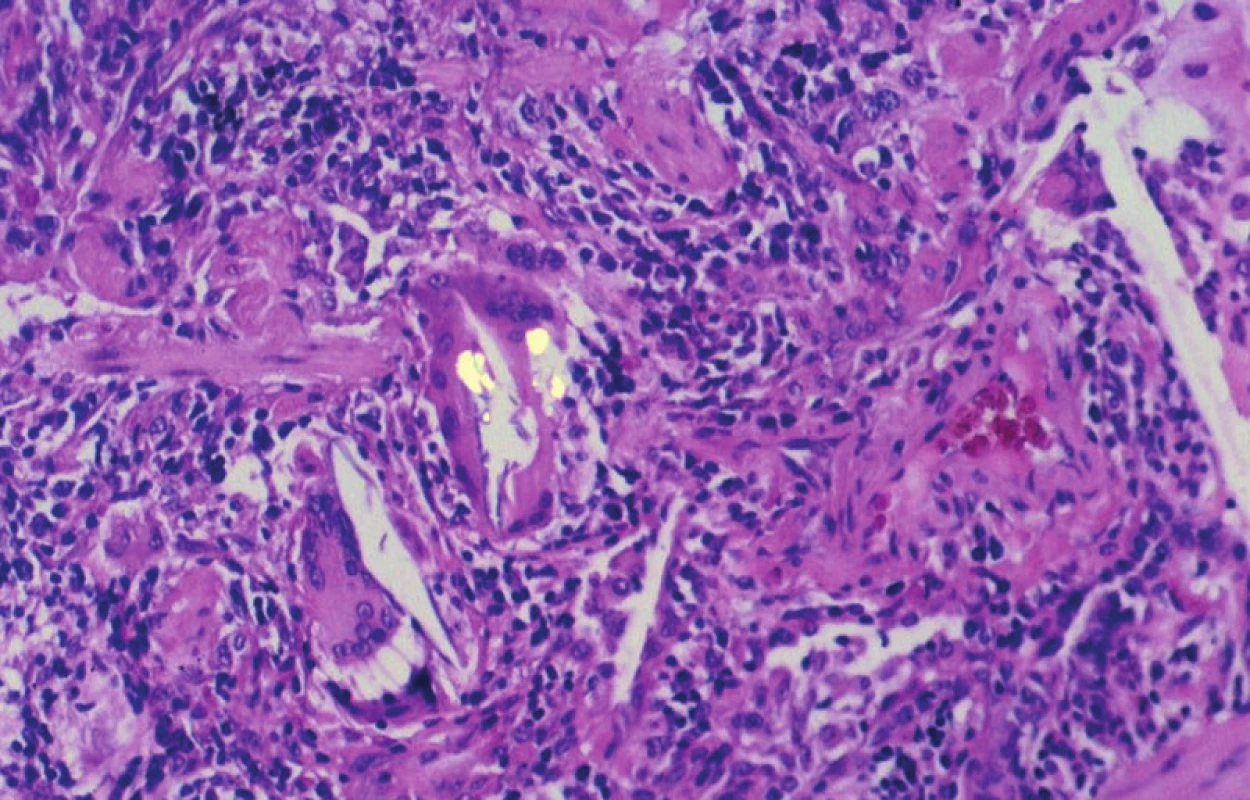
Etiopatogeneze onemocnění souvisí s imunitní reakcí na antigeny bakterií a mykóz či na proteiny obsažené v exkrementech živočichů, ale podobnou tkáňovou odezvu vyvolávají i některé léky jako je metotrexát. Proto se změny tohoto typu vyskytují v plicní tkáni u pracovníků v zemědělství (farmářská plíce), u pěstitelů hub, u chovatelů ptactva (holubářská plíce) či potkanů, dále pak u pracovníků v průmyslu, zpracovávajících např. korek, u dřevorubců těžících javory, u sládků apod. Zdrojem však může také být kontaminovaná voda chladících zařízení nebo prací prášky.
U histiocytózy z Langerhansových buněk se lze v pokročilejších stadiích setkat s výskytem málo buněčných jizev, které většinou mají cípatý tvar a nemusí vůbec obsahovat diagnostické histiocytární elementy. To je vcelku dobře známý jev, vyskytující se i v jiných lokalizacích, související s jakýmsi spontánním hojením lézí charakteru eozinofilního granulomu.
Nález fibrózy s pokročilými přestavbovými změnami charakteru voštinovité plíce se doporučuje uzavřít jako kryptogenní fibrotizující alveolitidu, nebo nález pouze popsat jako pokročilou remodelaci plicní tkáně, neboť u běžné intersticiální pneumonie by měly být přítomny i partie s normální histologickou strukturou.
U pneumokonióz je nutné pátrat po azbestových tělíscích a charakteristických silikotických uzlících. Uzlovitá fibróza je poměrně častým nálezem také u silikatóz, které lze odhalit na základě nálezu dvojlomných krystalků silikátů. Pokročilou formu uhlokopské nemoci charakterizuje nález antrakotického pigmentu v uzlících v okolí bronchiolů.
U idiopatické hemosiderózy jsou v ložiscích fibrózy snadno rozpoznatelné uloženiny železitého pigmentu.
Prof. MUDr. Ctibor Povýšil, DrSc.
Ústav patologie 1. LF UK a VFN
Studničkova 2
128 52 Praha 2
Tel.: 224 968 660
e-mail: ctibor.povysil@lf1.cuni.cz
Sources
1. American Thoracic Society/European Respiratory Society: International multidisciplinary consensus classification of the idiopathic interstitial pneumonias. Am. J. Respir. Crit. Care Med. 165, 2002, 277–304.
2. Craig, P.J., Wells, A.U., Hoffman, S. et al.: Desquamative interstitial pneumonia, respiratory bronchiolitis and their relationship to smoking. Histopathology, 45, 2004, 275–282.
3. Cheung, O.Y., Chan, J.W.M., Ng, C.K. et al.: The spectrum of pathological changes in severe acute respiratory syndrome (SARS). Histopathology, 45, 2004, 119–124.
4. Gordon, I.O., Cipriani, N., Arif, Q.: Update in nonneoplastic lung diseases. Arch. Pathol. Lab. Med. 133, 2009, 1096–1105.
5. Katzenstein, AL.A., Fiorelli, R.F.: Nonspecific interstitial pneumonia/fibrosis: histologic features and clinical significance. Am. J. Surg. Pathol. 18, 1994, 136–147.
6. Katzenstein, AL.A., Zisman, D.A., Litzky, L.A. et al.: Usual interstitial pneumonia. Histologic study of biopsy and explant specimens. Am. J. Surg. Pathol. 26, 2002, 1567–1577.
7. Liebow, A.A., Carrington, C.B.: The interstitial pneumonias. In: Simon, M., Potchen, E.J., Lemay, E., ed. Frontiers in pulmonary radiology. New York: Grune and Stratton, 1969, s. 102–141.
8. Leslie, K.O.: My approach to interstitial lung disease using clinical, radiological and histopathological patterns. J. Clin. Pathol. 62, 2009, 387–401.
9. Nicholson, A. G.: Classification of idiopathic interstitial pneumonias: making sense of the alphabet soup. Histopathology 41, 2002, 381–391.
10. White, E.S., Lazar, M.H., Thannickal, V.J.: Pathogenetic mechanisms in usual interstitial pneumonia/idiopathic pulmonary fibrosis. J. Pathol. 201, 2003, 343–354.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2010 Issue 1
Most read in this issue- Histopathological Classification of Idiopathic Interstitial Pneumonias
- Lymphoma of the Small Intestine
- Caspase 1, Superoxiddismutase (D-mutase) and Calretinin Expression in the Placenta and in the Basal Decidua in Preeclampsia
- Analysis of Bone Marrow Angiogenesis in Multiple Myeloma
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

