-
Medical journals
- Career
Možnosti využití MRI a PSA denzity v indikaci biopsie prostaty
: Miroslav Záleský 1,4; Jiří Stejskal 1; Vanda Adamcová 1; Jan Hrbáček 1; Ivo Minárik 2; Adam Pavličko 3; Jan Votrubová 3; Marek Babjuk 2; Roman Zachoval 1,4
: Urologická klinika, 3. LF UK a Thomayerova nemocnice, Praha 1; Urologická klinika, Fakultní nemocnice Motol, Praha 2; Radiologické oddělení, Thomayerova nemocnice, Praha 3; Urologická klinika 1. LF UK, Praha 4
: Ces Urol 2019; 23(1): 43-50
: Original Articles
Hlavní stanovisko práce: Při vhodném nasta‑vení kritérií lze kombinaci MRI a PSA denzity bez‑pečně použít k rozhodnutí o neprovedení biopsie prostaty u pacientů s elevací PSA.
Cíl: Cílem práce je vyhodnocení počtu ušet‑řených biopsií a záchytu nesignifikantního karcinomu prostaty (KP) oproti počtu nezachycených signifikantních karcinomů v závislosti na nastavení indikačních kritérií MRI a PSA denzity k neprovedení biopsie prostaty.
Soubor pacientů a metoda: V průběžné ana‑lýze prospektivního souboru z období 2015–2017 byly vyhodnoceny výsledky 397 pacientů, kteří pro elevaci PSA podstoupili MRI s následnou cílenou MRI/TRUS fúzní biopsií prostaty a standardní syste‑matickou biopsií prostaty. U 223 pacientů se jednalo o primobiopsii, u 174 pacientů se jednalo o rebiopsii.
Byla vypočtena frekvence detekce klinicky sig‑nifikantního karcinomu a klinicky nesignifikantního karcinomu prostaty v podskupinách stratifikova‑ných dle skóre PIRADS a dle PSAD, jak samostatně, tak v kombinaci obou parametrů.
Cílem bylo najít optimální mezní hodnotu PSAD v kombinaci s PIRADS skórem, potřebné k maxi‑malizaci ušetřených biopsií a minimalizaci počtu nezachycených signifikantních karcinomů prostaty. Analýza byla provedena pro hodnoty PSAD v roz‑mezí 0,1–0,5 ng/ml2.
Výsledky: Z hlediska diagnostiky signifikantního karcinomu se jako nejbezpečnější kritéria k neprovede‑ní biopsie prostaty jeví PIRADS <3 a PSAD <0,2 ng/ml2. Při jejich současném užití je možné neprovést 21,5 % (48/223) biopsií, což vede k nediagnostikování 16,7 % (5/30) klinicky nesignifikantních KP a 3,7 % (3/82) signifikantních karcinomů ve skupině primobiopsií.
Ve skupině rebiopsií je možné neprovést 12,6 % (22/174) biopsií, což vede k nediagnostikování 4,4 % (1/23) klinicky nesignifikantních KP a 6,9 % (4/58) signifikantních karcinomů.
Závěr: Při vhodném nastavení kritérií lze kom‑binaci MRI a PSA denzity použít k rozhodnutí o ne‑provedení biopsie prostaty u pacientů s elevací PSA, a to zvláště u pacientů indikovaných k primobiopsii.
Klíčová slova:
karcinom prostaty – Biopsie – fúze – MRI – PSA denzita
ÚVOD
Od zařazení vyšetření prostatického specifického antigenu (PSA) do diagnostického algoritmu karcinomu prostaty (KP) před více než 30 lety je vlastní diagnostika založena na detekci zvýšené hladiny PSA následované systematickou biopsií prostaty pod kontrolou transrektální sonografie (TRUS) (1).
Systematická (necílená) TRUS biopsie prostaty s doporučeným odběrem 10–12 vzorků nezachytí 20–30 % nádorů a zároveň vede k záchytu značného množství nesignifikantních karcinomů prostaty (2).
Narůstající množství studií prokazuje přínos multiparametrické MRI (mpMRI) jak v detekci, tak přesné lokalizaci ložiska signifikantního KP. Cílená MRI biopsie také vede ke zlepšení diagnostiky signifikantního KP a snížení záchytu nesignifikantního karcinomu (3–5). Některé práce poukazují i na možnost snížení počtu nutných biopsií i vlastních bioptických vzorků (6).
PSA denzita (PSAD) kalkulovaná jako hladina PSA dělená objemem prostaty je v poslední době stále častěji zmiňována jako další možné kritérium, které by bylo možné použít v rozhodovacím algoritmu diagnostiky karcinomu prostaty (7–9).
Cílem této práce je zjistit, zda užití kombinace mpMRI a PSAD v našem souboru pacientů může vést ke snížení počtu biopsií, aniž by došlo k významnějšímu snížení záchytu signifikantního karcinomu u těchto pacientů. Dalším cílem je zjištění kritérií (cut‑off hodnot) vedoucích k bezpečnému nastavení diagnostického algoritmu při možném snížení počtu biopsií.
SOUBOR PACIENTŮ A METODA
V průběžné analýze prospektivního souboru z období 2015–2017 byly vyhodnoceny výsledky 397 pacientů, kteří pro elevaci PSA (PSA > 2 ng/ ml, poměr freePSA/PSA < 20 %, pokračující nárůst PSA v čase) podstoupili mpMRI s následnou cílenou MRI/TRUS fúzní biopsií prostaty a standardní systematickou biopsií prostaty. U 223 pacientů se jednalo o primobiopsii (PB), u 174 pacientů se jednalo o rebiopsii (RB).
U primobiopsí byla mpMRI provedena na 1,5 T MR přístroji (Signa HDxT GE; General Electric, Milwaukee, USA) s endorektální cívkou (Medrad, Pittsburgh, USA) a osmikanálovou celotělovou cívkou (General Electric, Milwaukee, USA). V případě rebiopsiích bylo vyšetření provedeno na stejném přístroji a část pacientů z externích pracovišť byla provedena na různých blíže nespecifikovaných přístrojích MRI.
Všechny léze patrné na mpMRI byly vyhodnoceny dle kritérií PIRADS v.1 a zařazeny do následujících skupin: negativní (PIRADS 1 nebo 2), PIRADS 3, PIRADS 4 nebo PIRADS 5 (10).
MRI/TRUS fúzní cílená biopsie s odběrem 1–4 vzorků (průměrně 2,2 vzorků na ložisko) z každého MRI suspektního ložiska byla provedena u pacientů ve skupině PIRADS 3–5, ve všech skupinách pacientů byla provedena systematická TRUS biopsie s odběrem 12 vzorků.
Transrektální sonografie a statický typ softwarové MRI/TRUS fúze byly provedeny za použití přístroje Toshiba Aplio 500 s fúzní jednotkou SmartFusion (Toshiba Medical System Corporation, Himoishigami, Japan) využívající magnetické trasování polohy sondy (11).
PSA bylo vyhodnoceno pomocí elektrochemiluminiscentní imunometodiky firmy Roche (La Roche AG, Basel). Objem prostaty byl stanoven měřením pomocí transrektální sonografie během biopsie. PSAD byla kalkulována jako hladina PSA (ng/ml) dělená objemem prostaty (ml), změřeným při ultrasonografii.
Dále byla vypočtena frekvence detekce klinicky signifikantního karcinomu a klinicky nesignifikantního karcinomu prostaty v podskupinách stratifikovaných dle skóre PIRADS a dle hodnot PSAD, jak samostatně, tak v kombinaci obou parametrů.
Cílem bylo najít optimální mezní hodnotu PSAD v kombinaci s PIRADS skórem, potřebné k maximalizaci ušetřených biopsií a minimalizaci počtu nezachycených signifikantních karcinomů prostaty. Analýza byla provedena pro hodnoty PSAD v rozmezí 0,1–0,5 ng/ml2.
Klinicky nesignifikantní karcinom byl definován následujícími parametry: Gleason skóre 6 a < 3 pozitivní vzorky a < 50 % karcinomu v bioptickém vzorku (12).
Studie byla schválena lokální etickou komisí a každý subjekt podepsal informovaný souhlas.
Statická analýza byla provedena pomocí statistického software „R“ verze 3. 4. 3. Kontinuální proměnné jsou uváděny v průměrných hodnotách se standardní odchylkou, kategoriální proměnné jsou uváděny jako proporce v procentech. K analýze vstupních dat byl použit Dvojstranný párový ttest a ANOVA test. Všechny testy byly provedeny s hranicí signifikace α = 0,05.
VÝSLEDKY
Průměrný věk a medián pacientů ve skupině PB byl 61,37 respektive 62,0 let, průměrné PSA a medián byl 6,67 respektive 5,40 ng/ml, průměrný objem prostaty a medián byl 55,53 respektive 51,0 ml. Průměrný věk a medián pacientů ve skupině s RB byl 64,40 respektive 65 let, průměrné PSA a medián byl 10,88 respktive 8,31 ng/ml, průměrný objem prostaty a medián byl 68,30 resepektive 63,0 ml. Průměrný počet předchozích biopsií byl 2,21.
Další charakteristika podskupin je uvedena v tabulce 1.
1. Charakteristika pacientů ve skupinách o primobiopsii a rebiopsii
Tab. 1. Clinical characteristics of the first biopsy and rebiopsy groups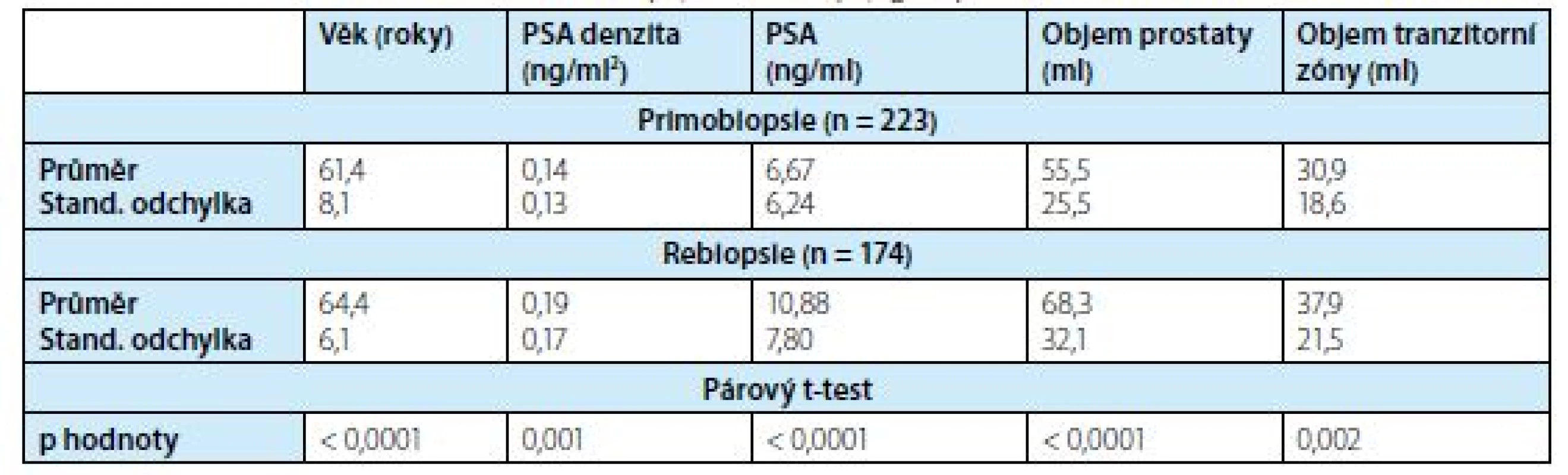
S ohledem na statisticky významný rozdíl mezi PB a RB u všech proměnných (párový t test, p < 0,001) bylo vyhodnocení provedeno pro tyto skupiny zvlášť.
Frekvence záchytu karcinomu prostaty stratifikovaná podle výsledku MRI (PIRADS skóre) jsou shrnuty v tabulce 2. Při výskytu více ložisek u jednoho pacienta bylo k vyhodnocení v tabulce použito dominantní ložisko s nejvyšším PIRADS skórem.
2. Detekce karcinomu prostaty podle PIRADS skóre ve skupině primobiopsií a rebiopsií
Tab. 2. Detection of prostate cancer according to PIRADS score in the first biopsy and rebiopsy groups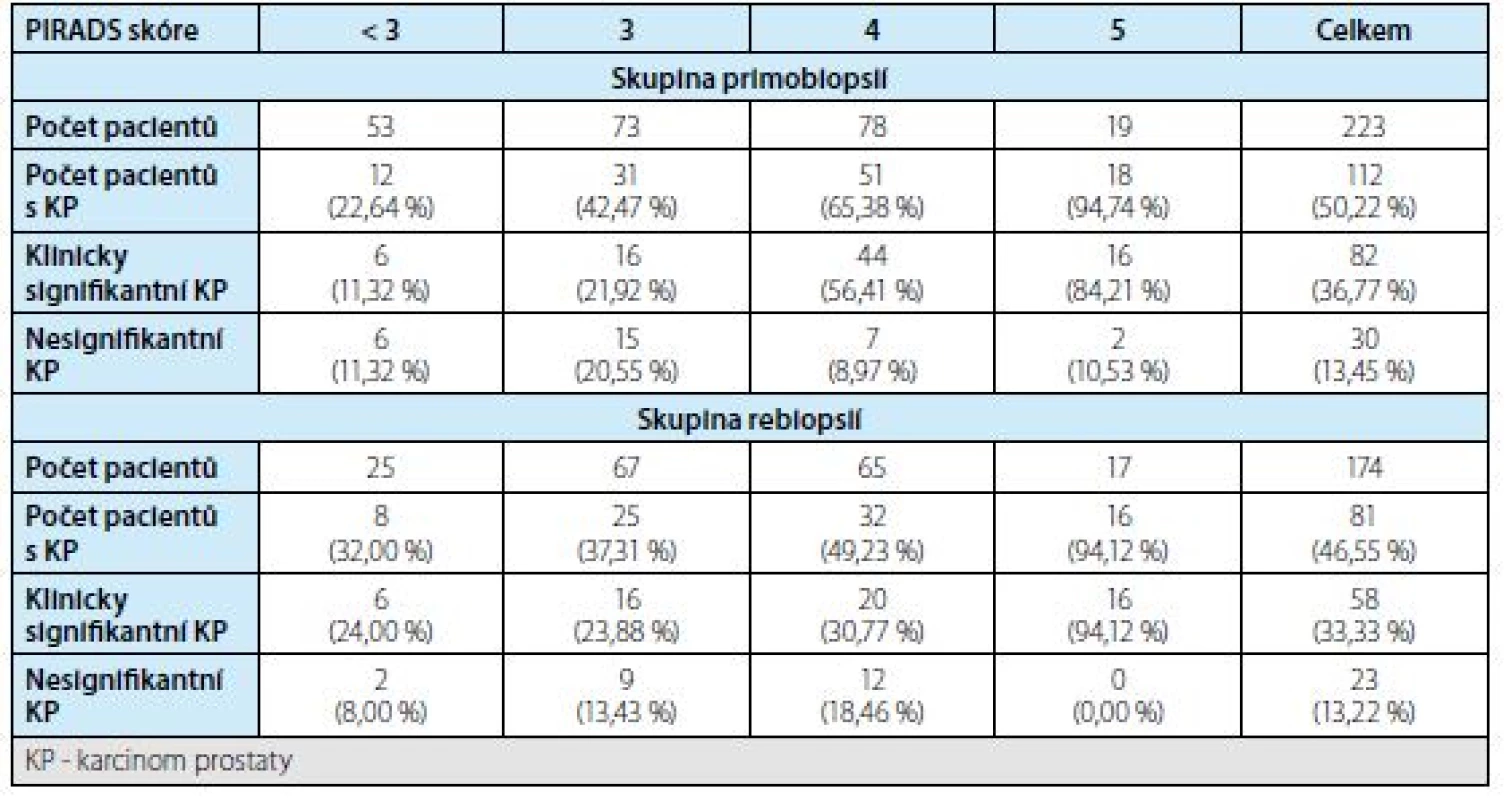
Hodnoty PIRADS skóre a PSAD jako kritéria k neprovedení biopsie prostaty.
Počet potenciálně neprovedených (nadbytečných) biopsií prostaty a počet nediagnostikovaných signifikantních karcinomů prostaty v závislosti na PSAD u pacientů s MRI nálezem PIRADS skóre < 3 a PIRADS 3 ve skupině primobiopsií a rebiopsií je zobrazeno v grafech 1–4.
1. Graf závislosti ušetřených biopsií a nediagnostikovaných signifikantních KP na PSA denzitě ve skupině pacientů bez předchozí biopsie s negativní MRI (PIRADS < 3)
Fig. 1. Lesions with a PIRADS score < 3 in the first biopsy group. The percentage of biopsies that would be avoided and the percentage of clinically significant cancers that would be missed as a function of PSA density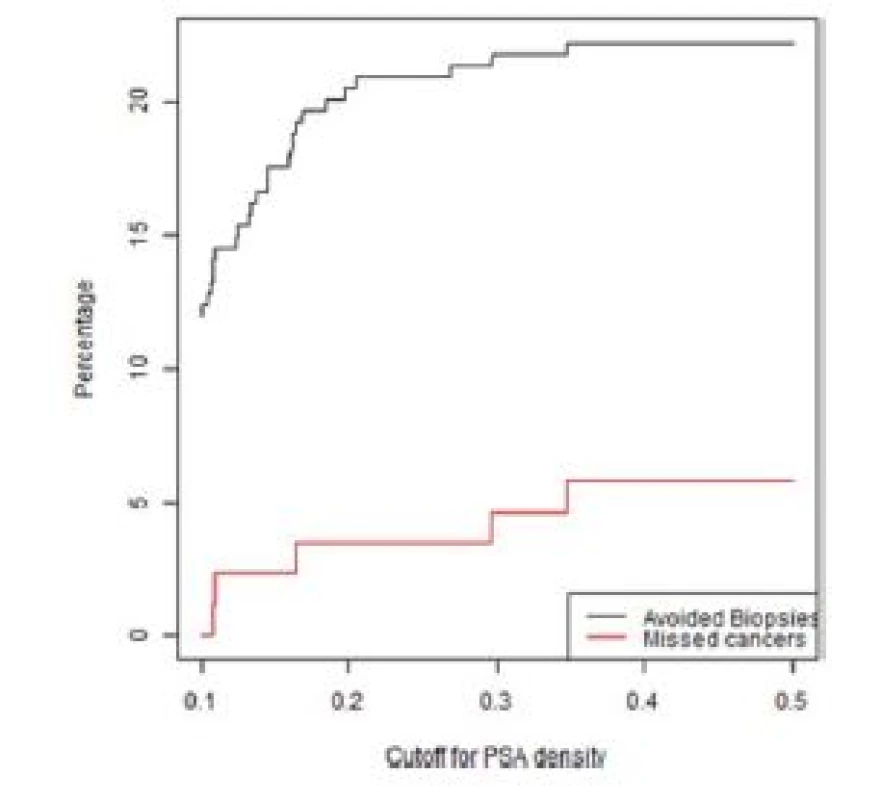
2. Graf závislosti ušetřených biopsií a nediagnostikovaných signifikantních KP na PSA denzitě ve skupině rebiopsií u pacientů s negativní MRI (PIRADS < 3)
Fig. 2. Lesions with a PIRADS score < 3 in the repeat biopsy group. The percentage of biopsies that would be avoided and the percentage of clinically significant cancers that would be missed as a function of PSA density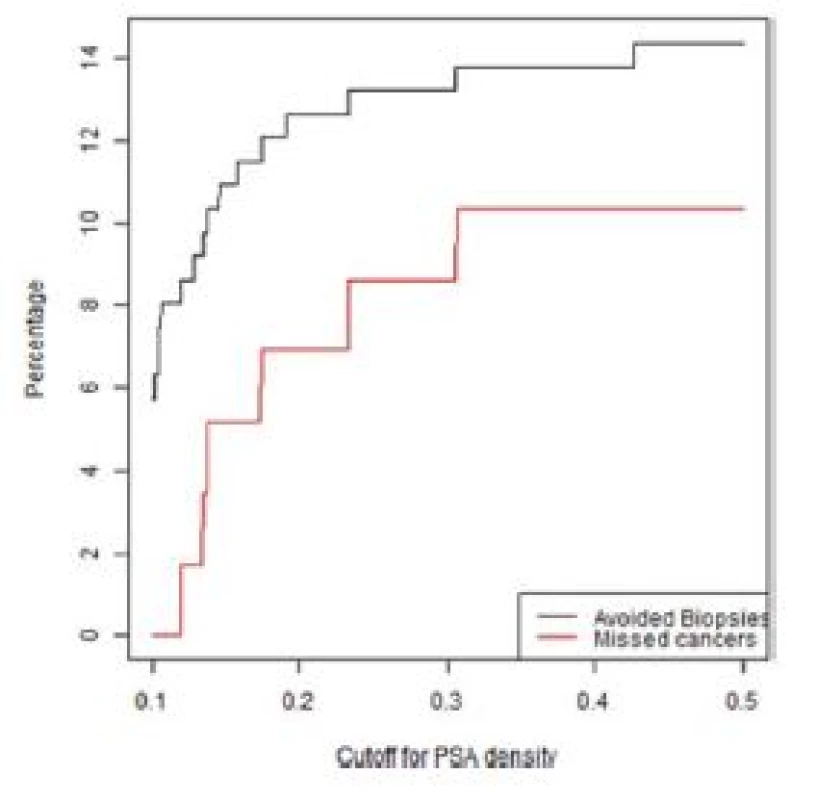
3. Graf závislosti ušetřených biopsií a nediagnostikovaných signifikantních KP na PSA denzitě ve skupině pacientů bez předchozí biopsie s nálezem PIRADS 3
Fig. 3. Lesions with a PIRADS score of 3 in the first biopsy group. The percentage of biopsies that would be avoided and the percentage of clinically significant cancers that would be missed as a function of PSA density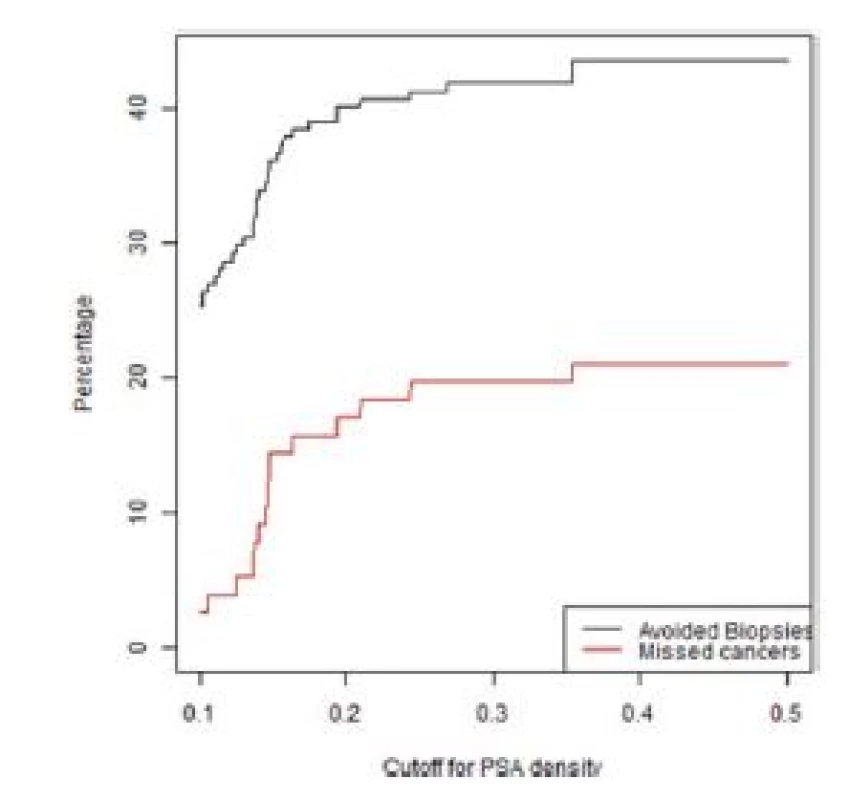
4. Graf závislosti ušetřených biopsií a nediagnostikovaných signifikantních KP na PSA denzitě ve skupině rebiopsií u pacientů s nálezem PIRADS 3
Fig. 4. Lesions with a PIRADS score of 3 in the repeat biopsy group.The percentage of biopsies that would be avoided and the percentage of clinically significant cancers that would be missed as a function of PSA density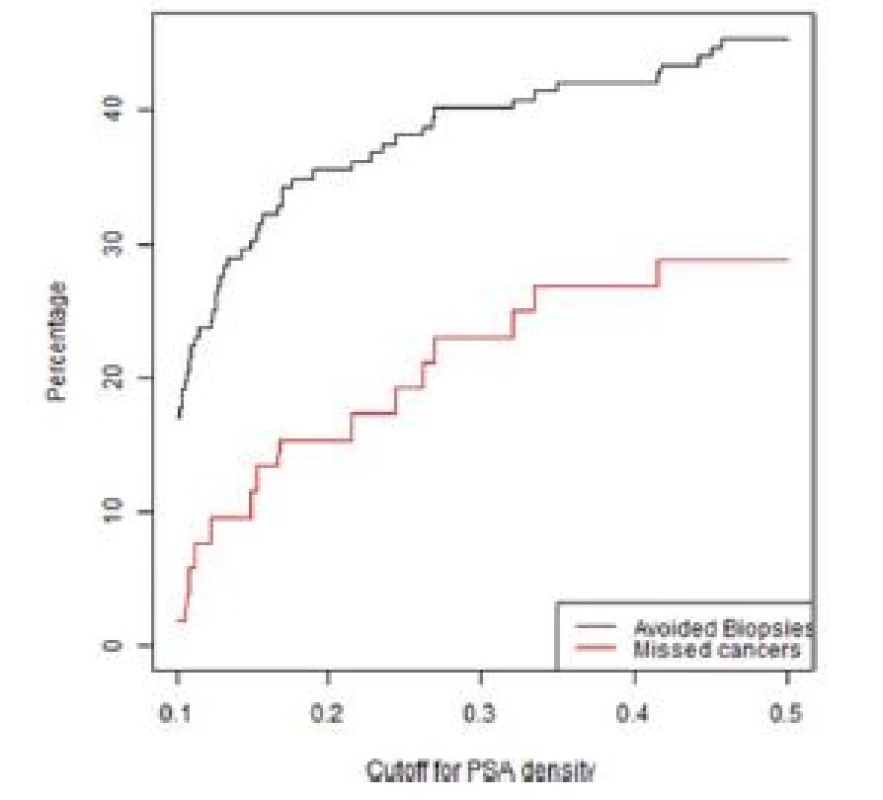
V tabulce 3 jsou sumarizovány výsledky počtu ušetřených biopsií a počet nediagnostikovaných karcinomů v závislosti na použitých kritériích k neprovedení biopsie prostaty
3. Počet ušetřených biopsií a počet nediagnostikovaných karcinomů v závislosti na použitých kritériích k neprovedení biopsie prostaty
Tab. 3. Avoided biopsies and missed cancers using the indicated criteria to decide not to perform a prostate biopsy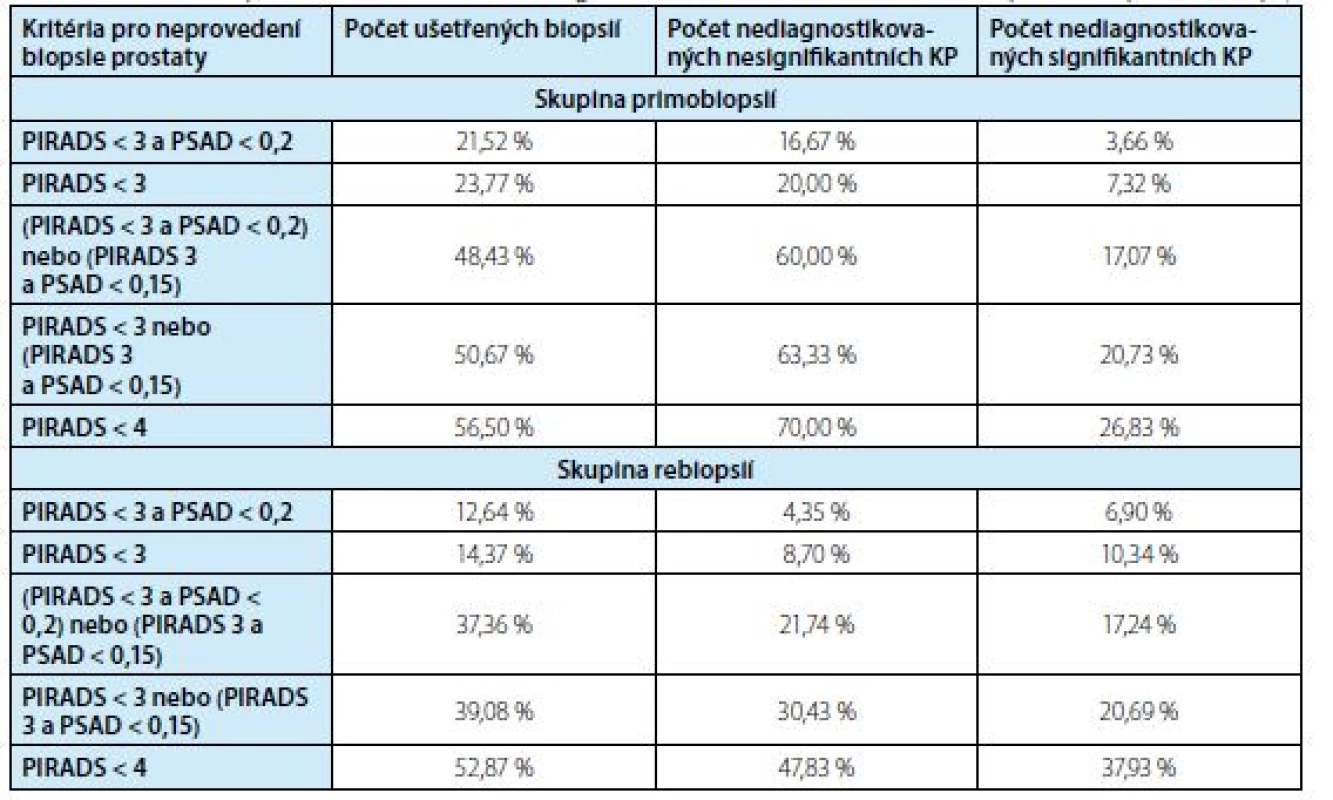
Z hlediska absence záchytu signifikantního karcinomu se jako nejbezpečnější kritéria k neprovedení biopsie prostaty jeví PIRADS < 3 a PSAD < 0,2 ng/ ml2. Při jejich současném užití je možné neprovést 21,5 % (48/223) biopsií, což vede k nediagnostikování 16,7 % (5/30) klinicky nesignifikantních KP a 3,7 % (3/82) signifikantních karcinomů ve skupině primobiopsií.
Ve skupině rebiopsií je možné neprovést 12,6 % (22/174) biopsií, což vede k nediagnostikování 4,4 % (1/23) klinicky nesignifikantních KP a 6,9 % (4/58) signifikantních karcinomů.
DISKUZE
Užití magnetické rezonance jako triage testu před biopsií prostaty je stále častěji zmiňovanou variantou v detekci karcinomu prostaty, tak aby došlo ke snížení počtu nadbytečných biopsií při zachování bezpečnosti záchytu zejména signifikantního karcinomu prostaty (6, 13).
Dle kvality provedení a popisu MRI se odvíjí výsledky celého diagnostického algoritmu karcinomu prostaty. Vzhledem výrazným interindividuálním rozdílům ve výsledcích MRI, ale i rozdílným výsledkům MRI mezi jednotlivými pracovišti, je třeba pečlivě validovat vlastní výsledky. V poslední době lze zaznamenat trend zařazení dalších kritérií, jako např. PSA denzity, do tohoto algoritmu za účelem snížení počtu nadbytečných biopsií (14, 15).
Diseler et al. (16) v souboru 1 040 pacientů zjistili negativní prediktivní hodnotu záchytu signifikantního karcinomu 79 % při užití kritéria PIRADS < 3. Pokud zároveň použili kritérium PSAD < 0,15 ng/ml2 , negativní prediktivní hodnota stoupla na 89 %. Ve skupině rebiopsií byl vzestup negativní prediktivní hodnoty při užití stejných kritérií z 83 % na 93 %. Při této strategii by v jejich souboru mohlo být ušetřeno cca 20 % biopsií. To odpovídá výsledkům našeho souboru, kde lze bezpečně ušetřit nejméně 21 % primobiopsií.
Washino et al. (17) ve svém souboru pacientů nezachytili žádný signifikantní karcinom, pokud použili kritéria PIRADS < 3 a PSAD < 0,15 ng/ml2. Dále zjistili, že jak PIRADS skóre, tak PSAD byly nezávislými prediktory záchytu klinicky signifikantního karci‑nomu prostaty. Při kombinaci parametrů PIRADS ≥ 4 a PSAD ≥ 0,15 ng/ml2 nebo PIRADS 3 a PSAD ≥ 0,30 ng/ml2 dosáhli ve skupině primobiopsií frekvenci detekce signifikantního karcinomu 76–97 %.
Hansen et al. (18) uvádějí nízký záchyt signifikantních karcinomů při užití hranice PSAD 0,2 ng/ml2 a to u pacientů s jak negativní MRI, tak u pacientů s nálezem PIRADS 3. Proto navrhují u těchto pacientů sledování namísto biopsie. Naopak u pacientů s vy‑sokým PSAD navrhují biopsii i při negativním MRI, stejně jako u pacientů s pozitivním nálezem MRI i přes nízkou PSAD.
Z grafů 1–4 a tabulky 3 je patrné, že s různým nastavením kritérií pro indikaci biopsie prostaty se mění počet ušetřených biopsií, ale také nediagnostikovaných signifikantních karcinomů prostaty. Dochází zde k výměnnému obchodu, kde za cenu snížení počtu biopsií platíme zvýšeným počtem nediagnostikovaných signifikantních karcinomů.
Pokud chceme zajistit maximální bezpečnost diagnostického algoritmu při snížení počtu biopsií, pak na základě analýzy našeho souboru je možné použít kritérium uvedené na prvním řádku tabulky 3, tedy PIRADS < 3 a PSAD < 0,2 ng/ml.
Ve skupině primobiopsií užitím těchto kritérií můžeme ušetřit 21 % biopsií při přijatelné absenci záchytu 4 % signifikantních karcinomů prostaty.
Užití jiných kritérií uváděných v literatuře (např. PIRADS 3 a PSAD <0,15) (17, 19, 20) by v našem souboru vedlo ke snížení počtu biopsií o 50 %, ale zároveň k nediagnostikování 21 % signifikantních karcinomů prostaty. V současnosti na základě předložených dat v případě primobiopsie u nálezu PIRADS 3 doporu‑čujeme pacienta odeslat ke kombinované cílení fúzní a systematické biopsii.
Lze předpokládat, že rozdílné výsledky se odvíjí především od kvality provedení a popisu mpMRI. Kvalita mpMRI závisí na vybavení (typ stroje, síla magnetického pole, síla gradient magnetického pole, použití typu snímací cívky, typu softwaru a hardwaru a výběru parametrů jednotlivých sekvencí), na faktorech závislých na vlastnostech pacienta (medikace, habitus, arteficiální pohyby během vyšetření, metalické implantáty, přítomnost plynu v rektu) a zejména na radiologické interpretaci získaných obrazů („learning curve“ efekt, subjektivita pozorování, interpersonální variabilita atd.) (8).
Zejména kvůli heterogenitě těchto faktorů, ale i heterogenitám při provedení cílené fúzní MRI/ TRUS biopsie je potřeba k extrapolaci jednotlivých publikovaných výsledků do vlastní klinické praxe přistoupit s opatrností (8, 21, 22).
Na základě porovnání výsledků naší studie s dalšími publikovanými výsledky se domníváme, že namísto přijetí externích parametrů, které mohou být ovlivněny jiným nastavením celého diagnostického procesu, může být vhodnější vyhodnocení vlastních výsledků MRI, které pak pomůže stanovit bezpečná kritéria k neprovedení biopsie prostaty.
Naše studie má některá omezení, které je třeba vzít v potaz v případě extrapolace výsledků na jiné soubory pacientů. Hlavním omezením je užití PIRADS verze 1. Studie je prospektivní a v době designování studie nebyl dostupný systém PIRADS v2. Dalším limitem je použití více MRI přístrojů z jiných pracovišť ve skupině rebiopsií, neboť protokol provedení na jednotlivých pracovištích může být rozlišný. Abychom co nejvíce předešli ovlivnění výsledků v této skupině, provedli jsme u každého externího MRI druhé čtení radiologem z našeho pracoviště.
ZÁVĚR
Při vhodném nastavení kritérií lze kombinaci MRI a PSA denzity použít k rozhodnutí o neprovedení biopsie prostaty u pacientů s elevací PSA.
V případě pacientů bez předchozí biopsie lze ušetřit 21 % biopsií při absenci záchytu 4 % signifikantních karcinomů prostaty.
Došlo: 2. 1. 2019
Přijato: 28. 2. 2019
Kontaktní adresa:
MUDr. Miroslav Záleský, Ph.D.
Urologická klinika, 3. LF UK a Thomayerova nemocnice
Vídeňská 800, Praha 4
e-mail: miroslav.zalesky@gmail.com
Střet zájmů: Žádný.
Prohlášení o podpoře: Podpořeno Agenturou pro zdravotnický výzkum MZČR, číslo projektu 15-27047 A.
Sources
1. Mottet N, Bellmunt J, Bolla M, et al. EAU‑ESTRO‑SIOG Guidelines on Prostate Cancer. Part 1: Screening, Diagnosis, and Local Treatment with Curative Intent. Eur Urol. 2017; 71(4): 618–629.
2. Ukimura O, Coleman JA, de la Taille A, et al. Contemporary role of systematic prostate biopsies: indi‑cations, techniques, and implications for patient care. Eur Urol. 2013; 63(2): 214–230.
3. Ryznarová Z, Horák M, Dvořák J, et al. Význam magnetické rezonance v diagnostice karcinomu prostaty a první zkušenosti s využitím MR spektroskopie. Ces Radiol 2009; 63(1): 80–88.
4. Stejskal J, Jašková V, Pavličko A, et al. Diagnostika karcinomu prostaty pomocí fúzní biopsie. Ces Urol 2018; 22(2): 87–98.
5. Kudláčková Š, Záťura F, Tüdös Z. Cílená biopsie prostaty pomocí magnetické rezonance – 1. část. Urol. praxi 2017; 18(2): 69–72.
6. Ahmed HU, El‑Shater Bosaily A, Brown LC, et al. Diagnostic accuracy of multi‑parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet. 2017; 389(10071): 815–822.
7. Benson MC, Whang IS, Pantuck A, et al. Prostate specific antigen density: a means of distinguishing benign prostatic hypertrophy and prostate cancer. J Urol. 1992; 147(3 Pt 2): 815–816.
8. Padhani AR, Weinreb J, Rosenkrantz AB, et al. Prostate Imaging‑Reporting and Data System Steering Committee: PI‑RADS v2 Status Update and Future Directions. Eur Urol. 2019; 75(3): 385–396.
9. Venderink W, van Luijtelaar A, Bomers JG, et al. Results of Targeted Biopsy in Men with Magnetic Resonance Imaging Lesions Classified Equivocal, Likely or Highly Likely to Be Clinically Significant Prostate Cancer. Eur Urol. 2018; 73(3): 353–360.
10. Barentsz JO, Richenberg J, Clements R, et al. ESUR prostate MR guidelines 2012. Eur Radiol. 2012; 22(4): 746–757.
11. Jelidi A, Ohana M, Labani A, et al. Prostate cancer diagnosis: Efficacy of a simple electromagnetic MRI‑TRUS fusion method to target biopsies. Eur J Radiol. 2017; 86 : 127–134.
12. Epstein JI, Walsh PC, Carmichael M, Brendler CB. Pathologic and clinical findings to predict tumor extent of nonpalpable (stage T1c) prostate cancer. JAMA 1994; 271(5): 368–374.
13. Simmons LAM, Kanthabalan A, Arya M, et al. The PICTURE study: diagnostic accuracy of multiparametric MRI in men requiring a repeat prostate biopsy. Br J Cancer 2017; 116(9): 1159–1165. 14. Kotb AF, Spaner S, Crump T, Hyndman ME. The role of mpMRI and PSA density in patients with an initial negative prostatic biopsy. World J Urol. 2018; 36(12): 2021–2025.
15. Schoots IG. MRI in early prostate cancer detection: how to manage indeterminate or equivocal PI‑RADS 3 lesions? Transl Androl Urol. 2018; 7(1): 70–82.
16. Distler FA, Radtke JP, Bonekamp D, et al. The Value of PSA Density in Combination with PI‑RADS for the Accuracy of Prostate Cancer Prediction. J Urol. 2017; 198(3): 575–582.
17. Washino S, Okochi T, Saito K, et al. Combination of prostate imaging reporting and data system (PI ‑RADS) score and prostate‑specific antigen (PSA) density predicts biopsy outcome in prostate biopsy naive patients. BJU Int. 2017; 119(2): 225–233.
18. Hansen NL, Barrett T, Koo B, et al. The influence of prostate‑specific antigen density on positive and negative predictive values of multiparametric magnetic resonance imaging to detect Gleason score 7-10 prostate cancer in a repeat biopsy setting. BJU Int. 2017; 119(5): 724–730.
19. Brizmohun Appayya M, Adshead J, Ahmed HU, et al. National implementation of multi‑parametric magnetic resonance imaging for prostate cancer detection – recommendations from a UK consensus meeting. BJU Int. 2018; 122(1): 13–25.
20. Alberts AR, Roobol MJ, Drost FH, et al. Risk‑stratification based on magnetic resonance imaging and prostate‑specific antigen density may reduce unnecessary follow‑up biopsy procedures in men on active surveillance for low‑risk prostate cancer. BJU Int. 2017; 120(4): 511–519.
21. Esses SJ, Taneja SS, Rosenkrantz AB. Imaging Facilities‘ Adherence to PI‑RADS v2 Minimum Technical Standards for the Performance of Prostate MRI. Acad Radiol. 2018; 25(2): 188–195.
22. Sonn GA, Fan RE, Ghanouni P, et al. Prostate Magnetic Resonance Imaging Interpretation Varies Substantially Across Radiologists. Eur Urol Focus. 2017; S2405–4569(17): 30266–30273
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology
2019 Issue 1-
All articles in this issue
- Laparoscopic radical cystectomy with open ureteroileostomy
- Robotic - assisted radical cystectomy in a woman
- Diagnosis, therapy and urological complications of cloacal malformations
- A urologists view of hematuria in pediatric patients
- Correlation of expression of Ki-67, MCM2, MCM5 and p53 in tissue specimens and cell blocks in patients with urothelial carcinoma
- Use of PSA density and multiparametric MRI for indication of prostate biopsy
- Endometriosis of the bladder as a cause of iatrogenic bladder perforation
- Bilateral laparoscopic adrenalectomy for metachronous adrenal metastases of renal cell carcinoma
- Self‑mutilation of the urogenital tract – is the solution limited to urologists?
- A condom as a bizarre foreign body in the urinary bladder in a 19-year-old man
- Diagnosis and laparoscopic suture of an extraperitoneal rupture of the urinary bladder
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endometriosis of the bladder as a cause of iatrogenic bladder perforation
- Use of PSA density and multiparametric MRI for indication of prostate biopsy
- A urologists view of hematuria in pediatric patients
- Diagnosis, therapy and urological complications of cloacal malformations
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

