-
Medical journals
- Career
MIKČNÍ POTÍŽE U PACIENTŮ S ROZTROUŠENOU SKLERÓZOU. JSME V ALGORITMU PÉČE O PACIENTA S ROZTROUŠENOU SKLERÓZOU JAKO UROLOGOVÉ DŮLEŽITÍ?
Authors: Zuzana Vaľová; Libor Zámečník; Roman Sobotka; Yvona Pichlíková; Květoslav Novák; Tomáš Hanuš
Authors‘ workplace: Urologická klinika VFN a 1. LF UK, Praha
Published in: Ces Urol 2016; 20(4): 259-274
Category: Review article
Overview
Hlavní stanovisko práce:
Článek shrnuje základní informace o urologických komplikacích roztroušené sklerózy, diagnostiku a léčbu urologických symptomů tohoto onemocnění.
Roztroušená skleróza (RS) je závažné autoimunitní onemocnění centrálního nervového systému (CNS). U neléčených pacientů dochází k invalidizaci se závažným socioekonomickým dopadem a zhoršením kvality života. Fyziologické prostředí CNS je narušováno dvěma procesy – vznikem fokálních demyelinizačních plak a difuzním postižením CNS.
Z urologického hlediska je důležitým faktem, že téměř u všech pacientů s RS dochází časem k postižení struktur podílejících se na inervaci dolních cest močových, což odpovídá tomu, že mikční potíže patří mezi časté symptomy RS.
Cílem této práce je shrnout dosavadní informace z urologického hlediska v pohledu na pacienta s RS a zamyslet se nad výsledným algoritmem specializované péče se zaměřením na neinvazivní a miniinvazivní možnosti.Klíčová slova:
Mikční dysfunkce, postmikční reziduum, roztroušená skleróza, urodynamika.EPIDEMIOLOGIE
Roztroušená skleróza je závažné autoimunitní a neurodegenerativní onemocnění centrálního nervového systému. Je nejčastější příčinou neurologické invalidity mladých dospělých pacientů. V etiologii hraje svou roli i genetická dispozice, expozice k neznámému patogenu v prostředí, která vede k rozvoji imunitní reakce proti nervovým strukturám (léze axonů, myelinu, neuronů a oligodendroglie).
Věkový průměr při diagnóze je 31,7 roku, 10 % nemocných je diagnostikovaných před 20. rokem a pouze 5 % po 50. roce života. Častěji jsou postiženy ženy, které tvoří 70 % nemocných. Prevalence RS v ČR v letech 2008–2009 byla 160/100 000 obyvatel. Celkem je v celé republice v současné době 17–19 000 pacientů s tímto onemocněním (1).
PŘÍZNAKY
Klinická symptomatologie koreluje s místem probíhajícího zánětu v CNS. Typicky se jedná o poruchy senzitivní, poruchy vizu (optická neuritida), motoriky (postižení pyramidové dráhy), poruchy funkce mozkového kmene a vestibulocerebelární poruchy, v neposlední řadě také mikční a sexuální dysfunkce. Kvantifikace postižení nervového systému odráží tzv. Kurtzkeho škála, známá jako EDSS „expanded disability status scale“ (2).
Image 1. Kurtzkeho škála převzato z www.msdecisions.org.uk (3) Fig. 1. Kurtzke Expanded Disability Status Scale (EDSS), from www.msdecisions.uk (3) 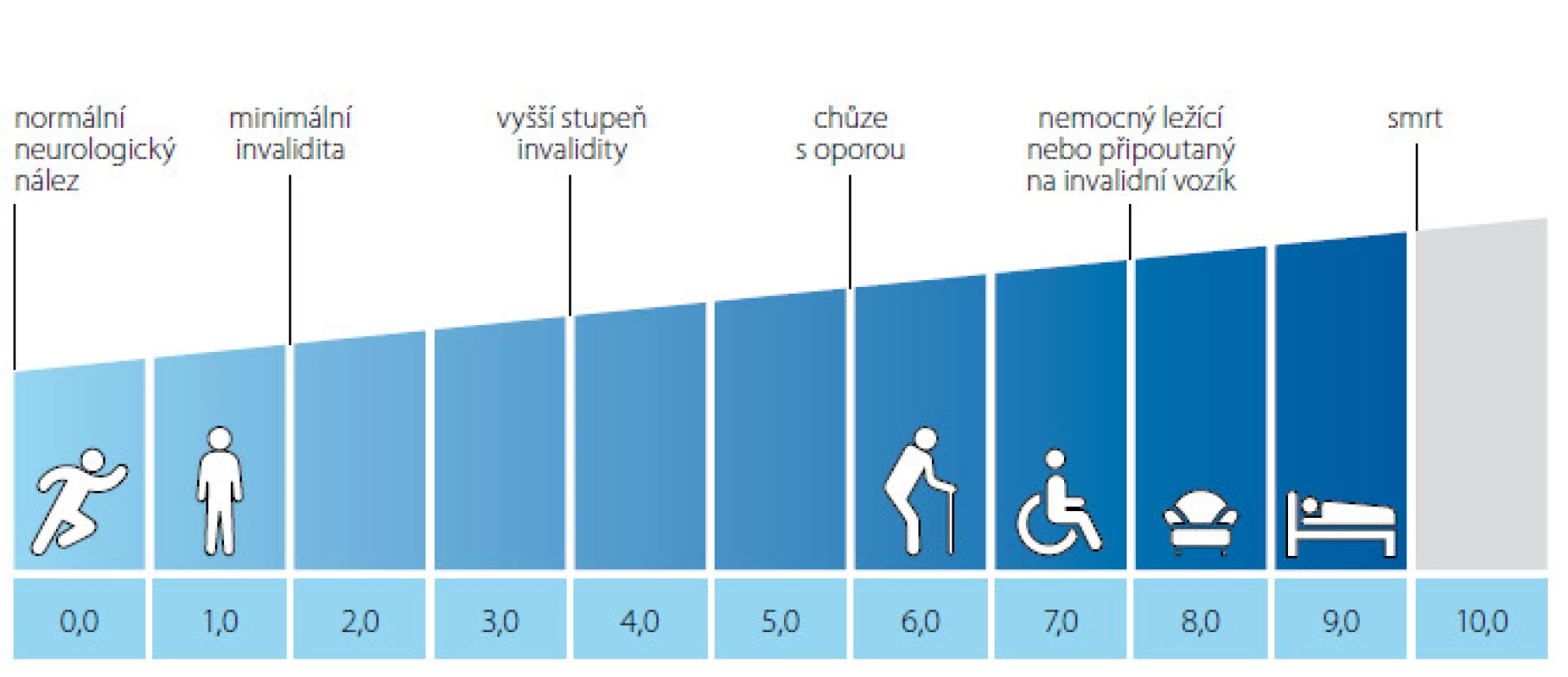
Klinický průběh onemocnění je variabilní od akutního zhoršení neurologických příznaků (relaps, exacerbace, ataka), až k postupným progresivním zhoršováním neurologických funkcí, eventálně jejich kombinacím. Diagnostická kritéria RS definoval a doporučil v roce 2001 McDoland a revidoval Polman (4).
Začátek onemocnění se u 80–85 % pacientů projeví jako klinicky izolovaný syndrom (s náhlým výskytem neurologické symptomatiky), následuje různě dlouhé období rozvoje dalších příznaků a vývoj klinicky definitivní diagnózy RS. Relapsing-remiting RS je nejčastější typ onemocnění a postihuje až 80 % pacientů. Deset až patnáct procent nemocných má nepřetržité zhoršování symptomů a invalidity, aniž by byli postiženi remitentní a relabující formou, jedná se o primárně progresivní RS, dalšími formami jsou sekundárně progresivní a progresivní relabující RS. Mechanizmus imunopatogeneze je zde nejasný (5).
UROLOGICKÁ SYMPTOMATOLOGIE U PACIENTŮ S RS
Z urologického hlediska je důležitý fakt, že u pacientů s RS jsou až ve 35–97 % postiženy struktury podílející se na inervaci dolních cest močových, to vysvětluje skutečnost, že mikční potíže patří mezi hlavní symptomy RS (6).
EAU guidelines uvádějí, že u pacientů postižených RS se časem vyvinou mikční obtíže, na začátku onemocnění v 10 %, u 80 % při onemocnění trvajícím více než 10 let. Mikční obtíže jako první příznaky samotného onemocnění se vyskytují pouze u 2–3 % nemocných.
Proto u každého mladšího pacienta s dysfunkcí dolních cest močových (DCM) v urologické ambulanci bychom měli být pozorní a pečlivě provést neurourologické vyšetření (7, 8). Častou chybou pacientů, ale i lékařů, je bagatelizace těchto potíží.
V závislosti na postižené oblasti CNS autoimunitním zánětem vzniká příslušný neurologický deficit, a proto u každého pacienta mohou příznaky a průběh nemoci probíhat zcela odlišně, včetně urologických symptomů. K nejčastějším jímacím symptomům zhoršujících kvalitu života pacientů s RS patří urgence, polakisurie a/nebo urgentní inkontinence. Nejčastější mikční a postmikční symptomy u pacientů s RS jsou slabší proud moči, pocit neúplného vyprázdnění močového měchýře a retence moči vyskytující se u 34–79 % nemocných.
Stejně jako neurologické symptomy, i urologické se mohou během přirozeného vývoje onemocnění měnit (9). Lze pozorovat změny funkcí dolních močových cest v průběhu onemocnění, přičemž téměř zcela chybí data o přirozeném průběhu urologických dysfunkcí u asymptomatických a mírně symptomatických pacientů, ojedinělé jsou studie posuzující vliv systémové terapie a jednotlivých typů léčby na vývoj dysfunkce dolních močových cest (7).
Nejčastější nálezy u pacientů s RS jsou: detruzorová hyperaktivita, detruzoro-sfinkterická dyssynergie, detruzorová hypokontraktilita.
Klinické symptomy neurogenní detruzorové hyperaktivity jsou polakisurie, urgence až urgentní inkontinence. Objevují se při suprapontinní nebo spinální lézi nad lumbosakrálním segmentem.
Postihuje 50–60 % RS pacientů. Až u poloviny pacientů vznikne přirozeným průběhem onemocnění porucha relaxace zevního sfinkteru uretry během detruzorové kontrakce, a tím rozvoj detruzoro - sfinkterické dyssynergie.
Detruzoro-sfinkterická dyssynergie je charakterizovaná samovolnou kontrakcí zevního svěrače uretry během detruzorové kontrakce. Je zapříčiněná lézí mezi mozkovým kmenem (pontinním mikčním centrem) a sakrálním spinálním mikčním centrem. Tato dyskoordinace mezi detruzorem a zevním sfinkterem nebo hrdlem močového měchýře vede k obstrukci, excesivnímu intravezikální mu tlaku během mikce a vysokému postmikčnímu reziduu. Mikční proud je slabý s nízkou křivkou dle UFM – „tonická dyssynergie“ nebo nepravidelně přerušovaný navíc spazmem perineálních svalů – „klonická dyssynergie“.
Table 1. Prevalence symptomů, urodynamický nález a komplikace u pacientů s RS (10) Table 1. Prevalence of symptoms, urodynamic findings and complications in patients with MS (10) 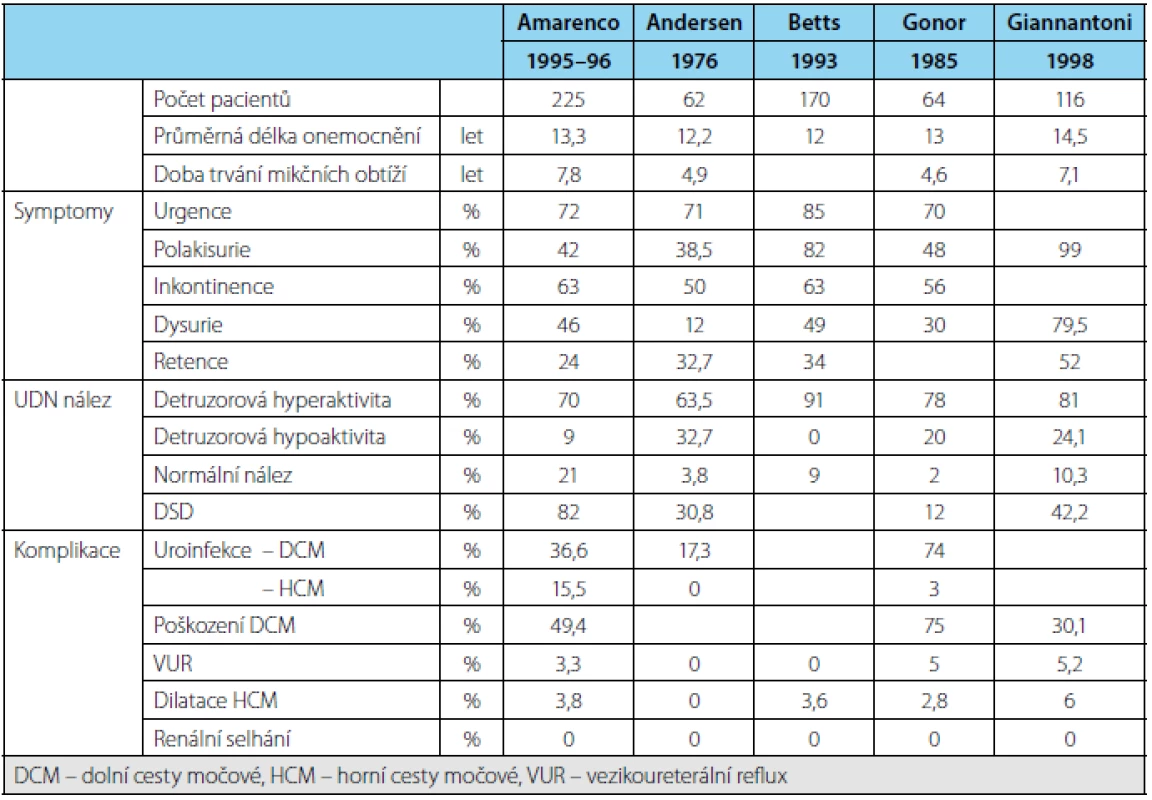
Klinicky má pacient jímací, mikční i postmikční symptomy (11).
Detruzorová hypokontraktilita, k níž dochází na podkladě lézí v sakrální míše, postihuje 20 % nemocných a klinicky se projevuje polakisuriemi, přerušovanou mikcí, slabým proudem, pocitem rezidua a často končí až močovou retencí (12).
Dle EAU guidelines je doporučena Madersbacherova klasifikace neuro-urologických dysfunkcí (obrázek 2). Představuje jednoduché a užitečné dělení z hlediska kontrakce detruzoru močového měchýře a sfinkteru močové trubice během plnící a mikční fáze (8, 13).
Image 2. Madersbacherova klasifikace neurogenní dysfunkce dolních cest močových v závislosti od úrovně léze CNS, převzato z www.uroweb.org (13, 14) Fig. 2. The EAU – Madersbacher classification systém of neurogenic lower urinary tract dysfunction from www.uroweb.org (13, 14) 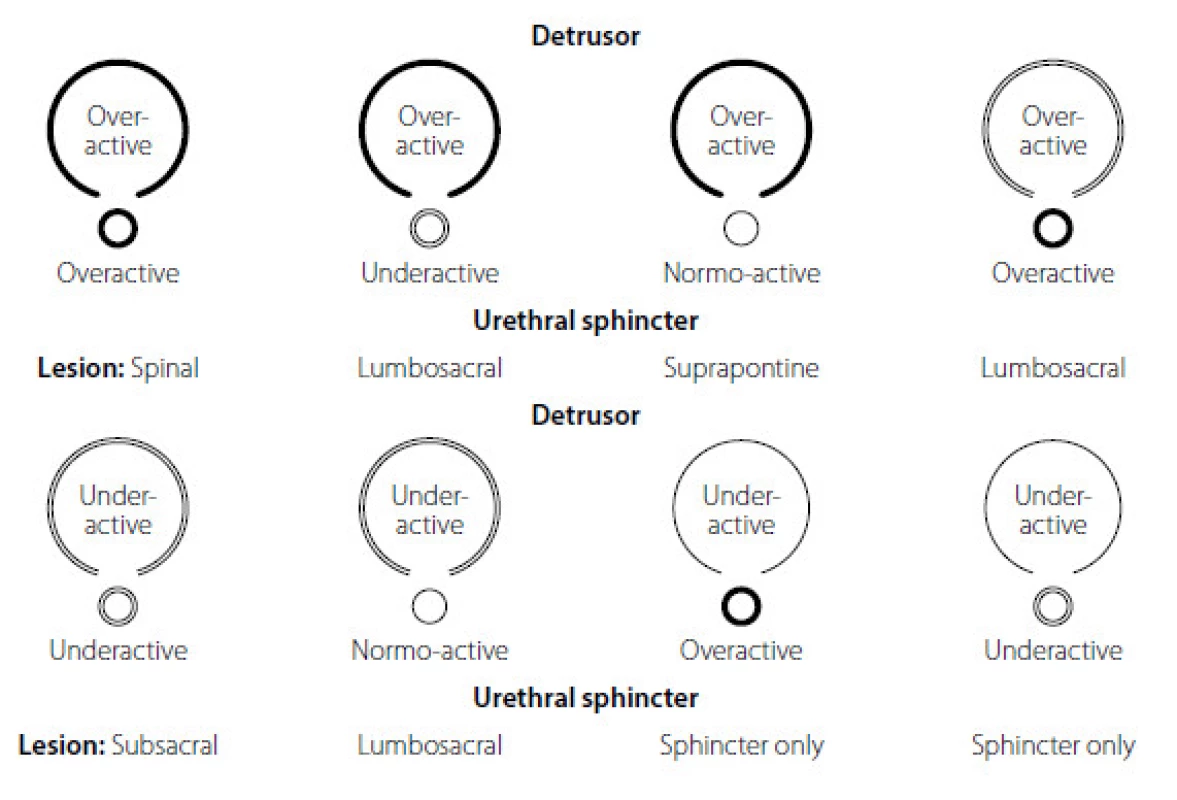
UROLOGICKÉ VYŠETŘENÍ PACIENTA S RS
Základem urologického vyšetření je pečlivá anamnéza, fyzikální, laboratorní a zobrazovací vyšetření. Součástí vstupního vyšetření je i minimální neurologické vyšetření reflexů urogenitální oblasti, tonusu sfinkterů a funkce pánevního dna, které by měl urolog znát (8).
Sonograficky vyšetřujeme celý močový trakt. U roztroušené sklerózy se popisují abnormality horních cest močových přibližně u 12,4 % nemocných (15). Nejčastěji se klinicky jedná o pyelonefritidy (0–25 %), hydronefrózy (0–25 %), VUR (0–15 %) a nefrolitiázu (2–11 %), čeští autoři popisují minimální vliv těchto změn na renální funkce ledvin (16, 17).
Nezbytnou součástí je i vyplnění mikčního deníku. V praxi požadujeme monitoraci údajů o mikci alespoň 48 hodin, u pacientek s inkontinencí je dle EAU guidelines doporučená monitorace tři dny.
Dále je také doporučena monitorace kvality života u pacientů s RS (GR B). Vhodné jsou dotazníky Qualiveen® nebo I-QoL (Incontinence Quality of Life Questionnaire) dotazník při současné inkontinenci (8, 13).
V diagnostice a léčbě neurogenních dysfunkcí DCM je důležité urodynamické vyšetření. Klinické příznaky a urodynamický nález u pacientů s RS nemusí korelovat a i u zcela asymptomatických pacientů můžeme zachytit významné urodynamické (UDN) abnormality. Možnosti UDN vyšetření jsou neinvazivní (uroflowmetrie, měření postmikčního rezidua, elektromyografie pánevního dna) a invazivní (cystometrie, profilometrie, PQ studie a videourodynamika) (18, 19).
EAU guidelines doporučují UDN vyšetření v rámci diagnostické rozvahy u neurogenních poruch dolních cest močových (GR A). Invazivní UDN vyšetření umožňuje přesnější identifikaci neurogenní dysfunkce DCM.
K základním urodynamickým metodám patří plnící cystometrie a PQ studie. Ještě přesnější urodynamické metody jsou v kombinaci s rentgenovým záznamem mikce – tzv. videourodynamika. Primárně je však indikováno videourodynamické vyšetření jen u míšních traumat (GR A) (8).
Někteří autoři naopak zpochybňují nutnost UDN v diagnostice urologických dysfunkcí u RS onemocnění. Vycházejí z toho, že je riziko poškození HCM velmi nízké, a u většiny pacientů lze aplikovat symptomatickou léčbu a není nutné pacienta zatěžovat invazivním urodynamickým a navíc relativně nepříjemným vyšetření (18, 20, 21).
Image 3. A. Znázornění dermatomů a odpovídajících oblastí míšních segmantů L2–S4 Fig. 3A. Dermatomes of spinal cord levels L2–S4 www.uroweb.org (8, 13) Obr 3B. Jednotlivé reflexy dle úrovně míchy, převzato z www.uroweb.org (8, 13) Fig. 3B. Urogenital and other reflexes in lower spinal cord from www.uroweb.org (8, 13) 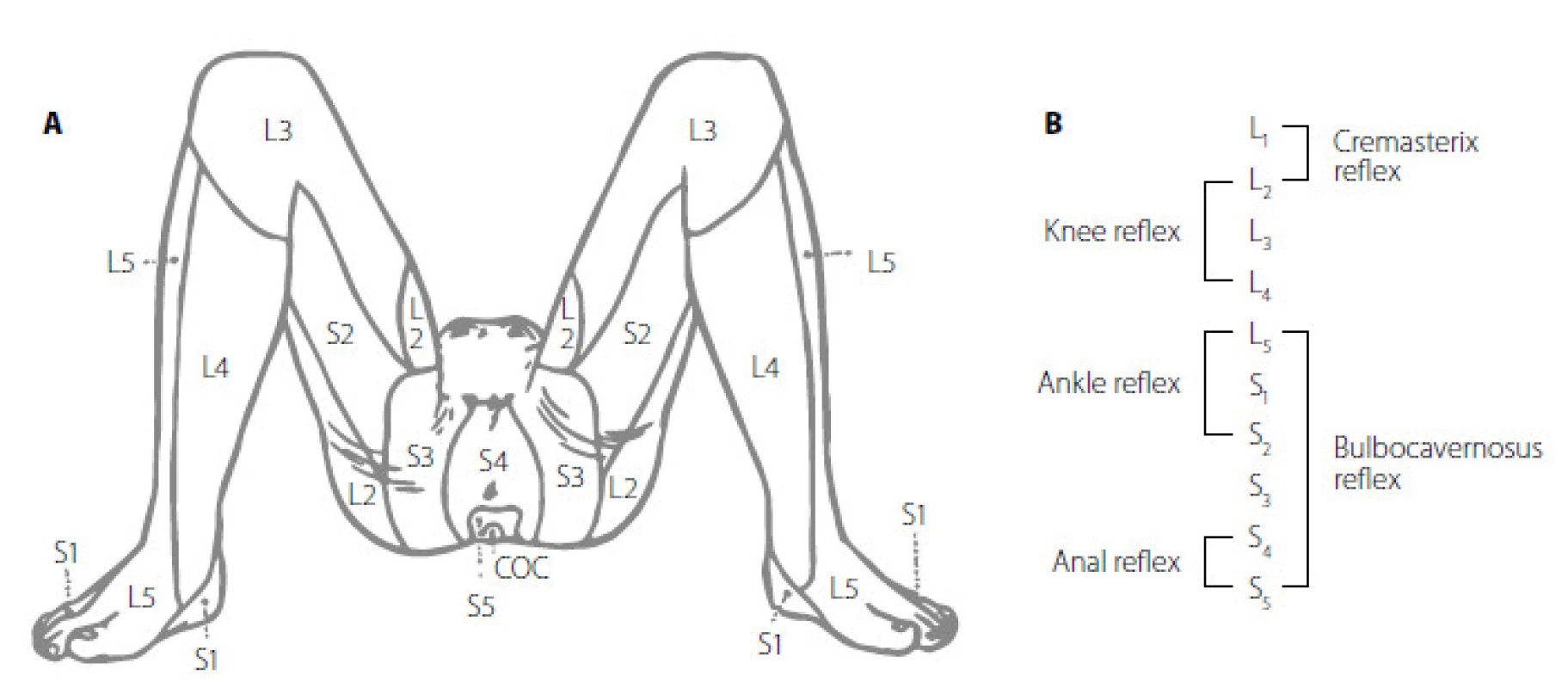
U většiny pacientů s RS a výraznými mikčními obtížemi nalezneme UDN abnormality, které často vzájemně nekorelují. Kombinace neinvazivních či minimálně invazivních terapeutických metod je u většiny nemocných dostačující. Z toho vyplývá, že u nekomplikovaných RS pacientů (například pacientka se stabilním RS onemocněním, s minimálním nebo žádným postmikčním reziduem a urgencemi) můžeme zahájit léčbu, aniž by museli absolvovat invazivní UDN vyšetření (22). Urodynamické vyšetření je indikováno u pacientů s RS nereagujících na konzervativní farmakologickou léčbu nebo u nichž došlo ke zhoršení urologických symptomů (23). Jiné práce upozorňují na skutečnost, že až 75 % pacientů, kteří byli léčeni bez předešlého urodynamického vyšetření, bylo léčeno nesprávně a že se UDN nález časem může měnit (24).
K dispozici je celá řada doporučení – guidelines pro diagnostiku a terapii neurogenních dysfunkcí, přehledná a jednoznačná guidelines na téma LUTS u pacientů s RS však chybí. Není jasně určeno, jak pacienty s RS vyšetřovat a sledovat, kdy má být indikováno první urologické vyšetření.
Zda má být:
- pacient s tímto onemocněním preventivně v péči urologa
- odeslán k urologickému vyšetření neurologem nejpozději při objevení se urologických potíží
- prováděno u každého pacienta s RS urodynamické vyšetření
To, jakým způsobem je zajištěna péče o pacienty s RS, ovlivňuje i zdravotnický systémem specifický pro danou krajinu.
EAU guidelines pro urology doporučují obecné principy managementu péče o pacienty s neurogenní dysfunkcí, nevěnují se však specificky problematice roztroušené sklerózy.
Jednou z možností v rámci diagnostického algoritmu při RS je doporučení dle Fowlerové (schéma 1) (GR D). Jedná se o algoritmus navržený ve Velké Británii, je jednoduchý, časově i materiálně nenáročný. Vyžaduje anamnestické údaje a semiobjektivní hodnoty získané z mikční karty. Klíčovým údajem je zde objem postmikčního rezidua (23). Pacient je odeslán neurologem k urologickému vyšetření v době zjištění LUTS. Urodynamické vyšetření není indikováno rutinně u pacientů s nízkým rizikem renálního poškození (25).
Schéma 1. Algoritmus managementu terapie u pacientů s RS a urologickou symptomatologií; volně dle Fowlerové (23). Scheme 1. An algoritmus of the management of the therapy in MS patients with urinary tract symptoms according to Fowler (23) 
Jiné schéma vyšetření nabízí práce francouzských autorů, to je určeno jak pro neurology, tak urology. Rozlišuje, zda má pacient symptomy močových cest či nikoli. Neurolog provádí minimální urologické vyšetření formou dotazníku na mikční potíže a měří postmikční reziduum. V případě, že je pacient symptomatický nebo má PMR (objemově ale není definováno), je odeslán k neuro-urologickému vyšetření. Jinak je pacient dále sledován neurologem. Neuro-urologické vyšetření obnáší vyplnění PM karty, ultrasonografické vyšetření, kultivační vyšetření moči, urodynamické vyšetření, clearence kreatininu, QoL dotazník. Po zhodnocení rizikových faktorů jsou pacienti bez vyššího rizika každý rok vyšetřeni v tomto rozsahu: třídenní PM karta, UFM a PMR. V opačném případě je navíc provedeno i sonografické vyšetření horních močových cest, clearence kreatininu, QoL dotazník a UDN vyšetření (to při změně stavu pacienta každý rok, jinak s odstupem tří let). Při zhoršení renálních funkcí je pacient dále v péči multidisciplinárního týmu. Při podezření na uroteliální karcinom je doporučeno ročně provádět CSK a cytologii (13).
V České republice v současné době guidelines pro diagnostiku a léčbu urologických obtíží u pacientům s RS k dispozici nemáme.
TERAPIE MIKČNÍCH DYSFUNKCÍ U PACIENTŮ S RS
Hlavním úkolem urologické péče je: udržet intravezikální tlak pod prahem kontinence, tj. tlak musí být nižší než je tzv. „únikový“ tlak (tzv. leak point pressure), zajistit efektivní evakuaci močového měchýře, minimalizovat riziko bakteriální kolonizace, zabránit recidivujícím uroinfekcím a zajistit prevenci poškození horních močových cest.
Obecně platí režimová opatření, tj. zajistit optimální příjem tekutin, minimalizovat abúzus kofeinu a jiných močopudných tekutin. Fyzioterapie zaměřená na rehabilitaci pánevního dna je doporučována pouze u pacientů se středním stupněm postižení (GR B) (23).
Behaviorální terapie
Rehabilitace pánevního dna zavedená Kegelem v roce 1948 je primárně určená k terapii stresové inkontinence. Existuje několik prací, které potvrzují efekt rehabilitace pánevního dna i u pacientů s RS, a to především u pacientů s urgencemi, urgentní inkontinencí a polakisuriemi. Provádění pravidelného cvičení svalů pánevního dna (SPD) u nemocných s RS má vliv na zlepšení symptomů dolních cest močových, signifikantní snížení počtu použitých inkontinenčních vložek na den a nykturií.
Sestavy cviků k provádění rehabilitace SPD jsou různé, nicméně všechny jsou založené na střídání kontrakcí a relaxací příslušné svalové skupiny. Nácvik by měl probíhat pod přímým dohledem specialisty (lékař, rehabilitační asistent). Nácvik je vhodné provést pod perineometrickou kontrolou (biofeedback kontrola) a další cviky již provádí pacient v domácím prostředí po dobu 12 týdnů (26).
Podle výsledků pozorování tato forma terapie nemá signifikantní efekt na parametry, jako je compliance, hyperaktivita detruzoru, maximální průtok, intravezikální tlak ani postmikční reziduum. Některé práce popisují významný nárůst průměrné funkční kapacity měchýře (26, 27).
Rehabilitací pánevního dna lze lépe zvládat urgence a evakuaci měchýře, pacient může oddálit mikci a předejít tím urgentní inkontinenci. Nácvikem správné relaxace SPD lze přispět k managementu léčby při detruzorosfinkterické dyssynergii či sfinkterické hyperaktivitě (26). V případě hyposenzitivního močového měchýře neexistuje farmakologická terapie, která by byla schopná zlepšit vnímání náplně v měchýři. Pacient by měl provádět tzv. „bladder training“ tedy mikci „dle hodinek“. Bez ohledu na to, zda má pocit na močení nebo nikoliv, provádí pacient mikci v pravidelných časových intervalech několikrát denně. Většinou doporučujeme mikci po 2–3 hodinách. Jelikož jsou behaviorální metody jednoduché, bezpečné, neinvazivní, časově a finančně nenáročné, měly by být doporučené všem pacientům s dysfunkcí mikce u RS.
Farmakologická terapie
Cílem farmakologické léčby je úprava symptomů dolních cest močových, zlepšení kontinence, a tím i zlepšení kvality života z dlouhodobého pohledu, ale především ochrana horních močových cest.
Podle doporučeného schématu lze u převážné většiny pacientů stanovit typ dysfunkce a k tomu adekvátní terapii. Tím je komplexní urologická invazivní diagnostika rezervovaná pro ty pacienty, kde je takto nastavená léčba neúspěšná, nebo kde jsou přítomny významné rizikové faktory ohrožující horní močové cesty. Jednou z možností se nabízí i již zmíněný modifikovaný algoritmus dle Fowlerové. Na základě získaných údajů lze stratifikovat pacienty do jednotlivých skupin s následnou symptomatickou terapií (tabulku 2) (18).
Table 2. Symptomy dysfunkce DCM a k tomu doporučená konzervativní terapie Tab. 2. Lower urinary tract symptoms and recommended conservative treatment 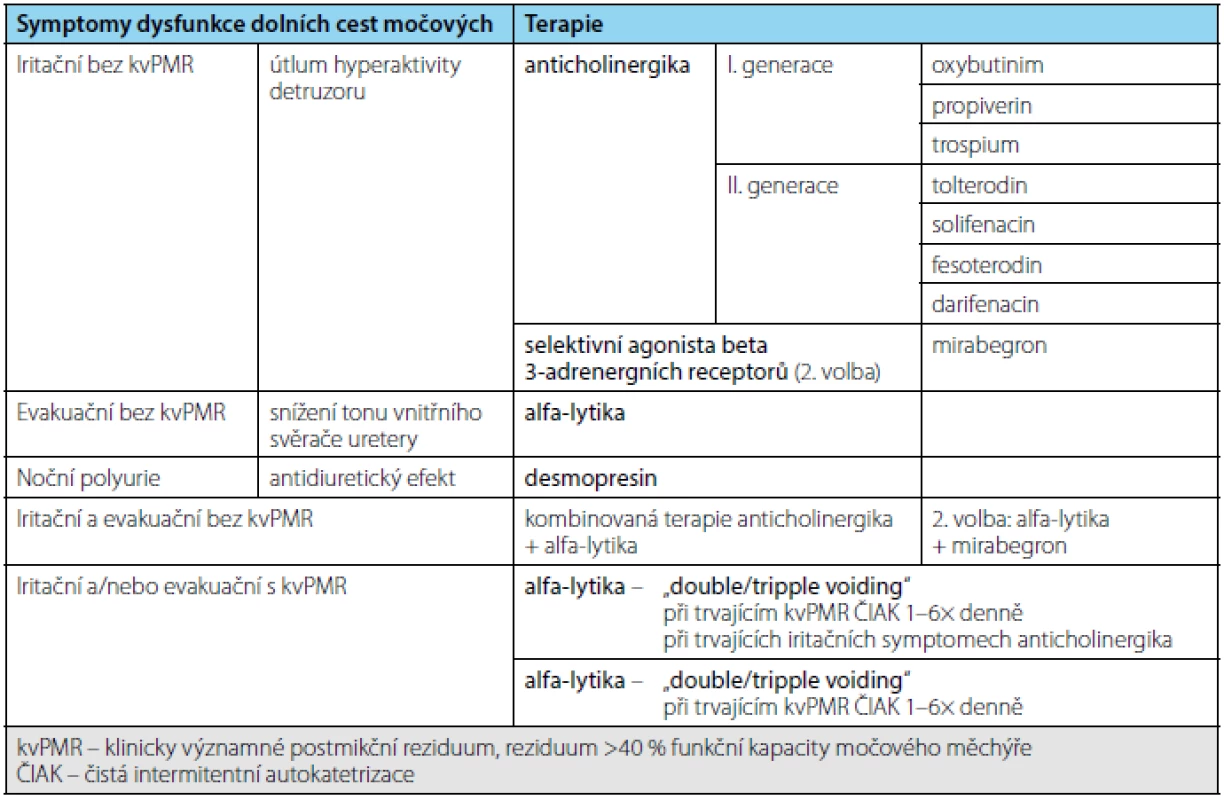
Farmakoterapie je v současné době nejrozšířenější metodou léčby neurogenní hyperaktivity močového měchýře.
U pacientů s RS jsou nejrozšířenější skupinou anticholinergika. Největší podíl na aktivaci detruzoru má stimulace postgangliových parasympatických muskarinových receptorů M3. Klíčovým problémem anticholinergní terapie je relativně nízká selektivita k M3 receptorům detruzoru a jejich efekt i na další muskarinové receptory v jiných orgánech. Výsledkem jsou časté nežádoucí účinky (např. obstipace, sucho v ústech, rozostřené vidění), které jsou i častou příčinou ukončení léčby pacientem. Mezi anticholinergika I. generace patří: oxybutinin, propiverin, trospium, II. generace: tolterodin, solifenacin, fesoterodin, darifenacin (28).
Alfablokátory (alfa-lytika) působí na alfa-receptory v hrdle močového měchýře a prostatické uretře, navíc ovlivňují i svěrač uretry. Výsledkem je příslušná svalová relaxace, a tím snížení odporu ve výtokové části dolních cest močových. U pacientů s RS se zkouší jejich účinnost i u detruzoro-sfinkterické dyssynergie (15, 29).
K symptomatické léčbě projevů hyperaktivity močového měchýře lze užít i nový preparát mirabegron – selektivní agonista beta3-adrenergních receptorů. Stimulace těchto receptorů způsobuje relaxaci hladkého svalstva močového měchýře, zvýšení jeho kapacity a snížení frekvence mikce (8, 30).
Nykturii a noční polyurii lze ovlivnit snížením produkce moči, a to antidiuretickým preparátem – desmopresinem. Je však důležité vyloučit jinou etiologii (kardiální dekompenzace, léčba diuretiky ev. neadekvátní příjem tekutin před spaním). Doporučená dávka je 60 mikrogramů před spaním sublinguálně. Při nedostatečném účinku lze zvýšit na 120 mikrogramů a následně na 240 mikrogramů vždy v týdenních intervalech. Při léčbě je nutné omezovat příjem tekutin na noc a v noci (29).
V literatuře se uvádí i experimentální terapie kanabinoidy. Je známá jejich „domácí“ aplikace u chronických onemocnění a těžko léčitelných příznaků, včetně chronických bolestí.
Při symptomech DCM u RS pacientů se popisuje efekt terapie hlavně u epizod urgentní inkontinence. Udává se zlepšení o 33 % a 38 % při užívání extraktu kanabinoidů a THC ve srovnání s placebem (18 %) – (LE Ib) (31). Farmaceutický preparát v nosním spreji obsahuje dvě potenciálně terapeutické sloučeniny: THC (delta-9-tetrahydrokanabinol) a CBD (kanabidiol). Hlavní efekt THC je analgetický, svalový relaxans, antiemetický, stimuluje chutě, zlepšuje motorické funkce a má psychoaktivní účinek. CBD působí jako antikonvulzivum, svalové relaxans, neuroprotektivum, antioxidant a má antipsychotické účinky. K nežádoucím účinkům patří závrať, únava, průjem, nauzea, poškození vnímání chutí a sucho v ústech. Přípravek je učen k orálnímu podání a je v ČR registrován jako preparát na zlepšení symptomů u dospělých pacientů se středně těžkou a těžkou spastickou formou RS (s nedostatečným efektem léčby ale prvotní příznivou odpovědí na léčbu spasticity). Na českém trhu není tento preparát volně dostupný (32).
Antibiotická terapie a profylaxe uroinfekcí
Symptomatické uroinfekce jsou u RS velmi časté a postihují až 29–36 % pacientů s RS (12). Ve skutečnosti trpí uroinfekcemi větší počet pacientů s RS než je obvykle detekován a léčen.
Vzhledem k neurogennímu postižení dolních cest močových jsou mnohdy klinické příznaky minimální a projevy incipientní uroinfekce tak bagatelizovány. To vede ke vzniku chronické mikroskopické pyurie a asymptomatické či subklinické uroinfekci (33). Popisuje se, že až u 50–60 % nemocných s RS zachytíme bakteriurii již při prvním vyšetření (24).
Dysfunkce dolních cest močových, mikrobiální kolonizace urotraktu a uroinfekce jsou u pacientů s RS časté. Způsobují signifikantní potíže a výrazně přispívají ke zhoršení kvality života. Uroinfekce mohou zhoršit neurologické symptomy a na druhé straně vysoké dávky kortikosteroidní léčby při akutní exacerbaci onemocnění, mohou vést k „odmaskování“ relativně asymptomatické neléčené uroinfekce.
Z důvodu nedokonalé evakuace měchýře, a tím stázy moči nebo častou katetrizací vznikají ideální podmínky pro recidivující uroinfekce, které v případě, že zůstanou neléčené, mohou vést až k systémovým infekcím s rizikem urosepse. Kromě jiného neléčená uroinfekce přispívá ke zvýšenému riziku vniku relapsu onemocnění. K častým příznakům uroinfekce u pacientů s RS patří kalná zapáchající moč, zhoršení inkontinence a urgencí ev. až zhoršení spasticity (Uhtoffův fenomén – zhoršení neurologického deficitu při fyzické zátěži nebo zvýšení tělesné teploty např. při febrilní uroinfekci). Naopak symptomy jako strangurie a dysurie často bývají minimální až žádné (33).
Před zahájením imunosupresivní léčby je důležité vyloučit případnou infekci (34). Kortikosteroidní léčba je při uroinfekci kontraindikována, jelikož svým imunosuprimujícím účinkem může vést k progresi infekce s rizikem urosepse a k celkovému zhoršení dalšího průběhu základního onemocnění (35). Součástí dnešní praxe je před zahájením kortikosteroidní léčby při akutní atace RS vyloučit uroinfekci. Kromě pečlivé anamnézy a fyzikálního vyšetření je součástí vyšetření i analýza moči kvantitativně i kvalitativně. Rychlé a relativně spolehlivé informace nabízí semikvantitativní „dip stick test“. V případě pozitivity nitritů a leukocytové esterázy současně, je specificita 70–87 % a senzitivita 68–88 %. Pokud nejsou přítomny známky jiné akutní systémové nemoci (např. dekompenzace diabetu), je doporučené ihned zahájit empiricky antibiotickou terapii po konzultaci s lokálním antibiotickým střediskem a neoddalovat tak kortikosteroidní léčbu. S odstupem 24–48 hod již máme k dispozici definitivní výsledky kultivace moči se stanovením senzitivity patogenů na antibiotika (33).
EAU guidelines antibiotickou profylaxi u neurogenního močového měchýře nedoporučují. Vzhledem k povaze symptomů dolních cest močových a ke značnému riziku uroinfekce u RS (spojené i s další neurologickou léčbou), se zdá dlouhodobé antibiotické zajištění výhodné pro nižší riziko exacerbace asymptomatických pyurií, tím i zmírnění příznaků dolních cest močových a zlepšení kvality života. Navíc recidivující uroinfekce jsou spojené se zhoršením průběhu onemocnění a tudíž management léčby uroinfekce u pacientů s RS je nezbytně nutný.
Při terapii chronických, zejména kolibacilárních infekcí, lze u pacientů s neurogenní dysfunkcí dolních cest močových (mimo akutní ataku RS) použít i imunomodulační terapii či enzymoterapii.
U pacientů s autoimunitním onemocněním se léčba stimulující imunitní systém všeobecně nedoporučuje. Na druhé straně, pro pacienty s RS onemocněním je recidivující uroinfekce nebo trvalá bakteriurie mnohem závažnější. Léčba imunumodulancii představuje z pohledu imunologů relativně bezpečný kompromis. Jakékoliv podání obdobných preparátů, včetně autovakcíny, by mělo být vždy konzultováno s imunologem dle aktuálního stavu pacienta (15).
Trvalá katetrizace močového měchýře
Dlouhodobá katetrizace permanentním močovým katétrem nebo epicystostomií významně zvyšuje riziko uroinfekce a tím i riziko dalších závažných komplikací. V případě, že je pacient odkázán na permanentní katétr, je vhodnější epicystostomie než uretrální katétr (prevence léze uretry, prodloužení periody k výměně derivace, nižší riziko kolonizace katétru i lepší tolerance pacientem) (23).
Čistá intermitentní (auto)katetrizace (ČIAK) je minimálně invazivní technika a představuje v dnešní době preferovanou metodu volby u pacientů s neurogenní dysfunkcí při nedostatečné evakuaci moči. Vzhledem k významnému benefitu se tak ČIAK stala nepostradatelnou metodou u širokého spektra pacientů s neurogenním postižením močových cest (36). Dle EAU guidelines je průměrná frekvence katetrizace 4–6x denně, s maximálním objemem do 400–500 ml (dle Pdet při cystometrii). Používají se katétry velikosti 12–16 Ch s použitím lubrikačního gelu nebo potažené hydrofilní vrstvou (37).
Dle EAU guidelines se standardně profylaktická antibiotická terapie při autokatetrizaci nedoporučuje. Nicméně u rizikových pacientů s RS má své opodstatnění. I asymptomatická bakteriurie může pro pacienta s RS představovat riziko. U pacientů odkázaných na ČIAK/ČIK je výskyt epizod alespoň jedné symptomatické uroinfekce u 74,8 % až 88 %, přičemž použití hydrofilních katétrů nemá vliv na incidenci asymptomatické bakteriurie, ale snižuje počet epizod symptomatické uroinfekce (38).
V progresivním stadiu onemocnění RS je tendence i ke zhoršení urologických symptomů. Pacienti sami trvají na intenzivní rehabilitaci pánevního dna či zajištění derivace a to cestou pravidelné autokatetrizace eventuálně derivací permanentním močovým katétrem či epicystostomií, což vede k výraznému zlepšení funkce dolních cest močových a zlepšení kvality života (23, 39).
Aplikace botulotoxinu
Pacienti, u nichž selhala primární farmakologická léčba (jedná se především o skupinu pacientů s hyperaktivitou detruzoru a pak také detruzoro-sfinkterickou dyssynergií), jsou indikováni k aplikaci botulinumtoxinu. Jedná se o neurotoxickou látku, produkovanou grampozitivní bakterií Clostridium botulinum, upravenou tak, aby byla mitigována její toxicita. V cílovém orgánu po aplikaci způsobuje dočasnou, ale déletrvající chemickou denervaci presynaptickou blokádou uvolňování acetylcholinu. To vede k paralýze orgánů inervovaných parasympatikem. Délka trvání je přibližně devět měsíců (43).
Cílem léčby je útlum detruzorové hyperaktivity. Na trhu jsou k dispozici dva preparáty: abobotulinumtoxin A (Dysport®) a onabotulinumtoxin A (Botox®). Ekvipotentní poměr mezi jednotkami je 3 : 1.
Pod endoskopickou kontrolou se aplikuje difuzně celkem do 20–30 míst v detruzoru, uzávěrový mechanizmus zůstává intaktní. Výkon lze provést i ambulantně. Kontraindikací k aplikaci botulinumtoxinu je současné onemocnění myasthenia gravis, nízkokompliantní močový měchýř s vazivovými strukturálními změnami a malým rozdílem mezi anatomickou a funkční kapacitou, gravidita a hemoragická diatéza. Za relativní kontraindikaci lze považovat současnou léčbu aminoglykosidovým antibiotikem (44).
Nejvíce obtěžujícím symptomem, značně zhoršujícím i kvalitu života pro pacienty, je inkontinence. Po aplikaci botulotoxinu lze očekávat redukci epizod urgentní inkontinence přibližně u 50 % pacientů, signifikantní zvýšení cystometrické kapacity a pokles maximálního detruzorového tlaku během kontrakce (45).
Doporučovaná dávka pro pacienty s RS je 200 UI, u pacientů s vyšším rizikem retence moči lze aplikovat i nižší dávku 100 UI. V jedné z největších studií dospěli k závěru, že 35 % a 42 % pacientů po aplikaci onabotulotoxinu (200 UI a 300 UI) dospělo k ČIAK. Navíc během prvních 12 týdnů mělo 18–28 % pacientů uroinfekci. Z toho vyplývá, že obzvlášť u RS pacientů je vhodná preventivní edukace k autokatetrizaci, a stejně tak i adekvátní antibiotická profylaxe (46).
Při botulotoxinem vyvolané reverzibilní paralýze svaloviny deruzoru může dojít i k retenci moči. Obleněná kontrakce detruzoru vede ke zhoršené evakuaci moči, a tím k postmikčnímu reziduu. V tomto případě je indikovaná ČIAK. Za horní hranici rezidua moči k zahájení katetrizace se doporučuje 100 ml (23).
Neuromodulační léčba
Krajním řešením při selhání konzervativní terapie jsou chirurgické metody, které jsou rezervovány jen pro pacienty s nejtěžšími symptomy. Neurostimulace a neuromodulace představují vhodnou alternativu v případě selhání konzervativní terapie u pacientů s neurogenní dysfunkcí DCM. U pacientů s RS je jejich uplatnění relativně malé (40).
Z praktického hlediska rozlišujeme metody neinvazivní, miniinvazivní a invazivní. K neinvazivním metodám patří anogenitální a transkutánní neurostimulace, které lze využít u pacientů s RS. K miniinvazivní perkutánní stimulace nervus tibialis posterior (NTP) a intravezikální elektrostimulace. K invazivním metodám řadíme sakrální neuromodulaci. U všech technik se používá nábojově vyvážený stejnosměrný elektrický proud s nízkou frekvencí (41).
Elektrická neurostimulace označuje přímé řízení cílového orgánu elektrostimulací příslušného nervu. V urologii představuje tuto metodu stimulace předních kořenů míšních (sacral anterior root stimulation – SARS) v kombinaci se sakrální deaferentací. Jedná se o ekonomicky velmi náročnou metodu, která je indikována výhradně u pacientů s kompletní míšní lézí nad sakrálním mikčním centrem, podmínkou je zachovalý sakrální mikční reflex (41). Její zásadní uplatnění je v léčbě chronické bolesti.
Druhou možnost představuje neuromodulační metoda. Její zásadní uplatnění je v léčbě chronické bolesti. Cílem zásahu jsou nejen bolestivé stavy různé etiologie, ale i epilepsie, míšní elasticita, poruchy srdečního rytmu, mikce, defekace, postižení zraku a sluchu atd. Elektrickou neuromodulací nervových drah a nervového řídícího centra se snažíme obnovit normální aktivitu řídícího centra nebo odstranit tu patologickou, a tím nepřímo ovlivnit funkci cílového orgánu. Tuto metodu lze uplatnit i u pacientů s RS onemocněním při urgencích a urgentní inkontinenci refrakterních na farmakoterapii a u skupiny pacientů s retencí na podkladě detruzoro-sfinkterické dyssynergie. Studie prokazují signifikantní zvýšení mikčního objemu, pokles postmikčních reziduí a epizod úniků, především ale signifikantní zlepšení kvality života u všech pacientů (56).
Významný efekt na zlepšení symptomů dolních cest močových u pacientů s neurogenní dysfunkcí lze dosáhnout také kombinací jednotlivých metod, jako např. elektrická stimulace s rehabilitací pánevního dna a EMG „biofeedback“ technikou (42).
Chirurgická léčba
Vzhledem k efektivním konzervativním a miniinvazivním možnostem, představuje v dnešní době chirurgické invazivní řešení pouze krajní možnost, a to v případě jejich selhání. Uvádí se, že 7 % pacientů s RS i přes intenzivní terapii dospěje k chirurgickému řešení a jedná se obvykle o pacienty s refrakterní detruzoro-sfinkterickou dyssynergií (47).
Z možností chirurgického řešení v rámci problematiky RS lze uplatnit metody indikované obecně u neurogenních dysfunkcí. Cílem je zajistit nebo zlepšit jímací a vyprazdňovací funkci močového měchýře, ale především ochránit funkci horních močových cest.
Jímací funkci lze zlepšit zvětšením kapacity močového měchýře, a to autoaugmentací (parciální myektomií detruzoru) nebo augmentací s využitím střevní kličky. Autoaugmentační techniky či vytvoření neoveziky jsou možnosti rezervované pro ty pacienty, u nichž jiné metody chirurgického řešení selhaly nebo nejsou vhodné. Dle prognózy pacienta a jeho celkového stavu (manuální zručnost, mentální stav pacienta a jeho celková compliance) pak pochopitelně volíme individuálně terapeutické možnosti (48). Častěji je volena tato varianta léčby u pacientů se sekundární progresí základního onemocnění, ale obvykle to bývají pacienti rizikoví z pohledu pooperační péče (49).
K dispozici jsou i další chirurgické možnosti, jako je např. vytvoření kontinentní či inkontinentní derivace moči. Variant provedení kontinentní vezikostomie či heterotopické nebo ortotopické náhrady močového měchýře (neoveziky) je několik. U pacientů s neurogenní dysfunkcí se však ortotopická kontinentní derivace indikuje zřídka. Obecně se nedoporučuje ani přímá implantace ureterů do gastrointestinálního traktu, vzhledem k jeho časté neurogenní dysfunkci (50). K evakuaci moči se pacient musí katetrizovat. U pacientů s omezenou zručností volíme katetrizaci stomií spíše než transuretrální cestou.
Řešení inkompetentního sfinkteru je rezervováno pro pacienty pouze s kontrolovanou aktivitou detruzoru bez přítomného vezikoureterálního reflexu a je třeba eventuálně počítat s případnou autokatetrizací. Mezi operační metody, které vedou ke zlepšení inkontinence, řadíme aplikaci periuretrálních implantátů („bulking agents“), slingové a páskové operace, umělý svěrač uretry a rekonstrukci nebo uzavření hrdla močového měchýře (51, 52). Někteří autoři považují metodu aplikace arteficiálního sfinkteru (AS) uretry za zlatý standard v léčbě inkontinence při neurogenní insuficienci svěrače, obvykle však není tato metoda pro pacienty s RS využívána.
Chirurgické možnosti nabízející snížení odporu výtokové části DCM jsou sfinkterotomie nebo inzerce stentů. Princip endoskopické sfinkterotomie představuje relativně vhodné řešení obstrukce DCM obzvláště u mužských pacientů s DSD po selhání konzervativních metod. Nutnost další intervence (sekundární sfinkterotomie) se popisuje až u 35 % a riziko selhání metody (ve smyslu recidivující uroinfekce, recidiva DSD či dilatace HCM) je až u 68 % pacientů (53). Intrauretrální stent přináší vhodné, relativně dlouhodobé řešení při managementu „farmakologicky rezistentní“ DSD, včetně pacientů, kteří již absolvovali sfinkterotomii. Nejčastější komplikací jsou dislokace s následnou stenózou, litiáza či kalcifikace a u 8,5 % pacientů je nutná jeho extrakce. Výsledky jsou srovnatelné se sfinkterotomií, jisté výhody představuje kratší doba a menší náročnost výkonu a hospitalizace. Na druhé straně ale náklady s tím spojené a možné komplikace jsou jistým limitem. Obě metody jak sfinkterotomie, tak i inzerce stentu mohou vést k různému stupni inkontinence a pacienti jsou pak odkázáni na inkontinenční pomůcky od vložek až po kondomový urinál. Metody jsou vhodné spíš jen pro pacienty s DSD při neschopnosti provádět autokatetrizaci (54). Z dnešního hlediska jsou intrauretrální stenty pro jejich cenu a komplikace v podstatě nepoužívané.
Inkontinentní derivace jsou dle EAU guidelines indikovány u pacientů, u nichž varianta ČIAK nebo ČIK není možná, a kteří jsou limitováni těžkým pohybovým postižením. Nejčastější metodou je ureteroileostomie dle Brickera (55).
ZÁVĚR
Roztroušená skleróza je závažné autoimunitní onemocnění postihující zejména mladší věkové skupiny. Urologické obtíže jsou velmi zásadní pro velkou část pacientů, a proto je důležitá multioborová péče o tyto pacienty.
U každého pacienta s RS onemocněním a LUTS by mělo být indikováno urologické vyšetření. Symptomy DCM často nekorelují s urodynamickým nálezem a je obzvlášť u těžších forem RS a pacientů nereagujících na farmakologickou terapii důležité indikovat včas urodynamické vyšetření.
Každou akutní uroinfekci je nutno považovat za stresový faktor, který může vést ke zhoršení základního onemocnění a nasazenou antibiotickou terapii je třeba vždy upravit dle definitivní kultivace moči.
Imunomodulační léčba včetně autovakcíny je u RS pacientů možná, ale její podání by mělo být konzultováno s imunologem, vždy dle aktuálního stavu pacienta.
Své místo v terapii urologických symptomů mírného a středního stupně u pacientů s RS má i behaviorální terapie.
Základem léčby neuro-urologických dysfunkcí je farmakoterapie a miniinvazivní metody jako ČIAK, neuromodulace a endoskopická aplikace botulotoxinu.
Chirurgické invazivní řešení představuje pouze krajní možnost, a to v případě selhání konzervativních léčebních postupů.
U každého pacienta je potřebný individuální přístup jak neurologa, tak i urologa, ideálně v rámci mezioborové spolupráce.
SEZNAM POUŽITÝCH ZKRATEK
- AS – arteficiální sfinkter
- ATB – antibiotická terapie
- CM – cystometrie
- CNS – centrální nervový systém
- CSK – cystoskopie
- ČIAK – čistá intermitentní autokatetrizace
- DCM – dolní cesty močové
- DSD – detruzoro-sfinkterická dyssynergie
- EAU – European Association of Urology
- GR A–D – grade of reccomendation
- HCM – horní cesty močové
- MR – magnetická rezonance
- NTP – nervus tibialis posterior
- Pdet – detruzorový tlak
- PM karta – pitní – mikční karta
- PMR – postmikční reziduum
- PQ – tlakově-průtoková studie
- RS – roztroušená skleróza mozkomíšní
- SPD – svaly pánevního dna
- UDN – urodynamické vyšetření
- UI – mezinárodní jednotky
- VUR – veziko-ureterální reflux
Došlo: 3. 2. 2015
Přijato: 19. 8. 2016
Střet zájmů: žádný
Prohlášení o podpoře: Jedná se o nezávislý článek, jeho tvorba nebyla podpořena žádnou farmaceutickou firmou nebo grantem.
Kontaktní adresa:
MUDr. Zuzana Vaľová
Urologická klinika VFN a 1. LF UK, Praha
Ke Karlovu 6, 128 08 Praha 2
e-mail: valova.z@gmail.com
Sources
1. Vachová M. Epidemie roztroušené sklerózy ve světě? Cesk Slov Neurol N 2012; 75/106(6): 701–706.
2. Dufek M. Roztroušená skleróza – EDSS (expanded disability status scale), tzv. Kurtzkeho škála. Neurol. praxi 2011; 12(Suppl. G): 6–9.
3. Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology 1983; 33(11): 1444–1452.
4. Polman CH, Reingold SC, Edan G, et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the „McDonald Criteria“. Annals of neurology 2005; 58(6): 840–846.
5. Zapletalová O. Léčba časných stadií roztroušené sklerózy mozkomíšní. Remedia 2009; 19(3): 198–204.
6. Araki I, Matsui M, Ozawa K, Takeda M, Kuno S. Relationship of bladder dysfunction to lesion site in multiple sclerosis. The Journal of urology 2003; 169(4): 1384–1387.
7. Zámečník L, Novák K, Soukup V, et al. Závisí vývoj dysfunkce mikce u roztroušené sklerózy na typu neurologické léčby? Cesk Slov Neurol N 2007; 70(6): 687–691.
8. Groen J, Pannek J, Castro Diaz D, et al. Summary of European Association of Urology (EAU) Guidelines on Neuro-Urology. European urology 2016; 69(2): 324–333.
9. Wheeler JS, Jr, Siroky MB, Pavlakis AJ, Goldstein I, Krane RJ. The changing neurourologic pattern of multiple sclerosis. The Journal of urology 1983; 130(6): 1123–1126.
10. de Seze M, Ruffion A, Denys P, Joseph PA, Perrouin-Verbe B. The neurogenic bladder in multiple sclerosis: review of the literature and proposal of management guidelines. Multiple sclerosis (Houndmills, Basingstoke, England) 2007; 13(7): 915–928.
11. Amarenco G, de Seze M, Ruffion A, Sheikh Ismael S. Clinical and urodynamic evaluations of urinary disorders in multiple sclerosis. Annals of physical and rehabilitation medicine 2014; 57(5): 277–287.
12. Manack A, Motsko SP, Haag-Molkenteller C, et al. Epidemiology and healthcare utilization of neurogenic bladder patients in a US claims database. Neurourology and urodynamics 2011; 30(3): 395–401.
13. Groen J, Pannek J, Castro Diaz D. Summary of European Association of Urology (EAU) Guidelines on Neuro-Urology. Eur Urol. 2016; 69(2): 324–333.
14. Madersbacher H. The various types of neurogenic bladder dysfunction: an update of current therapeutic concepts. Paraplegia 1990; 28(4): 217–229.
15. Zámečník L, Novák K, Hanuš T. Pacient s roztroušenou sklerózou v ordinaci praktického urologa. Urol. praxi 2001; 2(1): 58–62.
16. Fletcher SG, Dillon BE, Gilchrist AS, et al. Renal deterioration in multiple sclerosis patients with neurovesical dysfunction. Multiple sclerosis (Houndmills, Basingstoke, England) 2013; 19(9): 1169–1174.
17. Krhut J, Hradilek P, Zapletalova O. Analysis of the upper urinary tract function in multiple sclerosis patients. Acta neurologica Scandinavica 2008; 118(2): 115–119.
18. Krhut J, Hradílek P, Mainer K, Zapletalová O. Nové schéma v diagnostice a terapii dysfunkcí dolních močových cest u pacientů s roztroušenou sklerózou. Urol. praxi 2005; 6(5): 209–212.
19. Del Popolo G, Panariello G, Del Corso F, De Scisciolo G, Lombardi G. Diagnosis and therapy for neurogenic bladder dysfunctions in multiple sclerosis patients. Neurological sciences: official journal of the Italian Neurological Society and of the Italian Society of Clinical Neurophysiology 2008; 29 Suppl 4: S352–355.
20. Colli E, Artibani W, Goka J, Parazzini F, Wein AJ. Are urodynamic tests useful tools for the initial conservative management of non-neurogenic urinary incontinence? A review of the literature. European urology 2003; 43(1): 63–69.
21. Panicker JN, Fowler CJ, Kessler TM. Lower urinary tract dysfunction in the neurological patient: clinical assessment and management. The Lancet Neurology 2015; 14(7): 720–732.
22. Dillon BE, Lemack GE. Urodynamics in the evaluation of the patient with multiple sclerosis: when are they helpful and how do we use them? The Urologic clinics of North America 2014; 41(3): 439–444, ix.
23. Fowler CJ, Panicker JN, Drake M, et al. A UK consensus on the management of the bladder in multiple sclerosis. Postgraduate medical journal 2009; 85(1008): 552–559.
24. Zámečník L. Mikční a sexuální poruchy. In: Havrdová E, editor. Roztroušená skleróza. Praha: Mladá Fronta; 2013. 125–131.
25. Urodynamics. In: Urinary Incontinence in Neurological Disease, Management of Lower Urinary Tract Dysfunction in Neurological Disease. NICE Clinical Guidelines, No. 148. London: Royal College of Physicians (UK); 2012. 53–63.
26. Lucio AC, Campos RM, Perissinotto MC, et al. Pelvic floor muscle training in the treatment of lower urinary tract dysfunction in women with multiple sclerosis. Neurourology and urodynamics 2010; 29(8): 1410–1413.
27. De Ridder D, Vermeulen C, Ketelaer P, Van Poppel H, Baert L. Pelvic floor rehabilitation in multiple sclerosis. Acta neurologica Belgica 1999; 99(1): 61–64.
28. van Rey F, Heesakkers J. Solifenacin in multiple sclerosis patients with overactive bladder: a prospective study. Advances in urology 2011; 2011 : 834753.
29. Zámečník L. Symptomatická terapie roztroušené sklerózy – mikční potíže. In: Havrdová E, editor. Roztroušená skleróza. Praha: Mladá Fronta; 2013. 378–382.
30. Otsuki H, Kosaka T, Nakamura K, et al. Beta3-adrenoceptor agonist mirabegron is effective for overactive bladder that is unresponsive to antimuscarinic treatment or is related to benign prostatic hyperplasia in men. International urology and nephrology 2013; 45(1): 53–60.
31. Freeman RM, Adekanmi O, Waterfield MR, et al. The effect of cannabis on urge incontinence in patients with multiple sclerosis: a multicentre, randomised placebo-controlled trial (CAMS-LUTS). International urogynecology journal and pelvic floor dysfunction 2006; 17(6): 636–641.
32. Preiningerová Lízrová J, Štětkářová I. Symptomatická terapie roztroušené sklerózy. Léčba spasticity a porucha chůze. In: Havrdová E, editor. Roztroušená skleróza. Praha: Mladá Fronta; 2013. 370–378.
33. Mahadeva A, Tanasescu R, Gran B. Urinary tract infections in multiple sclerosis: under-diagnosed and under-treated? A clinical audit at a large University Hospital. American journal of clinical and experimental immunology 2014; 3(1): 57–67.
34. Moore KN, Murray S, Malone-Lee J, Wagg A. Rapid urinalysis assays for the diagnosis of urinary tract infection. British journal of nursing (Mark Allen Publishing) 2001; 10(15): 995–1001.
35. Rakusa M, Murphy O, McIntyre L, et al. Testing for urinary tract colonization before high-dose corticosteroid treatment in acute multiple sclerosis relapses: prospective algorithm validation. European journal of neurology: the official journal of the European Federation of Neurological Societies 2013; 20(3): 448–452.
36. Hanuš T. Intermitentní katetrizace močového měchýře. Čas Lék Čes 1983; 122 : 1135–1137.
37. Krhut J. Intermitentní katetrizace. In: Krhut J, editor. Neurourologie. Praha Galén; 2005. 37–40.
38. Šámal V, Kyriánová A, Šrám J, Mečl J, Fogl J. Čistá intermitentní autokatetrizace u neurogenních dysfunkcí dolních močových cest po spinálním poranění. Porovnávání výsledků při použití hydrofilnch a standardních PVC katetrů. Ces Urol 2011; 15(4): 229–236.
39. Nicholas R, Young C, Friede T. Bladder symptoms in multiple sclerosis: a review of pathophysiology and management. Expert opinion on drug safety 2010; 9(6): 905–915.
40. Krhut J. Neinvazivní neuromodulace a neurostimulace. In: Krhut J, editor. Neurourologie. Praha Galén; 2005. 46–47.
41. Rejchrt M. Využití neuromodulace v léčbě dysfunkcí dolních cest močových. Ces Urol 2012; 16(1): 5–12.
42. McClurg D, Ashe RG, Lowe-Strong AS. Neuromuscular electrical stimulation and the treatment of lower urinary tract dysfunction in multiple sclerosis-a double blind, placebo controlled, randomised clinical trial. Neurourology and urodynamics 2008; 27(3): 231–237.
43. Schurch B, Carda S. Onabotulinumtoxin A and multiple sclerosis. Annals of physical and rehabilitation medicine 2014; 57(5): 302–314.
44. Krhut J. Aplikace botulotoxinu do detruzoru. In: Krhut J, editor. Neurourologie. Praha Galén; 2005 : 44–46.
45. Schurch B, de Seze M, Denys P, et al. Botulinum toxin type a is a safe and effective treatment for neurogenic urinary incontinence: results of a single treatment, randomized, placebo controlled 6-month study. The Journal of urology 2005; 174(1): 196–200.
46. Ginsberg D, Gousse A, Keppenne V, et al. Phase 3 efficacy and tolerability study of onabotulinumtoxinA for urinary incontinence from neurogenic detrusor overactivity. The Journal of urology 2012; 187(6): 2131–2139.
47. Sirls LT, Zimmern PE, Leach GE. Role of limited evaluation and aggressive medical management in multiple sclerosis: a review of 113 patients. The Journal of urology 1994; 151(4): 946–950.
48. Gough DC. Enterocystoplasty. BJU international 2001; 88(7): 739–743.
49. DeLong J, Tighiouart H, Stoff el J. Urinary diversion/reconstruction for cases of catheter intolerant secondary progressive multiple sclerosis with refractory urinary symptoms The Journal of urology 2011; 185(6): 2201–2206
50. Castro-Diaz D, Barret D, Grise P. Surgery for the neuropathic patient In: Abrams P, Khoury S, Wein A, editors Incontinence Plymouth: Health Publication; 2002
51. Krhut J. Dysfunkce typu A (hyperaktivní detruzor + hyperaktivní sfinkter) – operační metody léčby In: Krhut J, editor Neurourologie Praha Galén; 2005 49–66
52. Ženíšek J. Novinky v léčbě stresové inkontinence u mužů Urol praxi 2014; 12(2): 68–71
53. Pan D, Troy A, Rogerson J, et al. Long‑term outcomes of external sphincterotomy in a spinal injured population The Journal of urology 2009; 181(2): 705–709
54. Seoane-Rodriguez S, Sanchez RLJ, Montoto-Marques A, et al. Long‑term follow‑up study of intraurethral stents in spinal cord injured patients with detrusor‑sphincter dyssynergia Spinal cord 2007; 45(9): 621–626
55. Schwartz SL, Kennelly MJ, McGuire EJ, Faerber GJ. Incontinent ileo‑vesicostomy urinary diversion in the treatment of lower urinary tract dysfunction The Journal of urology 1994; 152(1): 99–102
56. Minardi D, Muzzonigro G. Sacral Neuromodulation in patients with multiple sclerosis Worl J Urol 2012; 30(1): 123–128.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2016 Issue 4-
All articles in this issue
- MIKČNÍ POTÍŽE U PACIENTŮ S ROZTROUŠENOU SKLERÓZOU. JSME V ALGORITMU PÉČE O PACIENTA S ROZTROUŠENOU SKLERÓZOU JAKO UROLOGOVÉ DŮLEŽITÍ?
- DYSFUNKCE DOLNÍCH MOČOVÝCH CEST U DIABETICKÝCH PACIENTŮ
- DOPORUČENÉ POSTUPY PRO DIAGNOSTIKU A LÉČBU NYKTURIE V ČESKÉ REPUBLICE
- PROGNOSTICKÝ VÝZNAM PARAMETRŮ VYCHÁZEJÍCÍCH Z POMĚRU NEUTROFILŮ K LYMFOCYTŮM U INVAZIVNÍCH NÁDORŮ MOČOVÉHO MĚCHÝŘE
- PROGNÓZA PACIENTŮ SE STŘEDNĚ A VYSOCE RIZIKOVÝM SVALOVINU DETROZORU NEINFILTRUJÍCÍM KARCINOMEM MOČOVÉHO MĚCHÝŘE LÉČENÝCH INTRAVEZIKÁLNÍMI INSTILACEMI MITOMYCINU C V OBDOBÍ NEDOSTUPNOSTI BCG VAKCÍNY
- ORGÁN ŠETRIACA LIEČBA SVALOVINU INFILTRUJÚCICH NÁDOROV MOČOVÉHO MECHÚRA
- NAŠE PRVNÍ ZKUŠENOSTI S VYUŽITÍM KOMETOVÉHO TESTU PŘI HODNOCENÍ INTEGRITY DNA VE SPERMIÍCH
- RARITNÍ HISTOLOGICKÝ NÁLEZ MALIGNÍHO TUMORU VYCHÁZEJÍCÍHO Z LOŽISKA ENDOMETRIÓZY LEDVINY
- HIBERNOM JAKO PŘEKVAPIVÝ NÁLEZ PŘI EXSTIRPACI PERIRENÁLNÍHO TUMORU
- 62ND CZECH UROLOGICAL SOCIETY ANNUAL CONFERENCE IN ČESKÉ BUDĚJOVICE 2016
- SELEKTIVNÍ KLAMPING PŘI ROBOTICKY ASISTOVANÉ RESEKCI LEDVINY
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- PROGNOSTICKÝ VÝZNAM PARAMETRŮ VYCHÁZEJÍCÍCH Z POMĚRU NEUTROFILŮ K LYMFOCYTŮM U INVAZIVNÍCH NÁDORŮ MOČOVÉHO MĚCHÝŘE
- ORGÁN ŠETRIACA LIEČBA SVALOVINU INFILTRUJÚCICH NÁDOROV MOČOVÉHO MECHÚRA
- MIKČNÍ POTÍŽE U PACIENTŮ S ROZTROUŠENOU SKLERÓZOU. JSME V ALGORITMU PÉČE O PACIENTA S ROZTROUŠENOU SKLERÓZOU JAKO UROLOGOVÉ DŮLEŽITÍ?
- DOPORUČENÉ POSTUPY PRO DIAGNOSTIKU A LÉČBU NYKTURIE V ČESKÉ REPUBLICE
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

