-
Medical journals
- Career
Pozdní krvácení po perkutánní extrakci konkrementu
Authors: Zdeněk Peremský 1; Filip Cihlář 2; Jiří Král 1; Miloš Bočan 1; Milouš Derner 2
Authors‘ workplace: Urologické oddělení Nemocnice Most o. z., Krajská zdravotní a. s. 1; Radiodiagnostické oddělení Masarykovy Nemocnice Ústí nad Labem o. z., Krajská zdravotní a. s. 2
Published in: Ces Urol 2011; 15(3): 189-193
Category: Case report
Overview
V článku předkládáme kazuistiku pozdního krvácení z pseudoaneuryzmatu poškozené intrarenální tepny. Tato komplikace byla řešena superselektivní embolizací.
Klíčová slova:
perkutánní extrakce konkrementu, hematurie, intrarenální pseudoaneuryzma, embolizace.Úvod
Perkutánní extrakce konkrementu je minimálně invazivní metoda, která je indikována u renálních konkrementů velikosti větší než 2 centimetry lokalizované v pánvičce, horním nebo středním kalichu. Dále u konkrementů větších než 1,5 cm lokalizovaných v oblasti dolního kalichu (1). Mezi závažné komplikace této metody patří sepse (0,9–4,7 %), renální krvácení (0,6–1,4 %), které je indikováno k dalšímu řešení, pleurální zranění (2,3–3,1 %) a poranění tlustého střeva (0,2–0,8 %) (2).
Před výkonem se doporučuje provést výpočetní tomografii (CT) nebo ultrasonografické (UZ) vyšetření k zobrazení vztahů konkrementu, dutého systému ledviny a okolních orgánů k naplánování optimálního perkutánního přístupu. Přístup se nejčastěji provádí dorzálním kalichem dolního pólu ledviny. Při nejméně traumatickém přístupu se místo kožní punkce nachází v prodloužení dlouhé osy cíleného kalichu a prochází papilou. V této oblasti se nevyskytují žádné významné cévy a při zákroku je zde riziko krvácení minimální. Pokud vznikne významné krvácení peroperačně, je nutné perkutánní extrakci konkrementu ukončit, zavést nefrostomii, a výkon pak dokončit ve druhé době. Žilní krvácení obvykle ustane do několika hodin po zasvorkování nefrostomie. Větší žilní nebo arteriální krvácení, lze zastavit během výkonu pomocí tamponádní nefrostomie (3). Přetrvávající nebo pozdní sekundární krvácení je způsobeno poraněním artérie. Primární diagnostickou metodou k určení zdroje renálního krvácení je kontrastní CT. V případech, kdy není dostupná, nebo je kontraindikovaná (renální selhání, alergie na kontrastní látku, choroby štítné žlázy), může být použito UZ vyšetření ledviny s aplikací kontrastní látky (4) nebo UZ vyšetření s barevným dopplerovským mapováním (5). Angiografické vyšetření renálních tepen pak prokáže příčinu krvácení a zároveň umožní krvácení zastavit pomocí superselektivní embolizace (6). V našem sdělení popisujeme případ pozdní recidivující hematurie po perkutánní extrakci konkrementu. Zdrojem krvácení byla lacerovaná dolní segmentální větev levé renální artérie, na které vzniklo pseudoaneuryzma. Léčebným zákrokem pak byla selektivní embolizace poškozené tepny kovovou spirálou.
Kazuistika
Pacientem je padesátisedmiletý muž s obezitou, hypertenzí, diabetes mellitus 2. typu na inzulinu, v osobní anamnéze dále akutní nekrotická pankreatitida s krvácením do gastrointestinálního traktu řešená laparotomií s laparostomií před 15 lety. Pacient je vyučen, žije sám a patří do skupiny sociálně slabého obyvatelstva. Vstupně byl u pacienta zaveden ureterální stent pro protrahovaný kolikovitý stav, jehož příčinou byla nekontrastní levostranná subrenální ureterolitiáza 8 × 5 mm. V rámci předoperačního CT vyšetření byla zjištěna změna polohy konkrementu, který byl patrný při stentu při horním okraji sacroiliakálního skloubení, velikost konkrementu se nezměnila. Pacientovi navrženo ureteroskopické odstranění konkrementu. Zároveň byl seznámen s možností relokace konkrementu do dutého systému ledviny a pak nutností znovuzavedení stentu a dalším řešením extrakorporální litotrypsí pod UZ zaměřením nebo flexibilní ureterorenoskopií s odstupem na jiném pracovišti. Dále navržena i možnost perkutánní extrakce konkrementu po ureteroskopické relokaci konkrementu v jedné době. Pacient byl poučen o všech možnostech řešení i o možných komplikacích, souhlasí s posledním navrženým postupem.
Při vlastním výkonu byla nejprve provedena ureteroskopická relokace konkrementu do horního kalichu levé ledviny s následnou perkutánní extrakcí konkrementu vcelku. Punkce byla vedena cestou dolního kalichu, dilatace punkčního kanálu na Amplatz tubus Ch 30. Vlastní operační zákrok provedl zkušený operatér standardně, bez peroperačních nebo časných pooperačních komplikací. Třetí pooperační den byla odstraněna nefrostomie, 6. pooperační den byl pacient propuštěn do domácího ošetřování.
Čtrnáctý pooperační den byl pacient rehospitalizován pro levostranné nefralgie, akutní močovou retenci a výraznou makroskopickou hematurii. Při přijetí byl pacient normotenzní, v laboratoři byl zaznamenán pokles hodnot hemoglobinu na 80 g/l ze 131 g/l, pokles hematokritu na 23,7 % z 37 %. Ihned po přijetí byla zahájena monitorace pacienta, založen lavážní močový katétr, podávána plná krev, mražená plazma, hemostyptika. Na CT angiografii renálních tepen prokázáno krvácení v punkčním kanále z dolní segmentální větve levé renální tepny s pseudoaneuryzmatem. Pacient byl indikován k superselektivní embolizaci. Výkon byl proveden v lokální anestezii mesocainem po katetrizaci a. femoralis communis vpravo, byl zaveden sheath 5F (Cordis, Miami, USA). Diagnostickým katétrem RC2 (Cordis, Miami, USA) byla provedena selektivní renální angiografie vlevo. V dolním pólu se plnilo pseudoaneuryzma o velikosti 16 × 10 mm v PA projekci (obr. 1). Následně byla superselektivně katetrizována přívodná tepna mikrovodičem Synchro-10 (Boston Scientific, Natick, USA). Mikrokatétrem Excelsior SL10 byly do přívodné tepny před pseudoaneuryzma implantovány tři odpoutatelné spirálky Matrix2 Helical Ultrasoft (Boston Scientific, Natick, USA). Velikost spirálek byla 3 × 60 mm, 3 × 40 mm a 2 × 60 mm. Na kontrolním nástřiku bylo potvrzeno uzavření přívodné tepny a absence plnění vaku pseudoaneuryzmatu (obr. 2, 3). Výkon proběhl bez komplikací. Bezprostředně po výkonu makroskopická hematurie ustala, 11. den po selektivní embolizaci byl pacient propuštěn do domácího ošetřování.
Image 1. Diagnostická DSA před embolizací Fig. 1. Diagnostic DSA before embolisation 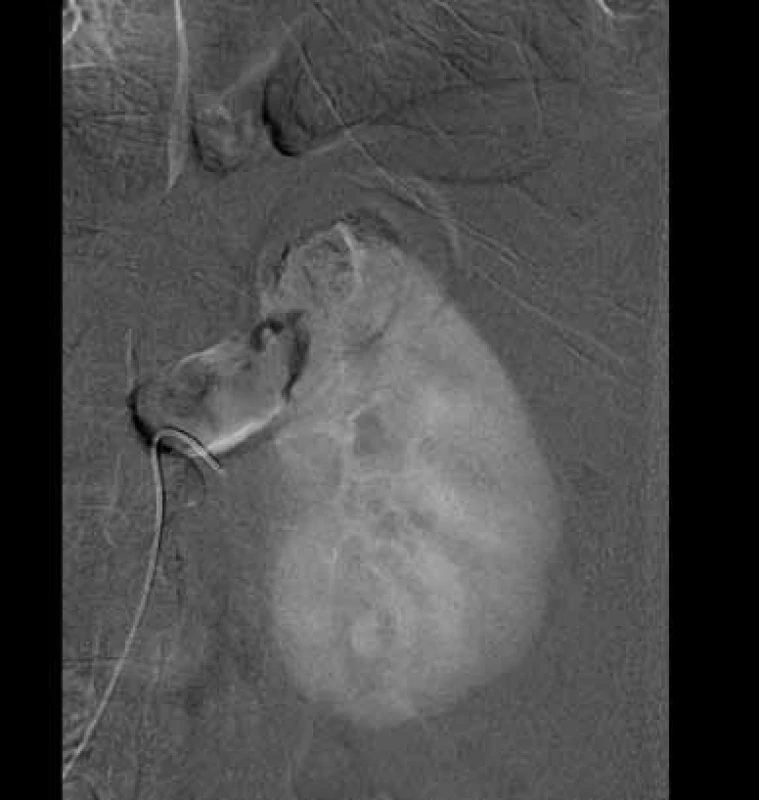
Image 2. DSA po embolizaci Fig. 2. DSA after embolisation 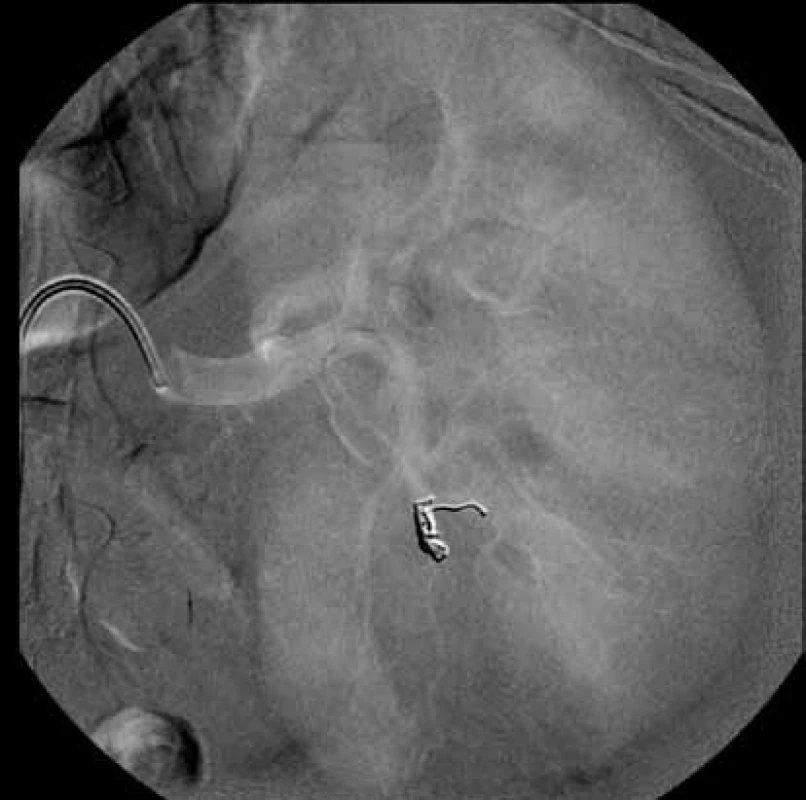
Image 3. RTG – spirálky uložené do tepny Fig. 3. X-ray – coils in artery 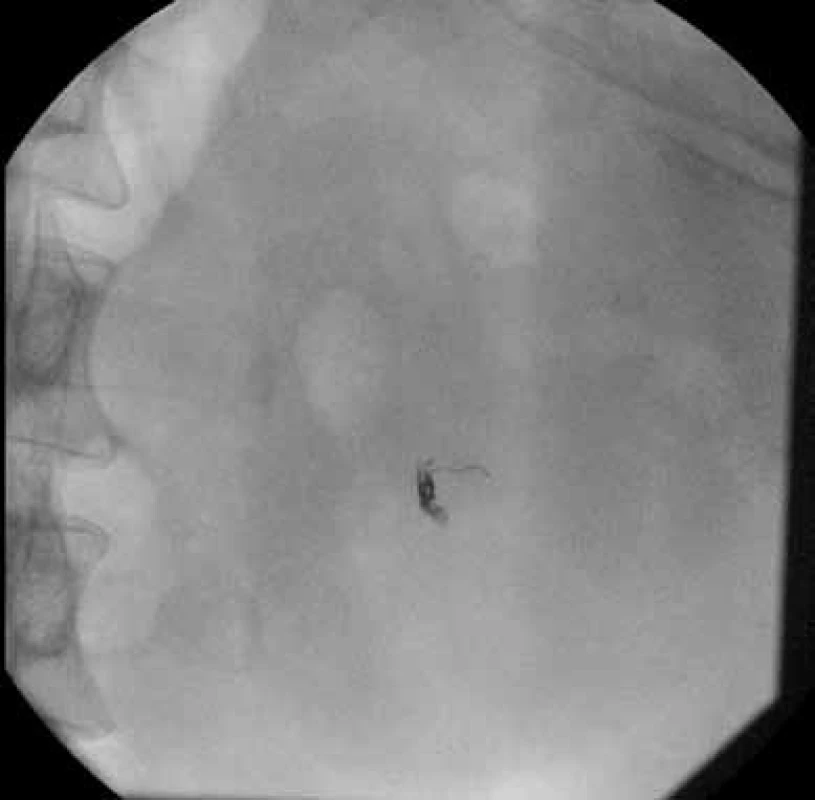
Měsíc po selektivní embolizaci je pacient zcela bez potíží, provedeno kontrolní CT vyšetření ledvin včetně CT angiografického vyšetření renálních tepen, kde jsou zobrazeny coily v dolní lobární větvi levé renální tepny, bez průkazu plnění pseudoaneuryzmatu (obr. 4). Pacient je nadále dispenzarizován v naší ambulanci.
Image 4. CT angiografie měsíc po embolizaci Fig. 4. CT angiogram one month after embolisation 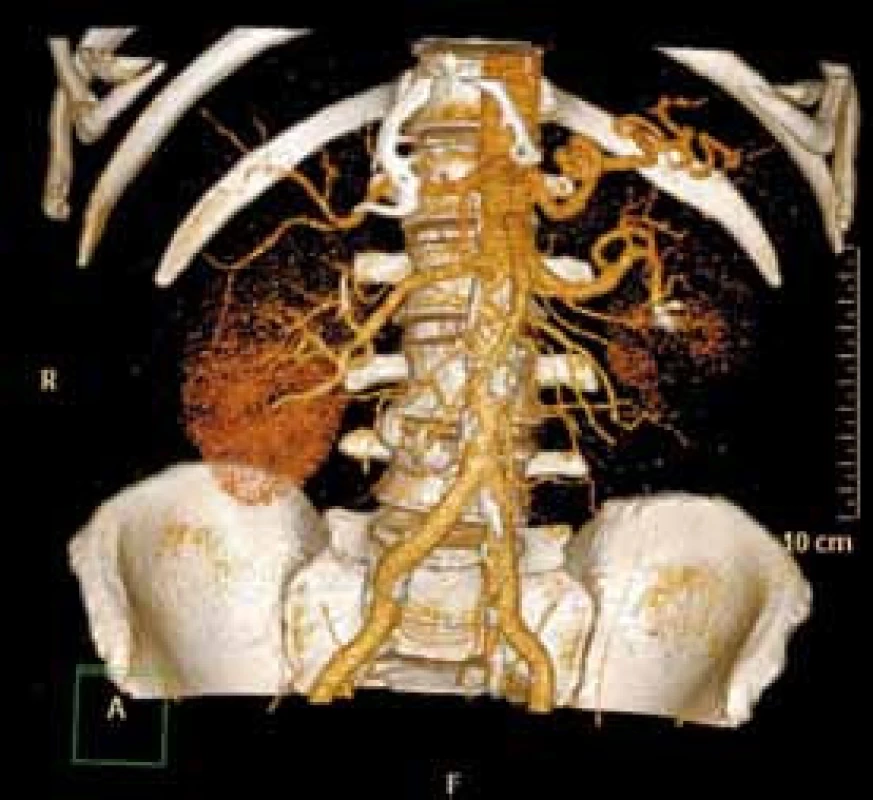
Diskuse
Relativně vzácnou komplikací perkutánního endoskopického výkonu je takové poranění intrarenální, hilové nebo kapsulární tepny, jenž vede k masivní nebo prolongované hematurii či hemoragii s následnými projevy oběhové nestability a alterací laboratorních parametrů. V našem případě se projevilo masivní pozdní hematurií. Nutnost podání krevních převodů v rámci řešení komplikací perkutánních endoskopických výkonů je udávána v rozmezí od 3 % do 23 % (7). Kromě standardních rigidních nefoskopů vyráběných ve velikostech 24–30 Ch, jsou i menší instrumenty, nazývané „Mini-perc“ od 11 do 18 Ch. Použití nefoskopu o menším kalibru je spojeno s nižší morbiditou než při použití standardního nefoskopu. Nicméně předpoklad výhodnosti použití menšího kalibru nefoskopů za účelem větší ochrany renálního parenchymu se nepotvrdil (8). Použití „Mini-perc“ u dospělých je kontroverzní a zůstává standardní metodou perkutánního odstranění litiázy u dětí (1). K určení zdroje krvácení se s výhodou používá kontrastní spirální CT vyšetření s možností CT angiografie k potvrzení a určení přesného místa lacerace tepny. Pseudoaneuryzma nemá vlastní stěnu, jde o disekci stěny cévy s hematomem perivazálně, v jehož části je zachován průtok krve mimo stěnu cévy a zpět. Není-li vtok bezpečně uzavřen, není léčebný efekt trvalý (9). Doporučeným postupem řešení je pak endovaskulární přístup – selektivní embolizace poraněné tepny. K vlastní embolizaci se používají permanentní embolizační materiály, jako jsou polyvinylalkoholové částice, trisacryl polymerové částice, kovové spirály volné nebo odpoutatelné, tkáňové lepidlo n-butyl-2-kyanoakrylát-enbukrylát nebo sklerotizační materiály (10). O specifickém použití embolizačního materiálu rozhoduje na základě typu krvácení, vlastní zkušenosti a ceny intervenční radiolog. V našem případě jsme použili kovové odpoutatelné spirály. Postembolizační komplikace se vyskytují asi u 5 % nemocných (11). Jejich příčinou je ischémie okolní či vzdálené tkáně. Postembolizační syndrom vzniká na základě resorpce nekrotické tkáně, projevuje se zvracením, febriliemi, bolestmi ischemické oblasti, leukocytózou. Většinou lze postembolizační komplikace zvládnout symptomatickou léčbou. Dalšími komplikacemi jsou pak specifické ischémie, například obrny nervů při ischémii vasa vasorum, sekundární infekce nekrózy a vznik abscesu, hemolýza, která byla popsána při embolizaci spirálami, nebo akutní plicní hypertenze (10). Prevencí postembolizačních komplikací je minimalizovat následnou ischémii co možná nejselektivnější aplikací embolizačního materiálu do místa léze. V našem případě jsme nezaznamenali žádnou postembolizační komplikaci. Pokrokem mikrokatetrizačních technik je celkové zmenšení rozsahu postembolizační ischémie renálního parenchymu. Ta je udávána v průměru kolem 11,7 % a 12 měsíců od výkonu 6 % (12). Práce zabývající se funkčními a morfologickými změnami na ledvinách po superselektivní embolizaci hodnotící krátkodobé a dlouhodobé účinky se shodují, že krátkodobé škodlivé účinky superselektivní embolizace provedené pro renovaskulární traumatické poranění jsou výraznější u pacientů se solitární ledvinou. Dlouhodobé sledování však ukazuje funkční a morfologické zlepšení embolizovaných částí ledvin. Tyto práce hodnotily změny na ledvinách pomocí hladiny kreatininu v séru, UZ ledvin, vylučovací urografie, radioizotopového vyšetření ledvin MAG3 (pomocí 99mTc-mercapto-acetyl triglycinu) a DMSA (99mTc-dimercaptosuccinylové kyseliny) (13). Na našem pracovišti jsme od roku 2006 do roku 2010 provedli celkem 266 perkutánních extrakcí konkrementů. Pozdní krvácení z pseudoaneuryzmatu poškozené intrarenální tepny jsme zaznamenali ve dvou případech. Oba případy jsme řešili superselektivní embolizací bez komplikací.
Závěr
Klinicky významné protrahované nebo pozdní sekundární krvácení po perkutánní extrakci konkrementu je komplikace způsobená poraněním artérie. Metodou volby řešení je superselektivní embolizace, což je endovaskulární minimálně invazivní metoda, která přináší bezprostřední terapeutický efekt spojený se zachováním vlastního orgánu.
Došlo: 11. 4. 2011.
Přijato: 8. 6. 2011.
Kontaktní adresa
MUDr. Zdeněk Peremský
Urologické oddělení Nemocnice Most o.z.,
Krajská zdravotní a.s.
J. E. Purkyně 270,
434 01 Most
e-mail: z.peremsky@seznam.cz
Sources
1. Turk C, Knoll T, Petrik A, Sarica K, Straus M, Seitz C. Guidelines on urolithiasis, 2011, March, [online], link: http://www.uroweb.org/gls/pdf/18_Urolithiasis.pdf
2. Skolarikos A, de la Rosette J. Prevention and treatment of complications following percutaneous nephrolithotomy. Current opinion in urology 2008; 18(2): 229–234.
3. Köhler O. Endoskopická léčba uroteliálních karcinomů horních močových cest. Urologické listy 2004; 3 : 53–59.
4. Lewicki A, Jędrzejczyk M, Jakubowski W, et al. Zastosowanie ultrasonograficznych środków kontrastujących (UŚK) w diagnostyce chorób nerek. Część II. Nerka prawidłowa, urazy nerek, choroby naczyń nerkowych, nerka przeszczepiona, ostre odmiedniczkowe zapalenie nerek. Urologia Polska 2008; 61(2): 105–110.
5. Boudný J. Současné postavení angiografie ledvin včetně intervencí. Urologické listy 2006; 4(2): 10–13.
6. Mathieu J, Schulman CC, Struyven J. Percutaneous embolic occlusion of an acquired bleeding intrarenal aneurysm. Eur Urol 1978; 4(3): 212–213.
7. Stoller ML, Wolf JS Jr. Estimated blood loss and transfusion rates associated with percutaneous nephrolithotomy. J Urol 1994; 152 : 1977–1979.
8. Feng MI, Tamaddon K, Mikhail A, et al. Prospective randomized study of various techniques of percutaneous nephrolithotomy. Urology 2001; 58(3): 345–350.
9. Köhler O, Fencl P. Strategie a taktika v léčbě pooperačního krvácení po retrográdní endopyelotomii. Česká urologie 2000; 2 : 9–14.
10. Krajina A, Peregrin JH, et al. Intervenční radiologie, miniinvazivní terapie, 1. vydání. Hradec Králové: O. Čermáková 2005; 116–124.
11. Schwartz MJ, Smith EB, Trost DW, Vaughan ED Jr. Renal artery embolization: clinical indications and experience from over 100 cases. BJU Int 2007; 99(4): 881–886.
12. Chatziioannou A, Brountzos E, Primetis E, et al. Effects of superselective embolization for renal vascular injuries on renal parenchyma and function. European journal of vascular and endovascular surgery the official journal of the European Society for Vascular Surgery 2004; 28(2): 201–206.
13. El-Nahas AR, Shokeir AA, Mohsen T, et al. Functional and morphological effects of postpercutaneus nefrolithotomy superselective renal angiographic embolisation. Urology 2008; 71(3): 408–412.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2011 Issue 3-
All articles in this issue
- INTEGRACE CHIRURGICKÉ A BIOLOGICKÉ LÉČBY U POKROČILÉHO RENÁLNÍHO KARCINOMU
- ČASNÁ CHIRURGICKÁ LÉČBA PORANĚNÍ URETERŮ
- Úloha laparoskopie v diagnostice a léčbě nehmatných varlat
- Infekční onemocnění urogenitálního traktu v anamnéze nemají vliv na biologické chování a prognózu karcinomu prostaty
- Prevalence symptomů hyperaktivního měchýře u pacientů urologických ambulancí
- Pozdní krvácení po perkutánní extrakci konkrementu
- EBU CERTIFIKACE POSTGRADUÁLNÍHO VZDĚLÁVÁNÍ NA UROLOGICKÉ KLINICE LF UK A FN PLZEŇ
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- ČASNÁ CHIRURGICKÁ LÉČBA PORANĚNÍ URETERŮ
- Úloha laparoskopie v diagnostice a léčbě nehmatných varlat
- Pozdní krvácení po perkutánní extrakci konkrementu
- Prevalence symptomů hyperaktivního měchýře u pacientů urologických ambulancí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

