-
Medical journals
- Career
INTEGRACE CHIRURGICKÉ A BIOLOGICKÉ LÉČBY U POKROČILÉHO RENÁLNÍHO KARCINOMU
Authors: Milan Hora 1; Petr Stránský 1; Viktor Eret 1; Ondřej Hes 2; Jindřich Fínek 3; Zdeněk Chudáček 4; Marko Babjuk 5
Authors‘ workplace: Urologická klinika LF UK a FN, Plzeň 1; Šiklův patologicko-anatomický ústav LF UK a FN, Plzeň 2; Onkologické a radioterapeutické oddělení LF UK a FN, Plzeň 3; Radiodiagnostické oddělení FN, Plzeň 4; Urologická klinika 2. LF UK a FNM, Praha 5
Published in: Ces Urol 2011; 15(3): 149-157
Category: Review article
Overview
Zavedení biologické léčby metastatického renálního karcinomu (mRK) od roku 2006 do určité míry mění i úlohu chirurgické léčby RK. Smyslem článku je dát přehled o integraci chirurgické a biologické léčby u mRK. Biologickou léčbou jsou zde myšleny tři skupiny léků: inhibitory tyrosinkinázy (TKI – sunitinib, sorafenib, pazopanib), mTOR inhibitory (temsirolimus a everolimus) a protilátky proti VEGF (bevacizumab).
Byly zpracovány dostupné informace o dané problematice získané zejména cestou PubMed. Většina poznatků se týká užití sunitinibu.
Cytoreduktivní nefrektomie (CRNE) měla jednoznačný profit prokázaný v době léčby cytokiny. V době biologické léčby zatím nemáme výsledky teprve se rozbíhajících prospektivních randomizovaných studií, ale některé dílčí informace z jiných studií ukazují na možnost profitu z CR NE i v době biologické léčby. Na indikaci neoadjuvantní a adjuvantní léčby zatím nemáme odpověď, opět studie zatím probíhají. Zmenšení inoperabilního tumoru (downsizing) lze očekávat jen asi u 30 % pacientů po asi 2–3 cyklech.
CRNE je u pacientů v dobrém biologickém stavu stále indikována. Laparoskopický přístup je akceptován. Dostatečný je i výkon záchovný, je-li technicky možný. Nedostatečný efekt CRNE je u pacientů ve špatném biologickém stavu, vysoce rizikových tumorů, u tumorů ≥ T3, u metastáz jater, symptomatických metastáz, postižení uzlin retroperitonea a mediastina, elevací LHD a poklesu albuminu. Zmenšení tumoru předoperačně (downsizing) pomocí biologické léčby je indikováno jen přísně individuálně. Neoadjuvantní i adjuvantní léčba jsou zatím cílem klinických studií bez indikace v každodenní klinické praxi. Vysazení TKI před operací se doporučuje alespoň 24 hodin, opětovné nasazení nejdříve za 4 týdny. Bevacizumab je nutné vysadit minimálně 4 týdny před operací.Klíčová slova:
nefrektomie, cytoreduktivní, biologická léčba, sunitinib.ÚVOD
Je známým faktem, že incidence zhoubných nádorů ledvin je v České republice nejvyšší na celém světě. V rámci České republiky je nejvyšší v Plzeňském kraji, na druhém místě v kraji Jihočeském. Poměr incidence/mortalita byl v roce 2007 v České republice 43 %. To znamená, že téměř polovina pacientů s nádorem ledviny na něj umírá (1). Konkrétně v roce 2007 na C 64 zemřelo v České republice 1199 lidí. U pacientů s generalizovaným (metastazovaným) renálním karcinomem (mRK) je prognóza špatná a průměrná doba přežití je do či kolem jednoho roku a dvouleté přežití je mezi 10–20 % (2, 3). U RK bylo a stále zůstává jedinou šancí na vyléčení časná diagnostika tumoru ledviny s následnou chirurgickou léčbou. Imunoterapie pro léčbu mRK zavedená v devadesátých letech 20. století na tomto tvrzení díky své nízké účinnosti pramálo změnila. Současná medicína stále nedokáže mRK vyléčit, ale v posledních letech se vyhlídky lidí s mRK přeci jen o něco zlepšují. Od roku 2006 se dostalo do klinické praxe postupně již šest léků tzv. biologické léčby (targeted therapy) (tab. 1) umožňující pozitivně ovlivnit průběh mRK. Tato léčba je v České republice v rukách onkologů, nicméně léčba má široké konsekvence i pro práci urologů. Cílem přehledného článku je sumarizovat poznatky o integraci chirurgické a biologické léčby. Konkrétně pojednává o cytoredukční nefrektomii (CR NE), dále jsou zmíněny i „downsizing“, neoadjuvantní a adjuvantní léčba a úloha metastazektomie.
Table 1. Přehled léků určených pro léčbu mRK v České republice (stav k 4/2011) Table 1. Review of drugs approved for treatment of metastatic renal cell carcinoma in the Czech Republic (status to April 2011) 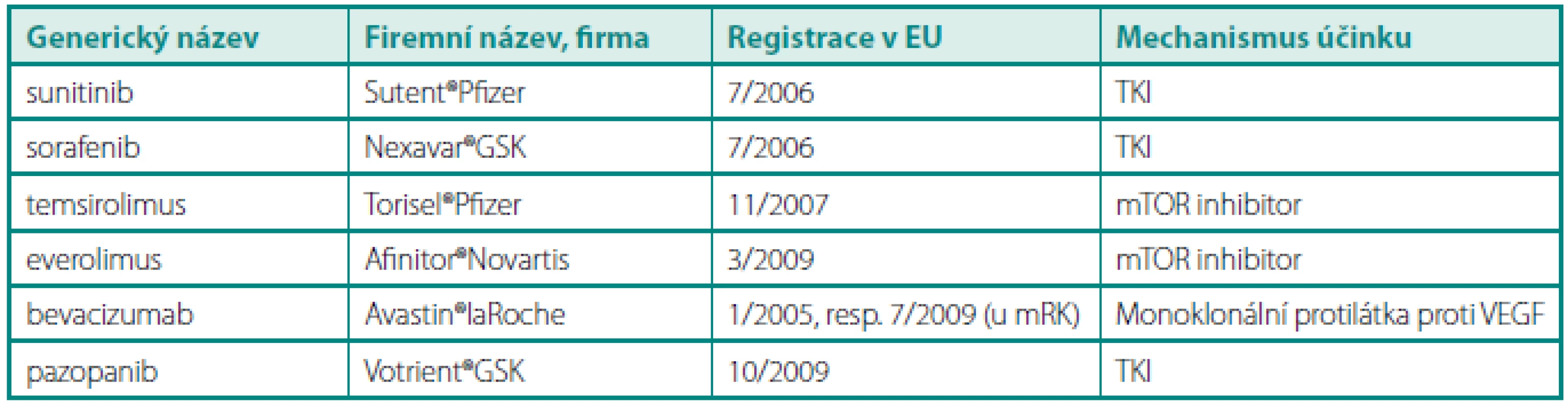
TKI – inhibitor tyrozinkinázy, mTOR (mammalian target of rapamycin) – proteinkináza CYTOREDUKTIVNÍ (CYTOREDUKČNÍ) NEFREKTOMIE V ÉŘE CYTOKINŮ
CR NE byla dříve indikována z důvodů paliativních v rámci léčby bolestí, hematurie a paraneoplastických syndromů (2). Ale již roku 1978 byl popsán určitý byť minimální efekt samotné CRNE u mRK (4). Došlo se k poznání, že CR NE může sice vzácně (v méně než 2 %), ale přece vést ke spontánní regresi onemocnění (5, 6). A tak CR NE začala být šířeji prováděna. Dalším impulzem byla devadesátá léta, kdy studie u imunoterapie prováděné s cytokiny u mRK prokázaly efekt předcházející CR NE. Ne sice kurativní, ale nabízela zlepšené celkové přežití. Nejdříve se jednalo poznatky z retrospektivních studií (2). Tyto studie z jednotlivých institucí vykazovaly odpověď u 8–39 % s mediánem přežití 12–30 měsíců.
Přesvědčivý důkaz významu CR NE ve spojení s imunoterapií u mRK podaly dvě prospektivní randomizované studie, jejichž výsledky byly publikovány v roce 2001. Mickisch et al. (7) randomizovali ve studii EORCT 30947 (European Organization for Research and Treatment of Cancer) 83 pacientů. Čas do progrese (PFS – progression-free survival) byl 5 vs. 3 měsíce (HR – hazard ratio – poměr rizika 0,60, 95 % CI – confidential interval – 95% interval spolehlivosti 0,36–0,97) a průměrné přežití 17 vs. 7 měsíců (0,54, 0,31–0,94). Ve prospěch CR NE. Flanigan et al. (8) ve studii SWOG 8949 (the Southwest Oncology Group) randomizovali 241 pacientů. Průměrné přežití bylo 11,1 vs. 8,1 měsíce ve prospěch CR NE.
Důvody, proč je přežití po CR NE lepší než bez ní, nejsou známy, uvádí se řada spekulací, ale ani poslední léta nepřinesla v této oblasti žádné zásadní poznatky. Pro úplnost uveďme nejčastěji uváděné hypotézy: tumor ledviny vychytává protilátky, imunitní buňky a protinádorové léky. Další teorie je, že nádorové buňky mohou produkovat proangiogenní růstové faktory. A v souvislosti s TKI se spekuluje, že TKI inhibují efekt těchto růstových faktorů produkovaných primárním tumorem (9).
CYTOREDUKTIVNÍ NEFREKTOMIE V ÉŘE BIOLOGICKÉ LÉČBY
V éře cytokinů byla tedy situace jasná. Pacient, který měl mRK, byl v dobrém biologickém stavu, byl schopen a ochoten podstoupit nefrektomii a měl možnost být poté léčen cytokiny, byl indikován k CR NE. Jak ale zmíněno v úvodu, od roku 2006 se v léčbě mRK začala užívat biologická léčba. Velmi zjednodušeně lze říci, že tato léčba se cílí zejména na růstový faktor VEGF (vascular endothelial growth factor), který je nutný k novotvorbě cév. Blokováním VEGF se omezí novotvoření cév, a tím růst nádorových ložisek. Se zavedením biologické léčby se otázka CR NE znovu otevřela. K dnešnímu dni nemáme zatím žádné výsledky z dobře designovaných prospektivních randomizovaných studií. Ty jsou teprve zahajovány a jsou zmíněné níže. Musíme tedy vycházet jen z dílčích výsledků studií, které se na úlohu CR NE přímo nezaměřovaly. Některé práce hovoří ve prospěch CR NE (10–12), jiné naopak (13, 14). V práci Motzera et al. srovnávající léčbu sunitinib vs. interferon alfa u mRK (10) vykazovali pacienti s předchozí CR NE dobu do progrese 11měsíců (11–13) oproti 6 měsícům (4–11); p = 0,0889. Choueiri et al. recentně publikovali (12) retrospektivní sledování 314 pacientů s mRK, z nichž 201 podstoupilo CR NE. Pacienti, kteří podstoupili CR NE, byli statisticky signifikantně mladší, v lepším biologickém stavu (s lepším Karnofsky performance status), s více než jedním místem metastáz a s nižší korigovanou hladinou kalcia. Medián celkového přežití u nich byl 19,8 měsíce vs. 9,4 (HR 0,44; 95 % CI 0,32, 0,59; p < 0,01) ve prospěch CR NE. V subanalýze dle rizikových skupin (nízké, střední a vysoké riziko) měli pacienti s vysokým rizikem jen marginální benefit (p = 0,06) a obdobně s Karnofsky performance status < 80 % (p = 0,08). Práci uzavírají s tím, že CR NE byla v retrospektivní studii spojena s prodloužením celkového přežití u pacientů s mRK léčených léky zasahujícími VEGF (vascular endothelial growth factor). Marginální efekt je u vysoce rizikových nádorů.
Efekt CR NE potvrdilo i retrospektivní hodnocení 43 143 pacientů z databáze SEER (Surveillance, Epidemiology, and End Results) z let 1988–2004 (15). Celkem 5372 mělo mRK, 2447 z nich (45,5 %) podstoupilo CRNE, zbytek (2925, 54,5 %) nikoliv. Přežití v 1, 2, 5 a 10 letech bylo s CR NE 53,6%, 36,3%, 19,4%, a 12,7% oproti skupině bez CRNE 18,5%, 7,4%, 2,3% a 1,2%. Nádorově specifické přežití (cancer-specific survival rate) bylo 58,1%, 40,8%, 24,3%, a 18,8% oproti 24,4%, 11,0%, 4,1%, a 2,9%. Byl tedy dán důkaz o efektivitě CR NE.
Culp et al. (16) hodnotili (též retrospektivně) skupinu 566 pacientů léčených pro mRK a definovali 7 parametrů, které predikovaly špatný efekt CR NE: elevace LDH (laktát dehydrogenázy), nižší hladina albuminu, symptomatické metastázy, jaterní metastázy, retroperitoneální lymfadenopatie, supradiafragmatická lymfadenopatie, klinická klasifikace tumoru ≥ T3. Efekt CR NE se zhoršuje s počtem negativních prognostických parametrů.
You et al. (11) hodnotili retrospektivně 78 pacientů léčených pro mRK biologickou léčbou, 45 po CRNE, 33 bez ní. Medián období bez progrese byl 11,7 vs. 9,0 měsíce ve prospěch skupiny s CR NE (p = 0,27) a medián celkového přežití 21,6 vs. 13,9 měsíce (p = 0,128).
Při multivarietní analýze byly Karnofsky performance status (HR 2,9, 95% CI 1,4–5,7, p = 0,003) a sarkomatoidní varianta (HR 2,9, 95% 1,3–6,7, p = 0,013) nezávislými prediktory přežití bez progrese. Karnofsky performance status (HR 3,3, 95% 1,7–6,5, p = 0,001), sarkomatoidní varianta (HR 2,7, 95% 1,2–6,2, p = 0,021) a jaterní metastázy (HR 2,7, 95% 1,0–7,1, p = 0,045) byly nezávislými prediktory celkového přežití. Autoři práci uzavírají s tím, že nenalezli statisticky signifikantní rozdíly a budou nutné prospektivní studie.
Richey et al. (14) retrospektivně zhodnotili 188 pacientů léčených biologickou léčbou (sunitinib, bevacizumab, pazopanib) bez CR NE. Jednalo se u 54,8 % o středně rizikový a u 44,1 % o vysoce rizikový tumor. Medián celkového přežití byl 10,4 měsíce. Ve srovnání s historickým přežitím po léčbě s IFN-α (7,8 měsíce) došlo k prodloužení přežití. Práci uzavírají s tím, že biologická léčba u pacientů s mRK bez CR NE má lepší přežití než v éře imunoterapie. Úloha CR NE je tedy nejasná. Práci ale zpochybňuje Escudier (17), zejména kvůli jejímu retrospektivnímu charakteru a řadu možných zkreslení.
Definitivní odpověď na úlohu CR NE nám dají teprve zahajované prospektivní randomizované studie. Nově se rozbíhají dvě studie zaměřující se na efekt CR NE – studie CARMENA a EORTC-30073. Podstatnější se zdá být CARMENA, EORTC-30073 ale zodpoví některé doplňkové otázky. Ve studii CARMENA (Clinical Trial to Assess the Importance of Nephrectomy; NCT00930033) (18, 19) byl náběr pacientů zahájen 2010 a výsledky se očekávají v roce 2016. Do studie jsou zařazováni pacienti s mRK, v dobrém biologickém stavu (ECOG PS 0 či 1) a bez předchozí léčby. Jsou randomizováni do dvou skupin – CR NE s následnou léčbou sunitinibem či léčba pouhým sunitinibem. Primárním sledovaným cílem je celkové přežití. Druhou studií je studie EORTC-30073 (the European Organisation for Research and Treatment of Cancer, NCT01099423) (18). Její název je Immediate Surgery or Surgery After Sunitinib Malate in Treating Patients With Metastatic Kidney Cancer. Studie byla zahájena v dubnu 2010 a výsledky jsou očekávány v říjnu 2014. Pacienti jsou rozděleni do dvou ramen. V prvním rameni se provádí okamžitá CR NE a za 4 týdny se zahájí léčba sunitinibem celkem 4 cykly (standardní schéma 4/2 – 4 týdny léčby a 2 týdny pauza). V druhém rameni je CR NE odložená. Podává se sunitinib 3 cykly (opět schéma 4/2), den po ukončení se provede CR NE a poté následující dva cykly sunitinibu 4/2.
Technické provedení CR NE se neliší od standardní radikální NE. Je třeba ale připomenout, že i zde má přednost laparoskopie, tedy minimálně u tumorů T1-2, není-li možná resekce (20), jak je zmíněno níže. Onkologické výsledky laparoskopické NE jsou srovnatelné s otevřenou, ale s výrazně nižší morbiditou a umožňují včasné zahájení biologické léčby (21). U lokalizovaných tumorů ledviny se stala již u kategorií T1a a i T1b standardem resekce ledviny, je-li technicky možná (20). V souvislosti s CR NE se však vždy pomýšlelo jen na radikální nefrektomii. Ale už je dokázáno, že i u mRK mají své místo ledvinu šetřící výkony (22–25). Vyplývá to zejména ze dvou velkých studií. První z nich srovnávala 2042 CR NE a 46 CR resekcí (24). Výsledky práce potvrdila data ze SEER. Z 2950 případů mRK, kteří podstoupili nefrektomii, byla u 2 % (70) indikována jen parciální nefrektomie. U resekce bylo riziko úmrtí na mRK 0,49 nižší oproti radikální nefrektomii (95 % CI 0,35–0,69, p < 0,001) (25). Dle těchto studií je u mRK místo CR NE dostatečně efektivní resekční výkon, je-li technicky možný (22–25).
DOWNSIZING A ADJUVANTNÍ BIOLOGICKÁ LÉČBA
V současnosti již běží studie s podáváním adjuvantní biologické léčby u rizikových pacientů. Tabulka 2 uvádí běžící studie fáze 3. Do ukončení těchto studií lze adjuvantní léčbu podávat právě pouze v rámci klinických studií. U downsizingu je cílem zajistit operabilitu původně inoperabilního nádoru. Jeho efekt je ale pozorován jen asi u 30 % indikovaných (19). Když se efekt dostaví, lze maximální efekt očekávat za 2–3 měsíce, takže se doporučují 3 cykly sunitinibu (což je celkem 18 týdnů) (9). U primárního tumoru lze efekt očekávat velmi zřídka a zmenšení tumoru nepřesahuje 30 % (28). V literatuře nicméně lze nalézt řadu kazuistik efektivity u uzlinového postižení či regrese nádorového trombu (29–32). V současné klinické praxi by downsizing měl být zvolen v individuálních případech, kdy primární operabilita není možná (obr. 1).
Table 2. Přehled probíhajících klinických studí s adjuvantní léčbou u renálního karcinomu Table 2. Review of clinical trials with adjuvant treatment in renal cell carcinoma 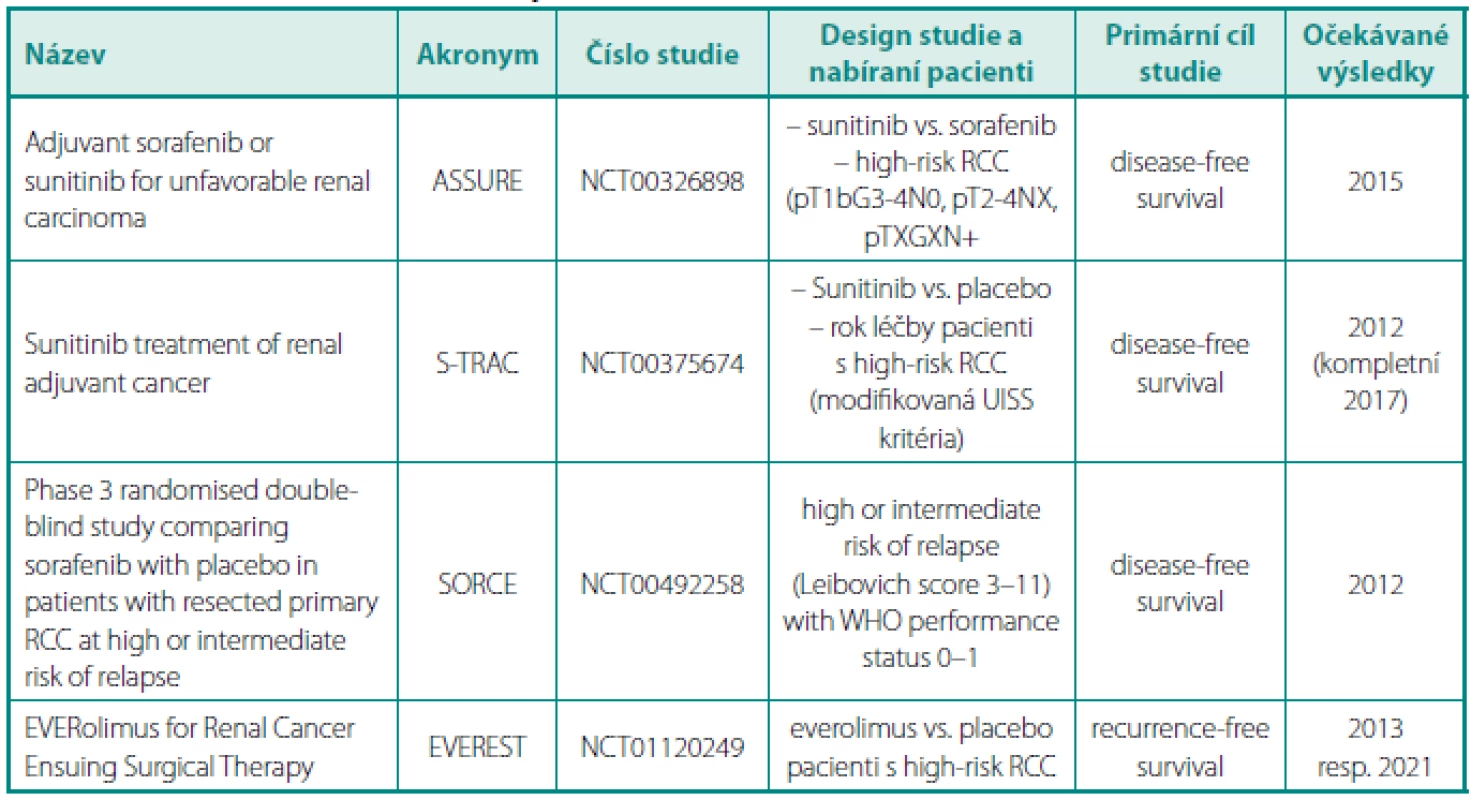
NCT – national clinical trial, UISS – UCLA Integrated Staging System (26, 27) Podrobnosti o studiích viz www.clinicaltrials.gov Image 1. Žena, 57 let, objemný tumor pravé ledviny T3aN2M0. Primární tumor uložený v dolním pólu a střední části ledviny v největším rozměru 10 cm, mnohočetné objemné splývající pakety uzlin před i za dolní dutou žilou zaujímající do sebe i hilové cévy. Nález hodnocen jako radikálně inoperabilní. Biopsií pod CT verifikován světlobuněčný renální karcinom grade 2 dle Fuhrmannové. Nález byl indikován k downsizingu pomocí biologické léčby. Pacientka léčbu sunitinibem bohužel špatně toleruje (zvracení). 1A –axiální řez, 1B – ární řez, 1C – ální řez Fig. 1. Woman 57-year-old with advanced renal tumour of the right kidney T3aN2M0, biopsy clear renal cell carcinoma, grade 2 by Fuhrmann. Tumour was indicated for downsizing with sunitinib. Unfortunately, the patient intolerates it due to vomiting. 1A – section, 1B – section, 1C – section 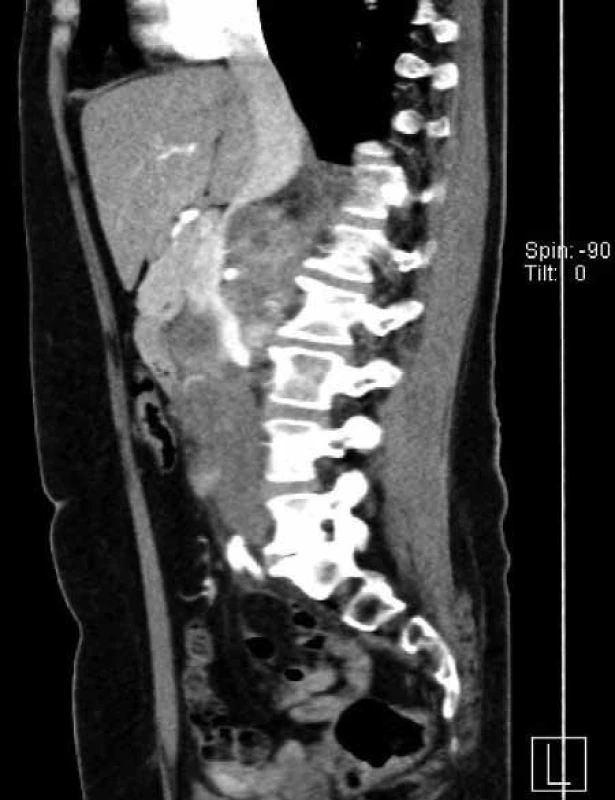
Provedení nefrektomie či resekce ledviny bezprostředně po vysazení biologické léčby by s sebou mohlo nést problémy s hojením rány, lokální progresi onemocnění před CRNE a růst tumoru v období vysazení léků během CRNE. Na tuto problematiku částečně odpovídá studie Powlese et al. (33). Práce publikuje výsledky dvou podobných studií z Holandska a Velké Británie a souhrnná práce potvrdila bezpečnost provedení CRNE po předchozí léčbě 2 čí 3 cyklů sunitinibem. Další výsledky v tomto směru jistě přinese zmíněná studie EORTC-30073. Jinak vysazení biologické léčby před chirurgickým výkonem se doporučuje minimálně 24 hodin před operací u TKI (9), jenž mají krátký poločas v řádu desítek hodin. Někteří autoři ale doporučují interval až 2 týdny (34). U bevacizumabu majícího poločas 21 dní se jeho předoperační podávání buď raději nedoporučuje (34) anebo by musel být vysazen minimálně 4 týdny před operací, u resekčních výkonů raději 6 týdnů, jak známo z využití bevacizumabu u kolorektálního karcinomu (35). Opětovné nasazení biologické léčby po chirurgickém výkonu je doporučováno v případě bezproblémového hojení až za 4 týdny (35).
CHIRURGICKÁ LÉČBA METASTÁZ
Obecně je přijímán názor, že chirurgická resekce omezeného počtu orgánových metastáz renálního karcinomu, je-li technicky možná, přináší pacientovi profit. Je však třeba zdůraznit, že toto doporučení vychází pouze z retrospektivních pozorování (36, 37). Výsledky se v údajích jednotlivých autorů významně liší v závislosti na konkrétním složení hodnoceného souboru. Pětileté přežití se pohybuje mezi 16 % a 69 % (36). Kavolius publikoval výsledky souboru 141 nemocných, u kterých byly radikálně odstraněny orgánové metastázy zachycené během sledování po nefrektomii (metachronní metastázy). Nejpříznivější výsledky byly spojeny s resekcí solitární metastázy, kde dosáhlo pětileté přežití 52 % oproti 29 % při resekci mnohočetných ložisek. Nejlepší prognózu (pětileté celkové přežití v 63 %) měli pacienti se solitárními ložisky ve žlázových orgánech (štítná žláza, slinné žlázy, pankreas, nadledvina, ovaria) následované nemocnými se solitárními plicními metastázami (pětileté celkové přežití v 54 %) (36). Van der Poel (37) potvrdil na souboru 101 pacientů se synchronními (zachycenými současně s primárním nádorem) i metachronními ložisky relativně dobrou prognózu nemocných po resekci plicních metastáz ve srovnání s ložisky v jiných lokalitách. Ve své analýze však neprokázal rozdíl mezi nádorově specifickým přežitím u solitárních a mnohočetných ložisek (37).
Na základě těchto pozorování byla chirurgická exstirpace solitární nebo omezeného počtu metastáz v případě jejich operability v době imunoterapie jednoznačně indikována. Vzhledem k tomu, že dostupná data v souvislosti s biologickou léčbou nejsou k dispozici, je tento koncept léčby doporučován i v současnosti. Teoreticky indikaci metastasektomie podporuje i skutečnost, že biologická léčba prodlužuje dobu do progrese i přežití, ale obvykle nevede k trvalému vyléčení pacienta. Metastasektomie by oproti tomu měla dávat šanci na vyléčení.
Jinou otázkou je indikace chirurgického výkonu po léčbě systémové, v případě jejího dobrého efektu. Již v éře imunoterapie bylo pozorováno, že u pacientů s dobrou odpovědí na systémovou léčbu lze dosáhnout velmi dobrých výsledků chirurgickou resekcí reziduálních nádorových ložisek (38). Vzhledem k předpokladu častější a lepší odpovědi u cílené biologické léčby bude zřejmě tento multimodální přístup v budoucnu využíván mnohem častěji (39). Konkrétní doporučení však budou muset být podložena širší zkušeností a prospektivními studiemi.
ZÁVĚR
Závěrem lze shrnout, že CRNE je i v době biologické léčby u pacientů v dobrém biologickém stavu zatím stále indikována. Nedostatečný efekt je u pacientů ve špatném biologickém stavu, vysoce rizikových tumorů, u tumorů ≥ T3, u metastáz jater, symptomatických metastáz, postižení uzlin retroperitonea a mediastina, elevací LHD a poklesu albuminu. Definitivní odpověď na úlohu CR NE dají až probíhající klinické studie, zejména CARMENA. Zmenšení (downsizing) inoperabilního tumoru předoperačně je indikováno jen přísně individuálně. Neoadjuvantní i adjuvantní léčba jsou zatím cílem klinických studií bez indikace v každodenní klinické praxi. Vysazení TKI před operací se doporučuje alespoň 24 hodin, lépe ale několik dní, opětovné nasazení nejdříve za 4 týdny. Bevacizumab je nutné vysadit minimálně 4 týdny před operací. Metatasektomie solitární metastázy či omezeného množství metastáz je stále indikována.
Práce byla podpořena výzkumným záměrem MSM 0021620819.
Došlo: 4. 5. 2011.
Přijato: 12. 7. 2011.
Kontaktní adresa
prof. MUDr. Milan Hora, Ph.D., MBA
Urologická klinika LF UK a FN
E. Beneše 13,
305 99 Plzeň
e-mail: horam@fnplzen.cz
Sources
1. Epidemiologie zhoubných nádorů v České republice, www.svod.cz
2. Kwan KG, Kapoor A. Cytoreductive nephrectomy in metastatic renal cell carcinoma: the evolving role of surgery in the era of molecular targeted therapy. Curr Opin Support Palliat Care 2009; 3 : 157–165.
3. Polcari AJ, Gorbonos A, Milner JE, Flanigan RC. The role of cytoreductive nephrectomy in the era of molecular targeted therapy. In t J Urol 2009; 16 : 227–233.
4. Dekernion JB, Ramming KP, Smith RB. The natural history of metastatic renal cell carcinoma: a computer analysis. J Urol 1978; 120 : 148–152.
5. Montie JE, Stewart BH, Straffon RA, et al. The role of adjunctive nephrectomy in patients with metastatic renal cell carcinoma. J Urol 1977; 117 : 272–275.
6. Marcus SG, Choyke PL, Reiter R, et al. Regression of metastatic renal cell carcinoma after cytoreductive nephrectomy. J Urol 1993; 150 : 463–466.
7. Mickisch GH, Garin A, van Poppel H, dePrijck L, Sylvester R. Radical nephrectomy plus interferon-a-based immunotherapy compared with interferon-a alone in metastatic renal-cell carcinoma: a randomised trial. Lancet 2001; 358 : 966–970.
8. Flanigan RC, Salmon SE, Blumenstein BA, Bearman SI, Rov V, McGrath PC, Caton JR Jr, Munshi N, Crawford ED. Nephrectomy followed by interferon a-2b compared with interferon a-2b alone for metastatic renal-cell cancer. N Engl J Med 2001; 345 : 1655–1659.
9. Bex A, Jonasch E, Kirkali Z, Majean A, Mulders P, Oudard S, Patard JJ, Powles T, Poppel H, Wood CG. Integrating surgery with targeted therapies for renal cell carcinoma: current evidence and ongoing trials. Eur Urol 2010; 58 : 819–828.
10. Motzer RJ, Figlin RA, Hutson TE, et al. Sunitinib versus interferonalfa (IFN-a) as first-line treatment of metastatic renal cell carcinoma (mRCC): Updated results and analysis of prognostic factors. J Clin Oncol 2007; 25 : 5024.
11. You D, Jeong IG, Ahn JH, Lee DH, Lee JL, Hong H, Ahn H, Kim CS. The value of cytoreductive nephrectomy for metastatic renal cell carcinoma in the era of targeted therapy. J Urol 2011; 195 : 54–59.
12. Choueiri TK, Xie W, Kollmannsberger C, North S, Knox JJ, Lampard JG, McDermott DF, Rini BI, Heng DY. The impact of cytoreductive nephrectomy on survival of patients with metastatic renal cell carcinoma receiving vascular endothelial growth factor targeted therapy. J Urol 2011; 185(1): 60–66.
13. Szczylik C, Porta C, Bracarda S, et al. Sunitinib in patients with or without prior nephrectomy (Nx) in an expanded access trial of metastatic renal cell carcinoma (mRCC). J Clin Oncol 2008; 26(Suppl): Abstract 5124.
14. Richey SL, Culp SH, Jonasch E, Corn PG, Pagliaro LC, Tamboli P, Patel KK, Matin SF, Wood CG, Tannir NM. Outcome of patients with metastatic renal cell carcinoma treated with targeted therapy without cytoreductive nephrectomy. Ann Oncol 2010 (Epub ahead of print).
15. Zini L, Capitanio U, Perrotte P, Jeldres C, Shariat SF, Arjane P, Widmer H, Montorsi F, Patard JJ, Karakiewicz PI. Population-based assessment of survival after cytoreductive nephrectomy versus no surgery in patients with metastatic renal cell carcinoma. Urology 2009; 73(2): 342–346.
16. Culp SH, Tannir NM, Abel EJ, Margulis V, Tamboli P, Matin SF, Wood CG. CanWe Better Select Patients With Metastatic Renal Cell Carcinoma for Cytoreductive Nephrectomy? Cancer 2010; 116 : 3378–3388.
17. Escudier B. Benefit of cytoreductive nephrectomy in metastatic RCC: do we learn from retrospective studies and small prospective studies? Ann Oncol 2011 (Epub ahead of print).
18. Clinical trials, www.clinicaltrials.gov
19. Bex A, van der Veldt AAM, Blank C, van den Eeertwegh AJM, Boven E, Horenblas S, Haanen J. Neoadjuvant sunitinib for surgically complex advanced renal cell cancer of doubtful resectability: initial experience with downsizing to reconsider cytoreductive surgery. World J Urol 2009; 27 : 533–539.
20. Ljungberg B, Cowan NC, Hanbury DC, Hora M, Kuczyk MA, Merseburger AS, Patard JJ, Mulders PF, Sinescu IC. EAU Guidelines on Renal Cell Carcinoma: The 2010 Update. Eur Urol 2010; 58(3): 398–403.
21. Matin SF, Madsen LT, Wood CG. Laparoscopic cytoreductive nephrectomy: The M.D. Anderson cancer center experience. Urology 2006; 68 : 528–532.
22. Krambeck AE, Leibovich BC, Lohse CM, Kwon ED, Zincke H, Blute ML. The role of nephron sparing surgery for metastatic (pM1) renal cell carcinoma. J Urol 2006; 176(5): 1990–1995.
23. Hutterer GC, Patard JJ, Colombel M, et al. Cytoreductive nephron sparing surgery does not appear to undermine disease-specific survival in patients with metastatic renal cell carcinoma. Cancer 2007; 110 : 2428–2433.
24. Capitanio U, Zini L, Perrotte P, Sharlat SF, Jejdres C, Arjane P, Pharand D, Widmer H, Péloquin F, Montorsi F, Patard JJ, Karakiewicz PI. Cytoreductive partial nephrectomy does not undermine cancer control in metastatic renal cell carcinoma: a population-based study. Urology 2008; 72 : 1090–1095.
25. Hellenthal NJ, Mansour AM, Hayn MH, Schwaab T. Is there a role for partial nephrectomy in patients with metastatic renal cell carcinoma? Urol Oncol 2011 (Epub ahead of print).
26. Patard JJ, Kim HL, Lam JS, et al. Use of the University of California Los Angeles integrated staging system to predict survival in renal cell carcinoma: An international multicenter study. J Clin Oncol 2004; 22(16): 3316–3322.
27. Tan MH, Kanesvaran R, Li H, Tan HL, Tan PH, Wong CF, Chia KS, Teh BT, Yuen J, Chong TV. Comparison of the UCLA Integrated Staging System and the Leibovich score in survival prediction for patients with nonmetastatic clear cell renal cell carcinoma. Urology 2010; 75(6): 1365–1370.
28. Abel EJ, Culp SH, Tannnir NM, Matin SF, Tamboli P, Jonasch E, Wood CG. Primary tumor response to targeted agents in patients with metatatic renal cell carcinoma. Eur Urol 2011; 59 : 10–15.
29. Karakiewicz PI, Suardi N, Jeldres C, et al. Neoadjuvant sutent induction therapy may effectively down-stage renal cell carcinoma atrial thrombi. Eur Urol 2008; 53 : 845–848.
30. Robert G, Gabbay G, Bram R, Wallerand H, Deminière C, Cornelis F, Bernhard JC, Ravaud A, Ballanger P. Case study of the month. Complete histologic remission after sunitinib neoadjuvant therapy in T3b renal cell carcinoma. Eur Urol 2009; 55(6): 1477–1480.
31. Patard JJ, Thuret R, Raffi A, Laguerre B, Bensalah K, Culine S. Treatment with sunitinib enabled complete resection of massive lymphadenopathy not previously amanable to excision in a patient with renal cell carcinoma, Eur Urol 2009; 55 : 237–239.
32. Thomas AA, Rini BI, Lane BR, Garcia J, Dreicer R, Klein EA, Novick AC, Campbell SC. Response of the primary tumor to neoadjuvant sunitinib in patients with advanced renal cell carcinoma. J Urol 2009; 181(2): 518–523.
33. Powles T, Kayani I, Blank C, Chowdhury S, Horenblas S, Peters J, Shamash J, Sarwar N, Boletti K, Sadev A, O‘Brien T, Berney D, Beltran L, Haanen J, Bex A. The safety and efficacy of sunitinib before planned nephrectomy in metastatic clear cell renal cancer. Ann Oncol 2011 (in print), doi: 10.1093/annonc/mdq65
34. Harshman LC, Yu RJ, Allen GI, Srinivas S, Gill HS, Chung BI. Surgical outcomes and complications associated with presurgical tyrosine kinase inhibition for advanced renal cell carcinoma (RCC). Urol Oncol 2011 (Epub ahead of print).
35. Mariani P. The safety of perioperative bevacizumab use. J Chir (Paris) 2010; 147(Suppl 1): S12–S17.
36. Kavolius, J.P., Mastorakos, D.P., Pavlovich, C, et al. Resection of metastatic renal cell carcinoma. J Clin Oncol 1998; 16 : 2261–2266.
37. Van der Poel, H.G., Roukema, J.A., Horenblas, S, et al. Metastasectomy in renal cell carcinoma: a multicenter retrospective analysis. Eur Urol 1999; 35 : 197–203.
38. Krishnamurthi V, Novick AC, Bukowski RM. Efficacy of multimodality therapy in advanced renal cell carcinoma. Urology 1998; 51 : 933–937.
39. Rini BI, Shaw V, Rosenberg JE, et al. Patiens with metastatic renal cell carcinoma with longterm disease-free survival after treatment with sunitinib and resection of residual metastases. Clin Genitourin Cancer 2006; 5(3): 232–234.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2011 Issue 3-
All articles in this issue
- INTEGRACE CHIRURGICKÉ A BIOLOGICKÉ LÉČBY U POKROČILÉHO RENÁLNÍHO KARCINOMU
- ČASNÁ CHIRURGICKÁ LÉČBA PORANĚNÍ URETERŮ
- Úloha laparoskopie v diagnostice a léčbě nehmatných varlat
- Infekční onemocnění urogenitálního traktu v anamnéze nemají vliv na biologické chování a prognózu karcinomu prostaty
- Prevalence symptomů hyperaktivního měchýře u pacientů urologických ambulancí
- Pozdní krvácení po perkutánní extrakci konkrementu
- EBU CERTIFIKACE POSTGRADUÁLNÍHO VZDĚLÁVÁNÍ NA UROLOGICKÉ KLINICE LF UK A FN PLZEŇ
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- ČASNÁ CHIRURGICKÁ LÉČBA PORANĚNÍ URETERŮ
- Úloha laparoskopie v diagnostice a léčbě nehmatných varlat
- Pozdní krvácení po perkutánní extrakci konkrementu
- Prevalence symptomů hyperaktivního měchýře u pacientů urologických ambulancí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



