-
Medical journals
- Career
Infekční onemocnění urogenitálního traktu v anamnéze nemají vliv na biologické chování a prognózu karcinomu prostaty
Authors: Jan Hrbáček 1; Michael Urban 1,5; Václav Eis 2; Eva Hamšíková 3; Ruth Tachezy 3; Marek Brabec 4; Jiří Heráček 1,5
Authors‘ workplace: Urologická klinika 3. LF UK a FNKV, Praha 1; Ústav patologie 3. LF UK a FNKV, Praha 2; Ústav hematologie a krevní transfuze, Praha 3; Ústav informatiky Akademie věd ČR, oddělení nelineárního modelování, Praha 4; Androgeos, Praha 5
Published in: Ces Urol 2011; 15(3): 172-180
Category: Original article
Overview
Cíl:
Souvislost mezi infekčním onemocněním urogenitálního traktu a karcinomem prostaty se ani po 20 letech výzkumů na tomto poli nepodařilo prokázat. Zatím se však nikdo nezabýval otázkou, zda infekce nemůže ovlivnit vlastnosti a průběh tohoto maligního onemocnění.Materiál a metoda:
Možnou spojitost mezi přítomností sérových protilátek (znakem prodělané infekce) proti rozličným pohlavně přenosným infekčním činitelům a biologickým chováním karcinomu prostaty jsme hledali na souboru 317 pacientů, kteří podstoupili radikální prostatektomii pro klinicky lokalizovaný karcinom prostaty. Do naší studie případů a kontrol jsme zahrnuli tyto sexuálně přenosné uropatogeny: lidský cytomegalovirus, herpes simplex virus 1 a 2, lidský papillomavirus 6, 11, 16, 18, 31 a 33, Chlamydia trachomatis, Mycoplasma pneumoniae, Ureaplasma urealyticum, Neisserii gonorrhoeae a Treponemu pallidum.Výsledky:
Přítomnost a titry specifických protilátek jsme vyhodnotili ve vztahu k histopatologickým charakteristikám tumoru: k lokálnímu rozsahu, Gleasonovu skóre a hladině prostatického specifického antigenu. Žádné klinicky významné rozdíly jsme nenalezli.Závěr:
Neprokázali jsme vztah mezi biologickým chováním karcinomu prostaty (tedy jeho prognózou) a prodělaným infekčním onemocněním urogenitálního traktu.Klíčová slova:
infekce, karcinom prostaty, pohlavně přenosné nemoci, staging nádoru.ÚVOD
Incidence karcinomu prostaty (KP) v České republice vykazuje v posledních 20 letech setrvalý vzestup. V roce 2007 činila 102,1/100 tisíc mužů, což odpovídá počtu 50,0 nových případů na 100 000 obyvatel obou pohlaví (1). V Evropské unii představoval v roce 2006 KP 20 % všech zhoubných nádorů s výjimkou kožních malignit (2) a ve Spojených státech amerických v roce 2010 dokonce 28 %. To znamená 217 730 nových případů a 32 050 úmrtí, neboli 11 % ze všech úmrtí na zhoubné nádory v USA (3).
Výborné výsledky léčby lokalizovaného onemocnění dnes kontrastují s neuspokojivou prognózou pacientů, u nichž nádor přesáhl hranice orgánu. Určení rizikových faktorů pro agresivnější chování KP, jeho rychlejší lokální šíření a posléze i metastazování by umožnilo rozdělit pacienty z hlediska prognózy a případně upravit strategii léčby.
Za posledních 20 let vzniklo přes 50 studií, jež se metodami sérologie a tkáňové detekce nukleových kyselin snažily prokázat případnou spojitost mezi infekcí urogenitálními patogeny šířenými především pohlavní cestou a vznikem KP. Mezi nejčastěji studovaná agens patřili jednak klasičtí původci sexuálně přenosných chorob Neisseria gonorrhoeae a Treponema pallidum, jednak běžné urogenitální patogeny dnešní doby: Chlamydia trachomatis, lidský papillomavirus (HPV), herpes simplex virus (HSV) a další. Přes různorodou metodologii výběru pacientů definici kontrolní skupiny i použitých laboratorních metod neprokázaly publikované práce žádnou konzistentní spojitost mezi urogenitální infekcí a rizikem vzniku KP (4).
Pokud je nám známo, nezabývala se zatím žádná studie otázkou, zda infekce urogenitálními infekčními agens nepřispívá k agresivnějšímu chování nádoru. Tato hypotéza je ospravedlnitelná vzhledem k tomu, že některá agens jsou prokazatelně onkogenní a u jiných se o této vlastnosti spekuluje. Její ověření pochopitelně vyžaduje exaktní histopatologický rozbor chirurgem odstraněné tkáně, nejlépe z radikální prostatektomie.
V naší studii jsme sérologickými metodami zjišťovali přítomnost protilátek proti nejběžnějším urogenitálním infekčním činitelům. Výsledky jsme vyhodnotili ve vztahu k lokální pokročilosti nádoru dle stadií klasifikace TNM, k jeho agresivitě vyjádřené Gleasonovým skóre (GS) a k předoperační hodnotě plazmatické koncentrace prostatického specifického antigenu (PSA).
METODA
Do studie jsme zařadili 317 pacientů, kteří v letech 2004–2010 podstoupili na Urologické klinice 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady otevřenou radikální retropubickou prostatektomii (RRP) pro klinicky lokalizovaný KP (5, 6). Demografické charakteristiky souboru shrnuje tabulka 1. Schéma náboru pacientů přehledně osvětluje obrázek 1. Všichni účastníci studie podepsali informovaný souhlas schválený Etickou komisí 3. LF UK a Interní grantové agentury Ministerstva zdravotnictví ČR.
Table 1. Demografické a klinicko-patologické charakteristiky studovaného souboru Table 1. Demographic, clinical and pathological characteristics of the study population 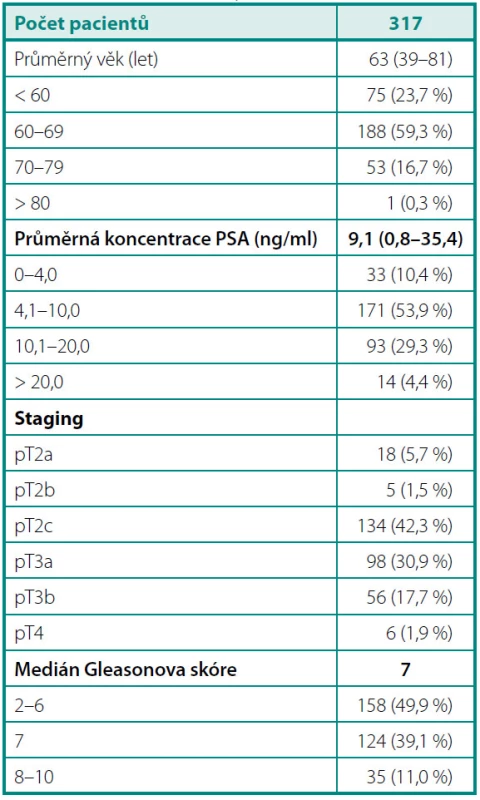
Image 1. Schéma náběru pacientů do studie Fig. 1. Patient flow diagram 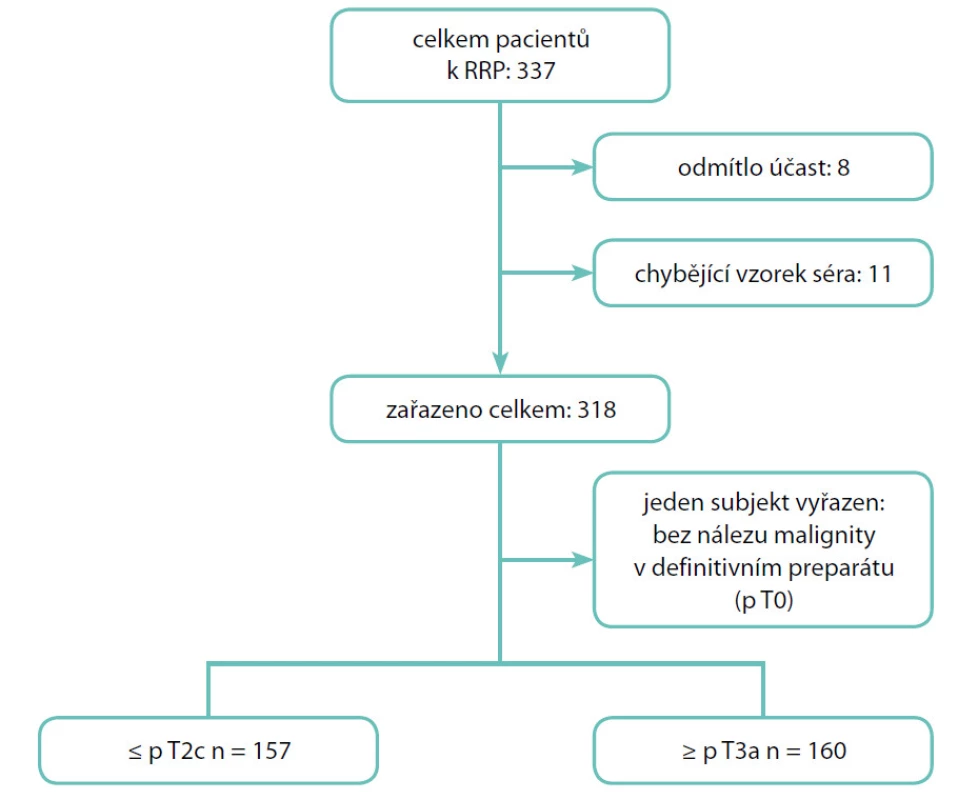
Zpracování tkáňových vzorků Bezprostředně po odběru tkáně jsme resekáty dopravili do Ústavu patologie k dalšímu zpracování. Vzorky z radikální prostatektomie jsme kompletně zpracovali podle schématu popsaného Montironim (7). Preparát jsme změřili, povrch označili tuší, semenné váčky amputovali a zpracovali zvlášť. Odřízli jsme apex a bázi prostaty v šířce 10 mm – tyto dvě části se krájely kolmo k povrchu paralelně s průběhem uretry. Zbylou tkáň prostaty jsme krájeli v tenkých lamelách (3–4 mm) kolmo k průběhu uretry a vše zalili do bločků.
Vzorky tkáně jsme fixovali v 10% pufrovaném formalínu a zalili do parafínu. Mikroskopické řezy šířky 5 μm jsme barvili hematoxylinem a eosinem a hodnotili pomocí světelné mikroskopie. Definitivní popis zahrnoval histologický typ nádoru dle klasifikace WHO (8), GS s primárním, sekundárním a případně terciárním stupněm (9), staging nádoru (10), procentuální zhodnocení rozsahu nádoru, rozsah lokální invaze do periprostatických měkkých tkání či do semenných váčků, posouzení perineurálního šíření, vyjádření k angioinvazi a posouzení chirurgického okraje resekátu (11). Jako pozitivní chirurgický okraj byla hodnocena přítomnost nádorových buněk přímo v okraji resekátu označeném tuší.
Sérologická vyšetření
Každému pacientovi jsme v den operačního výkonu mezi 6. a 8. hodinou ranní odebrali vzorek periferní žilní krve. Po 20minutové centrifugaci rychlostí 2000 otáček/min. jsme odebrali alikvoty séra a zmrazili je při teplotě -80 °C až do dalšího zpracování.
Detekce protilátek
Přítomnost protilátek proti Ch. trachomatis, HSV 1 a 2, lidskému cytomegaloviru (CMV), N. gonorrhoeae, T. pallidum, M. hominis a U. urealyticum jsme prokazovali metodou ELISA (Enzyme-Linked ImmunoSorbent Assay), testem vazby komplementu a testem nepřímé imunofluorescence s využitím komerčně dostupných diagnostických souprav. Všechny testy jsme prováděli dle pokynů výrobců. Protilátky proti HPV jsme detekovali přímým testem ELISA, jako antigeny jsme použili tzv. virům podobné částice (virus-like particles, VLP).
Detekce specifických protilátek proti HPV
Příprava viru podobných částic
Hmyzí buňky Sf9 jsme namnožili v suspenzi v TNM-FH hmyzím médiu (SIGMA) s 10 % fetálního telecího séra. Přibližně 4 × 109 buněk při multiplicitě infekce 10 PFU/buňku jsme infikovali rekombinantním bakulovirem, nesoucím gen pro kapsidový protein HPV L1. Sedmdesát dvě hodiny po infekci byly buňky sklizeny, propláchnuty pufrovaným fyziologickým roztokem (PBS) a zmrazeny při teplotě -20 °C. Buněčný pelet jsme resuspendovali ve 40 ml extrakčního pufru (10 mmol/l MgCl2, 50 mmol/l CaCl2, 150 mmol/l NaCl, 0,01% Triton X-100, 20 mmol/l HEPES, pH 7,4) a buňky rozbíjeli ultrazvukem 3 × 30 sekund při 0 °C. Sedimentovaný pelet jsme znovu resuspendovali ve 40 ml extrakčního pufru a celou proceduru zopakovali. Spojené supernatanty jsme nasytili chloridem cesným do 30% koncentrace a centrifugovali 22 hodin při 45 000 otáčkách/min. a 18 °C. Horní proužek jsme rozdělili na „step“ gradientu chloridu cesného (36,0–30,5–16,0 %) 4 hodiny při 35 000 otáčkách/min. a 18 °C. Přítomnost kapsid v odpovídajícím proužku jsme zjišťovali SDS - -polyakrylamidovou elektroforézou (koncentrace proteinů), Western blottingovou analýzou a testem ELISA se specifickými monoklonálními protilátkami.
Detekce protilátek
Pro zjištění přítomnosti specifických protilátek v sérech jsme použili metodu ELISA, antigeny byly VLP odpovídající HPV nízce rizikových typů 6 a 11 a vysoce rizikových typů 16, 18, 31 a 33. Na povrch jamek mikrotitračních destiček (Polysorp NUNC immunoplate, Thermo Fisher Scientific, Dánsko) jsme navázali VLP v 50 μl PBS v koncentraci 2 μg/ ml dvě hodiny při teplotě 37 °C a přes noc při 4 °C. U všech dalších jednohodinových inkubací při 37 °C vždy následovalo pětinásobné promytí jamek promývacím roztokem A (PBS, 0,21 mol/1 NaCl, 0,1% Triton X-100). Potenciálně volná vazebná místa jamek se vysytila 1% roztokem BSA v PBS a poté jsme k jamkám přidávali v paralelách séra ředěná 1 : 25 v roztoku A s 1% BSA. Navázané protilátky jsme označili oslím imunoglobulinem proti lidskému IgG (H a L řetězec), konjugovaným s křenovou peroxidázou (Jackson ImmunoResearch Laboratories, Inc, West Grove, PA, USA), ředěným 1 : 7500 v roztoku A s 1% BSA a barevná reakce byla vyvolána 0,04% roztokem o-fenylendiaminu v substrátovém pufru (50 mmol/l fosfátový-citrátový pufr, pH 5,0) s 0,006 % peroxidu vodíku. Reakci jsme zastavili přidáním 2 mol/l roztokem kyseliny sírové a vyhodnotili spektrofotometricky jako optickou denzitu (OD) s referenční vlnovou délkou 492 a 630 nm (Infinite 200 microplate reader, TECAN, Rakousko). Pro zjištění reaktivity pozadí jsme stejná séra vyšetřovali na mikrotitrační destičce bez antigenu (pouze BSA). Na každou destičku se vždy zařazovala standardní pozitivní a negativní kontrola proti danému antigenu. Od hodnoty OD séra, získané na mikrotitrační destičce s VLP, byla odečtena hodnota OD stejného séra na destičce kontrolní. Pro každý antigen a destičku jsme vypočítali hraniční hodnotu (cut-off, CO) jako aritmetický průměr rozdílů OD plus dvě směrodatné odchylky; séra s rozdílem OD vyšším než hodnota vypočtená jsme vyloučili a proceduru opakovali tak dlouho, dokud hodnota rozdílu OD žádného ze zbývajících sér nebyla vyšší. Všechny výsledky testů ELISA jsme vyjádřili jako tzv. OD index (podíl mezi rozdílem OD daného séra a hodnotou CO), který do určité míry ukazuje sílu protilátkové odpovědi. Testovaná séra s OD indexem vyšším než 1 jsme označili jako pozitivní. Pro konfirmaci výsledků jsme všechny vzorky s OD indexem do 10 % nad hodnotou CO znovu dvakrát testovali a jako pozitivní označili ty, které byly pozitivní opakovaně. Pro kontrolu jsme opakovaně testovali také čtvrtinu vzorků z celého souboru (12).
Statistický rozbor
Metodami popisné statistiky jsme vyhodnotili demografická a klinická data pacientů včetně zastoupení jednotlivých stadií lokálního šíření nádoru a jeho agresivity dle GS (tab. 1). U všech subjektů jsme kvalitativně a případně i kvantitativně vyšetřili vzorky sér na přítomnost protilátek proti zkoumaných infekčním činitelům.
Pomocí Wilcoxonova neparametrického testu jsme hledali možnou spojitost mezi séropozitivitou a výší plazmatické hladiny PSA, mezi séropozitivitou a výškou kombinovaného GS a konečně mezi výškou titrů sérových protilátek a lokální pokročilostí nádoru. Všechny testy byly vyhodnoceny na 5% hladině významnosti za použití statistického software „R“ (http//www.r-project.org). Při zpracování článku jsme se řídili současnými mezinárodními doporučeními pro publikaci výsledků observačních studií (13).
VÝSLEDKY
Do studie jsme zařadili celkem 317 pacientů průměrného věku 63 (39–81) let, s průměrnou sérovou koncentrací PSA 9,1 ng/ml. Více než polovina operovaných měla PSA v „šedé zóně“ 4,1–10,0 ng/ml. V definitivních histopatologických nálezech byly stejnou měrou zastoupeny lokalizované (49,5 %) a lokálně pokročilé (50,5 %) formy onemocnění. Polovina pacientů (49,8 %) měla GS ≤ 6; 11 % nádorů spadalo mezi agresivní typy s GS 8–10.
V průměrné výšce hladiny PSA (tab. 2) jsme nezaznamenali žádný statisticky významný rozdíl mezi pacienty s protilátkami proti jednotlivým infekčním činitelům a séronegativními jedinci. Porovnáním průměrů GS mezi těmito skupinami (tab. 3) jsme zjistili jediný statisticky signifikantní rozdíl v případě protilátek proti HPV 6. Séropozitivní pacienti měli vyšší průměrnou hodnotu GS než muži bez průkazu protilátek v séru (6,75 vs. 6,45, p = 0,0305). Ve výšce titrů sérových protilátek jsme nenalezli žádný statisticky významný rozdíl mezi skupinou s lokalizovaným a lokálně pokročilým onemocněním (tab. 4).
Table 2. Srovnání průměrných hladin prostatického specifického antigenu (ng/ml) u séronegativních a séropozitivních pacientů Table 2. Mean prostate specific antigen levels (ng/ml) in seronegative and seropositive subjects 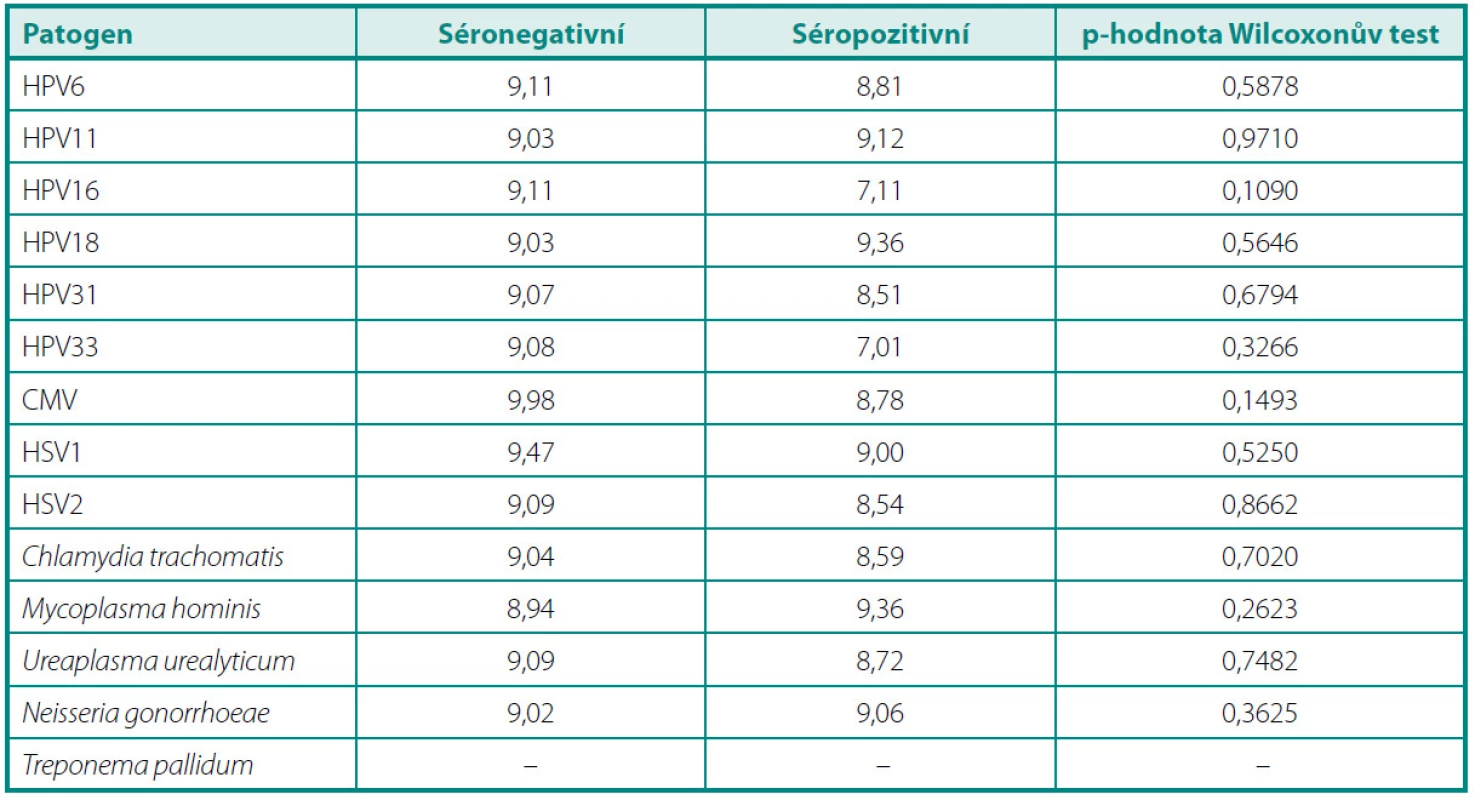
Table 3. Průměrné hodnoty Gleasonova skóre u séronegativních a séropozitivních pacientů Table 3. Mean Gleason score in seronegative and seropositive patients 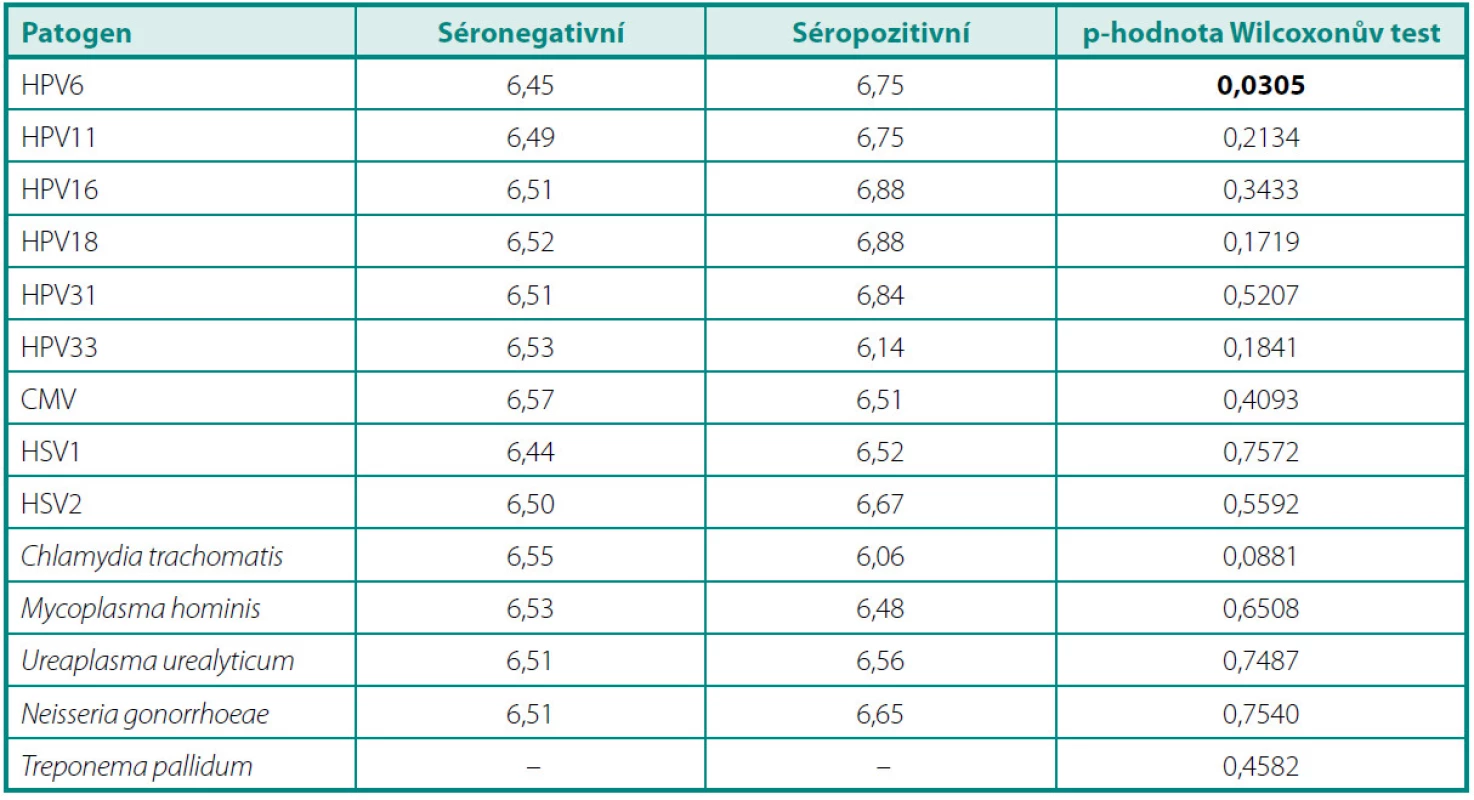
Table 4. Podmíněně průměrné (tj. vypočítané pouze z reaktivních sér) hladiny titrů sérových protilátek proti jednotlivým patogenům v OD/CO (optická denzita/hodnota cut-off) u pacientů s lokalizovaným a pokročilým onemocněním Table 4. Serum antibody levels for different genitourinary pathogens in patients with localized and locally advanced disease. Only reactive serum samples (OD/CO > 1.0) were considered for the calculation of mean values 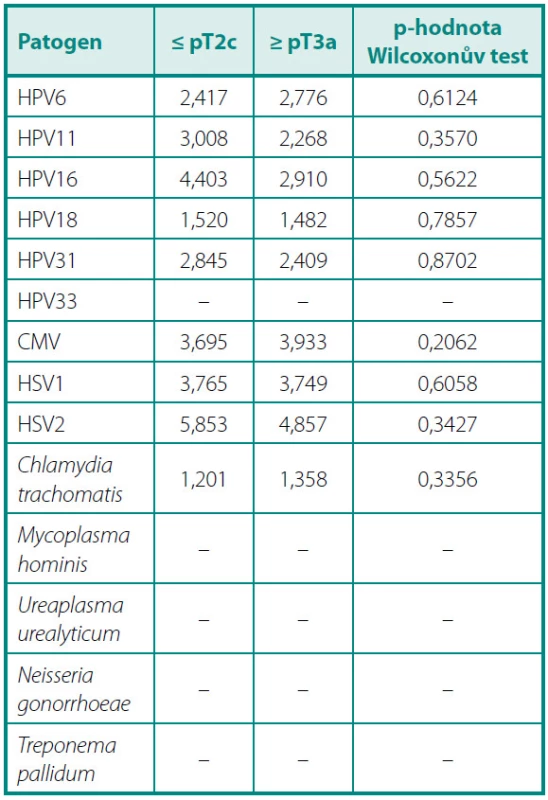
Prevalenci protilátek specifických pro jednotlivá infekční agens v našem studovaném souboru jsme porovnali s daty o prevalenci protilátek v obecné populaci získanými z literatury (obr. 2).
Image 2. Graf srovnávající séroprevalenci proti specifickým protilátkám ve studovaném souboru s údaji z literatury Svislá osa: séroprevalence v procentech; světlé sloupce: údaje z našeho souboru; tmavé sloupce: údaje z literatury; *(osobní sdělení, Eva Hamšíková, Praha 2011) Fig. 2. This figure compares our study population’s seroprevalence rates with those found in the literature Vertical axis: percentages of seroprevalence; fair columns: our data; dark columns: data published elsewhere *(personal communication, Eva Hamšíková, Prague 2011) 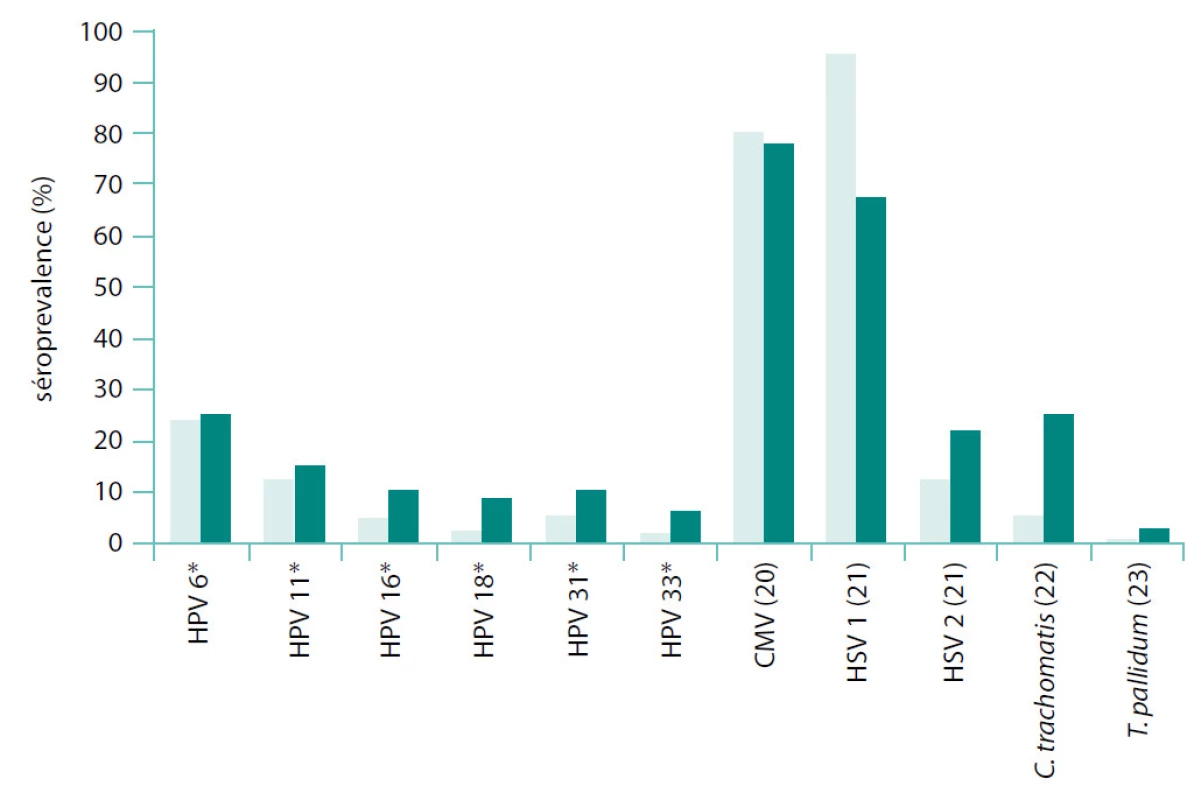
DISKUSE
Navzdory velikosti zkoumaného souboru a zahrnutí řady uropatogenních mikroorganismů do statistických rozborů se nám nepodařilo prokázat, že by prodělaná urogenitální infekce ovlivňovala biologické chování karcinomu prostaty. Jediným statisticky signifikantním zjištěním byl rozdíl v průměrné výšce GS mezi pacienty s protilátkami proti HPV 6 a jejich séronegativními protějšky. Ačkoliv statisticky významná, z klinického pohledu se tato odlišnost průměrné hodnoty GS 6,45 v séronegativní a 6,75 v séropozitivní skupině nejeví jako podstatná. Jednak představuje rozdíl 0,3 na škále GS od 2 do 10 přibližně 4% body, jednak – a to je podstatné – se stále pohybujeme v pásmu GS 2–7, pro něž (při splnění dalších kritérií) aktuální guidelines Evropské urologické společnosti doporučují jako hlavní modalitu léčby RRP (14).
V patologii lidského urogenitálního traktu jsou sérotypy HPV 6 a 11 spojovány s benigními slizničními a kožními lézemi – jejich DNA nalézáme v 90 % špičatých kondylomat (15). V souvislosti s HPV je zajímavé zmínit postižení jiného orgánového systému. Je jím nezhoubné onemocnění dýchacího traktu – recidivující respirační papilomatóza, u které dochází asi v 1 % případů k malignímu zvratu.
Dle publikovaných prací byly v buňkách malignizovaných forem této vzácné choroby detekovány nukleové kyseliny HPV 11, v menším počtu případů i typu HPV 6 (16). V některých případech byla zjištěna integrace HPV do genomu hostitelské buňky či změny v genomu virů, které mohly být příčinou jejich zvýšeného onkogenního potenciálu (17).
V minulosti si řada studií kladla otázku, zda prodělaná infekční onemocnění urogenitálního traktu zvyšují riziko pozdějšího vzniku KP. Většinou se jednalo o rozsáhlé epidemiologické výzkumy, kde k zařazení do skupiny pacientů postačoval pozitivní výsledek punkční biopsie prostaty nebo diagnóza incidentálního karcinomu při transuretrální resekci prostaty či otevřené prostatektomii indikované pro benigní hyperplazii. Bližší údaje charakterizující vlastnosti nádoru se zaznamenávaly jen zřídka a prakticky nikdy nebývaly publikovány.
Pokud je nám známo, nikdo – a to ani ve světové literatuře – se dosud nezabýval problematikou infekce a karcinomu prostaty z takového úhlu pohledu jako naše studie. Důvodem je nejspíše to, že k provedeným analýzám (stanovení rozsahu nádoru a definitivního GS) je třeba vyšetřit celou prostatu – tedy preparát z RRP, což je technicky a organizačně náročné a pro tisícové soubory popisované epidemiology nevhodné. Naše výsledky nenaznačují, že by existoval klinicky významný rozdíl v prevalenci protilátek proti studovaným patogenům v závislosti na gradingu a stagingu KP.
Dosud se také žádná studie nezabývala klinickým vztahem infekce mykoplazmaty a ureaplazmaty a KP. Běžně tyto patogeny působí negonokokové uretritidy, epididymitidy a dle některých prací také chronickou prostatitidu (18). Poslední zmíněná kategorie je zajímavá zejména ve světle recentní studie z USA, ve které benigní prostatické buňky infikované mykoplazmaty in vitro kumulovaly mutace genomu. Po inokulaci těchto buněk laboratorním myším došlo in vivo ke vzniku invazivních nádorů (19). Ani v případě ureaplazmat a mykoplazmat jsme na našem souboru nezjistili významné odlišnosti mezi skupinou s prokázanými sérovými protilátkami a séronegativními kontrolami.
Na závěr naší studie jsme porovnali prevalence protilátek proti studovaným patogenům u pacientů s KP zjištěné v naší studii s údaji uváděnými pro obecnou populaci (viz obr. 1). Zjištěné hodnoty séroprevalence jsou v zásadě srovnatelné, drobné odchylky připisujeme odlišným charakteristikám referenčních populací včetně geografických rozdílů v promořenosti jednotlivými patogeny.
Za hlavní možná úskalí naší studie považujeme ne zcela prozkoumanou dynamiku výše sérových protilátek proti některým ze studovaných patogenů a také relativně malou velikost souboru. První zmíněný problém je způsoben nedostatkem publikovaných prací, které by se touto otázkou zabývaly, druhý je dán technickými a finančními omezeními.
ZÁVĚR
Četnými sérologickými studiemi ani molekulárně biologickými analýzami nádorové tkáně se dosud nikomu nepodařilo prokázat vliv infekce urogenitálního traktu na etiopatogenezi KP. Naše výsledky potvrzují tato pozorování a dále je rozšiřují o studium vztahu s dalšími, dříve nezkoumanými patogeny. Přítomnost sérových protilátek proti studovaným infekčním agens není spojena s agresivnějším chováním, a tedy horší prognózou karcinomu prostaty. Prodělaná infekce močopohlavního ústrojí zkoumanými patogeny není rizikovým faktorem pro klinicky závažnější průběh tohoto častého nádorového onemocnění. To platí i přesto, že někteří infekční činitelé přenášení pohlavní cestou jsou prokazatelně onkogenní a u dalších se o této vlastnosti spekuluje.
Došlo: 14. 4. 2011.
Přijato: 17. 5. 2011.
Kontaktní adresa
doc. MUDr. Jiří Heráček, Ph.D.
Urologická klinika 3. LF UK a FNKV
Šrobárova 50,
100 34 Praha 10
e-mail: heracek@fnkv.cz
Práce byla podpořena grantem IGA MZ NS9984.
Sources
1. Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice (online). Masarykova univerzita 2005 (cit. 2011–5–14). Dostupný z: http://www.svod.cz/ report.php?diag=C61&type=pdf. Verze 7.0 (2007).
2. Marberger M. Prostate cancer 2008: Challenges in diagnosis and management. Eur Urol Suppl 2009; 3 : 89–96.
3. Jemal A, Siegel R, Xu J, Ward E. Cancer Statistics, 2010. CA Cancer J Clin 2010; 60 : 277–300.
4. Hrbáček J, Urban M, Hamsikova E, et al. Serum antibodies against genitourinary infectious agents in prostate cancer and benign prostate hyperplasia patients: a case-control study. BMC Cancer 2011; 11 : 53.
5. Reiner WG, Walsh PC. An anatomical approach to the surgical management of the dorsal vein and Santorini’s plexus during radical retropubic surgery. J Urol 1979; 121 : 198–200.
6. Walsh PC. Anatomic radical prostatectomy. Evolution of the surgical technique. J Urol 1998; 160 : 2418–2424.
7. Montironi R, van der Kwast T, Boccon-Gibod L, Bono AV, Boccon-Gibod L. Handling and patology reporting of radical prostatectomy specimens. Eur Urol 2003; 44 : 626–636.
8. Eble JN, Kauter G, Epstein JI, Sesterhenn I. Pathology and genetics of tumours of the urinary system and male genital organs (IARC/World Health Organization Classification of Tumours). Lyon, France: IARC Press 2003.
9. Epstein JI, Allsbrook WC, Amin MB, Egevad LL. ISUP Grading Committee: The 2005 International Society of Urological Pathology (ISUP) Consensus conference on Gleason grading of prostatic carcinoma. Am J Surg Pathol 2005; 29(9): 1228–1242.
10. Sobin LH, Wittekind CH. TNM Classification of Malignant Tumours, 6th Edition. New York Wiley 2002.
11. Srigley JR, Amin MB, Epstein JI, et al. Updated protocol for the examination of specimens from patients with carcinomas of the prostate gland. Arch Pathol Lab Med 2006; 130(7): 936–946.
12. Hamsikova E, Smahel M, Sapp M, et al. Correlation between the presence of anti HPV33 VLP antibodies and HPV DNA in cervical neoplasia patients. Arch Virol 1997; 142(2): 413–416.
13. von Elm E, Altman DG, Egger M, et al. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: guidelines for reporting observational studies. J Clin Epi 2008; 61 : 344–349.
14. Heidenreich A, Bolla M, Joniau S, et al. Guidelines on Prostate Cancer. EAU 2010. s. 55. http://www.uroweb.org/gls/pdf/Prostate%20Cancer%202010%20June%2017th.pdf
15. Giuliano AR, Tortolero–Luna G, Ferrer E, et al. Epidemiology of Human Papillomavirus Infection in Men, Cancers otherthan Cervical and Benign Conditions. Vaccine 2008; 26(Suppl 10): K17–K28.
16. Jeong WJ, Park SW, Shin M, et al. Presence of HPV type 6 in dysplasia and carcinoma arising from recurrent respiratory papillomatosis. Head Neck 2009; 31(8): 1095–1101.
17. Reidy PM, Dedo HH, Rabah R, et al. Integration of human papillomavirus type 11 in recurrent respiratory papilloma–associated cancer. Laryngoscope 2004; 114 : 1906–1909.
18. Porš J, Kolombo I, Hanuš T, Poršová M. Sexuálně přenosné nemoci. In: Kolombo I, Hanuš T, eds. Infekce močových cest pro praktické lékaře a specialisty. Praha: Galén 2007; 111–113.
19. Namiki K, Goodison S, Porvasnik S, et al. Persistent exposure to Mycoplasma induces malignant transformation of human prostate cells. PLoS ONE 2009; 4(9): e6872. doi:10.1371/journal. pone.0006872
20. Staras SAS, Dollard SC, Radford KW, et al. Seroprevalence of cytomegalovirus infection in the United States, 1988–1994. Clin Inf Dis 2006; 43 : 1143–1151.
21. Xu F, Schillinger JA, Sternberg MR, et al. Seroprevalence and Coinfection with Herpes Simplex Virus Type 1 and Type 2 in the United States, 1988 – 1994. J Infect Dis 2002; 185 : 1019–1024.
22. Zprávy CEM 1998; Suppl 1 : 34–36.
23. Hayes RB, Pottern LM, Strickler H, et al. Sexual behaviour, STDs and risks for prostate cancer. Br J Cancer 2000; 82(3): 718–725.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2011 Issue 3-
All articles in this issue
- INTEGRACE CHIRURGICKÉ A BIOLOGICKÉ LÉČBY U POKROČILÉHO RENÁLNÍHO KARCINOMU
- ČASNÁ CHIRURGICKÁ LÉČBA PORANĚNÍ URETERŮ
- Úloha laparoskopie v diagnostice a léčbě nehmatných varlat
- Infekční onemocnění urogenitálního traktu v anamnéze nemají vliv na biologické chování a prognózu karcinomu prostaty
- Prevalence symptomů hyperaktivního měchýře u pacientů urologických ambulancí
- Pozdní krvácení po perkutánní extrakci konkrementu
- EBU CERTIFIKACE POSTGRADUÁLNÍHO VZDĚLÁVÁNÍ NA UROLOGICKÉ KLINICE LF UK A FN PLZEŇ
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- ČASNÁ CHIRURGICKÁ LÉČBA PORANĚNÍ URETERŮ
- Úloha laparoskopie v diagnostice a léčbě nehmatných varlat
- Pozdní krvácení po perkutánní extrakci konkrementu
- Prevalence symptomů hyperaktivního měchýře u pacientů urologických ambulancí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

