-
Medical journals
- Career
Klinický fenotyp a genetická diagnostika raritného syndrómu cutis laxa u polystigmatizovaného novorodenca
Authors: Lenhartová Nina 1; Kršiaková Jana 1; Maťašová Katarína 2; Zibolen Mirko 2
Authors‘ workplace: Oddelenie lekárskej genetiky, Univerzitná nemocnica Martin 1; Neonatologická klinika JLF UK a Univerzitná nemocnica Martin 2
Published in: Čes-slov Pediat 2022; 77 (4): 226-231.
Category: Case Report
doi: https://doi.org/10.55095/CSPediatrie2022/037Overview
De Barsyho syndróm, známy aj pod názvom cutis laxa typu III (ARCL3), je raritný autozomálne recesívne dedičný syndróm charakterizovaný faciálnou dysmorfiou, progeroidným vzhľadom, voľnou starecky vyzerajúcou kožou, prenatálnou a postnatálnou rastovou retardáciou a intelektuálnym postihnutím, s pridruženými okulárnymi príznakmi, atetoidnými pohybmi a hyperreflexiou. Známky tohto syndróm sú manifestné už pri narodení a mal by byť v povedomí klinického genetika privolaného k novorodencovi prezentujúcemu sa progeroidným vzhľadom. Diferenciálne diagnostický algoritmus zahŕňa posúdenie klinického fenotypu, pátranie po mikroskopických a submikroskopických chromozómových aberáciách a DNA analýzu kandidátnych génov identifikovaných vzhľadom na fenotyp a symptomatológiu pacienta. Prezentujeme prípad polystigmatizovaného novorodenca s progeroidným vzhľadom, prehľad jeho klinického fenotypu a diagnostický postup v rámci odboru klinickej genetiky.
Klíčová slova:
cutis laxa – de Barsyho syndróm – neonatálny progeroidný syndróm – PYCR1
Úvod
De Barsyho syndróm je autozomálne recesívne dedičné ochorenie spojené s progeroidnými črtami a zmeneným charakterom kože manifestné už v neonatálnom období. Prvýkrát bol popísaný v roku 1968 u dieťaťa s oligofréniou a degeneráciou elastického tkaniva kože, neskôr doplnený o rozsiahly popis klinického fenotypu u ďalších pacientov.(1,2) Prevalencia v populácii nie je známa, doteraz bolo popísaných okolo 35 prípadov z 22 rodín na svete. Molekulárno - -genetická podstata tohto ochorenia bola objasnená v roku 2009 mapovaním homozygotných oblastí genómu piatich kosanguinných rodín.(3) Identifikované boli dva gény asociované s de Barsyho syndrómom (pozri tab. 2) a najmenej 6 génov asociovaných s ostatnými typmi syndrómov cutis laxa,(4) pričom pacienti s klinicky diagnostikovanými neonatálnymi progeroidnými syndrómami sa objavili už aj v slovenskej a českej literatúre.(5,6) V tejto kazuistike prezentujeme prípad pediatrickej pacientky s progeroidným vzhľadom pri narodení, vývoj jej klinického fenotypu od novorodeneckého obdobia a diagnostický postup v rámci odboru klinickej genetiky. Zdravotné údaje a fotografie pacientky boli získané, spracované a uverejnené s písomným súhlasom jej zákonného zástupcu.
Kazuistika
Prezentovaná pacientka (obr. 1–8, tab. 1) sa narodila zdravým rodičom z druhej komplikovanej gravidity. Prenatálnym ultrasonografickým vyšetrením boli identifikované viaceré abnormality: oligohydramnion, intrauterínna rastová reštrikcia (IUGR), dysplázia chodidiel a suspícium na vývojovú chybu mozgu. Biochemický skríning v I. a II. trimestri bol bez patologického nálezu. Matka absolvovala prenatálne genetické vyšetrenie s negatívnym výsledkom diagnostiky aneuploidií pomocou fluorescenčnej in situ hybridizácie (FISH) a normálnym karyotypom. V rodinnej anamnéze nefiguroval údaj o výskyte vrodených vývojových chýb či dedičných ochorení.
Image 1. Fenotyp v novorodeneckom veku. Pozorovaná bola progeroidná facies, voľná suchá tenká koža s presvitajúcou cievnou kresbou, vrodená vývojová chyba dolných končatín. 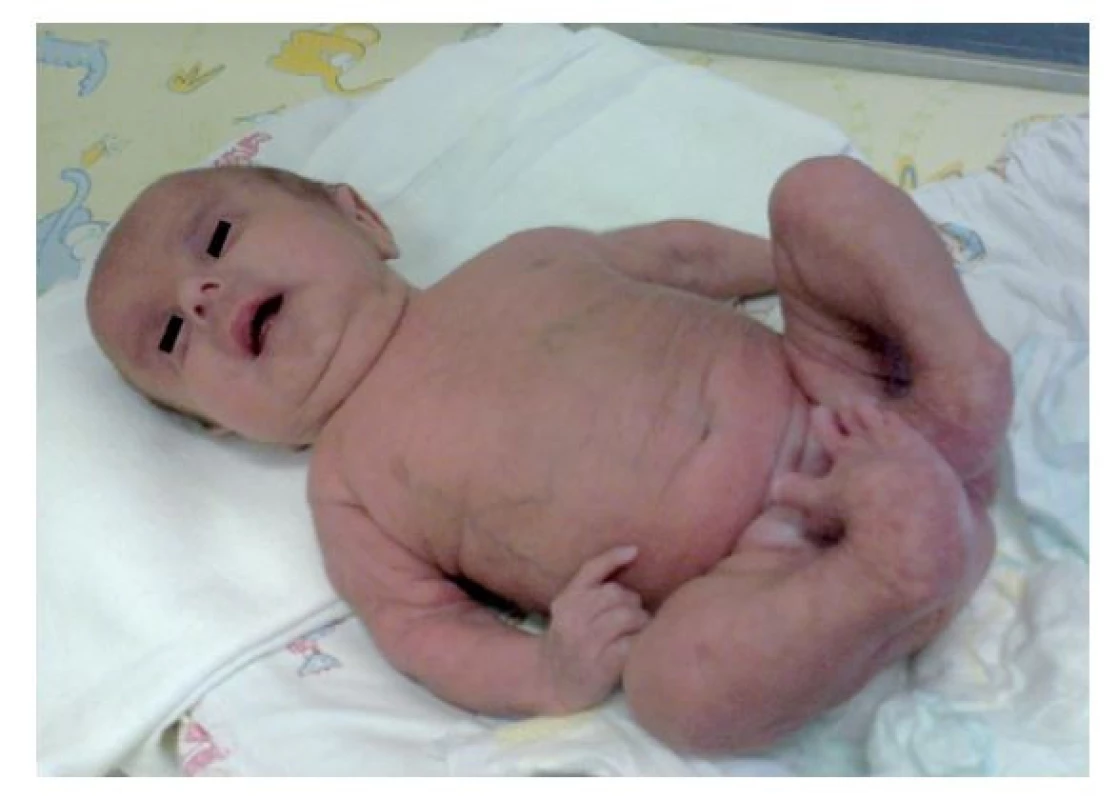
Fotografia bola uverejnená s písomným súhlasom zákonného zástupcu. Image 2. Voľná zriasnená koža so zmenenou kvalitou pozorovaná v novorodeneckom veku. 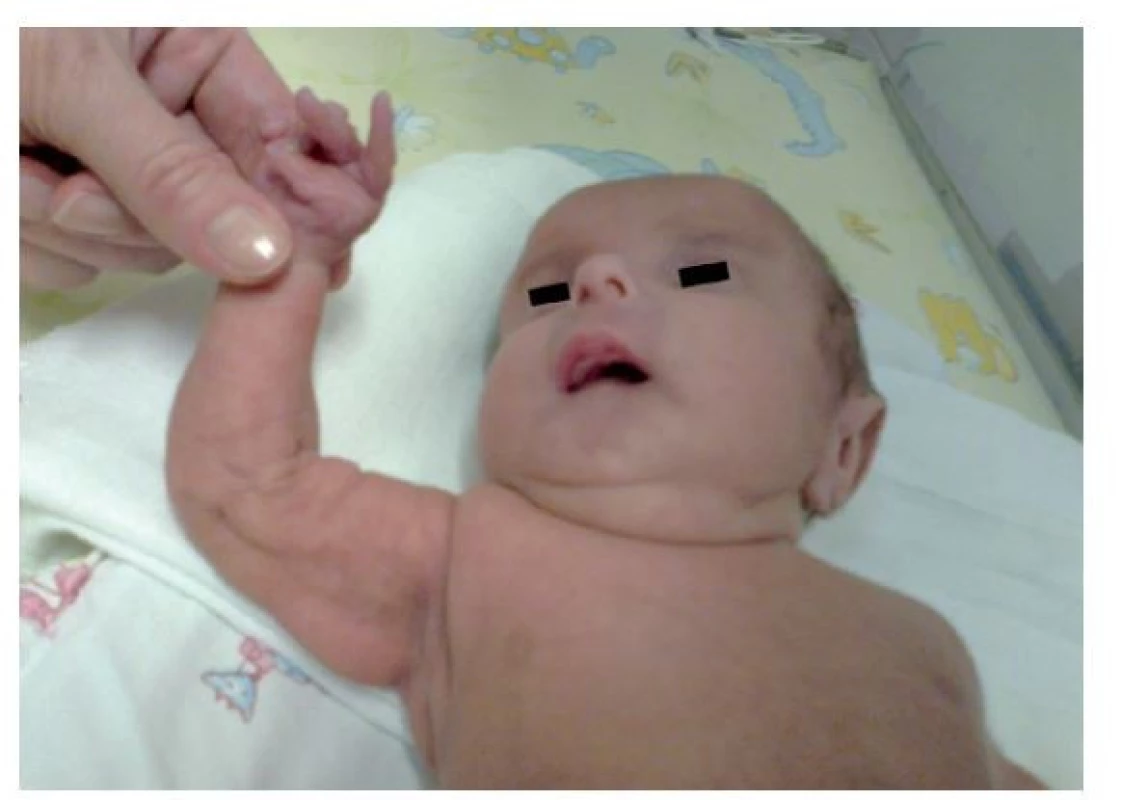
Fotografia bola uverejnená s písomným súhlasom zákonného zástupcu. Image 3. Vrodená vývojová chyba pravého chodidla – talipes equinovarus s preaxiálnou polydaktýliou. 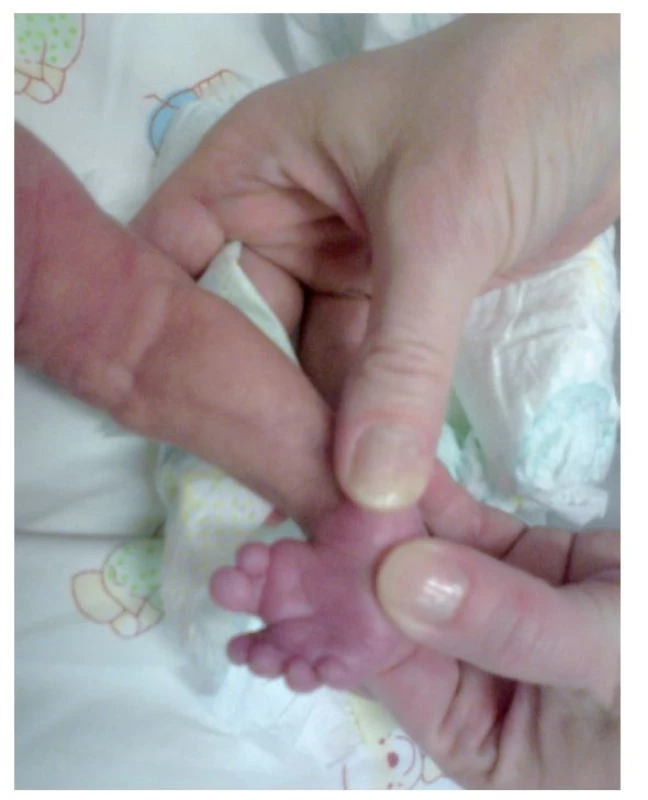
Fotografia bola uverejnená s písomným súhlasom zákonného zástupcu. Image 4. Fenotyp vo veku 17 mesiacov. Pretrváva progeroidný vzhľad a rastová reštrikcia. 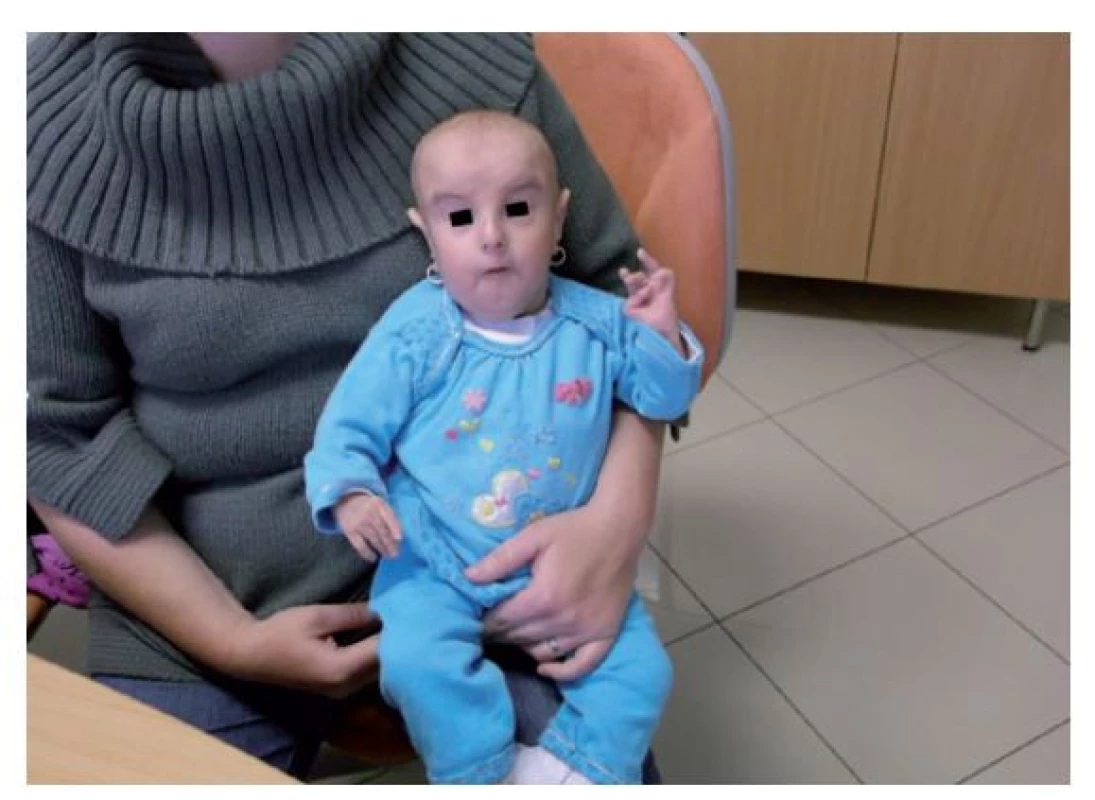
Fotografia bola uverejnená s písomným súhlasom zákonného zástupcu. Image 5. Facies vo veku 17 mesiacov s detailom na veľkú ušnicu. Viditeľná je atypická jamka v koži nad ramenným kĺbom. 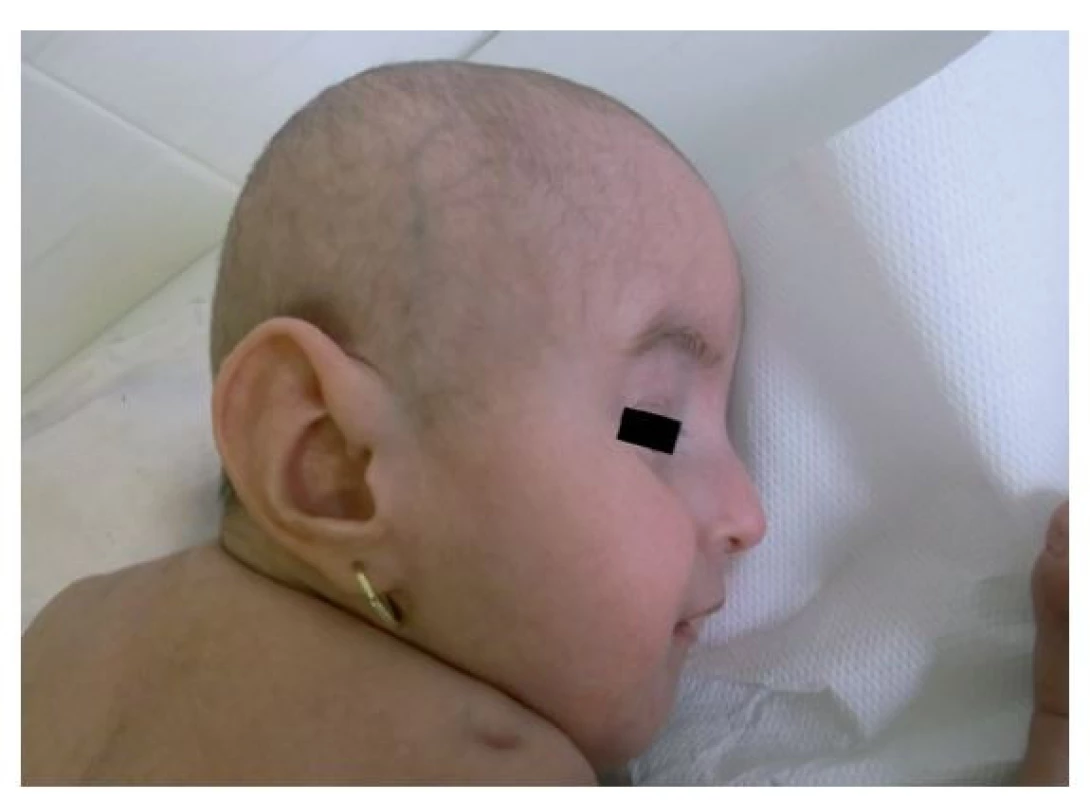
Fotografia bola uverejnená s písomným súhlasom zákonného zástupcu. Image 6. Atypický genitál s výrazne hypoplastickými labia majora vo veku 17 mesiacov. 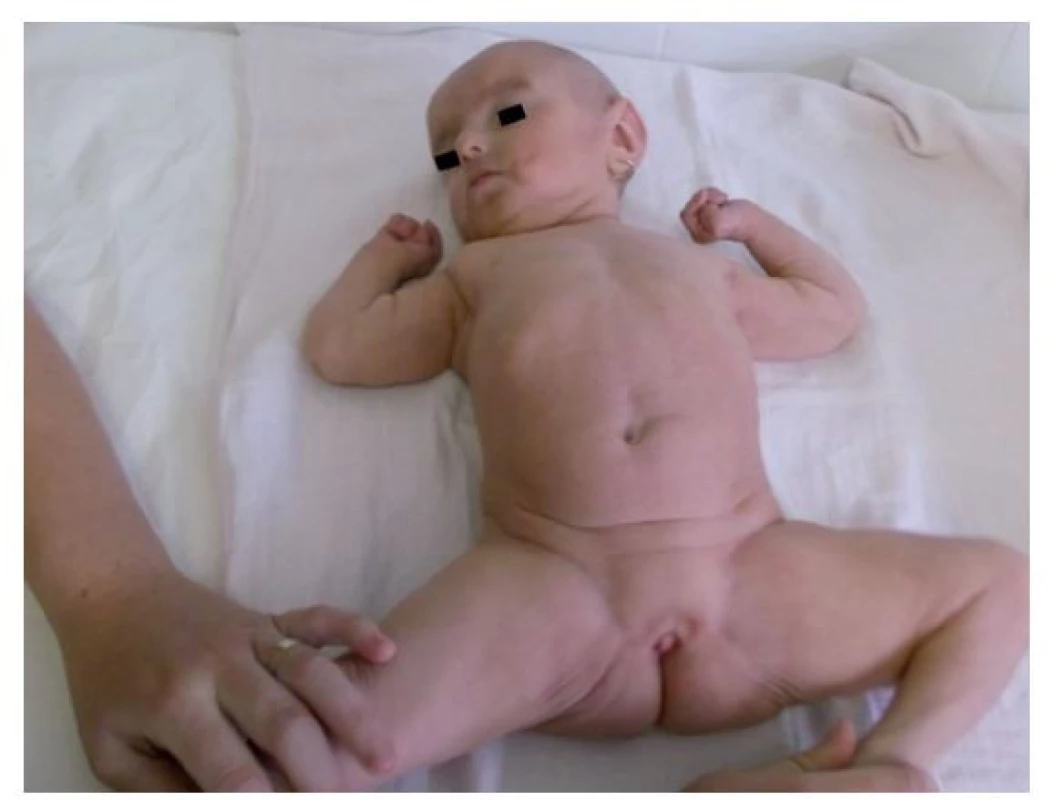
Fotografia bola uverejnená s písomným súhlasom zákonného zástupcu. Image 7. Fenotyp vo veku 5,5 roka. 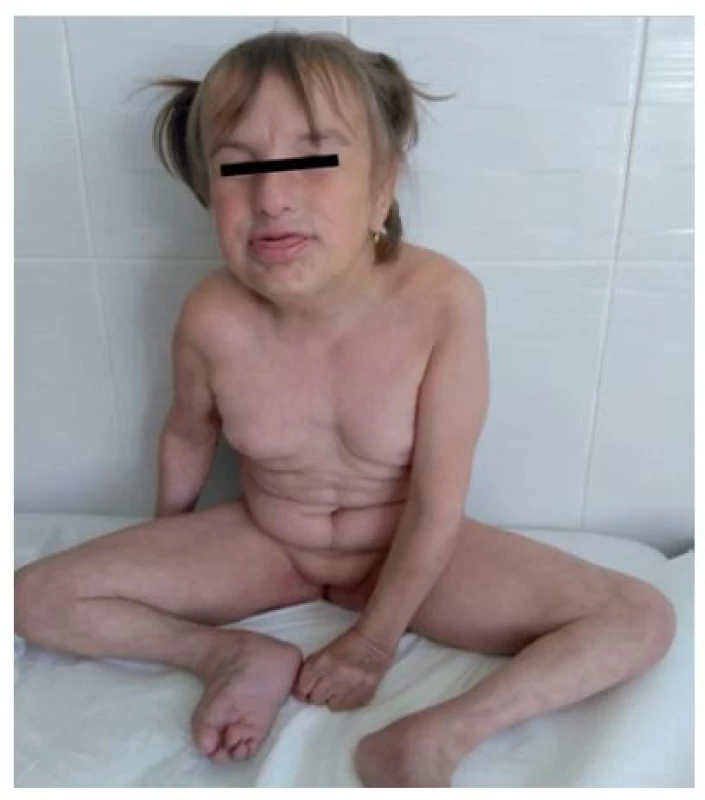
Fotografia bola uverejnená s písomným súhlasom zákonného zástupcu. Image 8. Ruky pacientky vo veku 5,5 roka so „stareckým“ vzhľadom s tenkou zvráskavenou kožou. 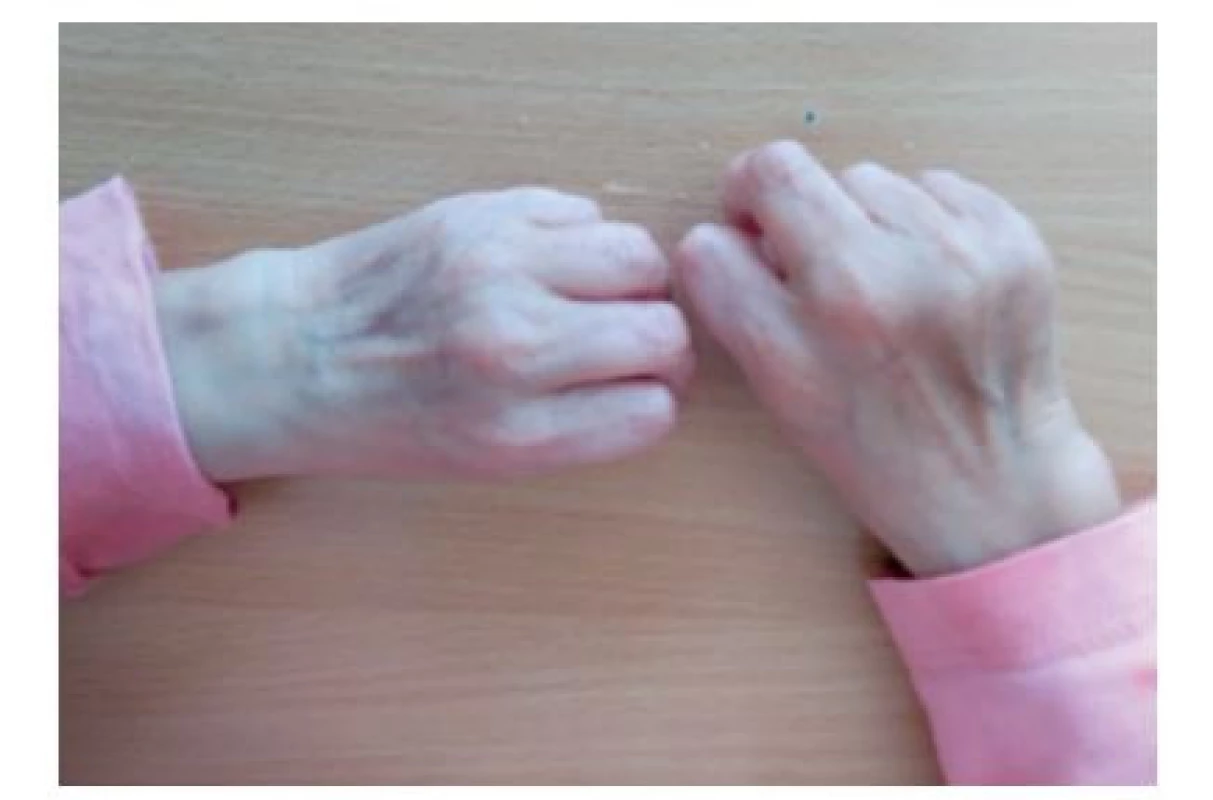
Fotografia bola uverejnená s písomným súhlasom zákonného zástupcu. Table 1. Kompletný fenotyp pacientky (prenatálne – 5,5 roka) 
Pôrod bol realizovaný v 34. gestačnom týždni operačne sekciou pre hypoxiu plodu pri patologickom CTG zázname. Dieťa po vybavení vyžadovalo akútnu resuscitačnú starostlivosť, Apgarovej skóre bolo stanovené na 6/5/5, pôrodná hmotnosť 1180 gramov, dĺžka 33 cm – oboje pod 3. percentilom podľa Fentonovej rastových kriviek. Pri klinickom vyšetrení bola pozorovaná zjavná stigmatizácia dieťaťa a viacpočetné vrodené vývojové chyby (VVCH) končatín. Sonografickým vyšetrením pri lôžku bola diagnostikovaná agenéza corpus callosum, neskôr potvrdená natívnym CT vyšetrením, spolu s nálezom ľahko hypoplastického cerebella. Na tretí deň života bolo pre hlučný holosystolický šelest realizované kardiologické vyšetrenie s nálezom apikálneho defektu komorového septa a foramen ovale apertum s malou vyklenujúcou sa aneuryzmou. Priebeh hospitalizácie bol bez výrazných komplikácií, rozvinula sa hyperbilirubinémia s potrebou fototerapie, dieťa prechodne vyžadovalo neinvazívnu ventilačnú podporu formou CPAP s minimálnou frakciou kyslíka a trvale bolo bez klinických či laboratórnych známok infekcie.
Počas hospitalizácie na Neonatologickej klinike UNM bolo dieťa vyšetrené klinickým genetikom pri lôžku. Pri vyšetrení bola viditeľná hypotrofia, faciálna dysmorfia so zdanlivou bilaterálnou mikroftalmiou, VVCH končatín v zmysle kamptodaktýlie rúk a výrazného obojstranného nálezu talipes equinovarus s preaxiálnou polydaktýliou pravej nohy, ako aj anomália genitálu s prominujúcim klitorisom a hypoplastickými labiami. U dieťaťa boli prítomné progeroidné črty – hypoplázia strednej časti tváre s ostrým nosom, vysoké čelo a malé neurokranium, úzke hlboké očné štrbiny, ustupujúca mikromandibula, mikro - a retroglosia, mikrostómia s úzkymi perami a podnebím. Pozoruhodnou klinickou známkou bola voľná, suchá, vrásčitá, krkvajúca sa koža s presvitajúcou cievnou kresbou a redukovaným podkožím.
Dieťa bolo ďalej dispenzarizované v genetickej ambulancii. Kontrolné vyšetrenia prebiehali v pravidelných intervaloch. V klinickom fenotype dominoval progeroidný výzor, zmenená kvalita kože, faciálna dysmorfia, malý vzrast a výrazne spomalený disharmonický psychomotorický vývoj s oneskoreným rozvojom reči a zaostávajúcou motorickou zložkou. Z neurologickej symptomatiky sa u dievčatka vyvinula tonusová porucha: kvadruhypertonický syndróm, axiálny hypotonus, prítomný tiež torticollis vpravo a mikrocefália. Bola reflexne rehabilitovaná Vojtovou metódou s pozitívnym efektom na motoriku. V 17 mesiacoch sa obracala z chrbta na bruško, začala štvornožkovať, kamptodaktylické kontraktúry sa uvoľnili s umožnením pomalého rozvoja jemnej motoriky, v 3 rokoch sa plazila, stavala na nohy a začínala chodiť s oporou. Závažný obojstranný talipes equinovarus bol korigovaný sadrovou fixáciou a chirurgicky, nadpočetný prst na pravej nohe bol odstránený. Defekt komorového septa sa spontánne uzavrel vo veku 15 mesiacov. Pri poslednom kontrolnom genetickom vyšetrení vo veku 5,5 roka v klinickom obraze dominovala voľná, suchá, krčivá, zriasená koža, dysmorfická facies, hypertonus a atetóza, poruchy intelektu, nevyvinutá reč, neprítomné hygienické návyky. Dieťa bolo schopné pevne sedieť, stáť s oporou, komunikovať jednoduchými hláskami a neverbálnymi prejavmi, úsmevom.
Diagnostický postup a výsledky
Na základe včasného klinického fenotypu evokujúceho syndromické postihnutie pri chromozómovej aberácii bola ako prvá indikovaná karyotypizácia. Cytogenetické vyšetrenie je vhodné na detekciu numerických a hrubých štrukturálnych chromozómových aberácií a translokácií, ako aj chromozómových zlomov. Stratu resp. duplikáciu genetického materiálu je možné použitím metodiky G-prúžkovania chromozómov rozlíšiť v rozsahu 5 – 10 megabáz. Výsledkom bol normálny ženský karyotyp, s funkčne a klinicky nevýznamným pridruženým nálezom zmnoženého heterochromatínu na q ramienku chromozómu 9 (46,XX,9qh+).
Pri negatívnom náleze abnormalít v karyotype ďalej nasledovala detekcia mikroaberácií metodikou array komparatívnej genómovej hybridizácie (aCGH), pomocou ktorej je možné identifikovať submikroskopické mikrodelécie či mikroduplikácie s rozlišovacou schopnosťou na desiatky kilobáz. Ani v tomto rozsahu vyšetrenia neboli identifikované genomické zmeny zodpovedné za stigmatizáciu pacientky.
Vzhľadom k negativite výsledkov doterajších vyšetrení bolo v ďalšom diagnostickom kroku vyslovené podozrenie na monogénovo podmienené ochorenie, pravdepodobne s recesívnou formou dedičnosti. V diferenciálnej diagnostike boli zvažované syndrómy s progeroidnou manifestáciou už v neonatálnom a skorom veku, ako je Hallermanov - -Streiffov-Francoisov syndróm (ORPHA:2108, MIM234100), Wiedemannov-Rautenstrauchov syndróm (tzv. neonatálny progeroidný syndróm) (ORPHA:3444, MIM264090), de Barsyho syndróm (ORPHA:2962, MIM614438), geroderma osteodysplastica (ORPHA:2078, MIM231070) s heterogénnou, prevažne autozomálne recesívnou dedičnosťou, prípadne iné ochorenie zo skupiny kolagenopatií.
Ako prvá bola zvolená cielená diagnostika Hallermanovho - Streiffovho-Francoisovho syndrómu. U dieťaťa boli prítomné niektoré známky patognomické pre tento syndróm: dysmorfická „vtáčia“ facies, zdanlivá bilaterálna mikroftalmia, atrofia kože, nízky vzrast.(7) Tento raritný syndróm s doposiaľ neobjasneným typom dedičnosti je zapríčinený patogénnymi mutáciami v géne GJA1 kódujúci konexín-43, jeden z transmembránových konexínových proteínov zodpovedajúci za integritu medzibunkových gap-junction kanálov. Realizovaná bola priama sekvenačná analýza všetkých funkčne relevantných oblastí daného génu – avšak bez nálezu kauzálneho patogénneho variantu, ktorý by mohol byť príčinou klinickej symptomatológie. Pacientka bola ďalej vedená pod pracovnou diagnózou progeroidného neonatálného syndrómu.
V ďalšom kroku sa pristúpilo k DNA analýze a selektovaných bolo niekoľko génov asociovaných so známymi formami cutis laxa: PYCR1 (AR cutis laxa typ IIIB), ALDH18A1 (AR cutis laxa typ IIIA), ATP6V0A2 (AR cutis laxa typ IIA) a GORAB (geroderma osteodysplastica). U pacientky bol priamou sekvenačnou analýzou identifikovaný patogénny variant c.769G>A (p.Ala257Thr; rs281875318) v géne PYCR1 v homozygotnom stave, potvrdzujúc tak diagnózu AR cutis laxa IIIB. Ochorenie je kategorizované aj ako PYCR1-asociovaný de Barsyho syndróm.
Diagnostika bola vo finálnom štádiu doplnená o segregačnú analýzu u oboch rodičov a sestry probandky. Obaja rodičia boli identifikovaní ako prenášači patogénneho variantu c.769G>A (p.Ala257Thr; rs281875318) v géne PYCR1 v heterozygotnom stave. Prenášačstvo zdedila od jedného z rodičov aj staršia sestra pacientky.
Diskusia
Pod pojmom de Barsyho syndróm sú v súčasnosti vedené dve monogénové ochorenia – autozomálne recesívne dedičná cutis laxa IIIA asociovaná s patogénnymi mutáciami génu ALDH18A1 a AR cutislaxa IIIB asociovaná s patogénnymi mutáciami génu PYCR1. Gén PYCR1 kóduje delta-1-pyrolín - 5-karboxylát reduktázu, mitochondriálny enzým katalyzujúci posledný krok v biosyntéze prolínu z glutamátu.(8) Výsledkom ablácie tohto enzýmu je hypoprolinémia, mitochondriálna dysfunkcia, zvýšená senzitivita k oxidačnému poškodeniu a nadmernej apoptóze fibroblastov, so zvýšenou fragmentáciou elastínu.(3) Prolín je kľúčovým regulátorom množstva biochemických procesov bunkového metabolizmu a od jeho deficitu sa odvíjajú klinické známky ochorenia. Je druhou najzastúpenejšou aminokyselinou v molekule kolagénu,(9) porucha jeho syntézy je teda jednou z hlavných príčin menejcennosti spojiva a kože u de Barsyho syndrómu. Úlohou prolínu a hydroxyprolínu je tiež vychytávanie reaktívnych molekúl a ochrana pred oxidačným stresom. Prolín zohráva aj dôležitú funkciu v syntéze DNA a proteínov v placente, čím zabezpečuje adekvátnu intrauterínnu výživu plodu.(10) Funkčne podobný produkt génu ALDH18A1 zodpovedá za biosyntézu prolínu, arginínu a ornitínu, pričom dysfunkcia tohto procesu má za následok identický klinický fenotyp s hypoargininémiou, hypoornitinémiou a hypoprolinémiou. Spektrum mutácií doteraz identifikovaných v géne PYCR1 zahŕňa bialelické bodové missense mutácie (ako v prípade našej pacientky), frameshift mutácie s posunom čítacieho reťazca, splice-site mutácie v zostrihovných oblastiach a jeden prípad delécie 22 bázových párov v oblasti exón-intrónovej hranice.(3) Okrem bialelických homozygotných mutácií boli identifikované aj dva prípady mutácií v zloženom heterozygotnom stave, ktorých následkom bol klinický fenotyp de Barsyho syndrómu a znížená produkcia PYCR1 mRNA vo fibroblastoch pacienta.(11)
Klinické prejavy de Barsyho syndrómu sú uvedené v tabuľke 2. Symptomatika je variabilná, dominuje v nej voľná hypoplastická koža a progeroidný výzor. U 96% pacientov je prítomná intrauterínna rastová reštrikcia a postnatálna rastová retardácia.(12) Defekt kolagénovej syntézy sa prejavuje aj okulárnymi príznakmi – strata Bowmanovej membrány v rohovke má za následok kongenitálnu korneálnu opacitu u 48% prípadov, prítomná môže byť katarakta, myopia a strabizmus.(13) U 76% pacientov sa prejaví deficit psychomotorického vývoja, v 48% prípadoch je závažný.(14) Dysgenéza až agenéza corpus callosum je síce nešpecifickým klinickým znakom, u pacientov s patogennými mutáciami v géne PYCR1 je však pozoruhodne bežná.(3,15) Pri porovnaní oboch foriem de Barsyho syndrómu sa pacienti s patogénnymi mutáciami v géne ALDH18A1 prejavujú závažnejším postihnutím než pacienti s deficitom PYCR1.(16)
Table 2. Prehľad klinických fenotypov autozomálne recesívne dedičných syndrómov spojených s progeroidným vzhľadom v novorodeneckom období 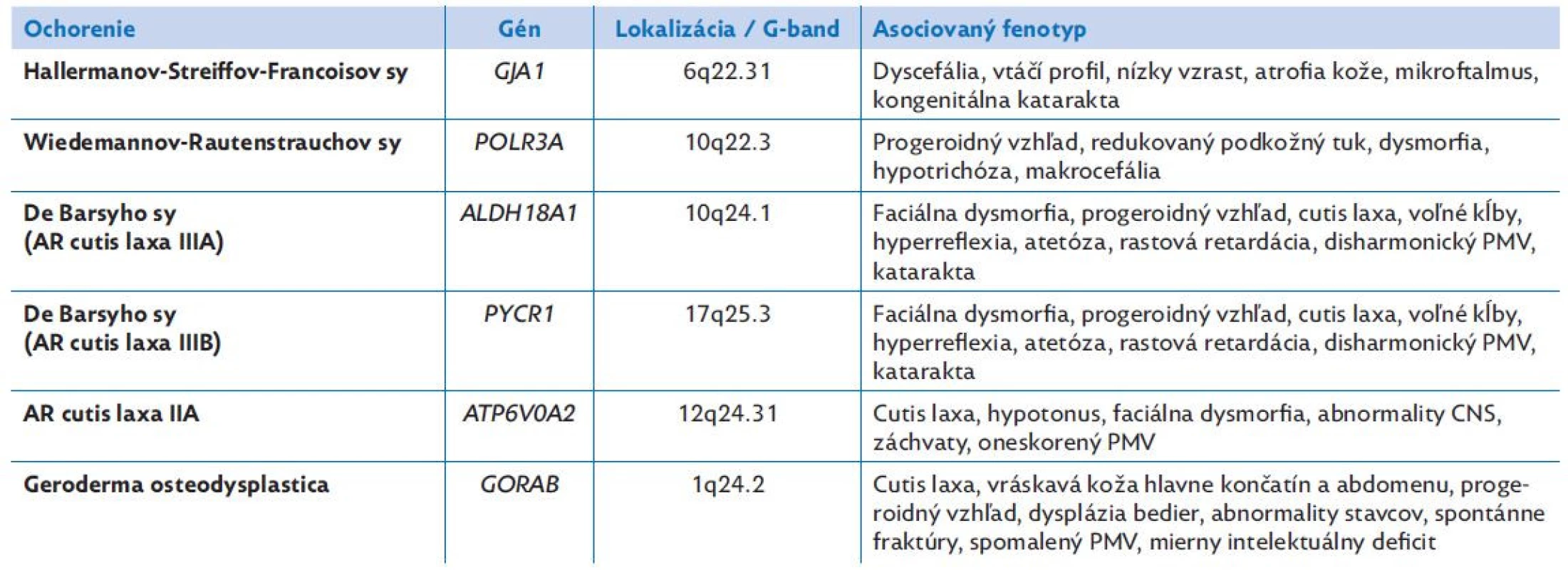
*údaje čerpané z databáz GeneCards.org a Orpha.net
PMV – psychomotorický vývinManažment de Barsyho syndrómu spočíva v multidisciplinárnej starostlivosti o pacienta, odporúča sa rehabilitačná a behaviorálna starostlivosť na stimuláciu psychomotorického vývoja. U našej pacientky bola nutná korekcia talipes equinovarus, ablácia nadpočetného prsta a reflexná rehabilitácia Vojtovou metódou. Prognóza z hľadiska prežívania nie je celkom objasnená. Najstarší diagnostikovaný pacient v dostupnej literatúre mal 24 rokov.(2) U pacientov s PYCR1-asociovanou formou de Barsyho syndrómu sa časom vyvinie charakteristická facies, možná je aj mierna regresia progeroidných známok a zastavenie progresie motorického deficitu. V dvoch prípadoch bol dokonca popísaný normálny intelekt.(16)
Záver
V diferenciálnej diagnostike prezentovaného ochorenia u našej pacientky bolo hlavnou výzvou značné prelínanie sa klinických známok viacerých ochorení podobného typu. Aj z tohto dôvodu je diagnostiku raritných genetických syndrómov manifestných už v novorodeneckom veku možné upresniť často až s odstupom času, pri sledovaní psychomotorického vývoja dieťaťa a klinickej symptomatológie ochorenia. Ako najsignifikantnejšia známka genetického ochorenia bola v diferenciálnej diagnostike identifikovaná cutis laxa spojená s progeroidnými črtami a na základe ich prítomnosti bola selektovaná skupina syndrómov vhodných na génovú analýzu. Vzhľadom na molekulovo-biologický efekt mutácií spôsobujúcich de Barsyho syndróm by hypoteticky mohla byť pomocným diagnostickým nástrojom na odlíšenie de Barsyho syndrómu od iných progeroidných syndrómov biochemická kvantifikácia prolínu, ornitínu a arginínu v krvi alebo v moči.
Korespondenční adresa:
doc. MUDr. Katarína Maťašová, PhD.
Neonatologická klinika, Univerzitná nemocnica Martin
Kollárova 2
036 59 Martin
Sources
1. de Barsy AM, Moens E, Dierckx L. Dwarfism, oligophrenia and degeneration of the elastic tissue in skin and cornea. A new syndrome?. Helv Paediatr Acta 1968; 23(3): 305–313.
2. Kunze J, Majewski F, Montgomery P, Hockey A, Karkut I, Riebel T. De Barsy syndrome-an autosomal recessive, progeroid syndrome. Eur J Pediatr 1985; 144(4): 348–354. doi: 10.1007/BF00441776
3. Reversade B, Escande-Beillard N, Dimopoulou A, et al. Mutations in PYCR 1 cause cutis laxa with progeroid features. Nat Genet 2009; 41(9): 1016–1021. doi: 10.1038/ng.413
4. Beyens A, Boel A, Symoens S, Callewaert B. Cutis laxa: A comprehensive overview of clinical characteristics and pathophysiology. Clin Genet 2021; 99(1): 53–66. doi: 10.1111/cge.13865
5. Seemanová E. Syndróm Debré cutis laxa. Čes-slov Pediat 2003; (1): 25–28.
6. Rosipal Š, Rosipalová D, Suchá K. Wiedemannov-Rautenstrachov syndróm s vrodenou chybou srdca. Čes-slov Pediat 2002; (5): 252–254.
7. Thomas J, Ragavi BS, Raneesha PK, et al. Hallermann-Streiff syndrome. Indian J Dermatol 2013; 58 : 383–4.
8. De Ingeniis J, Ratnikov B, Richardson AD, et al. Functional specialization in proline biosynthesis of melanoma. PLoS One 2012; 7(9): e45190. doi: 10.1371/journal.pone.0045190
9. Albaugh VL, Mukherjee K, Barbul A. Proline precursors and collagen synthesis: biochemical challenges of nutrient supplementation and wound healing. J Nutr 2017; 147(11): 2011–2017. doi: 10.3945/jn.117.256404
10. Wu G, Bazer FW, Burghardt RC, et al. Proline and hydroxyproline metabolism: implications for animal and human nutrition. Amino Acids 2011; 40(4): 1053–1063. doi: 10.1007/s00726–010–0715–z
11. Lin DS, Chang JH, Liu HL, et al. Compound heterozygous mutations in PYCR 1 further expand the phenotypic spectrum of De Barsy syndrome. Am J Med Genet A 2011; 155A(12): 3095–3099. doi: 10.1002/ajmg.a.34326
12. Kivuva EC, Parker MJ, Cohen MC, et al. De Barsy syndrome: a review of the phenotype. Clin Dysmorphol 2008; 17(2): 99–107. doi: 10.1097/ MCD.0b013e3282f4a964
13. Aldave AJ, Eagle RC Jr, Streeten BW, et al. Congenital corneal opacification in De Barsy syndrome. Arch Ophthalmol 2001; 119(2): 285–288.
14. Dutta A, Ghosh SK, Ghosh A, Roy S. A 5-year journey with cutis laxa in an Indian child: the De Barsy syndrome revisited. Indian J Dermatol 2016; 61(1): 81–84. doi: 10.4103/0019–5154.174031
15. Gardeitchik T, Mohamed M, Fischer B, et al. Clinical and biochemical features guiding the diagnostics in neurometabolic cutis laxa. Eur J Hum Genet 2014; 22(7): 888–895. doi: 10.1038/ejhg.2013.154
16. Zampatti S, Castori M, Fischer B, et al. De Barsy Syndrome: a genetically heterogeneous autosomal recessive cutis laxa syndrome related to P5CS and PYCR 1 dysfunction. Am J Med Genet A 2012; 158A(4): 927–931. doi: 10.1002/ajmg.a.35231
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2022 Issue 4-
All articles in this issue
- Co jsme psali
- Purkyňova cena za rok 2022 byla udělena prof. MUDr. Otto Hrodkovi, DrSc.
- Editorial
- Gregor Mendel slaví 200 let: ze zahrad augustiniánského kláštera v Brně až ke kauzální léčbě monogenně podmíněných chorob
- Dystrofinopatie
- Gregor Mendel a řízení růstu dítěte: geny, molekuly a pediatrická klinická praxe
- Syndrom intelektuálního postižení související s DYRK1A
- Fabryho choroba v dětském věku – přehled a kazuistika
- Klinický fenotyp a genetická diagnostika raritného syndrómu cutis laxa u polystigmatizovaného novorodenca
- Pacient s Williamsovým–Beurenovým syndromem v ordinaci dětského lékaře
- Diferenciální diagnostika mikroskopické hematurie
- Hypertermie, její příčiny a rizika z pohledu patofyziologa
- Sepse u dětí
- Za MUDr. Janem Škovránkem, CSc.
- Pediatrická poezie
- Ze sbírky moderního českého a slovenského umění
- Genetická různorodost monogenního diabetu na Ukrajině
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sepse u dětí
- Diferenciální diagnostika mikroskopické hematurie
- Hypertermie, její příčiny a rizika z pohledu patofyziologa
- Dystrofinopatie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

