-
Medical journals
- Career
U adolescentiek s mentálnou anorexiou počet cirkulujúcich krvných buniek asociuje s denzitou kostného minerálu
Authors: Čagalová Alžbeta 1; Kovalčíková Gaál Alexandra 1; Tichá Ubica 1; Šebeková Katarína 2; Podracká Udmila 1
Authors‘ workplace: Detská klinika Lekárskej fakulty Univerzity Komenského a Národného ústavu detských chorôb, Bratislava 1; Ústav molekulárnej biomedicíny, Lekárska fakulta Univerzity Komenského, Bratislava 2
Published in: Čes-slov Pediat 2022; 77 (3): 158-165.
Category: Original Papers
Overview
Úvod: Mentálna anorexia (AN) je závažné psychosomatické ochorenie, ktoré sa rozvíja najmä v adolescentnom veku. Závažná nutričná deprivácia s rozvratom vnútorného prostredia a hormonálnou dysreguláciou ovplyvňujú aj hematopoézu a kostný metabolizmus. Cieľom tejto práce bolo zistiť, či existuje vzájomný vzťah medzi poruchou hematopoézy a zníženým kostným metabolizmom u dievčat s mentálnou anorexiou.
Metodika: Do štúdie bolo zahrnutých 25 dievčat s AN (priemerný vek 16,2 ± 1,0 roka) a 13 zdravých dievčat s normálnou hmotnosťou (priemerný vek 16,7 ± 1,2). Krvný obraz a markery kostného metabolizmu boli vyšetrené štandardnými metódami. Denzita kostného minerálu bola vyšetrená duálnou röntgenovou absorpciometriou. Výsledky sme hodnotili štandardnými matematicko-štatistickými metódami.
Výsledky: Anorektičky mali významne nižšie počty krvných buniek a hodnoty markerov kostného metabolizmu (fosfor, ALP, P1NP, osteokalcín) v porovnaní so zdravými kontrolami (p ≤ 0,05). Anorektičky mali významne nižšiu denzitu kostného minerálu (BMD) a BMD Z-skóre v proximálnej časti ľavého femuru (p ≤ 0,05) a nižší obsah kostného minerálu (BMC) pri celotelovom meraní bez zachytenia hlavy (TBLH, p ≤ 0,05). Markery kostného metabolizmu (fosfor, ALP, P1NP, osteokalcín) pozitívne korelovali s počtom leukocytov a erytrocytov (p ≤ 0,05). Celkový počet leukocytov pozitívne koreloval s BMD v proximálnej časti ľavého femuru (r = 0,34; p ≤ 0,05). Počty lymfocytov a monocytov korelovali s BMD a BMD Z-skóre vo všetkých oblastiach merania (p ≤ 0,05).
Záver: Naša štúdia potvrdila vzájomný pozitívny vzťah medzi poruchou hematopoézy a poruchou kostného metabolizmu u pacientiek s AN. Zníženie počtu osteoblastov, ktoré vytvárajú podporné mikroprostredie pre hematopoetické kmeňové bunky, vedie k zníženiu počtu všetkých analyzovaných krvných buniek u dievčat s AN. Predpokladáme, že zníženie počtu osteoblastov a tým aj hematopoetických buniek u pacientok s AN súvisí so zvýšením množstva tukového tkaniva v kostnej dreni. Potvrdenie tejto hypotézy bude úlohou ďalšej štúdie. Okrem toho sú potrebné longitudinálne štúdie na zhodnotenie vplyvu zmien hmotnosti na hematopoézu a kostný metabolizmus.
Klíčová slova:
kostný metabolizmus – denzita kostného minerálu – porucha príjmu potravy – krvotvorba
Úvod
Mentálna anorexia (anorexia nervosa – AN) je závažná porucha príjmu potravy s prevalenciou 1,2–4 % medzi adolescentnými dievčatami a mladými ženami.(1) Charakteristickým prejavom ochorenia je cielený hmotnostný úbytok v dôsledku nutričnej reštrikcie, intenzívny strach z dosiahnutia fyziologickej telesnej hmotnosti a skreslené vnímanie obrazu vlastného tela.(2) Dlhodobé hladovanie a dramatický pokles telesnej hmotnosti vedie k celkovej alterácii organizmu a spôsobuje multiorgánové poškodenie vrátane poruchy hematopoézy a kostného metabolizmu.
Porucha krvotvorby pri AN je najčastejšie spôsobená hypopláziou kostnej drene. Misra a spol. zistili anémiu u 32 % dievčat s AN, pričom anorektičky v porovnaní s kontrolnou skupinou mali nielen signifikantne nižší počet erytrocytov, ale aj leukocytov.(3) Porucha mineralizácie a úbytok kostnej hmoty sú častou komplikáciou anorexie u mladých dievčat.(4,5) Pokles denzity kostného minerálu (BMD) o viac ako jednu štandardnú odchýlku pod priemerné hodnoty pre vek sa zistil u viac ako polovice adolescentiek s AN a až 10 % z nich má BMD dokonca nižšiu ako dve smerodajné odchýlky pod priemerom, čo potvrdzujú aj naše pozorovania.(3,5) Úzke prepojenie hematopoézy a kostného metabolizmu dokumentujú viaceré in vitro/vivo štúdie. Efektívna tvorba krviniek v kostnej dreni závisí od „živného“ mikroprostredia, ktoré zahŕňa hematopoetické a nehematopoetické bunky, ako aj široké spektrum extracelulárnych komponentov. Nehematopoetické stromálne bunky reprezentujúce osteoblasty a ich prekurzory ovplyvňujú diferenciáciu krvotvorných kmeňových buniek na zrelé hematopoetické línie.(6) Indukovaná deplécia osteoblastov u myší viedla k zníženiu erytroidných, lymfoidných a myeloidných progenitorov.(7) Aj u ľudí sa preukázal úzky vzťah medzi anémiou, koncentráciou hemoglobínu a kostnou denzitou.(8) U starších mužov bol úbytok kostnej hmoty v oblasti bedra spojený so signifikantným rizikom anémie a lymfopénie.(9) Nedávna štúdia tiež potvrdila pozitívnu asociáciu medzi erytrocytmi a leukocytmi a BMD v oblasti lumbálnej chrbtice a bedra u premenopauzálnych žien.(10) Či môže determinovať porucha kostnej denzity u mladých dievčat s anorexiou zmeny cytopénie v čase diagnostiky ochorenia, nie je presne známe.
Cieľom našej klinickej štúdie bolo preskúmať vzťah medzi denzitou kostného minerálu a počtom červených a bielych krviniek u pacientok s mentálnou anorexiou.
Materiál a metódy
Súbor
Zo súboru 43 dievčat s mentálnou anorexiou, ktoré boli hospitalizované na Detskej klinike Lekárskej fakulty Univerzity Komenského a Národného ústavu detských chorôb (NÚDCH) v rokoch 2016–2020, sme do retrospektívnej štúdie vyselektovali podskupinu 25 dospievajúcich dievčat s aktívnou mentálnou anorexiou s priemerným vekom 16,2 ± 1,0 rok.
Menatálnu anorexiu sme diagnostikovali podľa odporúčaní 5. vydania Diagnostického a štatistického manuálu duševných porúch.(2) K základným diagnostickým kritériám patrí pretrvávajúce obmedzenie príjmu energie vedúce k výrazne nízkej telesnej hmotnosti, intenzívny strach z priberania alebo tučnoty a porucha vnímania vlastného tela. Sedem dievčat malo primárnu amenoreu a 18 dievčat sekundárnu amenoreu.(11) Všetky merania sme vykonali v čase stanovenia diagnózy, tj. pred začatím farmakologickej liečby a realimentácie.
Do kontrolnej skupiny sme zaradili 13 zdravých dievčat (priemerný vek 16,7 ± 1,2 roku) s normálnou hmotnosťou (medzi 10.–90. percentilom pre daný vek), ktoré absolvovali preventívnu prehliadku v pediatrickej ambulancii NÚDCH. Zdravé kontroly mali pravidelnú menštruáciu a v anamnéze nemali poruchu príjmu potravy.
Antropometrické merania
Telesnú výšku sme merali na nástennom stadiometri (Seca, Hamburg, Nemecko) s presnosťou na 0,1 cm, telesnú hmotnosť na digitálnej váhe (Seca, Hamburg, Nemecko) s presnosťou 0,1 kg. Dievčatá sme merali/ vážili v spodnom prádle, bez topánok. Index telesnej hmotnosti (body mass index – BMI) sme kalkulovali zo vzorca hmotnosť (kg) / výška2 (m) a vyjadrili ako BMI Z-skóre pre daný vek a pohlavie podľa referenčných hodnôt slovenských detí.(12)
Laboratórna analýza
Krv na vyšetrenia sme odoberali v ranných hodinách (6.00–8.00) po 8hodinovom nočnom lačnení do skúmaviek s K3EDTA , lítium-heparínom, alebo SSTTM II (Becton Dickinson, Česká republika). Krvný obraz sme vyšetrovali na hematologickom analyzátore Sysmex XN-1000TM (Sysmex Groupʼs, Kóbe, Japonsko). Sérový vápnik, fosfor, alkalickú fosfatázu (ALP) sme stanovili štandardnými laboratórnymi metódami na prístroji Cobas c501 (Roche Diagnostic, Mannheim, Nemecko). 25-OH vitamín D sme vyšetrili chemiluminiscenčou metódou (Vitros 5600, Ortho Clinical Diagnostic, Raritan, New Jersey, USA). Osteokalcín, amino-terminálny propeptid ľudského prokolagénu typu I (PINP), karboxy-terminálny telopeptid kolagénu typu I (CTX) a parathormón sme analyzovali elektrochemiluminiscenčnými metódami (Cobas e411, Roche Diagnostic, Mannheim, Nemecko).
Denzitometrické vyšetrenie
Denzitu kostného minerálu (bone mineral density – BMD, g/cm2) a obsah kostného minerálu (bone mineral content – BMC, g) sme merali v oblasti lumbálnej chrbtice (L1–L4), proximálnej časti ľavého femuru a celého tela okrem hlavy (celotelové meranie bez zachytenia hlavy, total body less head – TBLH) duálnou röntgenovou absorpciometriou (DXA) (Hologic, Inc. Horizon QDR Danbury, Connecticut, USA) s použitím pediatrického softvéru. Výsledky BMD sme porovnali s referenčnými hodnotami zdravých kontrol rovnakého veku a pohlavia a vyjadrili ako BMD Z-skóre. Z-skóre BMD ≤ − 2 SD sme hodnotili podľa odporúčaní Medzinárodnej spoločnosti pre klinickú denzitometriu ako „denzitu pod očakávaným rozsahom pre daný vek“.(13)
Štatistická analýza
Všetky analýzy sme vykonávali použitím štatistického softvéru GraphPad (GraphPad Software Inc, La Jolla, USA). Distribúciu dát sme hodnotili Shapirovým – Wilkovhovým testom. Normálne rozdelené dáta sme vyjadrili ako priemer ± štandardná odchýlka (SD). Dáta, ktoré neboli normálne rozdelené, sme vyjadrili ako medián s medzikvartilovým rozsahom (25.–75. percentil). Výsledky v skupine anorektičiek a kontrolnej skupine sme porovnali Studentovým t-testom (normálne rozdelené dáta), resp. Mann-Whitneyho U-testom (nenormálne rozdelené dáta). Korelácie medzi normálne distribuovanými premennými sme analyzovali Pearsonovým testom, vzťahy medzi nenormálne distribuovanými dátami Spearmanovým testom. Za hladinu štatistickej významnosti sme považovali p ≤ 0,05.
Schválenie etickej komisie
Štúdiu sme uskutočnili v súlade s usmerneniami Helsinskej deklarácie. Schválenie protokolu štúdie udelila Etická komisia Národného ústavu detských chorôb, Bratislava, Slovenská republika. Zákonní zástupcovia všetkých dievčat zúčastnených v štúdii podpísali informovaný súhlas.
Výsledky
Antropometrické merania
Hodnoty antropometrických meraní pacientiek s AN a zdravých dievčat uvádza tabuľka 1.
Table 1. Antropometrické dáta dievčat s mentálnou anorexiou a zdravých dievčat 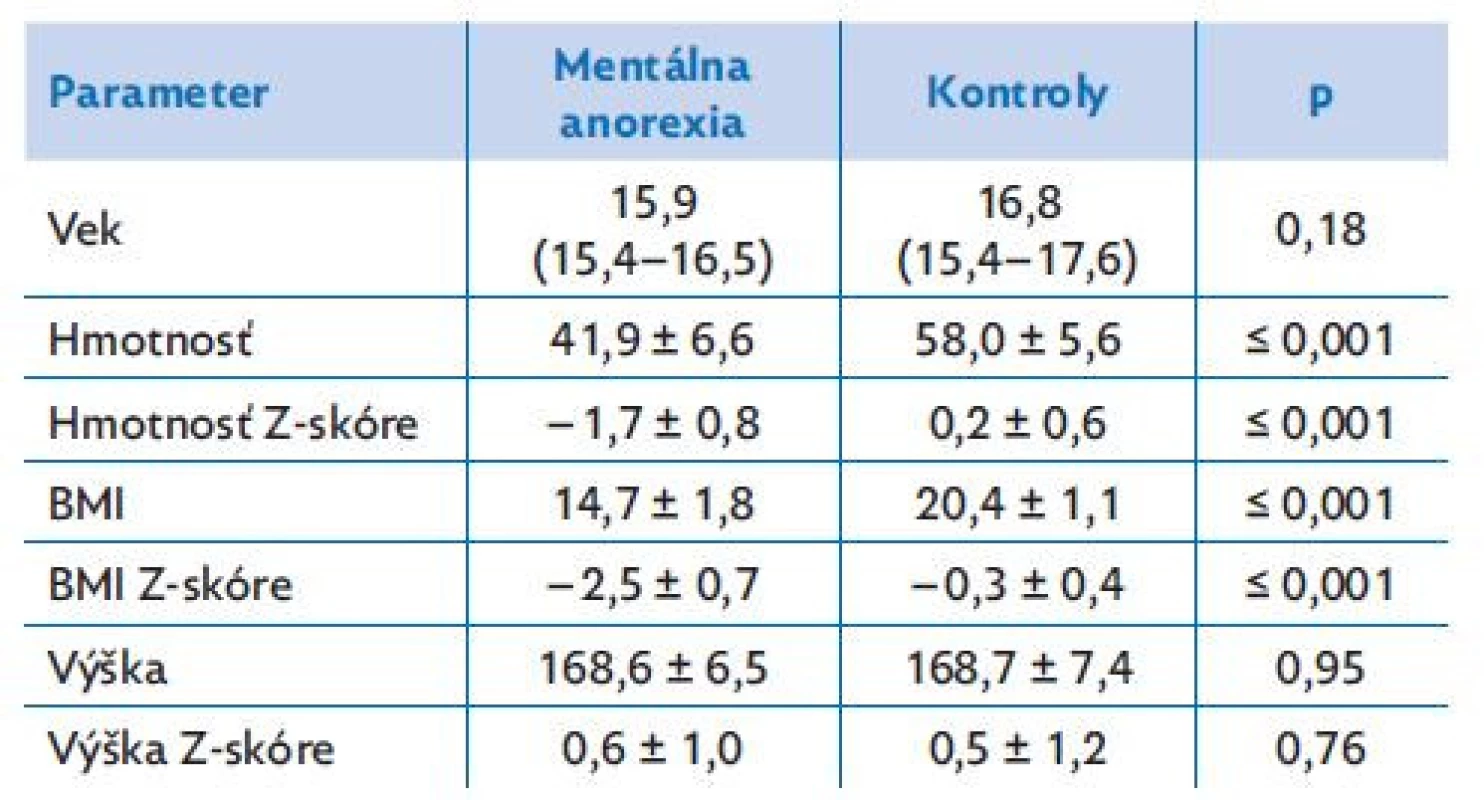
Dáta sú vyjadrené ako priemer ± smerodajná odchýlka (SD, normálne distribuované dáta) alebo ako medián (25.–75. percentil, nenormálne rozdelené dáta). BMI – index telesnej hmotnosti. Obe skupiny mali porovnateľný vek, telesnú výšku a Z-skóre. Telesná hmotnosť, BMI a BMI Z-skóre boli významne nižšie u pacientiek ako v kontrolnej skupine (p ≤ 0,001; tabuľka 1).
Laboratórne výsledky
Pacientky s AN mali signifikantne nižšie počty všetkých krvných elementov v periférnej krvi (leukocyty, erytrocyty: p ≤ 0,01; trombocyty: p ≤ 0,05; tabuľka 2). Vyšetrenie diferenciálneho leukogramu preukázalo signifikantne nižšie počty neutrofilov (p ≤ 0,05) a monocytov (p ≤ 0,001), počty lymfocytov sa medzi skupinami signifikantne nelíšili (p > 0,05).
Table 2. Krvný obraz u pacientiek s mentálnou anorexiou a u zdravých kontrol 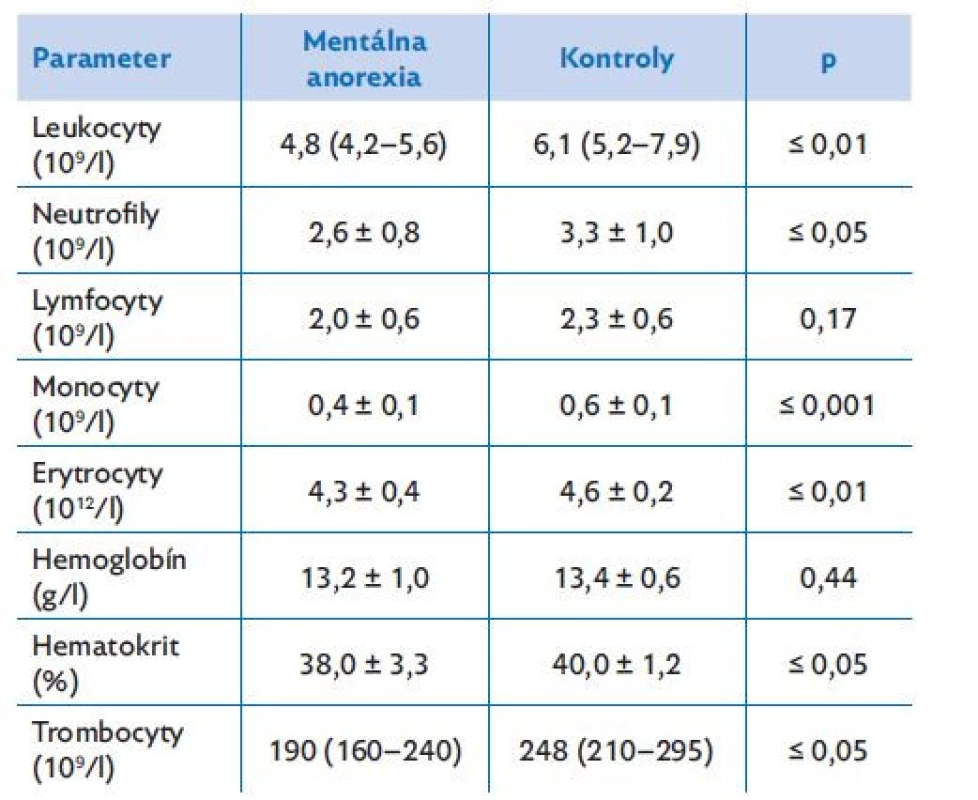
Dáta sú vyjadrené ako priemer ± smerodajná odchýlka (SD, normálne distribuované dáta) alebo ako medián (25.–75. percentil, nenormálne rozdelené dáta). Anorektičky mali signifikantne nižšie sérové koncentrácie fosforu a ALP v porovnaní so zdravými kontrolami (fosfor: p ≤ 0,01; ALP: p ≤ 0,001; tabuľka 3). Priemerné koncentrácie vápnika a parathormónu sa medzi skupinami významne nelíšili (p > 0,05). Anorektičky mali signifikantne vyššie hodnoty 25-OH vitamínu D ako zdravé dievčatá (p ≤ 0,05), signifikantne nižšie koncentrácie markeru kostnej tvorby P1NP (p ≤ 0,001) a markeru kostného obratu osteokalcínu (p ≤ 0,001). Na druhej strane, priemerné hodnoty markerov kostnej resorpcie CTx sa medzi skupinami nelíšili (p > 0,05).
Table 3. Markery kostného metabolizmu u dievčat s mentálnou anorexiou a u zdravých dievčat 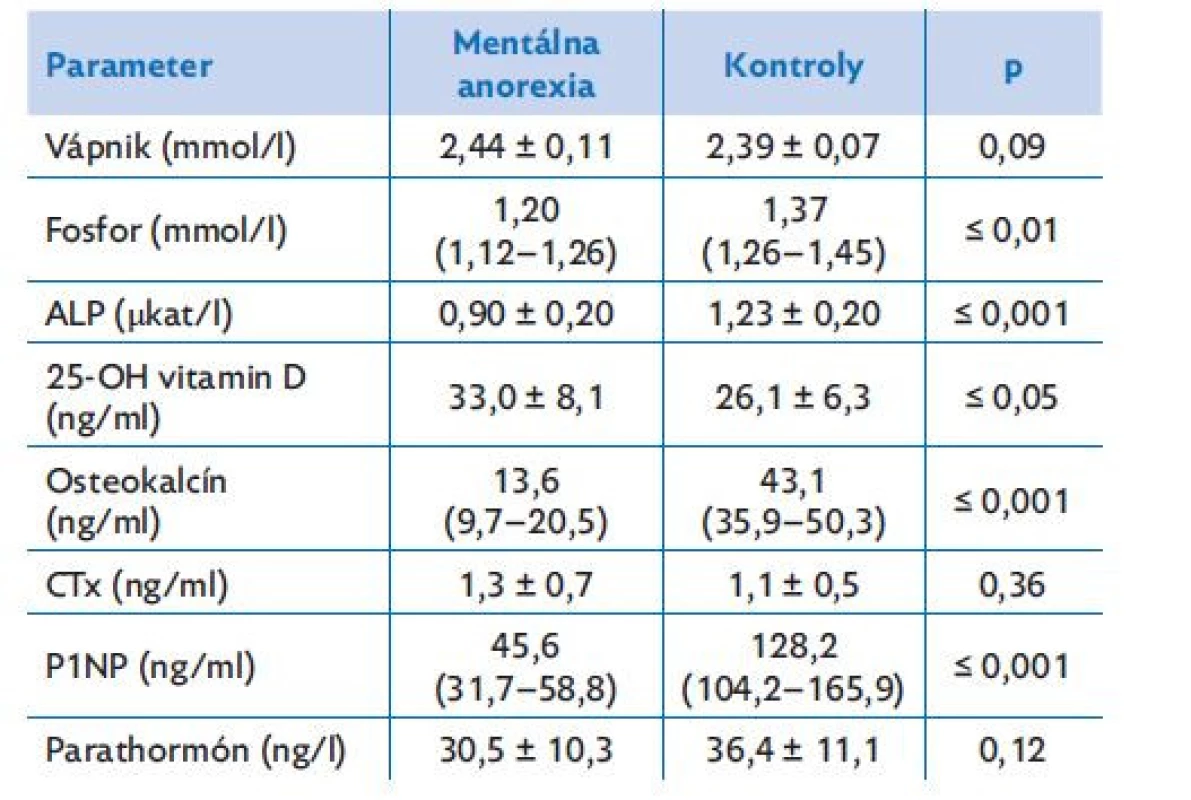
Dáta sú vyjadrené ako priemer ± smerodajná odchýlka (SD, normálne distribuované dáta) alebo ako medián (25.–75. percentil, nenormálne rozdelené dáta). ALP – alkalická fosfatáza, CTx – C-terminálny telopeptid kolagénu, P1NP – amino- -terminálny propeptid prokolagénu typu 1. Denzitometrické vyšetrenie
Výsledky denzitometrického vyšetrenia sú uvedené v tabuľke 4. Skupiny sa významne líšili v BMD a BMD Z-skóre v oblasti ľavého proximálneho femuru (p ≤ 0,05), pričom anorektičky vykazovali signifikantne nižšie hodnoty ako zdravé dievčatá s normálnou hmotnosťou. Analogicky aj TBLH meranie preukázalo signifikantne nižšie BMC u dievčat s anorexiou v porovnaní s kontrolami (p ≤ 0,05). V oblasti lumbálnej chrbtice sa významné rozdiely medzi skupinami nezistili (p > 0,05; tabuľka 4). Podľa očakávania dievčatá s AN mali signifikantne nižšie množstvá tukovej aj netukovej hmoty (p ≤ 0,001) a percento telesného tuku (p ≤ 0,001).
Table 4. Výsledky denzitometrického vyšetrenia u pacientiek s mentálnou anorexiou a u zdravých dievčat 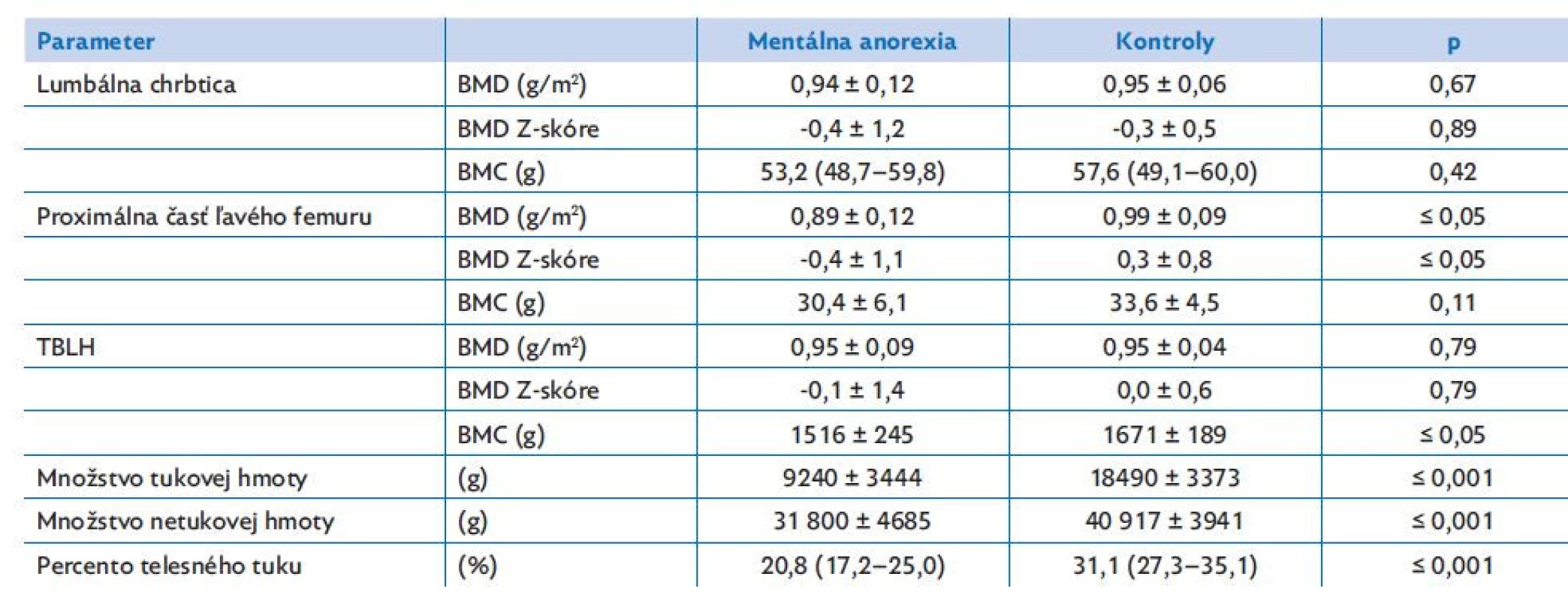
Dáta sú vyjadrené ako priemer ± smerodajná odchýlka (SD, normálne distribuované dáta) alebo ako medián (25.–75. percentil, nenormálne rozdelené dáta).
BMC – obsah kostného minerálu, BMD – denzita kostného minerálu, TBLH – celotelové meranie bez zachytenia hlavy.Vzťah medzi markermi kostného metabolizmu a krvným obrazom
Výsledky korelačných analýz medzi markermi kostného metabolizmu a krvnými elementami u pacientiek s AN a zdravých dievčat sumarizuje tabuľka 5. Konvenčné markery kostného metabolizmu ako sérový fosfor a ALP pozitívne korelovali s počtom leukocytov (fosfor: r = 0,33; p ≤ 0,05; ALP: r = 0,33; p=0,06) a erytrocytov (fosfor: r = 0,34; p ≤ 0,05; ALP: r = 0,54; p ≤ 0,001). Marker kostnej tvorby P1NP a marker kostného obratu osteokalcín pozitívne korelovali s počtom leukocytov (P1NP: r = 0,39; p ≤ 0,05; osteokalcín: r = 0,34; p ≤ 0,05) a erytrocytov (P1NP: r = 0,63; p ≤ 0,001; osteokalcín: r = 0,50; p ≤ 0,01). Korelačná analýza potvrdila pozitívny vzťah medzi BMD v oblasti proximálnej časti ľavého femuru, množstvom tukovej aj netukovej hmoty a počtom leukocytov (proximálna časť ľavého femuru BMD: r = 0,34; p ≤ 0,05; tuková hmota: r = 0,36; p ≤ 0,05; netuková hmota: r = 0,44; p ≤ 0,01). Množstvo tukovej a netukovej hmoty pozitívne korelovalo aj s erytrocytmi (tuková hmota: r = 0,39; p ≤ 0,05; netuková hmota: r = 0,39; p ≤ 0,05). Navyše pri analýze vzťahu medzi kostným metabolizmom a leukogramom sa zistila pozitívna asociácia medzi ALP, P1NP a osteokalcínom s počtom lymfocytov (ALP: r = 0,39; p ≤ 0,05; P1NP: r = 0,39; p ≤ 0,05; osteokalcín: r = 0,34; p = 0,06) a monocytov (ALP: r = 0,46; p ≤ 0,01; P1NP: r = 0,66; p ≤ 0,001; osteokalcín: r = 0,60; p ≤ 0,001). Lymfocyty a monocyty pozitívne korelovali aj s BMD (monocyty: r = 0,38; p ≤ 0,05) a BMD Z-skóre v oblasti lumbálnej chrbtice (lymfocyty: r = 0,34; p ≤ 0,05; monocyty: r = 0,37; p ≤ 0,05), v oblasti ľavého proximálneho femuru (BMD vs. lymfocyty: r = 0,43; p ≤ 0,05; BMD vs. monocyty: r = 0,55; p ≤ 0,001) a v TBLH meraniach (BMD vs. lymfocyty: r = 0,47; p ≤ 0,01; BMD vs. monocyty: r = 0,44; p ≤ 0,05; tabuľka 5). Pozitívny vzťah sa preukázal aj medzi množstvom tukovej a netukovej hmoty a počtom monocytov (tuková hmota: r = 0,40; p ≤ 0,05; netuková hmota: r = 0,45; p ≤ 0,01). Korelačnou analýzou dát sme potvrdili vzťah medzi Z-skóre BMI a krvnými elementami (leukocyty: r = 0,422; p ≤ 0,001; lymfocyty: r = 0,305; p ≤ 0,05; monocyty: r = 0,556; p ≤ 0,001; erytrocyty: r = 0,344; p ≤ 0,05). Nepozorovali sme signifikantnú závislosť medzi BMI a množstvom neutrofilov a trombocytov.
Table 5. Vzťah medzi kostnými markermi a krvným obrazom v súbore pacientiek s mentálnou anorexiou a zdravých dievčat 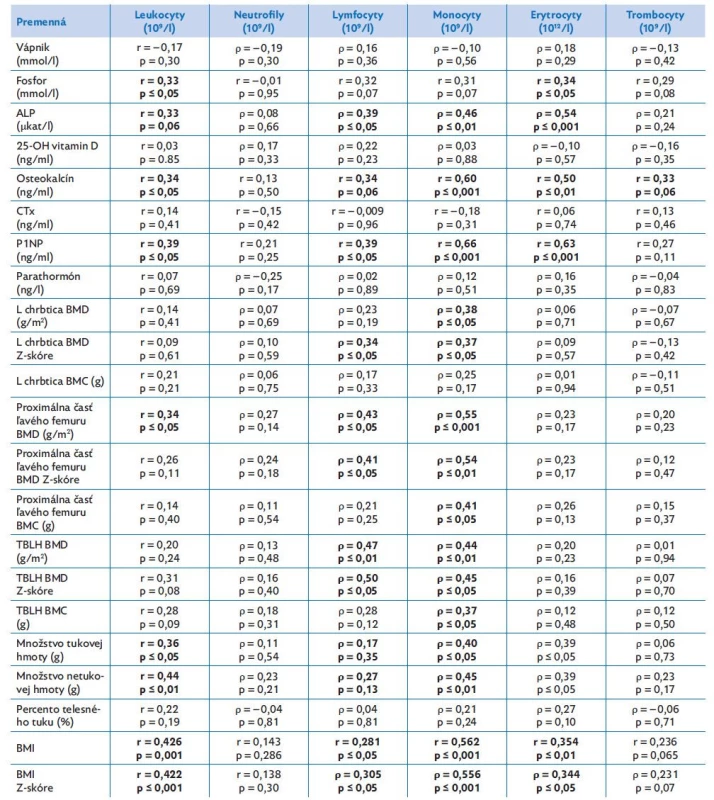
ALP – alkalická fosfatáza, BMC – obsah kostného minerálu, BMD – denzita kostného minerálu, CTx – C-terminálny telopeptid kolagénu, P1NP – amino-terminálny propeptid prokolagénu typu 1, TBLH – celotelové meranie bez zachytenia hlavy, r – Spearmanov korelačný koeficient, ρ – Pearsonov korelačný koeficient. Diskusia
V retrospektívnej klinickej štúdií sme zhodnotili vzťah medzi denzitou kostného minerálu a počtom cirkulujúcich periférnych krvných buniek u dospievajúcich dievčat s mentálnou anorexiou. Zistili sme, že anorektičky mali signifikantne nižšie zastúpenie všetkých krvných elementov v porovnaní so zdravými kontrolami a nižšiu BMD v proximálnej časti ľavého femuru ako v kontrolnom súbore. Preukázali sme tiež pozitívny vzťah medzi BMD a počtom cirkulujúcich krvných buniek v periférnej krvi. Tieto výsledky podporujú našu hypotézu, že znížená denzita kostného minerálu môže ovplyvňovať efektívnu krvotvorbu v kostnej dreni.
Charakteristické črty mentálnej anorexie ako dlhodobé hladovanie, nutričná reštrikcia a kritický pokles telesnej hmotnosti vedú k rozvoju závažných somatických komplikácií vrátane poruchy mineralizácie a remodelácie kosti. Kompenzačné zmeny hypotalamo-hypofýzového systému na energetickú depriváciu a závažný nutričný deficit významne prispievajú k úbytku kostnej hmoty už v adolescentnom veku.(14–16) Tento predpoklad podporuje nález signifikantne nižšej denzity v oblasti ľavého femuru v našej kohorte. V tomto kontexte sú zaujímavé výsledky merania distribúcie tuku v kostnej dreni magnetickou rezonanciou u dievčat s AN, ktoré identifikovali epifýzu femuru ako predominantné miesto zmien tukovej zložky kostnej drene.(17)
Svalová a tuková hmota pôsobí anabolicky na kosť a uvoľňuje z adipocytov hormóny asociované s tvorbou kosti.(18) To korešponduje s nálezom významne nižších koncentrácií osteokalcínu u našich pacientok s AN a asociácie medzi osteoformačne pôsobiacim osteokalcínom a počtom leukocytov a erytrocytov. Na dôležitú úlohu tukového tkaniva pri (ne)efektívnej krvotvorbe poukazuje aj signifikancia BMI Z-skóre a/alebo množstva tukovej hmoty s počtom krvných elementov. Inými slovami, čím mali anorektičky nižšie BMI a osteokalcín, tým bol nižší počet bielych a červených krviniek v periférii. Hoci sa znížená kostná denzita diagnostikovala už v čase iniciálnej hospitalizácie, je zrejmé, že devastujúci vplyv nutričných a hormonálnych faktorov na kostný metabolizmus perzistoval dlhšie. Tento predpoklad sa opiera o longitudinálne observačné štúdie, ktoré za spoľahlivý prediktor straty kostnej hmoty uvádzajú dĺžku trvania ochorenia.(19) Rastúci skelet je obzvlášť vulnerabilný na chronické hladovanie, ktoré môže mať ďalekosiahle následky na kostné zdravie, keďže adolescencia je kritické obdobie pre formáciu maximálneho „peaku“ kostnej masy a rapídnu remodeláciu kostného tkaniva.(15,20) Zmeny kostnej denzity a mikroarchitektoniky kostnej štruktúry môžu zásadne ovplyvniť lokálne millieu kostnej drene tvorené hustou spleťou hematopoetických a stromálnych osteoprogenitorových buniek, ktoré je sídlom aktívnej krvotvorby. V experimente sa dokázalo, že indukovaná deplécia osteoblastov viedla k poklesu erytroidných, lymfoidných a myeloidných progenitorov.(7) Účinky buniek osteoblastovej línie na špecifické hematopoetické populácie závisia od stavu maturácie, tvorby cytokínov a špecifických regulačných signálnych dráh.(21) Osteoblasty sú zdrojom početných cytokínov a rastových faktorov, ktoré majú kľúčovú úlohu pri hematopoetickom a myeloidnom vývoji, vrátane faktora stimulujúceho kolónie granulocytov,(22) faktora stimulujúceho kolónie granulocytov-makrofágov,(23) interleukínu-6 a tumor nekrotizujúceho faktora-α.(24) V klinike demonštrovali potenciálne spojenie medzi kostnou denzitou a krvnými bunkami Valderrabano a spol., ktorí v pilotnej štúdií zahrňujúcej veľkú skupinu starších mužov zistili, že úbytok najmä kortikálnej kosti asociuje s anémiou, zníženým počtom lymfocytov a monocytov a vyšším počtom neutrofilov.(9) Je zaujímavé, že koreláciu medzi úbytkom kostnej hmoty a počtom lymfocytov a monocytov sme potvrdili aj v našom súbore dospievajúcich anorektičiek. To naznačuje, že porucha kostného metabolizmu môže nezávisle od veku determinovať fragilné mikroprostredie kostnej drene a narušiť fyziologickú diferenciáciu hematopoetickej kmeňovej bunky.
Osteoblasty exprimujú dôležité kostné markery, ako je alkalická fosfatáza a kolagén typu I. Terminálny osteoblast lokalizovaný na povrchu kosti syntetizuje osteokalcín, najdôležitejší nekolagénový proteín kostnej matrix.(25) O porušenej funkcii osteoblastov u našich adolescentiek s AN nepriamo svedčí znížená aktivita alkalickej fosfatázy, ako aj nižšie sérové koncentrácie osteokalcínu a P1NP. Osteoblasty pochádzajú z rovnakej progenitorovej kmeňovej bunky ako ďalší dôležitý komponent mikroprostredia kostnej drene – tukové tkanivo (bone marrow adipose tissue – BMAT ). Hoci presná funkcia BMAT nie je celkom jasná, viaceré štúdie poukazujú na úzky fyziologický vzťah medzi kostným a tukovým tkanivom kostnej drene.(26,27) Nové svetlo do patogenetickej osi kosť–hematopoéza prinieslo vyšetrenie magnetickou rezonanciou s kvantifikáciou a distribúciou tuku v kostnej dreni. U dievčat s AN sa prekvapivo zistil paradoxný fenomén, keď napriek zníženému množstvu viscerálneho tuku sa preukázal nárast BMAT a inverzný vzťah medzi BMAT a BMD vo viacerých skeletálnych oblastiach.(17) V súlade s tým sú závery recentnej štúdie u premenopauzálnych žien, ktoré potvrdili inverznú koreláciu medzi počtom krvných elementov a množstvom BMAT.(28) Hoci sme BMAT v našej kohorte nevyšetrovali, môžeme špekulovať, že pozitívna korelácia medzi počtom krvných elementov a BMD naznačuje, že úbytok kostných buniek ovplyvňujúcich efektívnu krvotvorbu môže súvisieť s vyšším zastúpením BMAT . Veľkou výzvou pre ďalší vedecký a klinický výskum je detailnejšie preskúmať vzťah medzi hematopoézou, denzitou kostného minerálu a množstvom BMAT u dievčat s mentálnou anorexiou.
Záver
Počas pandémie došlo k prudkému nárastu incidencie mentálnej anorexie u detí, ktorá sa stala „horúcim“ problémom v klinickej praxi.
Pediatri by mali mať na zreteli, že subklinické hematologické zmeny v rutinnom krvnom obraze sú častou sprievodnou komplikáciou mentálnej anorexie. Príčinou menej efektívnej krvotvorby je hlboký nutričný a kalorický deficit a nie nedostatok železa, vitamínu B12 či kyseliny listovej. Úbytok kostnej hmoty môže narušiť „živné“ mikroprostredie kostnej drene a prispievať k menej efektívnej hematopoéze. Výsledky našej prierezovej štúdie dokumentujú potenciálny vzťah medzi kostným metabolizmom a krvotvorbou u adolescentných dievčat s anorexiou.
Či ide o kauzálne spojenie, treba potvrdiť v longitudinálnych prospektívnych štúdiách na veľkom súbore anorektičiek rôzneho veku.
Táto štúdia bola podporená Grantom Ministerstva zdravotníctva Slovenskej republiky 2018/36-LFUK-10 a Grantovou agentúrou Ministerstva školstva, vedy, výskumu a športu Slovenskej republiky VEGA 1/0613/17.
Korespondenční adresa:
MUDr. Ľubica Tichá, PhD.
Detská klinika LF UK a NÚDCH
Limbová 1
833 40 Bratislava
Sources
1. Smink FRE, Van Hoeken D, Oldehinkel AJ, Hoek HW. Prevalence and severity of DSM-5 eating disorders in a community cohort of adolescents. Int J Eat Disord 2014; 47 : 610–619.
2. Association AP. Diagnostic and Statistical Manual of Dsm-5 TM. 2013.
3. Misra M, Aggarwal A, Miller KK, et al. Effects of anorexia nervosa on clinical, hematologic, biochemical, and bone density parameters in community - dwelling adolescent girls. Pediatrics 2004; 114 : 1574–1583.
4. Robinson L, Aldridge V, Clark EM, et al. A systematic review and meta-analysis of the association between eating disorders and bone density. Osteoporos Int 2016; 27 : 1953–1966.
5. Čagalová A, Tichá Ľ, Killinger Z, Podracká Ľ. Vplyv mentálnej anorexie na kostný metabolizmus. Clin Osteol 2020; 25 : 37–43.
6. Lorenzo J, Horowitz M, Choi Y. Osteoimmunology: Interactions of the bone and immune system. Endocr Rev 2008; 29 : 403–440.
7. Visnjic D, Kalajzic Z, Rowe DW, et al. Hematopoiesis is severely altered in mice with an induced osteoblast deficiency. Blood 2004; 103 : 3258–3264.
8. Cesari M, Pahor M, Lauretani F, et al. Bone density and hemoglobin levels in older persons: results from the InCHIANTI study. Osteoporos Int 2005; 16 : 691–699.
9. Valderrábano RJ, Lui L-Y, Lee J, et al. Bone density loss is associated with blood cell counts. J Bone Miner Res 2017; 32 : 212–220.
10. Polineni S, Resulaj M, Faje AT , et al. Red and white blood cell counts are associated with bone marrow adipose tissue, bone mineral density, and bone microarchitecture in premenopausal women. J Bone Miner Res 2020; 35 : 1031–1039.
11. Practice T, Medicine R. Current evaluation of amenorrhea. Fertil Steril 2008; 90: S219–S225.
12. Regecová V, Hamade J, Janechová H, Ševčíková Ľ. Comparison of Slovak reference values for anthropometric parameters in children and adolescents with international growth standards: implications for the assessment of overweight and obesity. Croat Med J 2018; 59 : 313–326.
13. Gordon CM, Leonard MB, Zemel BS; International Society for Clinical Densitometry. 2013 Pediatric Position Development Conference: Executive Summary and Reflections. J Clin Densitom 2014; 17 : 219–224.
14. Soyka LA, Misra M, Frenchman A, et al. Abnormal bone mineral accrual in adolescent girls with anorexia nervosa. J Clin Endocrinol Metab 2002; 87 : 4177–4185.
15. Tichá, Payer J, Killinger Z, Podracká. Porucha kostného metabolizmu pri mentálnej anorexii. Čes-Slov Pediatr 2016; 71 : 287–292.
16. Čagalová A, Tichá Ľ, Gaál Kovalčíková A, et al. Bone mineral density and oxidative stress in adolescent girls with anorexia nervosa. Eur J Pediatr 2022; 181 : 311–321.
17. Bredella MA, Fazeli PK, Miller KK, et al. Increased bone marrow fat in anorexia nervosa. J Clin Endocrinol Metab 2009; 94 : 2129–2136.
18. Biver E, Salliot C, Combescure C, et al. Influence of adipokines and ghrelin on bone mineral density and fracture risk: a systematic review and meta-analysis. J Clin Endocrinol Metab 2011; 96 : 2703–2713.
19. Legroux-Gerot I, Vignau J, Collier F, Cortet B. Bone loss associated with anorexia nervosa. Joint Bone Spine 2005; 72 : 489–495.
20. Winther A, Jørgensen L, Ahmed LA, et al. Bone mineral density at the hip and its relation to fat mass and lean mass in adolescents: The Tromsø Study, Fit Futures. BMC Musculoskelet Disord. 2018. https: //doi. org/10.1186/s12891-018-1933-x.
21. Panaroni C, Tzeng YS , Saeed H, Wu JY. Mesenchymal progenitors and the osteoblast lineage in bone marrow hematopoietic niches. Curr Osteoporos Rep 2014; 12 : 22–32.
22. Taichman RS, Emerson SG. Human osteoblasts support hematopoiesis through the production of granulocyte colony-stimulating factor. J Exp Med 1994; 179 : 1677–1682.
23. Taichman RS, Emerson SG. Human osteosarcoma cell lines MG-63 and SaOS-2 produce G-CSF and GM-CSF: Identification and partial characterization of cell-associated isoforms. Exp Hematol 1996; 24 : 509–517.
24. Nelissen JMDT, Torensma R, Pluyter M, et al. Molecular analysis of the hematopoiesis supporting osteoblastic cell line U2-OS. Exp Hematol 2000; 28 : 422–32.
25. Aubin JE. Regulation of osteoblast formation and function. Rev Endocr Metab Disord 2001; 2 : 81–94.
26. Moerman EJ, Teng K, Lipschitz DA, Lecka-Czernik B. Aging activates adipogenic and suppresses osteogenic programs in mesenchymal marrow stroma/stem cells: the role of PPAR -γ2 transcription factor and TGF-β/BMP signaling pathways. Aging Cell 2004; 3 : 379–389.
27. Di Iorgi N, Rosol M, Mittelman SD, Gilsanz V. Reciprocal relation between marrow adiposity and the amount of bone in the axial and appendicular skeleton of young adults. J Clin Endocrinol Metab 2008; 93 : 2281–2286.
28. Polineni S, Resulaj M, Faje AT , et al. Red and White Blood Cell Counts Are Associated With Bone Marrow Adipose Tissue, Bone Mineral Density, and Bone Microarchitecture in Premenopausal Women. J Bone Miner Res 2020; 35 : 1031–1039.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2022 Issue 3-
All articles in this issue
- Dopis z Ukrajiny českým a slovenským pediatrům
- Co jsme psali
- Invazivní meningokokové onemocnění – závažná nemoc, u níž rozhoduje čas. Ochranou je očkování
- Editorial
- Suicidalita a sebepoškozování v dětství a adolescenci – aktuální situace
- Suicidalita u detí a adolescentov – rizikové faktory a dopad pandémie covidu-19
- Poruchy autistického spektra
- Vplyv lockdownu a online výučby počas pandémie covidu-19 na duševné zdravie slovenských adolescentov
- U adolescentiek s mentálnou anorexiou počet cirkulujúcich krvných buniek asociuje s denzitou kostného minerálu
- Realimentační syndrom
- Pohlavní/rodová neshoda v dětství
- Vážný průběh akutní infekce SARS-CoV-2 u pacientů na Pediatrické klinice Fakultní nemocnice v Motole
- Profesor Nevoral oslavil osmdesáté narozeniny
- Pediatrická poezie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Poruchy autistického spektra
- Pohlavní/rodová neshoda v dětství
- Suicidalita a sebepoškozování v dětství a adolescenci – aktuální situace
- Realimentační syndrom
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

