-
Medical journals
- Career
Laboratorní novorozenecký screening
Authors: Honzík Tomáš 1; Kožich Viktor 1; Pešková Karolína 1; Votava Felix 2
Authors‘ workplace: Klinika pediatrie a dědičných poruch metabolismu 1. LF UK a VFN, Praha 1; Klinika dětí a dorostu 3. LF UK a FN Královské Vinohrady, Praha 2
Published in: Čes-slov Pediat 2022; 77 (1): 12-18.
Category: Chapters for Specialization in Pediatrics
Overview
Úvod: laboratorní novorozenecký screening (LNS) je preventivní celopopulační program, který umožňuje včasnou diagnostiku a účinnou léčbu pacientům s vybranými vrozenými a dědičnými nemocemi a podstatně zlepšuje kvalitu jejich života.
Metodika: vyšetření kapilární krve odebrané mezi 48. až 72. hodinou života ve formě suché krevní kapky metodami tandemové hmotnostní spektrometrie, fluorimetrie, imunoeseje či molekulárně genetickými.
Výsledky: v České republice byl LNS zahájen v roce 1975 vyhledáváním fenylketonurie (PKU), dále se rozšířil v roce 1985 o kongenitální hypotyreózu (CH), v roce 2006 o kongenitální adrenální hyperplazii (CAH), v roce 2009 o cystickou fibrózu (CF) a dalších 9 dědičných poruch metabolismu. K dalšímu rozšíření počtu onemocnění došlo v roce 2016. V letech 2010–2020 bylo vyšetřením více než 1,2 milionu novorozenců zachyceno pomocí LNS celkem 1100 pacientů s některou z cílových nemocí. Kumulativní novorozenecká prevalence všech 18 nemocí činí 1 : 1100. Mezi nejčastější patří CH, PKU, CF a parciální deficit biotinidázy. Od roku 2022 je plánován start pilotního programu dalšího rozšíření LNS o spinální svalovou atrofii a těžké kombinované imunodeficity.
Závěr: LNS programy se díky pokrokům v technologiích a léčbě celosvětově rozšiřují za dodržení stále platných kritérií WHO dle Wilsona a Jungnera.
Klíčová slova:
cystická fibróza – kongenitální adrenální hyperplazie – laboratorní novorozenecký screening – kongenitální hypotyreóza – fenylketonurie – dědičné poruchy metabolismu
ÚVOD
Pojem screening (z anglického screen = síto) označuje systematické cílené vyhledávání osob se zvýšeným rizikem určité nemoci před její klinickou manifestací s cílem předejít včas jejím možným následkům. Mimořádný dosah má tato forma sekundární prevence právě v pediatrii, kde umožňuje včasný záchyt a včasné zahájení léčby některých vzácných vrozených či geneticky podmíněných nemocí, které by bez této intervence vedly k těžkému nevratnému poškození zdraví, nebo i k úmrtí.
OBECNÉ PRINCIPY SCREENINGOVÝCH PROGRAMŮ
Cílem screeningu je při vyšetření cílové populace identifikovat ty její členy, kteří trpí určitou skrytě probíhající nemocí. Screeningový test tak odděluje jedince, kteří s vysokou pravděpodobností trpí určitou nemocí, od těch, kteří jí pravděpodobně netrpí. Screeningová vyšetření nejsou testem jednoznačně potvrzujícím či vylučujícím onemocnění, konfirmační vyšetření jinými metodami je dalším nezbytným krokem u pozitivně screenovaných jedinců.
Podle zvolené populace, v níž je porucha vyhledávána, můžeme rozlišovat screening celoplošný nebo selektivní.
• Celoplošný screening se provádí u celé předem definované populace. Příkladem jsou screeningy nádorových onemocnění nebo novorozenecký screening. S jeho pomocí jsou u všech novorozenců narozených na daném území, většinou státu, vyhledávána vrozená a genetická onemocnění či vývojové vady. Další celoplošné screeningy jsou součástí systému definovaných preventivních pediatrických prohlídek.
• Selektivní screening je zaměřen na vyhledávání konkrétní, většinou vzácně se vyskytující nemoci u pacientů, kteří manifestovali klinické projevy daného onemocnění, či vyhledávání v rizikové populaci, např. v rodinách probandů.
Novorozenecký screening slouží k časné identifikaci novorozenců, kteří trpí určitou zdravotní poruchou a kteří mohou mít prospěch z jejího včasného zjištění. Umožňuje identifikovat postižené jedince ve věku, kdy ještě příznaky nemoci chybějí nebo je lze snadno přehlédnout. V novorozeneckém věku jsou např. vyhledávány:
• některé vrozené vývojové vady včetně koarktace aorty – pátrání po nich je součástí prvního vyšetření pediatrem po narození;
• vrozená dysplazie kyčelních kloubů – první vyšetření se provádí ještě za pobytu dítěte na novorozeneckém oddělení, pak následuje ještě sonografické a ortopedické vyšetření;
• vrozené smyslové poruchy – provádí se vyšetření otoakustických emisí a oftalmologické vyšetření s cílem včasného záchytu poruch sluchu a vrozené katarakty či retinoblastomu;
• vrozené vývojové vady ledvin pomocí sonografického vyšetření;
• vybraná vrozená a dědičná onemocnění pomocí laboratorního novorozeneckého screeningu (LNS) založeného na vyšetřeních suché kapky krve analytickými laboratorními metodami. Pro efektivitu LNS je potřebný sofistikovaný způsob centrální organizace, obzvláště v současné době s nevídanými technologickými laboratorními a léčebnými možnostmi. Předmětem tohoto sdělení je seznámit čtenáře s historií, současností a výhledy LNS v ČR.
HISTORIE LABORATORNÍHO NOVOROZENECKÉHO SCREENINGU
Zakladatelem LNS je profesor Robert Guthrie z Univerzity v Buffalu ve státě New York, USA. V roce 1963 vyvinul a následně i zavedl do celoplošného provádění jednoduchou, levnou a spolehlivou semikvantitativní metodu měření koncentrace fenylalaninu využívající na fenylalaninu závislý růst kultury bakterií Bacillus subtillis pro LNS fenylketonurie (obrázek 1).(1) Poprvé použil k tomuto účelu metodu zaschlých vzorků kapilární krve na speciálním filtračním papírku, tzv. suchých kapek krve (SKK). Na této metodě odběru krve stojí systém LNS dodnes a „Guthrieho kartičky“ jsou běžně používaným pojmem na celém světě.
Image 1. Robert Guthrie (1916–1995) a laboratorní novorozenecký screening fenylketonurie (http://pkuworld.org/home/docs/ history/guthrie200.jpg). Metoda využívá na fenylalaninu závislý růst kultury bakterií Bacillus subtillis, jež se lépe a rychleji dělí v přítomnosti vyšší hladiny fenylalaninu difundující do kultivačního média z papírku nasátého kapilární krví dítěte s fenylketonurií. 
Po roce 1965 se začal LNS celosvětově rychle rozšiřovat. Zahájení celoplošných screeningových programů (nejen LNS) si vyžádalo formulování obecných pravidel pro jejich provádění, což učinili zadáním Světové zdravotnické organizace (WHO) Wilson a Jungner v roce 1968.(2) Předpoklady pro zahájení celoplošného screeningu jakéhokoliv onemocnění lze shrnout do následujících kritérií WHO dle Wilsona a Jungnera:
1. Představuje významný zdravotní/sociální problém (prevalence nestanovena).
2. Je jasně diagnosticky definovatelné (existuje konfirmační test).
3. Má latentní nebo nespecifické časné stadium.
4. Jeho přirozený průběh musí být znám.
5. Včasná detekce umožňuje takovou léčbu, která zásadně pozitivně ovlivní průběh nemoci.
6. Musí být odborný konsenzus koho a jak léčit.
7. Existuje obecně uznaný screeningový test.
8. Společnost je schopna zabezpečit nejen screening, ale i následnou léčbu.
9. Přínos screeningu je vyšší než jeho náklady – rovnováha „cost/benefit ratio“.
10. Screening je kontinuální proces – efektivita musí být trvale vyhodnocována.
Počátky LNS v našich zemích časově nikterak významněji nezaostávaly a jsou spjaty se jmény prof. MUDr. Bohunky Blehové, CSc. (1917–1996), prof. MUDr. Josefa Hyánka, DrSc. (* 1933) a Ing. Antonína Mrskoše, CSc. (1923–2014) v případě fenylketonurie a prof. MUDr. Olgy Hníkové, CSc. (1931–2017) v případě vrozené hypotyreózy. Roky zahájení pravidelných celoplošných LNS jsou uvedeny v tabulce 1.
V následujících desetiletích byly vyvinuty technologicky pokročilé analytické metody, např. imunoeseje, fluorimetrie a především tzv. spřažená hmotnostní spektrometrie (tandem mass spectrometry – TMS či MS/MS) a molekulárně genetické metody umožňující významné rozšíření spektra nemocí či zvýšení specificity screeningu pro vyhledávané nemoci na základě vyšetření SKK.
SOUČASNOST LABORATORNÍHO NOVOROZENECKÉHO SCREENINGU
Systém LNS v ČR nespočívá pouze v samotné laboratorní analýze SKK, ale zahrnuje celou logistiku preanalytické části (informování rodičů a vyjádření informovaného souhlasu, způsob, podmínky, časování a event. opakování odběrů suché kapky krve), analytické části (jaké analyty, jakým způsobem a kde jsou měřeny) a postanalytické části (postupy screeningových laboratoří při pozitivním či nejednoznačném nálezu, návaznost na klinická pracoviště s optimalizací dalšího diagnostického postupu a zabezpečení dlouhodobé léčby a sledování pacientů, vyhodnocování a zpracování dat screeningu, skladování a využití vzorků). Systém je natolik složitý, že jeho „lege artis“ provádění je definováno metodickým návodem (MN) vydávaným MZ ČR, který se aktualizuje dle rozvoje LNS. Poslední aktualizace je uvedena ve Věstníku MZ z roku 2016 a v budoucnu se bude jistě měnit a je povinností zainteresovaných pracovišť změny sledovat.(3) Přehled v současné době v ČR screenovaných nemocí a jejich výskytu je uveden v tabulce 1. Pravděpodobnost, že novorozenec bude postižen některou ze screenovaných nemocí, (kumulativní novorozenecká prevalence všech 18 nemocí) činí 1 : 1100.
Preanalytická fáze
Pro zdravotníky pečující o novorozence je základní podmínkou správného fungování celého systému LNS dodržování pravidel zveřejňovaných ve zmíněném MN. Přesné znění MN a řadu dalších informací ohledně LNS lze nalézt na webových stránkách www. novorozeneckyscreening.cz.
Důležitou podmínkou screeningových programů je vzájemná důvěra mezi vyšetřovanou populací a zdravotníky. Nezbytnou součástí LNS je poskytnutí přiměřených informací zákonným zástupcům novorozence, nejlépe v předporodní době a nejpozději před odběrem vzorku krve novorozenci. Nejvýznamnějším zdrojem informací pro rodiče jsou neonatologové a pediatři. Webová stránka a metodický návod obsahují různé informační materiály pro odborníky i laickou veřejnost, přesto reprezentativní vzorek 1,4 tisíce matek ukázal, že 18 % matek nevědělo o tom, že LNS byl proveden.(4)
V současnosti se odběr SKK provádí mezi 48. – 72. hodinou života novorozence. Za správné provedení odběru a další kroky dle MN je zodpovědný lékař (poskytovatel zdravotních služeb), který má v této době novorozence v péči. Odběr lze provést pouze se souhlasem zákonného zástupce. Odběr se provádí drobnou incizí patičky v oblasti dle obrázku 2. Kapky krve se zachycují na filtrační papírek, který je součástí speciální dvojité screeningové kartičky – obrázek 3.
Image 2. Odběr kapilární krve z paty pro LNS. Červeně jsou vyznačené oblasti vhodné k odběru. 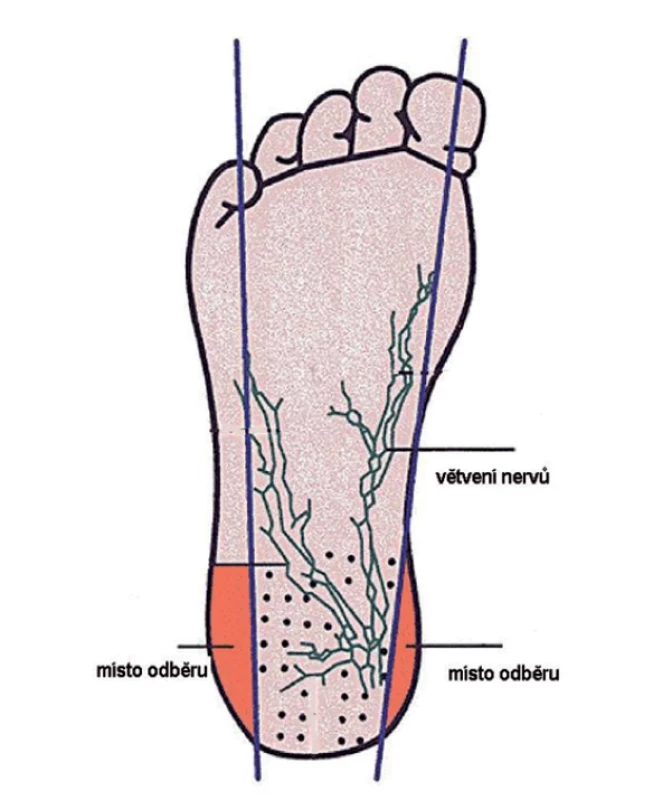
Image 3. Odběrová „screeningová“ kartička. Správně provedený odběr = vyznačená políčka jsou dokonale prosáknutá krví. Před odběrem se vyplňují všechna políčka pro demografické údaje a informace o novorozenci. 
Velmi důležitá je kvalita SKK. Krev musí zcela zaplnit předtištěná políčka a prosáknout filtrační papír i do rubové strany. Kapky se ale nesmí slévat a čímkoliv kontaminovat. Po zaschnutí při pokojové teplotě se odesílají co nejdříve poštou nebo poslem s řádně vyplněnými demografickými údaji a informacemi o novorozenci. Jeden list do příslušných imunoanalytických laboratoří a druhý do laboratoří tandemové hmotnostní spektrometrie a fluorimetrie. Rychlé dodání SKK je nezbytné pro včasnou diagnostiku a léčbu pacientů s akutně probíhajícími formami vyhledávaných onemocnění, které se mohou manifestovat klinicky již ke konci prvního týdne života.
V některých klinických situacích novorozence je třeba odběr SKK opakovat – provést tzv. rescreening. Za indikaci rescreeningu a jeho zajištění je opět odpovědný lékař, který má novorozence v době indikace rescreeningu v péči. Přesná pravidla jsou uvedena v MN. Zde jsou uvedeny příklady indikace rescreeningu:
• U novorozence s porodní hmotnosti < 1500 g v době, kdy dosáhne hmotnosti 1500 g.
• 8.–14. den života novorozence se provádí rescreening pokud:
- byla matce 48 hodin před porodem nebo novorozenci před prvním odběrem podána kortikoterapie;
- byla matka v posledním trimestru léčena tyreostatiky nebo léky s vysokým obsahem jodu (nikoliv běžná jodidová suplementace v těhotenství);
- byl novorozenec před prvním odběrem léčen dopaminem nebo léky s vysokým obsahem jodu;
- byl novorozenci před prvním odběrem podán transfuzní přípravek;
- byly novorozenci před prvním odběrem podány infuze aminokyselin, glukózy nebo lipidů.
Může nastat situace, zvláště v případě nezralých novorozenců, kdy bude o další odběr žádat screeningová laboratoř. V tomto případě se nejedná o rescreening, ale buď o nekvalitní odběr vzorku krve na SKK, nebo nejasný nález hraničních koncentrací analytu v oblasti, která nedosahuje hodnot typických pro pozitivní nález. Tento typ opakování obvykle podezření na nemoc nepotvrdí a je následně klasifikován jako f alešně pozitivní nález.
Analytická fáze
Základní analytické postupy metodami tandemové hmotností spektrometrie, fluorimetrie či imunoeseje a metodami molekulárně genetickými jsou zmíněny v tabulce 1. Pro vyšetření se používají jednak prvostupňové (primární) markery nemocí (koncentrace analytů či jejich poměry), u některých nemocí se v případě abnormálního nálezu před vyhodnocením výsledku doplňují ze zaslaného vzorku SKK ještě druhostupňové markery (např. celkový homocystein při screeningu homocystinurie). V případě LNS cystické fibrózy se ke snížení falešné pozitivity u max. 1 % vzorků provádí molekulárně genetická analýza 50 nejčastějších patogenních variant v CFTR genu (zahrnuje 93 % alel pacientů s CF v Evropě). I když screeningové programy definují předem cílové nemoci, některé markery můžou vést i k zachycení tzv. sekundárních cílových nemocí s menší spolehlivostí záchytu nebo nižší efektivitou léčebných intervencí (v ČR je možné kromě cílových nemocí zachytit metodou MS/MS okolo 20 sekundárních cílových nemocí).
Table 1. Přehled 18 nemocí vyhledávaných pomocí celoplošného laboratorního novorozeneckého screeningu v České republice (řazeno chronologicky dle roku zahájení, reálná novorozenecká prevalence v České republice na základě vyšetření 1 225 358 novorozenců v období 1. 1. 2010 – 31. 12. 2020) 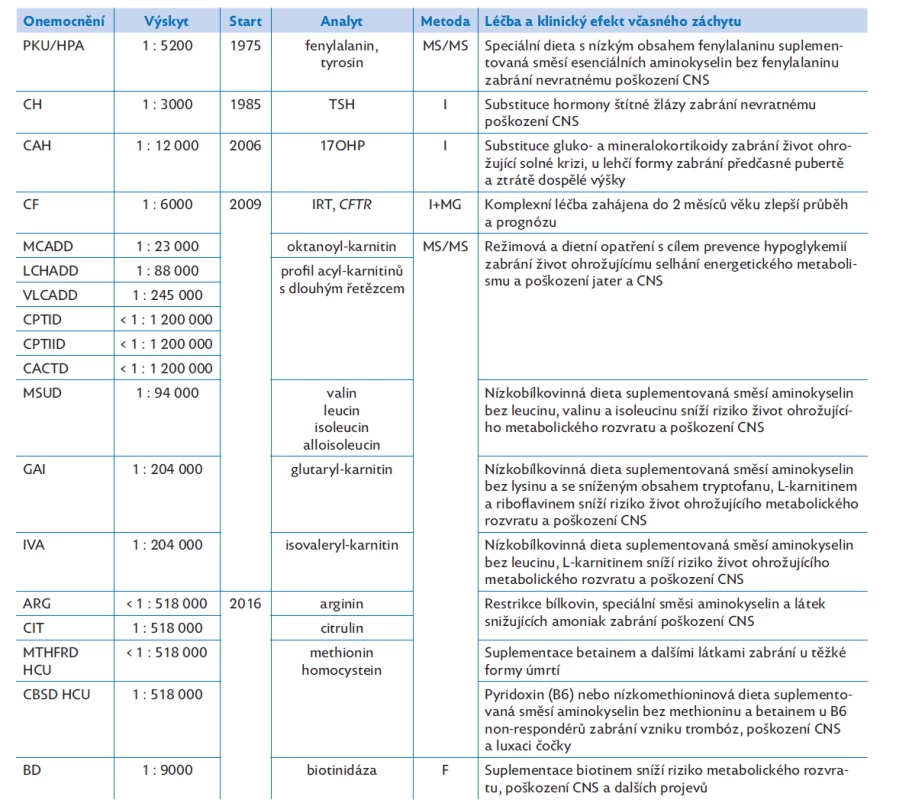
PKU/HPA – fenylketonurie/hyperfenylalaninemie, CH – kongenitální hypotyreóza, CAH – kongenitální adrenální hyperplazie, resp. deficit 21-hydroxylázy, CF – cystická fibróza, MCADD – deficit acyl-CoA dehydrogenázy mastných kyselin se středně dlouhým řetězcem, LCHADD – deficit 3-hydroxyacyl-CoA dehydrogenázy mastných kyselin s dlouhým řetězcem, VLCADD – deficit acyl-CoA dehydrogenázy mastných kyselin s velmi dlouhým řetězcem, CPTID – deficit karnitinpalmitoyltransferázy I, CPTIID – deficit karnitinpalmitoyltransferázy II, CACTD – deficit karnitinacylkarnitintranslokázy, MSUD – leucinóza (nemoc javorového sirupu), GAI – glutarová acidurie typu I, IVA – isovalerová acidurie, ARG – argininemie, CIT – citrulinemie, MTHFD HCU – homocystinurie z deficitu metylentetrahydrofolátreduktázy, CBSD HCU – homocystinurie z deficitu cystationin beta-syntázy, BD – deficit biotinidázy.
Start – rok zahájení pravidelného celoplošného laboratorního novorozeneckého screeningu v České republice, analyt – měřený biomarker, TSH – tyreoideu stimulující hormon, 17OHP – 17-hydroxyprogesteron, IRT – imunoreaktivní trypsinogen, CFTR – gen pro cystickou fibrózu, metody – laboratorní analytické metody používané v ČR pro screeningové vyšetření.
Metody používané v ČR: I – imunoesej, F– fluorimetrie, MS/MS – tandemová hmotnostní spektrometrie, MG –molekulárně genetické vyšetření.Postanalytická fáze
Pozitivní nález v LNS není potvrzením diagnózy. Znamená pouze, že vzniklo vysoké podezření na dané onemocnění. Naopak negativní nález neznamená jednoznačné vyloučení přítomnosti 18 screenovaných nemocí, ale znamená pouze to, že koncentrace laboratorních markerů v LNS nebyly v době odběru v rozmezích typických pro nemoc. Falešná negativita LNS je nízká a zpravidla se vyskytuje u klinicky lehkých forem onemocnění. Vznikne-li později klinické podezření na některou screenovanou nemoc, musí být diferenciálně diagnosticky zvažována i v případě provedeného a negativního nálezu při LNS.
V případě pozitivního nálezu (= vzniku podezření na nemoc) za další neodkladné kroky k zajištění konfirmace diagnózy, zahájení léčby a další sledování pacientů jsou zodpovědné laboratoře LNS ve spolupráci s příslušnými diagnostickými laboratořemi a klinickými pracovišti uvedenými v MN.
Falešná pozitivita LNS je prokázána až při konfirmačních vyšetřeních či při opakování screeningu dle požadavku laboratoří. Výskyt falešné pozitivity závisí do značné míry na typu markeru (např. 17-hydroxyprogesteron je zvýšený i nespecificky při stresu novorozence a nízké porodní hmotnosti). Na obrázku 4 je uveden příklad počtu falešně pozitivních nálezů dle hmotnosti novorozence a typu screenované nemoci v jednom reprezentativním roce.
Image 4. Počet vyšetřených novorozenců, zachycených pacientů a falešně pozitivních nálezů. Obrázek ukazuje výsledky LNS za rok 2020, počty falešně pozitivních (FP) nálezů se liší dle porodní hmotnosti a typu nemoci. 
MEZINÁRODNÍ SROVNÁNÍ
Spektrum nemocí a celková organizace LNS je v jednotlivých zemích či regionech velmi rozmanitá. Ve všech státech USA je nyní doporučen screening 35 cílových nemocí, při jejich diagnostice je možné nalézt ještě 18 dalších chorob (https://www.hrsa.gov/advisory-committees/heritable-disorders/rusp/index. html).(5) V Evropě je situace mnohem pestřejší a počet nemocí se pohybuje mezi 2 a přibližně 40, rovněž organizace programů LNS je variabilní.(6)
BUDOUCNOST LABORATORNÍHO NOVOROZENECKÉHO SCREENINGU
Význam LNS s rozvojem analytických technologií, zejména v oblasti tandemové hmotnostní spektrometrie a molekulární genetiky, přitahuje pozornost zejména v komunitě věnující se vzácným nemocem (https://download2.eurordis.org/documents/pdf/ eurordis_nbs_position_paper.pdf). Zásadními impulsy pro úpravy či rozšiřování LNS jsou nové vysoce efektivní terapeutické možnosti. Bude zapotřebí hledat nová etická i legislativní pravidla a celospolečenský konsenzus. V evropském prostoru je významnou platformou projekt Screen4rare (https://www. isns-neoscreening.org/isns-position-concerning-recent-statements-by-ifcc-and-eurordis-on-neonatal-screening-policies/). Příkladem tohoto vývoje je LNS spinální svalové atrofie (SMA) založený na molekulárně genetické (MG) analýze genu SMN1 a těžké kombinované imunodeficience (SCID) založený na MG průkazu nedostatku cirkulárních zbytků DNA při vývoji receptorů lymfocytů (tzv. TREC – T cell receptor excision circles a/nebo KREC – k-deleting recombination excision circles). Start pilotní studie LNS SMA a SCID je připraven od 1. 1. 2022. V některých zemích je již rutinně používaná pro druhostupňové vyšetření zaslaných SKK metoda sekvenování nové generace (NGS) pro panel nemocí.(7) O vhodnosti použití NGS jako primárního postupu ve screeningu se vedou již delší dobu debaty,(8) tento přístup však zatím v rutinní praxi není využíván. Ve vzdálenější budoucnosti nelze vyloučit LNS na základě analýzy fetální DNA z periferní krve matky.
Podpořeno RVO-VFN64165, PROGRES Q26 a Q36
Korespondenční adresa:
doc. MUDr. Felix Votava, CSc.
Klinika dětí a dorostu 3. LF UK a FN Královské Vinohrady
Šrobárova 1150
100 34 Praha 10
Sources
1. Guthrie R, Susi A. A simple phenylalanine method for detecting phenylketonuria in large populations of newborn infants. Pediatrics 1963; 32 : 338–343.
2. Wilson JMC, Junger G. Principles and practise of screening for disease. Public Health Papers 1968; 34, Geneva World Health Organization.
3. Metodický návod k zajištění celoplošného novorozeneckého laboratorního screeningu a následné péče. Věstník Ministerstva zdravotnictví ČR, 2016; 6 : 2–12.
4. Franková V, Dohnalová A, Pešková K, et al. Factors influencing parental awareness about newborn screening. Int J Neonatal Screen 2019; 5(3): 35. doi: 10.3390/ijns5030035
5. McCandless SE, Wright EJ. Mandatory newborn screening in the United States: History, current status, and existential challenges. Birth Defects Res 2020; 112(4): 350–366.
6. Loeber JG, Platis D, Zetterström RH, et al. Neonatal Screening in Europe Revisited: An ISNS Perspective on the Current State and Developments Since 2010. Int J Neonatal Screen 2021; 7(1): 15. doi: 10.3390/ijns7010015
7. Tangeraas T, Sæves I, Klingenberg C, et al. Performance of expanded newborn screening in Norway supported by post-analytical bioinformatics tools and rapid second-tier DNA analyses. Int J Neonatal Screen 2020; 6(3): 51. doi: 10.3390/ijns6030051
8. Mohamed AE, van den Heuvel L. Editorial: Newborn screening for inborn errors of metabolism: Is it time for a globalized perspective based on genetic screening? Front Genet 2021; 12 : 758142. doi: 10.3389/fgene.2021.758142
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2022 Issue 1-
All articles in this issue
- Vybrané poznámky k psychofarmakoterapii dětského a dorostového věku
- Laboratorní novorozenecký screening
- Hereditárny angioedém u detí: čo potrebuje vedieť pediater
- Perinatální mortalita a morbidita u infekce SARS-CoV-2 v průběhu těhotenství
- Diferenciální diagnostika syndromu multisystémové zánětlivé odpovědi asociované s nákazou SARS-CoV-2 u dětí a mladistvých
- Kardiovaskulární projevy u syndromu multisystémové zánětlivé odpovědi asociované s covidem-19 u dětí (PIMS-TS)
- Sekundární hemofagocytující lymfohistiocytóza při infekci virem SARS-CoV-2
- Z historie pediatrie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Laboratorní novorozenecký screening
- Diferenciální diagnostika syndromu multisystémové zánětlivé odpovědi asociované s nákazou SARS-CoV-2 u dětí a mladistvých
- Vybrané poznámky k psychofarmakoterapii dětského a dorostového věku
- Z historie pediatrie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

