-
Medical journals
- Career
Infekční endokarditida s embolizací vegetace do centrální nervové soustavy
Authors: J. Pavlíček 1,2; A. Molnárová 3; M. Ptáček 1,4; P. Hanzlíková 2,5; S. Polanská 1; T. Gruszka 1,2; M. Hla-Dík 1,2
Authors‘ workplace: Klinika dětského lékařství FN a LF OU, Ostrava 1; Lékařská fakulta, Ostravská univerzita, Ostrava 2; Dětské oddělení, Městská nemocnice Ostrava 3; Fakulta bezpečnostního inženýrství, Vysoká škola báňská, Technická univerzita Ostrava 4; Ústav radiodiagnostický, Fakultní nemocnice Ostrava 5
Published in: Čes-slov Pediat 2021; 76 (3): 152-157.
Category: Case Report
Overview
Infekční endokarditida (IE) je závažné onemocnění s vysokou morbiditou a mortalitou. Častější je u pacientů se strukturální patologií srdce. IE nejčastěji postihuje srdeční chlopně, patologický proces může vzniknout i na nástěnném endokardu nebo na cizích tělesech, která jsou v srdci umístěna. U dětí se strukturálně normálním srdcem patří mezi rizikové skupiny pro vznik IE jedinci s malignitami, nezralí novorozenci, pacienti se zavedeným centrálním žilním katetrem, děti s extrakardiálními strukturálními malformacemi nebo genetickými syndromy a mladí narkomani. Jedno z rizik je embolizace části vegetace do dalších orgánových systémů. Vznik IE je možný i na normálním srdci a bez rizikových faktorů v anamnéze.
V kazuistice je demonstrována infekční endokarditida tříletého zdravého dítěte s významnou embolizací do mozku.
Klíčová slova:
embolizace – endokarditida – infekce – vegetace
ÚVOD
Infekční endokarditida (IE) je zánětlivé postižení srdeční výstelky, vyvolávajícím agens jsou různé druhy mikroorganismů. Zánětlivý proces na endokardu způsobují bakterie, plísně, chlamydie, rickettsie nebo i viry [1]. IE nejčastěji postihuje srdeční chlopně, patologický proces může být lokalizován i na nástěnném endokardu nebo na cizích tělesech, která jsou v srdci umístěna (chlopenní protézy, umělé konduity, kardiostimulační elektrody) [2]. IE se častěji vyskytuje u pacientů se srdeční vadou, nejčastěji je její výskyt dokumentován u cyanotických vad typu Fallotovy tetralogie a u defektů komorového septa [3]. U pacientů se srdečním defektem je IE rizikem pooperačního průběhu [4]. Vyšší riziko mají pacienti, u kterých jsou použity umělé materiály. U dětí se strukturálně normálním srdcem patří mezi rizikové skupiny pro vznik IE jedinci s malignitami, nezralí novorozenci, pacienti se zavedeným centrálním žilním katetrem, děti s extrakardiálními strukturálními malformacemi nebo genetickými syndromy a mladí narkomani [4, 5]. Z epidemiologického hlediska pak od nozokomiální IE odlišujeme IE komunitní.
Infekční endokarditida je charakterizována nálezem vegetací na srdeční výstelce. Pro jejich vznik je nutná alterace endotelu turbulentním tokem krve. Poškození endotelu a obnažení kolagenu vede při adhezi a agregaci trombocytů ke vzniku sterilního trombu, který je za určitých podmínek osídlen mikroorganismy. Fragilita a odlamování částí vegetace způsobuje typické embolizační komplikace. IE může mít prolongovaný průběh s nespecifickými příznaky (teploty, únava, nechutenství, ztráta hmotnosti), nebo akutní formu s obrazem septického stavu. Varující jsou déletrvající a nejasné teploty u pacienta se srdeční vadou nebo u původně zdravého jedince detekce nového šelestu, změna stávajícího šelestu a vznik klinických známek oběhového selhávání [1].
Laboratorní diagnostika se opírá o vyšetření známek zánětu a pozitivitu hemokultur. K základním zobrazovacím metodám patří echokardiografické vyšetření, které může identifikovat vegetace, abscesy, destrukci chlopně s nově vzniklou regurgitací, dehiscenci umělé chlopně. Pro diagnostiku IE jsou stále používána Duke/Durack kritéria, která hodnotí kombinaci klinických, patologických, mikrobiologických a echokardiografických nálezů [6]. Konzervativní terapie IE spočívá v dlouhodobé intravenózní terapii antibiotiky, chirurgický výkon je indikován při komplikacích.
Přestože se u dětí IE vyskytuje nejčastěji u pacientů s vrozenou srdeční vadou, autoři představují kazuistiku tohoto onemocnění u tříletého dítěte s negativní kardiální anamnézou.
KAZUISTIKA
Tříletá pacientka s negativní osobní anamnézou, normálním psychomotorickým vývojem a bez sledovaných nebo přidružených onemocnění byla v rámci popisovaného onemocnění poprvé ošetřena u obvodního lékaře s anamnézou tři dny trvajících febrilií s třesavkami. Ošetřující lékař stav zhodnotil jako infekci horních cest dýchacích, pro CRP 102 mg/l doplnil perorální léčbu cefalosporinovými antibiotiky II. generace. Po přechodném zlepšení stavu a poklesu CRP teploty po 14 dnech recidivovaly, stav byl doprovázen kašlem a zvracením.
Pacientka byla přijata k hospitalizaci, CRP ve vstupní laboratoři vykazovalo hodnotu 156 mg/l, prokalcitonin 54 ng/ml, leukocyty 8,9 x 109/l a trombocyty 70 x 109/l. Pro zřetelný a nově zachycený srdeční šelest bylo v den přijetí doplněno kardiologické vyšetření, echokardiografie potvrdila patologický nález vegetace na mitrální chlopni. Vegetace byla velikosti 9 x 3 mm, chlopeň významně regurgitovala (obr. 1a-c). Srdce bylo bez zjevné strukturální vady, dítě nevykazovalo hemodynamické ani klinické známky oběhového selhávání.
Image 1. Echokardiografie: a) vegetace na mitrální chlopni, 2D obraz, dlouhá osa levé komory; b) vegetace v obraze 4D, čtyřdutinová projekce; c) významná regurgitace chlopně, barevné dopplerovské zobrazení (LS: levá síň, LK: levá komora). Fig. 1. Echocardiography: a) the mitral valve vegetation, 2D image, long axis of the left ventricle; b) vegetation in 4D image, fourchamber scan; c) significant regurgitation of the valve, Doppler colour flow mapping (LS: left atrium, LK: left ventricle). 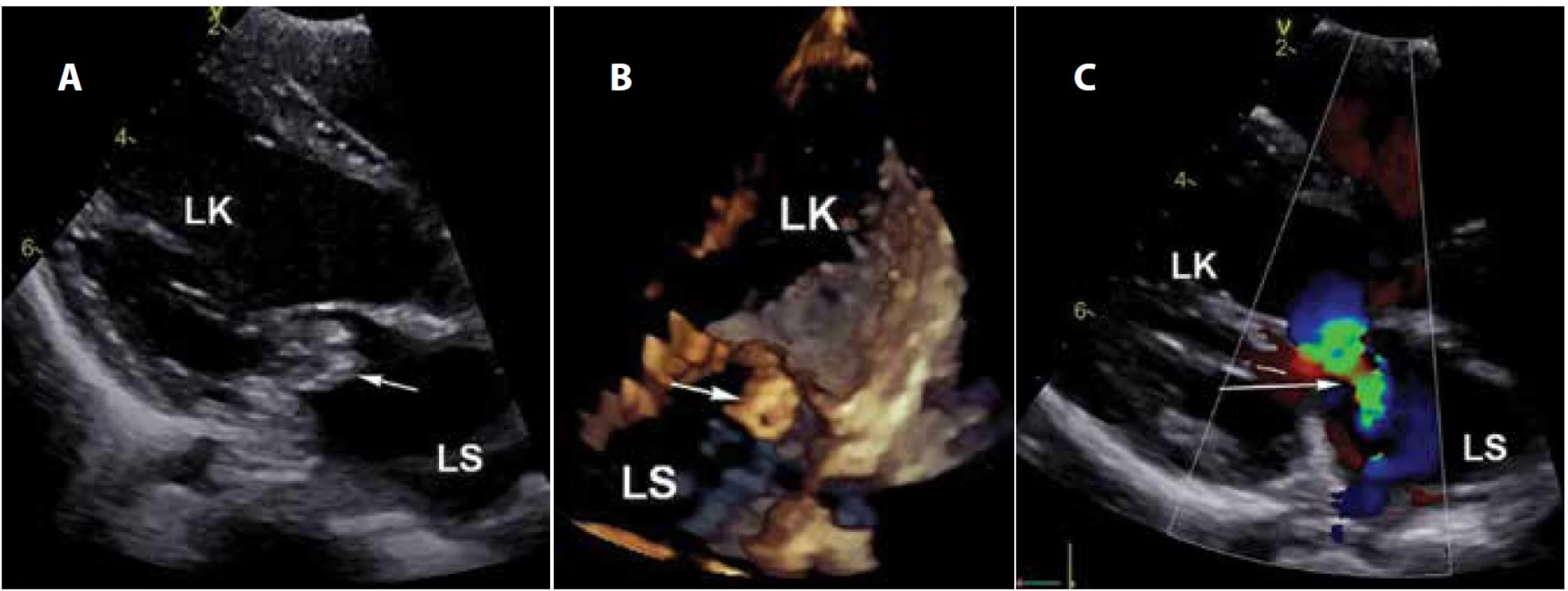
Po odebrání hemokultur jsme dítě zajistili kombinací antibiotik (vankomycin + gentamicin). Teploty klesly k normě po dvou dnech, provedená paraklinická vyšetření (RTG plic, sonografie břicha a ledvin, ORL, dopplerovské vyšetření renálních tepen, oční, neurologie) nedetekovala patologii. První dvě hemokultury byly pozitivní s nálezem Streptococcus pneumoniae typ 23B. Dle citlivosti byl vankomycin vyměněn za Penicilin G, gentamycin jsme ponechali v kombinaci s penicilinem 14 dní a poté ukončili. Třetí až šestá hemokultura při léčbě byla negativní.
Od 19. dne hospitalizace došlo k recidivě febrilií s třesavkou a zvracením s dalším chudým klinickým nálezem. Kontrolní CRP stouplo na 52 mg/ml. Penicilin G jsme po konzultaci s ATB centrem vyměnili za cefotaxim intravenózně. Hemokultury již nevykazovaly pozitivitu. Kontrolní kardiologické vyšetření neidentifikovalo vegetaci na chlopni a vyslovili jsme podezření z jejího utržení a embolizace. Magnetická rezonance (MR) mozku provedená 23. den, včetně MR angiografie, prokázala velmi suspektní emboly v jedné z větví arteria cerebri media vpravo a okrsky dokončené ischémie v oblasti zevní kapsuly vpravo (obr. 2a, 3a). Antibiotika byla vyměněna za cefriaxon intravenózně a byla doplněna antikoagulační terapie Fraxiparinem.
Na kontrolní MR mozku 39. den vymizely známky akutní ischémie a byly popsány reziduální postischemické pruhovité gliové okrsky a obtékané embolizační změny ve větvení arteria cerebri media vpravo (obr. 2b, 3b). Neurologickým vyšetřením nebyla opakovaně prokázána patologie topického nálezu, další komplikace se nevyskytly. Antibiotickou terapii jsme dokončili ceftriaxonem, celková doba podávání i.v. antibiotik byla 6 týdnů. Antikoagulační terapie byla ukončena za 3 měsíce od propuštění. Kontrolní MR mozku za 4 měsíce od propuštění popsala jen minimální reziduální nález a výraznou regresi postmalatických změn (obr. 2c, 3c).
Image 2. Magnetická rezonance, T2 Flair skeny: a) vstupní – axiálně s T2 hypersignálním lemem juxtakortikálně až kortikálně na rozhraní gyrus frontalis inferior a gyrus temporalis superior vpravo; b) za 2 týdny s přetrváváním edému; c) za 4 měsíce s diskrétními reziduálními gliotickými změnami v místě původní ischémie. Fig. 2. Magnetic resonance imaging, T2 Flair axial scan: a) initially T2 hypersignal area juxtacortically to cortically at the interface of the inferior frontal gyrus and the superior temporal gyrus on the right side b) after two weeks with the persistence of oedema and gliosis; c) after four months with discrete residual gliotic changes at the site of the original ischemia. 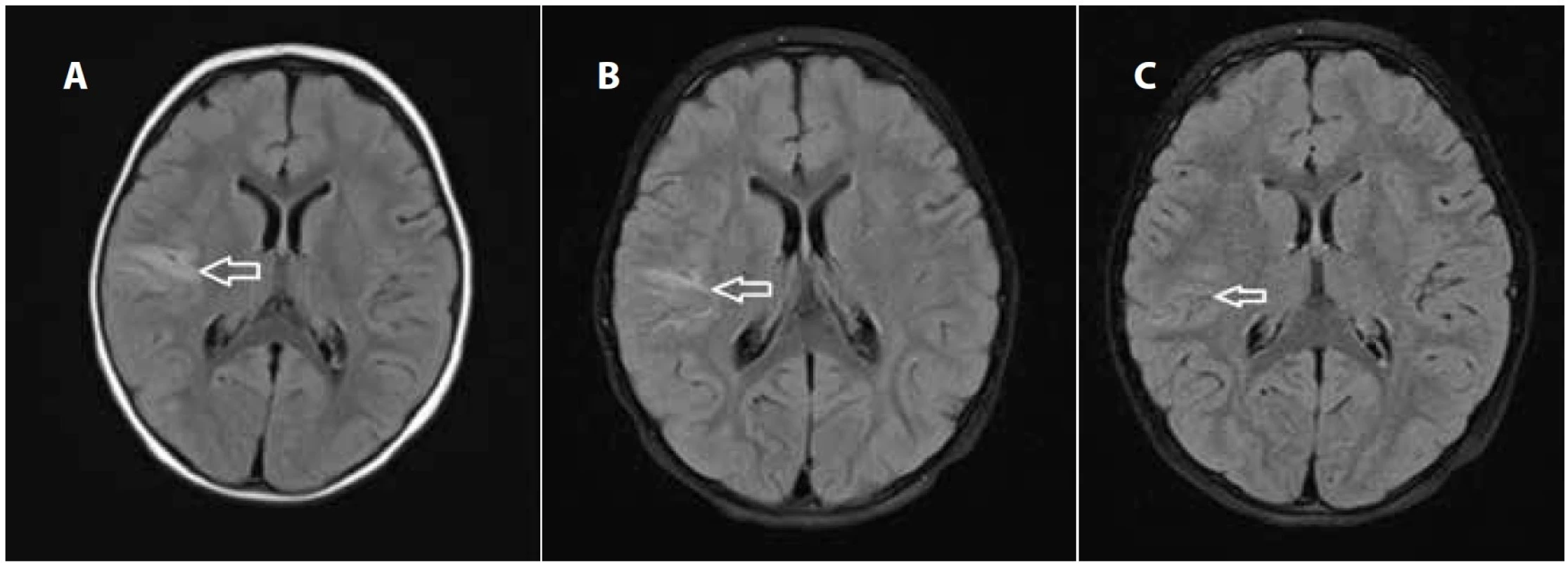
Image 3. Magnetická rezonance, ADC (aparentní difuzní koeficient) mapa difuzně vážených skenů: a) restrikce v difuzi, nález odpovídá cytotoxickému edému při ischémii; b) za 2 týdny s obnovenou difuzí v místě poškození tkáně, reparační procesy; c) za 4 měsíce za bez zvláštností v hodnocení omezení difuze ve zhojené tkáni. Fig. 3. Magnetic resonance imaging, ADC (transparent diffusion coefficient) map of diffusion-weighted imaging: a) initial scan – the hyposignal area is the restriction in diffusion, the sign corresponds to cytotoxic oedema in ischemia; b) in two weeks with restored diffusion at the site of tissue damage, repair processes; c) after four months with no pathological findings in the evaluation of the diffusion – it corresponds to rearranged tissue with gliosis. 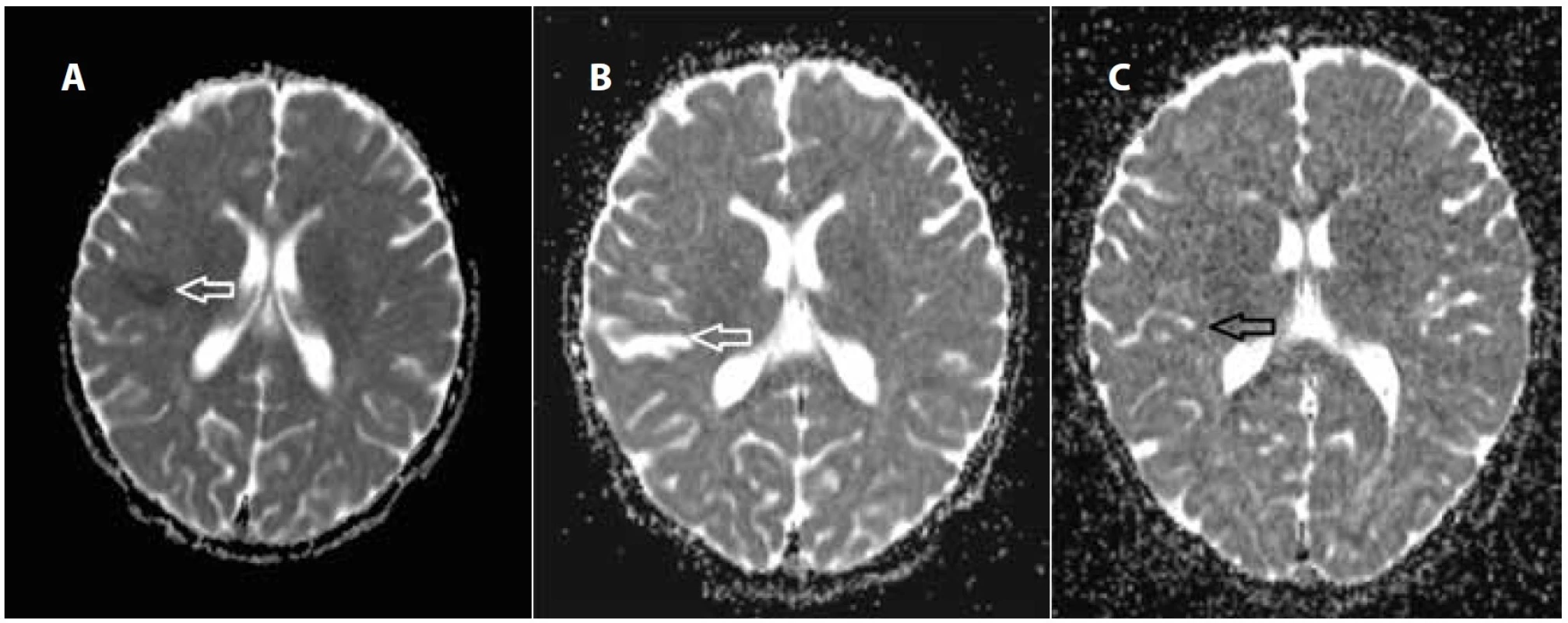
Pacientka je v současnosti ve velmi dobrém stavu, neurologicky bez deficitu. Z pohledu dětské kardiologie je zatím volen konzervativní postup, v nálezech dominuje významná mitrální regurgitace.
DISKUSE
Infekční endokarditida je u dětí vzácné, ale závažné onemocnění spojené s vysokou morbiditou a mortalitou [3, 7]. Incidence IE se celkově obtížně odhaduje, studie uvádějí roční incidenci 2–5/100 000 u dospělých a 0,3–3/100 000 u dětí a dospívajících [8, 9]. V dětském věku dominuje IE u pacientů se srdeční vadou. Kumulativní riziko vzniku IE u dítěte se strukturální vadou se uvádí okolo 6 případů IE na 1000 pacientů se srdečním defektem. Nejvyšší riziko mají pacienti s cyanotickými srdečními vadami, vadami atrioventrikulárních chlopní a levostrannými lézemi [10]. Incidence IE u dětí s vrozenou srdeční vadou je odhadována až 100x vyšší než v běžné zdravé populaci [11]. U dětí se strukturálně normálním srdcem pak rizikové skupiny pro vznik IE zahrnují děti s centrálním žilním katetrem, děti onkologicky nemocné, nezralé novorozence a mladé narkomany [12].
Diagnostikované a léčené děti ve FN Ostrava se liší od publikovaných prací v tom, že všichni pacienti byli bez existujícího strukturálního onemocnění srdce, ať už před operací, nebo po kardiochirurgickém výkonu. Incidence IE je ve sledovaném regionu Moravskoslezského kraje nízká, autoři registrují pouhých 5 případů IE za posledních 20 let. Nedosahujeme ani počtu hospitalizací IE, které je v zahraničních studiích uváděno 0,8–3,3 dětských případů IE na 1000 hospitalizací [3].
Studie popisující infekční endokarditidu na zdravém srdci u dětských pacientů s negativní anamnézou existují [13, 14]. Přesný vznik IE u těchto dětí není zcela znám. Možný výskyt infekční endokarditidy na normálním srdci potvrzuje i naše kazuistika. U pacientky nebyla nalezena vrozená srdeční vada, předchozí anomálie nebo změny mitrální chlopně ale nelze zcela vyloučit. Pro děti s VSV jsou popsána riziková období pro vznik IE (kojenci a dospívání), pro děti bez prokázané VSV toto ale nelze specifikovat [15, 16]. Věk naší pacientky ale považujeme spíše za méně typický pro IE, i naši předchozí pacienti byli buď novorozenci, nebo dospívající. IE je možná u imunokompromitovaných jedinců, dítě uvedené v kazuistice nevykazovalo v anamnéze podezření na imunodeficienci a laboratorní imunologická vyšetření neprokázala patologické odchylky. Ve výše uvedených studiích byly nejčastějšími příznaky šelest a teplota, stejně tak jako u našeho případu. Z dalších příznaků u IE se strukturálně normálním srdcem autoři popsali nejčastěji splenomegalii, třískovité hemoragie, hematurii. Anamnéza u těchto dětí většinou nepřinesla identifikaci rizikových faktorů, u některých dětí bylo v předchorobí popsáno infekční kožní onemocnění nebo špatný stav dentice. Téměř vždy šlo o levostranné postižení, tzn. postižení aortální a mitrální chlopně, i naše pacientka měla jasnou vegetaci na mitrální chlopni.
Infekce je u IE komunitní nebo nozokomiální. U dětí jsou z komunitních agens nejčastější streptokoky (viridující-viridans, mutans, sanguis, bovis, mitis) a Streptococcus pneumoniae a stafylokoky. Možné jsou infekce enterokoky a bakteriemi skupiny HACEK (Haemophilus, Actinobacillus, Cardiobacterium, Eikenella, Kingella). Stafylokoková infekce je častější u dětí se srdeční vadou [17]. U nozokomiálních infekcí se nejčastěji uplatňují koaguláza-negativní stafylokoky, Staphylococcus aureus, podmíněně patogenní gramnegativní tyčky (Pseudomonas, Acinetobacter, Serratia, Citrobacter, Proteus, Morganella a další) a kandidy. U naší pacientky jsme ve dvou úvodních hemokulturách identifikovali Streptococcus pneumoniae typ 23B. Je třeba zdůraznit, že existují případy infekční endokarditidy, u kterých jsou hemokultury negativní a původce se nepodaří prokázat. V našem případě jsme do výsledku hemokultur léčbu indikovali jako terapii etiologicky neznámé IE na nativní chlopni a použili vankomycin s gentamicinem. Při potvrzeném agens a jeho zjištěné citlivosti jsme pokračovali krystalickým penicilinem.
Pro stanovení diagnózy IE stále používáme Duke/Durack kritéria, která byla naposledy revidována v roce 2015 Evropskou kardiologickou společností [18]. Kritéria jsou patologická a klinická. Do patologických kritérií patří průkaz mikroorganismu kultivačně či histologicky ve vegetaci nebo ve vegetaci, která embolizovala. Mezi hlavní klinická kritéria patří opakované pozitivní hemokultury a důkaz postižení endokardu při echokardiografickém vyšetření. Do vedlejších klinických kritérií jsou řazeny predispozice (srdeční defekt, protézy, umělé materiály), horečka, cévní příznaky (embolizace, septické infarkty, mykotická aneuryzmata, nitrolební krvácení, krvácení do spojivek), glomerulonefritida, Oslerovy uzlíky, Rothovy skvrny, mikrobiologický nález nesplňující hlavní kritéria. Výsledkem hodnocení je pak infekční endokarditida prokázána, možná nebo vyloučená.
Naše pacientka splňovala dvě hlavní kritéria: dvě pozitivní hemokultury se stejným výsledkem a pozitivní echokardiografický nález. Pro průkaz vegetací postačovala vzhledem k věku a dobré vyšetřitelnosti echokardiografie transtorakální, jícnové vyšetření obvyklé u dospělých pacientů není u dětí většinou nutné [19]. Z vedlejších klinických nálezů pacientka v úvodu splňovala horečku a v pozdějším průběhu septickou embolizaci. Embolizační příhody u IE jsou častější u velkých vegetací a u mykotické a stafylokokové etiologie [20, 21]. U naší pacientky toto potvrzuje veliká vegetace, která se celá uvolnila z mitrální chlopně a embolizovala do centrální nervové soustavy. Embolizační příhody do centrální nervové soustavy nebo neurologické komplikaci jsou u dětí s IE opakovaně popsány [14]. U naší pacientky přes poměrně velký embolus nedošlo k vývoji ložiskové neurologické symptomatologie a embolizace se dobře zhojila. Pro možnou infekci CNS bylo nutno změnit antibiotickou léčbou a přidat antikoagulační terapii.
U aktivní infekční endokarditidy je přibližně jedna třetina pacientů indikována ke kardiochirurgickému výkonu a jedna třetina dospěje k rekonstrukční operaci poškozených struktur po vyléčení. Naše pacientka neměla srdeční selhávání ani jinou jasnou indikaci k invazivnímu řešení. Jedinou indikací by byla v průběhu časné léčby obava z utržení vegetace, která se nakonec potvrdila. Dítě jsme nestačili včas představit indikační komisi v kardiochirurgickém centru. Z časné operace dětský pacient může profitovat a chirurgický zákrok snižuje riziko septických embolizaci a recidivu choroby. Výkon i v akutní fázi onemocnění má nízkou operační mortalitu a dobré výsledky [22].
Poznatky o časování časného kardiochirurgického výkonu se stále rozšiřují, největší přínos časného výkonu pravděpodobně bude u komorové dysfunkce a stafylokokové etiologie. V těchto případech může odstranění vegetací minimalizovat riziko embolizací, zabránit formování abscesu a zlepšit komorovou funkci [21, 22]. Po vyléčení byla naše pacientka indikována k celoživotní rizikové prevenci infekční endokarditidy.
Prevence IE znamená cílené podání antibiotika ohroženým pacientům před výkony, u kterých vzniká přechodná bakteriémie (nejčastěji výkony v ústní dutině, nosohltanu, v gastrointestinálním a urogenitálním traktu). Rozlišujeme běžnou a rizikovou prevenci. Běžná prevence je indikována u vrozených srdečních vad vyjma defektu síňového septa, jiných chlopňových vad včetně revmatických postižení a prolapsu mitrální chlopně s regurgitací a u obstrukční formy hypertrofické kardiomyopatie.
Riziková prevence je doporučena u pacientů po srdečních korekcích za použití umělých materiálů (umělé chlopně, konduity, cévní protézy), u komplexních cyanotických vad, u pacientů po operacích a katetrizačních výkonech v období prvních šesti měsíců a u pacientů po proběhlé IE. Výkony, které jsou nebo nejsou doporučeny k prevenci, jsou přesně dány, stejně tak jako doporučená antibiotika. Děti se srdeční vadou jsou většinou vybaveny průkazem, kde je vyznačen druh prevence, jmenovány výkony, které vyžadují a nevyžadují prevenci, a kde jsou rovněž uvedeny dávky antibiotik.
Ve světě jsou názory na indikaci prevence IE rozdílné a existují snahy redukovat tyto postupy pro vysoce rizikové pacienty, za které pokládáme pacienty s chlopenní protézou, relapsy infekční endokarditidy a některé typy vrozených srdečních vad [23, 24]. Naši pacientku po prodělané infekční endokarditidě pokládáme za jasně vysoce rizikovou a riziková prevence jí byla doporučena [25]. U pacientů s vysokým rizikem IE pak zdůrazňujeme nutnost správné životosprávy a dentální hygieny.
ZÁVĚR
Infekční endokarditida je v dětském věku spojena s vysokou morbiditou a mortalitou [7, 26]. Stafylokoky a streptokoky tvoří až 90 % případů pozitivních hemokultur. Mortalita je signifikantně vyšší u stafylokokových infekcí, v průběhu studií ale výskyt stafylokokových IE v dětském věku klesá, na rozdíl od dospělých pacientů [15, 27].
Naše pacientka zvládla toto významné streptokokové onemocnění bez alterace celkového stavu. Přes embolizaci velké vegetace do mozku nedošlo k vývoji neurologického deficitu. Pacientka zůstává v trvalém kardiologickém sledování. Operační výkon na chlopni je v budoucnu velmi pravděpodobný.
Došlo: 9. 6. 2020
Přijato: 10. 7. 2020Korespondující autor:
MUDr. Jan Pavlíček, Ph.D.
Oddělení dětské a prenatální kardiologie
Klinika dětského lékařství
Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: jan.pavlicek@fno.cz
Sources
- Chaloupecký V, et al. Dětská kardiologie. Praha: Galén, 2006.
- Beneš J, Gregor P, Mokráček A. Infekční endokarditida. Doporučené postupy diagnostiky, léčby, dispenzarizace a profylaxe. Cor Vasa 2007; 49 (6): K157–K171.
- Day MD, Gauvreau K, Shulman S, Newburger JW. Characteristics of children hospitalized with infective endocarditis. Circulation 2009; 119 : 865–870.
- Gilboa SM, Salemi JL, Nembhard WN, et al. Mortality resulting from congenital heart disease among children and adults in the United States, 1999 to 2006. Circulation 2010; 122 (22): 2254–2263.
- Ferrieri P, Gewitz MH, Gerber MA, et al. Unique features of infective endocarditis in childhood. Circulation 2002; 105 (17): 2115–2126.
- Naber CK, Bartel T, Eggebrecht H, Erbel R. Diagnosis of endocarditis today: Duke criteria or clinical judgment? Herz 2001; 26 (6): 379–390.
- Rosenthal LB, Feja KN, Levasseur SM, et al. The changing epidemiology of pediatric endocarditis at a children’s hospital over seven decades. Pediatr Cardiol 2010; 31 (6): 813–820.
- Beneš J, Kvasnička J. Infekční endokarditida. Cor Vasa 2000; 42 (2): K21–K28.
- Toyoda N, Chikwe J, Itagaki S, et al. Trends in infective endocarditis in California and New York State, 1998–2013. JAMA 2017; 317 : 1652–1660.
- Rushani D, Kaufman JS, Ionescu-Ittu R, et al. Infective endocarditis in children with congenital heart disease: cumulative incidence and predictors. Circulation 2013; 128 (13): 1412–1419.
- Niwa K, Nakazawa M, Tateno S, et al. Infective endocarditis in congenital heart disease: Japanese national collaboration study. Heart 2005; 91 : 795–800.
- Ferrieri P, Gewitz MH, Gerber MA, et al. Unique features of infective endocarditis in childhood. Circulation 2002; 105 (17): 2115–2126.
- Lin YT, Hsieh KS, Chen YS, et al. Infective endocarditis in children without underlying heart disease. J Microbiol Immunol 2013; 46 (2): 121–128.
- Marom D, Ashkenazi S, Samra Z, Birk E. Infective endocarditis in previously healthy children with structurally normal hearts. Pediatr Cardiol 2013; 34 (6): 1415–1421.
- Gupta S, Sakhuja A, McGrath E, Asmar B. Trends, microbiology, and outcomes of infective endocarditis in children during 2000–2010 in the United States. Congenit Heart Dis 2017; 12 (2): 196–201.
- Ware AL, Tani LY, Weng HY, et al. Resource utilization and outcomes of infective endocarditis in children. J Pediatr 2014; 165 (4): 807–812.
- Johnson JA, Boyce TG, Cetta F, et al. Infective endocarditis in the pediatric patient: a 60-year single-institution review. Mayo Clin Proc 2012; 87 : 629–635.
- Habib G, Lancellotti P, Antunes MJ, et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015; 36 : 3075–3128.
- Milazzo Jr AS, Li JS. Bacterial endocarditis in infants and children. Pediatr Infect Dis J 2001; 20 (8): 799–801.
- Mugge A, Daniel WG, Frank G, Lichtlen PR. Echocardiography in infective endocarditis: reassessment of prognostic implications of vegetation size determined by the transthoracic and the transesophageal approach. J Am Coll Cardiol 1989; 14 : 631–638.
- Shamszad P, Khan MS, Rossano JW, Fraser Jr CD. Early surgical therapy of infective endocarditis in children: a 15-year experience. J Thorac Cardiovasc Surg 2013; 146 (3): 506–511.
- Le Cam B, Guivarch G, Boles JM, et al. Neurologic complications in a group of 86 bacterial endocarditis. Eur Heart J 1984; 5 (Suppl C): 97–100.
- Wilson W, Taubert KA, Gewitz M, et al. Prevention of infective endocarditis: guidelines from the American heart association: a guideline from the American heart association rheumatic fever, endocarditis and Kawasaki disease committee, council on cardiovascular disease in the young, and the council on clinical cardiology, council on cardiovascular surgery and anesthesia, and the quality of care and outcomes research interdisciplinary working group. J Am Dent Assoc 2008; 139: S3–S24.
- Centre for Clinical Practice at NICE (UK). Prophylaxis against infective endocarditis: antimicrobial prophylaxis against infective endocarditis in adults and children undergoing interventional procedures. London: National Institute for Health and Clinical Excellence (UK); 2008 Mar.
- Heinc MP. Současný pohled na prevenci bakteriální endokarditidy. Interní Med 2005; 5 (11): 535–539.
- Coward K, Tucker N, Darville T. Infective endocarditis in Arkansan children from 1990 through 2002. Pediatr Infect Dis J 2003; 22 (12): 1048–1052.
- Pant S, Pate, NJ, Deshmukh A, et al. Trends in infective endocarditis incidence, microbiology, and valve replacement in the United States from 2000 to 2011. J Am Coll Cardiol 2015; 65 (19): 2070–2076.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2021 Issue 3-
All articles in this issue
- Ženy a muži v české pediatrii
- Závislosti hodnôt variability frekvencie srdca a tlaku krvi od parametrov rastu a vývoja nedonosených novorodencov
- Terapie teduglutidem u pacientů se syndromem krátkého střeva
- Hypernatriemická dehydratácia
- Infekční endokarditida s embolizací vegetace do centrální nervové soustavy
- Kongenitální epulis
- Klíšťová encefalitida a kojení
- Tumory srdce u dětí
- Vzpomínka na profesora MUDr. Emila Poláčka, DrSc., zakladatele dětské nefrologie v Čechách
- Akí sme boli. Antropometria a demografia pražských detí pred 130 rokmi
- Rozlúčili sme sa s primárkou MUDr. Marianou Miklerovou
- VYHLÁŠENÍ CENY JANA EVANGELISTY PURKYNĚ
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klíšťová encefalitida a kojení
- Hypernatriemická dehydratácia
- Tumory srdce u dětí
- Kongenitální epulis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

