-
Medical journals
- Career
Růstové databáze a registry – cesta k poznání fyziologických účinků růstového hormonu
Authors: A. Kodýtková; D. Zemková; S. Koloušková; J. Lebl
Authors‘ workplace: Pediatrická klinika 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol, Praha
Published in: Čes-slov Pediat 2020; 75 (4): 251-255.
Category:
Overview
Růstový hormon (GH) se používá jako lék od roku 1956. Od poloviny 80. let 20. století je pro léčbu k dispozici rekombinantní lidský růstový hormon, jehož výroba přispěla k rozšíření indikací léčby a k významnému nárůstu počtu léčených pacientů.
Ke sledování fyziologických účinků léčby růstovým hormonem v rutinní praxi posloužily v minulých 35 letech růstové databáze a registry, které shromažďovaly klinické údaje o léčených pacientech. První a početně nejrozsáhlejší databáze KIGS obsahuje údaje o více než 83 tisících dětí. Na jejím základě vznikly robustní matematické modely, které predikovaly účinky léčby růstovým hormonem. Databáze GeNeSIS obsahuje údaje o více než 22 tisících dětech. Mimo jiné přispěla k poznání genetické etiologie deficitu růstového hormonu a k posouzení potenciálních rizik terapie. Databáze Nordinet® IOS má data o téměř 18 tisících dětí. Poslední, nejmenší, ale unikátní je databáze ECOS, která díky elektronickému sběru dat o každé injekci umožnila posoudit adherenci a compliance pacientů a jejich vliv na efekt terapie.
Růstové databáze a registry pomohly porozumět algoritmům léčby růstovým hormonem, přispěly k její optimalizaci a do jisté míry i k efektivnějšímu využití finančních prostředků na léčbu.
Klíčová slova:
databáze – růstový hormon – léčba – KIGS – GeNeSIS – ECOS – NordiNet® IOS
HISTORIE LÉČBY RŮSTOVÝM HORMONEM
První pokusy získat hypofyzární růstový hormon (GH) pro léčebné účely se datují do poloviny 40. let 20. století, kdy se podařilo extrahovat a purifikovat vepřový a hovězí GH, který ale vzhledem k druhové odlišnosti neměl dostatečnou biochemickou ani metabolickou aktivitu [1]. Příčinou byly genové mutace a duplikace v GH, ke kterým došlo v linii primátů. Ačkoli je evoluce GH napříč třídou savců velmi konzervativní, k vývoji růstového hormonu u primátů došlo během relativně krátkého období a míra odlišností byla zvláště vysoká na funkčně důležitých místech (liší se v 59 aminokyselinách). Stejně tak i receptor lidského růstového hormonu (GHR) vykazuje výraznou druhovou specificitu, tedy může interagovat pouze s lidským GH [2].
V roce 1956 byl izolován čištěný extrakt z kadaverózních lidských hypofýz, který byl s úspěchem poprvé léčebně aplikován – zvýšil růstovou rychlost u desetiletého chlapce s deficitem růstového hormonu. GH se pacientům s deficitem růstového hormonu podával intramuskulárně 2–3krát týdně. Vzhledem k nedostatku lidských hypofýz a v koincidenci s prokázaným rizikem nákazy Creutzfeldtovou-Jakobovou nemocí (CJD) prostřednictvím pituitárních extraktů [3, 4] byl v roce 1985 poprvé uveden na trh biosyntetický rekombinantní lidský růstový hormon (N-terminální methionyl-GH), díky kterému se stala léčba růstových poruch dostupnější a bezpečnější [5, 6]. V následujících letech byl tento polypeptid dále upravován tak, aby koncem 80. let byl vyvinut již zcela bezpečný „autentický“ rekombinantní růstový hormon bez methioninového zbytku (rhGH – recombinant human growth hormone), díky čemuž se mohla léčba růstových poruch naplno rozvinout. Za účelem sledování účinků léčby vznikly první mezinárodní růstové databáze, které si kladly za cíl shromáždit údaje o účincích a rizicích dlouhodobé léčby rhGH u dětí a adolescentů s růstovými poruchami [7].
V současné době je v Evropě léčba rhGH určena pro pacienty v osmi indikačních oblastech (tab. 1), které byly na základě studií o bezpečnosti a účinnosti schváleny národními lékovými úřady jednotlivých evropských zemí a/nebo Evropskou lékovou agenturou (EMA – European Medicines Agency). Patří mezi ně vrozený či získaný deficit růstového hormonu u dětí a dospělých (GHD), ale také další přesně definované skupiny pediatrických pacientů: Turnerův syndrom (TS), deficit SHOX, syndrom Pradera-Williho (PWS), růstová porucha u dětí s chronickou renální insuficiencí (CRI), postnatální selhání růstu navazující na intrauterní růstovou restrikci (SGA/IUGR – small for gestational age/intrauterine growth restriction) a nově od února 2020 i syndrom Noonanové. V USA jsou k léčbě rhGH navíc indikovány další dvě skupiny dětských pacientů. První z nich je heterogenní a nejasně ohraničená – pacienti s idiopatickým malým vzrůstem (ISS – idiopatic short stature), zatímco do druhé indikační skupiny patří děti i dospělí s metabolickým strádáním v důsledku AIDS (Acquired Immune Deficiency Syndrome) [8–10].
Table 1. Rok zahájení léčby rekombinantním lidským růstovým hormonem (rhGH) u jednotlivých diagnóz. (Upraveno dle [9, 10]) ![Rok zahájení léčby rekombinantním lidským růstovým hormonem
(rhGH) u jednotlivých diagnóz. (Upraveno dle [9, 10])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/a69aa44910815488d5c0e2ddb450ae4f.png)
SGA/IUGR – postnatální selhání růstu navazující na intrauterinní růstovou restrikci (small for gestational age/intrauterine growth restriction)
ISS – idiopatický malý vzrůst (idiopatic short stature)VÝZNAMNÉ MEZINÁRODNÍ RŮSTOVÉ DATABÁZE A REGISTRY
● KIGS
KIGS (původně akronym z Kabi International Growth Study, nynější označení je Pfizer International Growth Database) je nejstarší a nejrobustnější mezinárodní farmako-epidemiologická databáze pacientů léčených rhGH. Stala se vzorem nejen pro další růstové databáze, ale také pro řadu dalších postmarketingových studií zaměřených na sledování účinnosti a bezpečnosti významných nových léčebných postupů. Originální koncept KIGS vznikl ve Stockholmu v sídle tehdejší farmaceutické společnosti Kabi. Od založení v roce 1987 až do roku 2012 shromažďovala studie KIGS longitudinální data z běžných klinických vyšetření dětí léčených rhGH z 52 zemí. Databáze obsahuje údaje o léčbě více než 83 000 pacientů, z nichž značná část byla sledována až do dosažení finální výšky. Shromážděná data byla průběžně i následně mnohokrát analyzována a výsledky jsou stále publikovány. Zpracování dat koordinuje KIGS Steering Committee; v minulosti se na něm podílel také KIGS Investigators board, složený ze zástupců všech přispívajících zemí. Databáze KIGS byla po léta hlavním zdrojem informací o léčbě růstovým hormonem [11, 12].
Údaje z databáze posloužily mimo jiné ke konstrukci matematických modelů, které predikují růstovou odpověď na léčbu rhGH a tak umožňují posoudit, zda pacient reaguje na léčbu podle očekávání, nebo zda ji je třeba upravit, aby bylo dosaženo lepšího výsledku. Takové algoritmy mohou být cennými nástroji v diagnostice a následně v terapii zejména proto, že vysvětlují odpověď na podávání rhGH na základě mnoha individuálních proměnných. Mohou poskytovat informace pro úpravu léčby, ale také přispět k porozumění patogeneze malého vzrůstu a k charakterizaci konkrétních skupin pacientů. Individuální přístup, který predikční modely nabízejí, přispívá ke zvýšení účinnosti, bezpečnosti a k optimalizaci nákladů na léčbu [12].
Data z KIGS také rozšířila poznání v diagnostické skupině dívek s Turnerovým syndromem, která se na přelomu 80. a 90. let stala druhou indikační oblastí rhGH. V případě Turnerova syndromu se nejedná o deficit růstového hormonu, ale o deficit SHOX proteinu, proto dávky nejsou substituční, ale farmakologické. Kromě celé řady jiných klinických problémů je tento syndrom spojen se ztrátou přibližně 20 cm finální výšky [13]. O dosažení optimálního výsledku léčby proto rozhoduje její včasné zahájení i vhodně zvolená dávka rhGH. Díky zpracování dat z databáze KIGS (cca 5500 pacientek) se podařilo navrhnout efektivnější terapii a vytvořit predikční modely pro tuto diagnózu [11].
Vedle databáze KIGS vznikla také databáze KIMS, určená ke sledování léčby dospělých pacientů s deficitem růstového hormonu.
● GeNeSIS
GeNeSIS (Genetics and Neuroendocrinology of Short Stature International Study) je nadnárodní databáze iniciovaná farmaceutickou společností Eli Lilly z USA, do které mezi lety 1999 a 2015 přispělo 827 center z 30 zemí longitudinálními údaji o 22 311 dětech léčených rhGH (obr. 1). Největší zastoupení měli pacienti s deficitem růstového hormonu (63 %), mezi dalšími diagnózami byli pacienti s ISS (13 %), s deficitem SHOX (12 %), s Turnerovým syndromem (8 %) a SGA (6 %). Hlavním cílem tohoto výzkumného programu bylo shromáždit dlouhodobé údaje o bezpečnosti a účinnosti rhGH u dětských pacientů a současně podpořit nové oblasti výzkumu, zejména oblast genetické podmíněnosti GHD a ISS [14, 15].
Image 1. Databáze GeNeSIS – počty pacientů z jednotlivých zemí (USA odpovídá cca 40 % z celkového počtu pacientů) (upraveno podle Blum et al., 2018). 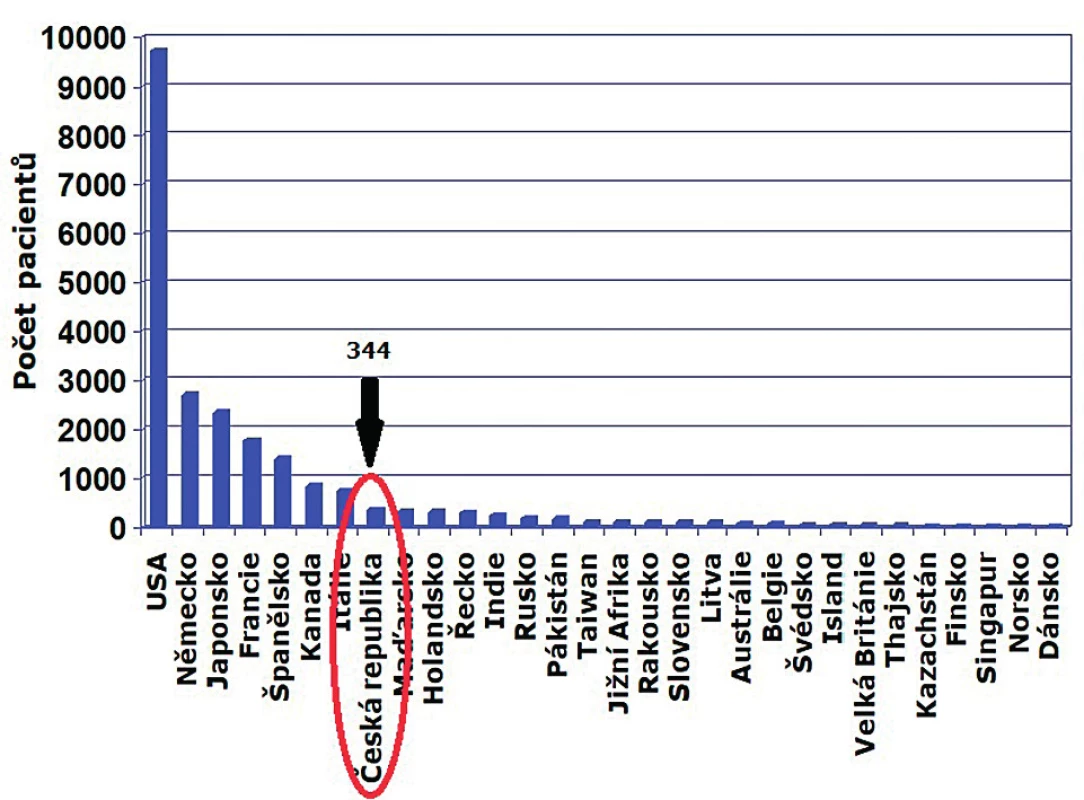
Z hlediska bezpečnosti umožnila databáze GeNeSIS analyzovat riziko diabetu, nádorů, cerebrovaskulárních onemocnění a mortality. Výsledky mimo jiné ukázaly, že terapie rhGH nezvyšuje riziko úmrtí nebo riziko vzniku primárního nádoru, ale ani výskyt hemoragické cévní mozkové příhody (CMP) u pacientů bez přítomnosti rizikových faktorů [14]. Oproti tomu incidence diabetu 2. typu (T2D) byla ve srovnání s předchozími studiemi vyšší [15], avšak ve většině případů pouze u osob s rizikovými faktory rozvoje diabetu, jako jsou obezita, hypertenze, vysoká hladina cholesterolu, genetická predispozice nebo polycystický ovariální syndrom [14, 15].
Genetická část studie GeNeSIS posuzovala frekvenci patogenních variant v genech, které řídí vývoj hypofýzy a sekreci růstového hormonu (např. geny GH1, GHRHR, GLI2, HESX1, LHX3, LHX4, PROP1, POU1F1 a SOX3). U pacientů s těžkým deficitem růstového hormonu je přítomnost patogenní varianty genu spojena s lepší odpovědí na terapii rhGH ve srovnání s pacienty bez prokázané patogenní genové varianty nebo s pacienty s jinou primární diagnózou než GHD [16].
● NordiNet® IOS
NordiNet® IOS (International Outcome Study) byla longitudinální, observační kohortová studie založená na systematickém shromažďování údajů přes webové rozhraní, jejímž iniciátorem byla farmaceutická společnost Novo Nordisk z Dánska. Databáze obsahuje klinické údaje o 17 995 dětských [18] a 2524 dospělých pacientech, čímž se poněkud odlišuje od ostatních. I následný výzkum odvozený z těchto dat je svým způsobem unikátní [19]. Do projektu se zapojilo 469 center pro léčbu růstovým hormonem z 24 evropských zemí. Ve stejnou dobu (2002–2016) probíhala v Americe analogická studie ANSWER (American Norditropin Studies: Web-Enabled Research Program). ANSWER byla původně postregistrační studie pediatrických i dospělých pacientů, která se později transformovala do neintervenční observační studie. Obě studie (NordiNet® IOS i ANSWER) byly komplementární, měly podobné cíle, využívaly stejnou elektronickou platformu a obsahovaly data srovnatelné struktury a rozsahu (obr. 2). V obou případech byli pacienti léčeni přípravkem Norditropin [18].
Table 2. Přehled mezinárodních růstových databází a registrů. (Upraveno dle [7]) ![Přehled mezinárodních růstových databází a registrů. (Upraveno dle [7])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/dade3a12cd6630ab6b0d1f3a06f34726.png)
rhGH – rekombinantní lidský růstový hormon
KIGS – dříve: Kabi International Growth Study, později: Pfizer International Growth Database
GeNeSIS – Genetics and Neuroendocrinology of Short Stature International Study
NordiNet® IOS – NordiNet International Outcome Study
ECOS – Easypod Connect Observational StudyImage 2. Distribuce jednotlivých diagnostických skupin – rozdíly mezi studií NordiNet® IOS a americkou studií ANSWER (upraveno podle Sävendahl et al., 2019). 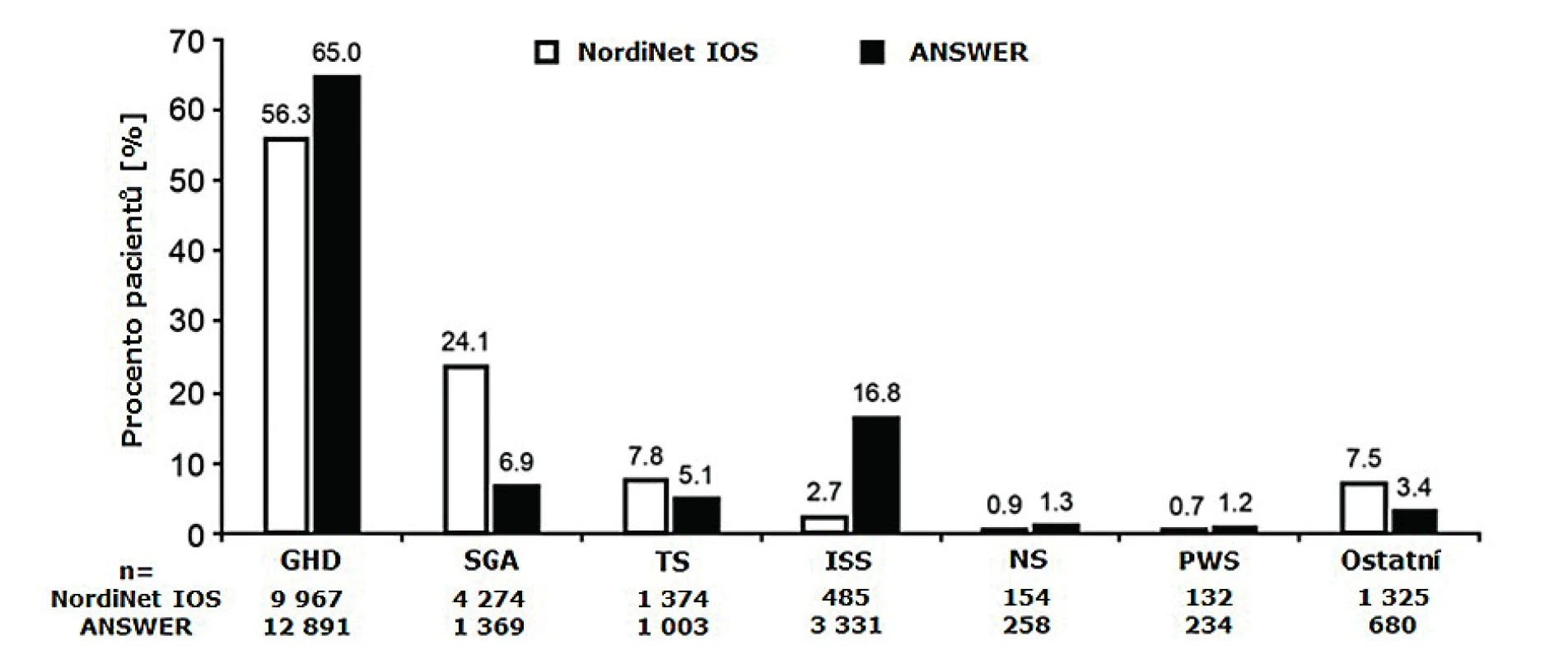
Řada studií analyzuje, jaký vliv mají nejrůznější faktory na finální výšku u pacientů léčených rhGH. Vzhledem k tomu, že u některých diagnóz je odezva příznivější než u jiných, hraje podstatnou roli především indikace k léčbě (primární diagnóza). Mezi další důležité faktory patří věk při zahájení terapie, míra růstové retardace a podávaná dávka rhGH. Pomyslná startovní čára léčby proto hraje velmi důležitou roli v růstové prognóze [20]. Ze studie Polaka et al. (2018) vyplývá, že včasné stanovení diagnózy a zahájení léčby adekvátní dávkou rhGH má vliv na optimalizaci dospělé výšky u všech zkoumaných diagnóz (v tomto případě GHD, IUGR/SGA bez postnatálního catch-up růstu a Turnerův syndrom). Výzkum také ukázal, že většina dívek s Turnerovým syndromem dostává dávky rhGH nižší, než je nejnižší doporučená dávka. Na druhou stranu Česká republika je společně s Německem jednou z mála zemí, kde se včasnou diagnostikou daří zvyšovat šance na dosažení genetického růstového potenciálu jednotlivých skupin pacientů [21].
Data z více než 10 let sledování navíc ukazují, že substituce rhGH zůstává významná i u dospělých s deficitem růstového hormonu. U dospělých dlouhodobá léčba zlepšuje tělesné složení, což se projevuje na výsledcích bioimpedance i v obvodových parametrech (zejména obvodu břicha). Celkově tyto výsledky potvrzují účinnost a bezpečnost dlouhodobé léčby i nad rámec dětského věku [19].
● ECOS
Nejnovější nadnárodní databází je ECOS (Easypod Connect Observational Study; 2010 – 2016), jejímž iniciátorem byla společnost Merck. Ačkoliv nemůže výše uvedeným databázím konkurovat počtem pacientů (obsahuje 2420 dětí), má nepopiratelný přínos pro výzkum léčby rhGH. Byla založena na pětiletém sledování pacientů prostřednictvím systému Easypod™ Connect [22]. Automatizovaný aplikátor růstového hormonu Easypod™ zaručuje přesné podání předem stanovené dávky, reguluje rychlost a hloubku vpichu, a navíc obsahuje elektronický dávkovací záznamník, který registruje údaje o všech podaných injekcích. Díky tomu poskytla databáze ECOS přesná, objektivní a robustní data o dodržování předepsané léčby rhGH u velké populace pacientů v reálném čase. Aplikátoru Easypod™ umožňuje identifikovat pacienty s nedostatečnou adherencí a compliancí (ti, kteří nedodržují četnost injekcí a dávkování) a odlišit tak tuto příčinu od ostatních příčin snížené odpovědi na léčbu. Získané informace umožňují podniknout opatření k dosažení maximálního účinku. Analýza dat z databáze ECOS navíc neprokázala žádné nové nežádoucí účinky a dokumentovala na validních údajích, že poměr rizik a přínosu léčby je příznivý [23].
Údaje ze systému Easypod™ Connect prokázaly obecně vysokou míru spolupráce (compliance) u pacientů a jejich rodin až do 5. roku od zahájení léčby. Na základě sledování určitého období byla stanovena průměrná hodnota compliance 89,3 %, což v průměru odpovídá méně než 1 vynechané injekci za týden [23]. Cutfield et al. (2011) ale současně ukázali, že u dvou třetin pacientů, kteří každý týden vynechali jednu nebo více injekcí rhGH, byl výškový přírůstek významně nižší ve srovnání s pacienty, kteří léčbu dodržovali. Vynechání jedné injekce týdně může snížit růstovou rychlost až o 25 %, a proto právě nespolupráce pacienta a rodiny je jedním z nejčastějších faktorů nedostatečné růstové odpovědi při terapii rhGH [24, 25].
DALŠÍ MEZINÁRODNÍ A NÁRODNÍ DATABÁZOVÉ SYSTÉMY
V minulých dvou desetiletích vzniklo v Evropě několik dalších projektů s cílem sledovat skupiny dětí léčených rhGH. Některé byly ukončeny ve fázi pilotního projektu, některé po omezenou dobu shromažďovaly klinická data z rutinní léčby – např. databáze PATRO iniciovaná farmaceutickou společností Sandoz. Specifické formy sběru dat probíhaly i v Severní Americe (např. systém farmaceutické společnosti Genentech a další).
Pro sběr epidemiologických dat o léčbě růstovým hormonem, a jako základ pro kvalifikovaná medicínská, organizační i farmakoekonomická rozhodnutí na lokální úrovni, mají velký význam národní databáze pacientů léčených pomocí rhGH. Mezi ně se již od roku 2014 řadí i česká národní databáze REPAR (REgistr PAcientů léčených Růstovým hormonem). Aktuální data o pacientech sledovaných v této databázi přináší jiné sdělení v tomto čísle časopisu Česko-slovenská pediatrie [26].
Mgr. Aneta Kodytková
Pediatrická klinika 2. LF UK
a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: aneta.kodytkova@fnmotol.cz
Sources
1. Frasier SD. The not-so-good old days: Working with pituitary growth hormone in North America 1956 to 1985. J Pediatr 1997; 131 : 1–4.
2. Liu J-C, Makova KD, Adkins RM, et al. Episodic evolution of growth hormone in primates and emergence of the species specificity of human growth hormone receptor. Mol Biol Evol 2001; 18 : 945–953.
3. Raben MS. Treatment of pituitary dwarf with human growth hormone. J Clin Endocrinol Metab 1958; 18 : 901–903.
4. Sumner JY. Human growth hormone: Current status of availability and usefullness. Pediatrics 1969; 44 : 766–767.
5. Flodh H. Human growth hormone produced with recombinant DNA technology: development and production. Acta Paediatr Scand 1986; 325 : 1–9.
6. Dean HJ, Friesen HG. Growth hormone therapy in Canada: end of one era and beginning of another. Can Med Assoc J 1986; 135 : 297–301.
7. Stochholm K, Kiess W. Long-term safety of growth hormone – a combined registry analysis. Clin Endocrinol (Oxf) 2018; 88 : 515–528.
8. Ayyar VS. History of growth hormone therapy. Indian J Endocrinol Metab 2011; 15 : 162–166.
9. Ranke MB, Wit JM. Growth hormone – past, present and future. Nat Rev Endocrinol 2018; 14 : 285–300.
10. Lebl J, Koloušková S, Průhová Š, et al. Léčba růstovým hormonem – historie, současnost a budoucnost. Farmakoter Rev 2017; 2 : 224–230.
11. Ranke MB, Lindberg A, Chatelain P, et al. Predicting the response to recombinant human growth hormone in Turner syndrome: KIGS models. Acta Paediatr 1999; 433 : 122–125.
12. Ranke MB, Lindberg A, Chatelain P, et al. The potential of prediction models based on data from KIGS as tools to measure responsiveness to growth hormone. Horm Res 2001; 55 : 44–48.
13. Ranke MB, Stubbe P, Majewsri F, et al. Spontaneous growth in Turner‘s syndrome. Acta Paediatr Scand 1988; 343 : 22–30.
14. Child CJ, Zimmermann AG, Chrousos GP, et al. Safety outcomes during pediatric GH therapy: Final results from the prospective GeNeSIS observational program. J Clin Endocrinol Metab 2018; 104 : 379–389.
15. Cutfield WS, Wilton P, Bennmarker H, et al. Incidence of diabetes mellitus and impaired glucose tolerance in children and adolescents receiving growth-hormone treatment. Lancet 2000; 355 : 610–613.
16. Pfäffle R, Land C, Schönau E, et al. Growth hormone treatment for short stature in the USA, Germany and France: 15 years of surveillance in the Genetics and Neuroendocrinology of Short-stature International Study (GeNeSIS). Horm Res Paediatr 2018; 90 : 169–180.
17. Blum WF, Klammt J, Amselem S, et al. Screening a large pediatric cohort with GH deficiency for mutations in genes regulating pituitary development and GH secretion: Frequencies, phenotypes and growth outcomes. E Bio Medicine 2018; 36 : 390–400.
18. Sävendahl L, Polak M, Backeljauw P, et al. Treatment of children with GH in the United States and Europe: Long-term follow-up from NordiNet® IOS and ANSWER program. J Clin Endocrinol Metab 2019; 104 : 4730–4742.
19. Weber MM, Gordon MB, Höybye C, et al. Growth hormone replacement in adults: Real-world data from two large studies in US and Europe. Growth Horm IGF Res 2020; 50 : 71–82.
20. Lee PA, Germak J, Gut R, et al. Identification of factors associated with good response to growth hormone therapy in children with short stature: results from the ANSWER Program®. Int J Pediatr Endocrinol 2011; 6 : 1–7.
21. Polak M, Konrad D, Pedersen BT, et al. Still too little, too late? Ten years of growth hormone therapy baseline data from the NordiNet® International Outcome Study. J Clin Endocrinol Metab 2018; 31 : 521–532.
22. https://www.merckgroup.com/en/news/ecos-study-2017-10-27.html.
23. Koledova E, Stoyanov G, Ovbude L, et al. Adherence and long-term growth: the easypod TM connect observational study (ECOS) in children with growth disorders. Endocr Connect 2018; 7 : 1–30.
24. Cutfield WS, Derraik GB, Gunn AJ, et al. Non-compliance with growth hormone treatment in children is common and impairs linear growth. PLoS One 2011; 6 : 5–7.
25. De Pedro S, Murillo M, Salinas I, et al. Variability in adherence to rhGH treatment: socioeconomic causes and effect on children’s growth. Growth Horm IGF Res 2016; 26 : 32–35.
26. Kodytková A, Al Lababidi E, Čermáková I, et al. Analýza dat z celostátního registru pacientů léčených růstovým hormonem REPAR. Čes-slov Pediat 2020; 75 (4): 205–212.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2020 Issue 4-
All articles in this issue
- Dětský růst v zrcadle času – a věčný třetí percentil
- Analýza dat z celostátního registru pacientů léčených růstovým hormonem REPAR
- Význam acidolabilní podjednotky (ALS) v etiologii a v diagnostice malého vzrůstu
- Syndrom Noonanové a další RASopatie: Etiologie, diagnostika a terapie
- Syndrom Noonanové z pohledu dětského kardiologa
- Prenatální fenotyp RASopatií
- Etiologie a diagnostika poruchy růstu u dětí, které se narodily malé na svůj gestační věk (SGA) s přetrvávající malou výškou v dětství (SGA-SS)
- Růstové databáze a registry – cesta k poznání fyziologických účinků růstového hormonu
- Porucha růstu u 11leté dívky s diabetem
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Syndrom Noonanové a další RASopatie: Etiologie, diagnostika a terapie
- Etiologie a diagnostika poruchy růstu u dětí, které se narodily malé na svůj gestační věk (SGA) s přetrvávající malou výškou v dětství (SGA-SS)
- Syndrom Noonanové z pohledu dětského kardiologa
- Prenatální fenotyp RASopatií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

