-
Medical journals
- Career
Nikdy nie je neskoro – herpetická encefalitída vyvolaná vírusom HSV1
Authors: E. Dická 1; Z. Pavlovičová 2; Ľ. Podracká 1
Authors‘ workplace: Detská klinika LFUK a NÚDCH, Bratislava, Slovensko 1; Rádiodiagnostické oddelenie NÚDCH, Bratislava, Slovensko 2
Published in: Čes-slov Pediat 2020; 75 (1): 34-39.
Category: Case Report
Overview
Herpetická encefalitída je najčastejšia sporadická fatálna encefalitída vo svete. Ochorenie postihuje všetky vekové skupiny. Zlatým štandardom v diagnostike je vyšetrenie vírusovej záťaže v likvore a magnetická rezonancia mozgu. Intravenóznu liečbu acyklovirom iniciujeme hneď pri podozrení na herpetickú encefalitídu. Dĺžka liečby je 21 dní. Pred jej ukončením sa odporúča kontrolná lumbálna punkcia na potvrdenie negativity vírusovej záťaže pomocou polymerázovej reťazovej reakcie v likvore.
V článku prezentujeme poučné kazuistiky dvoch detí s encefalitídou vyvolanou herpes simplex typu 1 s odlišným klinickým priebehom a prognózou.
Klíčová slova:
herpetická encefalitída – lumbálna punkcia – liečba acyklovirom
ÚVOD
Herpetická encefalitída (HSE, encefalitída zapríčinená vírusom herpes simplex) je celosvetovo najčastejšia sporadická fatálna encefalitída a tvorí 5–10 % všetkých prípadov vírusových encefalitíd. Ochorenie postihuje všetky vekové skupiny, pričom jedna tretina prípadov sa vyskytuje u detí [1]. Ochorenie vyvoláva vírus herpes simplex typ 1 (HSV1) a typ 2 (HSV2). Infekcia HSV1 je častejšia u detí ako dospelých (až v 95 %), u novorodencov dominuje HSV2, kedy sa infekcia prenáša na dieťa pri pôrode od infikovanej matky [2, 3]. Mortalita neliečenej HSE je vysoká, zomiera až 70–82 % postihnutých, ale aj pri adekvátnej terapii je úmrtnosť od 20 do 30 % [4].
Začiatok ochorenia je zväčša prudký až fulminantný, niekedy môže byť dvojfázový s nešpecifickými „flu-like“ príznakmi v predchorobí. Až u 90 % pacientov dominuje horúčka s kvantitatívnou a kvalitatívnou poruchou vedomia (asi 80 % má Glasgow coma scale >10 bodov), 51–62 % má epileptické záchvaty a neurologické ložiskové príznaky [4]. Pri typickej forme ochorenia sú postihnuté temporálne laloky mozgu, ale zasiahnuté môžu byť aj frontálne a parietálne oblasti. Pri atypickej forme býva poškodený mozgový kmeň, často je prítomná myelitída a difúzna encefalitída [4, 5].
Štandardný diagnostický postup sa opiera o likvorologické vyšetrenie a magnetickú rezonanciu mozgu. U 85 % chorých je v mozgovomiechovom moku pleocytóza s prevahou lymfocytov (počet elementov do 500/mm3) a zvýšená proteinorhachia. Zlatým diagnostickým štandardom je dôkaz vírusovej záťaže HSV polymerázovou reťazovou reakciou (PCR) v likvore a sére. Vyšetrenie intratekálnych protilátok má význam pre retrospektívnu diagnostiku, iniciálne sérologické vyšetrenie odlíši primárnu infekciu od reaktivácie. Magnetická rezonancia mozgu je výpovedná už v prvých dňoch ochorenia, kým počítačová tomografia mozgu (CT) je v úvode nešpecifická [3, 5].
Intravenóznu terapiu acyklovirom treba začať hneď pri podozrení na herpetickú infekciu a nečakať na výsledok PCR HSV. Dĺžka liečby je 21 dní až do negatívnej vírusovej záťaže HSV v likvore [3, 6], pri kratšej terapii sa pozorujú relapsy [4, 7]. Prognóza ochorenia závisí od veku, imunitného profilu jedinca, poruchy vedomia, včasného začiatku a dĺžky liečby. Aj napriek adekvátnej a promptnej antivírusovej liečbe až polovica pacientov má dlhodobé reziduálne ložiskové neurologické následky, poruchu kognitívnych funkcií, epileptické záchvaty či poruchy reči [6, 8].
V článku prezentujeme dve zaujímavé kazuistiky herpetickej encefalitídy s odlišným klinickým priebehom a prognózou.
KAZUISTIKA Č. 1
V prvej kazuistike uvádzame prípad 4,5-ročného dovtedy zdravého dievčatka. Absolvovalo všetky povinné očkovania, malo nízku chorobnosť a neprekonalo varicelu. V predchorobí bolo dievčatko v kontakte s deťmi, ktoré mali enterovirózu.
Ochorenie začalo výraznou únavou a horúčkou do 38,5 °C. CRP bolo menej ako 8 mg/l, stav sa uzavrel ako viróza. Horúčka pretrvávala ďalších 5 dní, pridružili sa bolesti hlavy a ojedinelé vracanie. Na 6.deň sa dostavilo slinenie s tvárovými automatizmami a ojedinelé tonické zášklby končatín s krátkodobou poruchou vedomia. Neurológ konštatoval cerebrálny záchvat pri febrilitách bez centrálnej topickej symptomatológie. V priebehu 24 hodín sa objavuje ľavostranná hemiparéza s opakovanými zášklbmi končatín, nystagmus s anizokóriou, pretrváva hyperpyrexia. Na CT mozgu sú nepriame známky edému mozgu, ale očné pozadie nevykazuje edém papily. Stav vedomia sa prudko zhoršil (GCS 7), šija oponuje na 4 cm, preto indikovaná lumbálna punkcia a MR mozgu. V likvore sa zistila zmiešaná pleocytóza (elementy 141/µl, Mo 139/µl, Poly 2/µl), v MR obraze známky akútnej meningoencefalitídy so zápalovým signálom v oboch temporálnych hemisférach (obr. 1, A1 a B1).
Image 1. MR FLAIR mozgu. A1 a B1: pred liečbou acyklovirom. Signálové zmeny temporomediálneho kortexu s prevahou vpravo. A2 a B2: 9 mesiacov po HSE. Malatické zmeny, leukoencefalopatia v pravom temporálnom laloku, dilatácia pravej mozgovej komory.
Fig. 1. MR FLAIR of brain. A1 and B1: before acyclovir treatment. Signal changes of the temporomedial cortex with the right-side predominance. A2 and B2: 9 months after HSE. Malatic lesions, leukoencephalopathy in the right temporal lobe, dilatation of the right ventricle.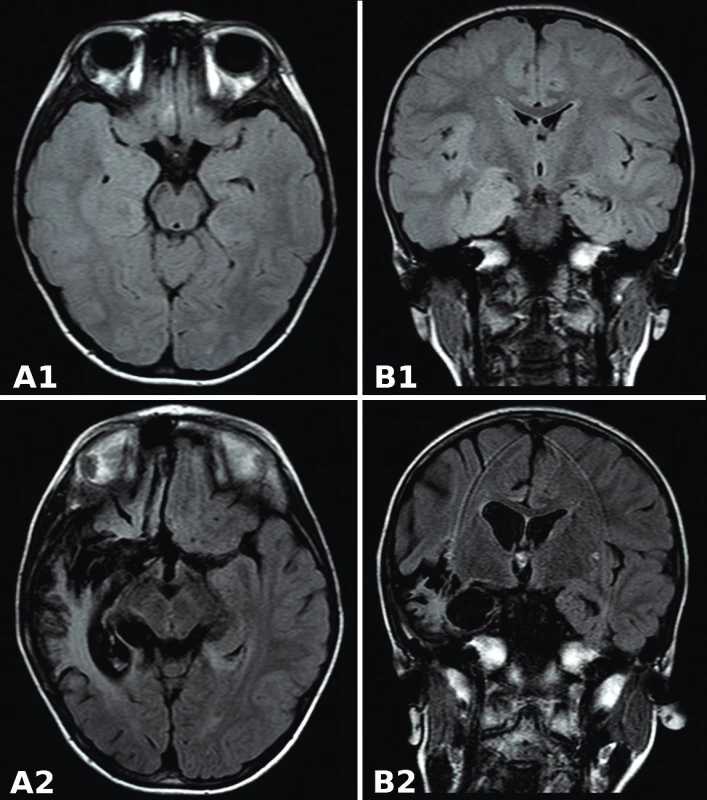
Promptne sa ordinovala empirická intravenózna antiinfekčná (cefotaxim, acyklovir) a antiedémová terapia (kortikoidy, manitol). V likvore sa potvrdila vysoká nálož HSV1 DNA (1 : 98 000 kópií/µl) a negatívne intratekálne HSV1 protilátky. Sérologické vyšetrenia vylúčili inú infekčnú príčinu neuroinfekcie. Pri liečbe acyklovirom v dávke 15 mg/kg à 8 hodín vymizla ľavostranná hemiparéza a centrálna paréza tvárového nervu. Nález v kontrolnej lumbálnej punkcii preukázal mononukleárnu pleocytózu (elementy 42,6/µl), negatívne PCR HSV1 a pozitívne intratekálne HSV1 IgG špecifické protilátky (tab. 1). Pre ojedinelé subfebrility a zmeny nálady bez klinických a laboratórnych známok inej akvirovanej infekcie, sme pokračovali v liečbe acyklovirom do 5 týždňov. O 5 mesiacov neskôr sa dostavili krátke tonicko-klonické zášklby na končatinách s deviáciou bulbov, dyslália, poruchy prehĺtania a afázia. Na MR mozgu neboli prítomné akútne lézie, avšak pribudli rozpadové zóny nekrotického tkaniva a progresia šírky bočnej komory vpravo (obr. 1, A2 a B2).
Table 1. Laboratórne parametre pred liečbou a počas liečby acyklovirom u pacientky z kazuistiky č. 1. 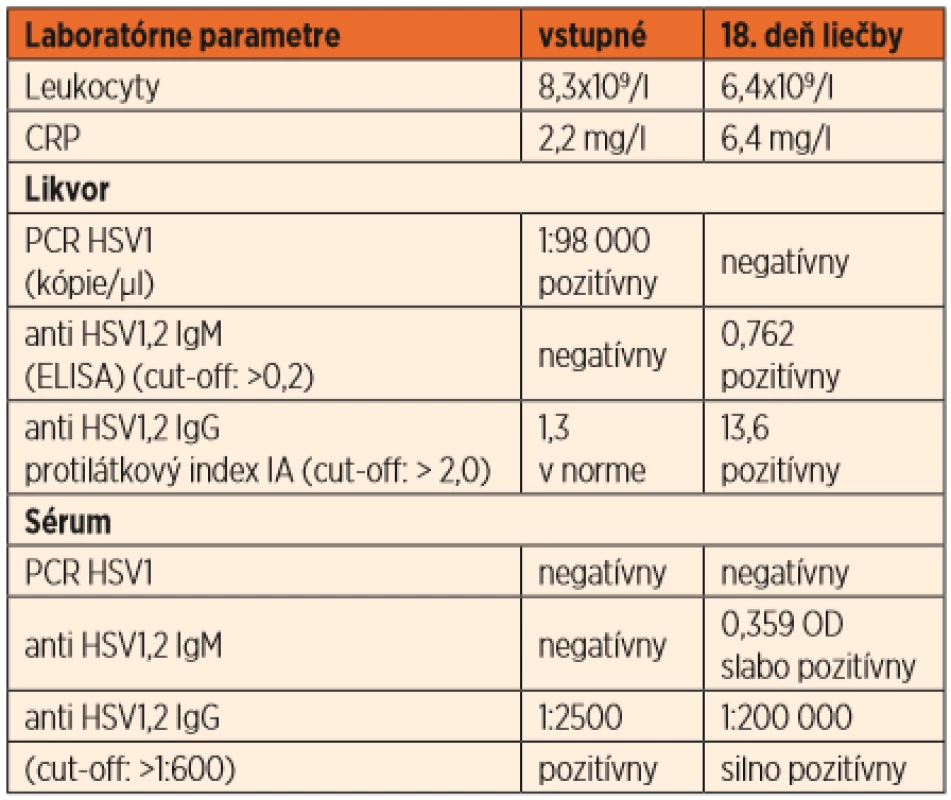
V EEG zázname sa znázornili generalizované špecifické epigrafoelementy temporálne vpravo. Klinický stav dieťaťa sa po úprave antiepileptickej liečby postupne stabilizoval, ale aký bude longitudinálny neurologický vývoj dieťaťa ukáže ďalšie sledovanie.
KAZUISTIKA Č. 2
V druhej kazuistike opisujeme zaujímavú históriu 26-ročnej ženy s prekonanou fulminantnou HSV1 encefalitídou v detstve. V čase prepuknutia choroby mala 14 rokov. V predškolskom veku prekonala varicelu bez komplikácii, ako 9-ročná mala hepatitídu A. Vo veku 12 rokov bola hospitalizovaná na infekčnom oddelení pre periférnu parézu n. VII vľavo a erythema migrans na tvári, bez sprievodnej horúčky. CT mozgu bolo negatívne, v likvore sa zistili elementy 34/ µl a proteinorhachia 0,31 g/l, intratekálna syntéza protilátok sa v tom čase ešte nevyšetrovala. Protilátky IgM aj IgG (Borrelia burgdorferi, HSV1,2, CMV, EBV, vírus kliešťovej encefalitídy) boli negatívne. Infektológ na základe klinického obrazu a nálezu seróznej meningitídy stav uzavrel ako neuroborelióza a indikoval intravenózne cefalosporíny 3. generácie po dobu 21 dní, ktoré viedli ku kompletnej dermato/neurologickej rezolúcii.
Prvé klinické prejavy terajšieho ochorenia sa manifestovali vo veku 14 rokov počas dovolenky na Balkánskom polostrove bolesťami brucha, horúčkou 38,5 ºC, vracaním, hnačky nemala. Na 3. deň sa k horúčke pridružil meningeálny syndróm. V likvore bola zmiešaná pleocytóza (elementy 12/µl, Poly 7,3/µl, Mo 4,6/µl, bielkoviny 0,22 g/l, glykorhachia 1,86 mmol/l) a pre predpokladaný rozvoj purulentnej meningitídy bola začatá empirická antibiotická liečba (ceftriaxon, gentamicin). Nasledujúci deň sa neurologická symptomatológia dramaticky mení, dievča nereaguje na oslovenie, je agresívne, nahlas nezrozumiteľne spieva. Pridružujú sa kŕče mimického svalstva a striedavé epizódy expresívnej afázie s mimovoľnými pohybmi očí a hlavy. Vracanie ustúpilo, ale pretrvávajú febrility a prehlbuje sa porucha vedomia (GCS 10 bodov). V likvore je vzostup elementov s prevahou polymorfonukleárov (Poly 173,3/µl, Mo 24/µl, bielkoviny 0,86 g/l, glykorhachia 3,36 mmol/l). Dievča v komatóznom stave (GCS 3 body) na kombinovanej antibiotickej liečby (ceftriaxon, gentamicin) bolo transportované na Slovensko.
Vzhľadom na kŕčovú anamnézu sa opakuje lumbálna punkcia, kde pretrváva pleocytóza s prevahou mononukleárov (elementy 116,6/µl, Poly 5,3/µl, Mo 114,3/µl, bielkoviny 0,83 g/l, glykorhachia 2,91 mmol/l). Pre podozrenie na herpetickú meningoencefalitídu sa indikoval intravenózny acyklovir 20 mg/kg à 8 hod s podpornou liečbou (kortikoidy, manitol). V priebehu dvoch dní sa stav zhoršuje, dochádza k respiračnému zlyhaniu s potrebou resuscitácie a umelej pľúcnej ventilácie. Na CT mozgu (obr. 2) je obraz akútnej encefalitídy s nekrotickým rozpadom mozgového parenchýmu fronto-temporo-parieto-okcipitálne (F-T-P-O) obojstranne, viac vľavo, herniáciou falxu doprava o 5–6 mm, s toxickým difúznym edémom mozgu a tlakom na bazálne cisterny a tentórium cerebri. V likvore sa dokázala pozitivita PCR HSV1 (v tom čase sa na Slovensku nevyšetrovala vírusová nálož HSV) a slabá pozitivita intratekálnej tvorby IgG protilátok anti-HSV1 (protilátkový index 2,8). V sére boli negatívne PCR HSV1 a anti-HSV1 IgM protilátky, protilátky triedy IgG boli pozitívne (1 : 14 000). Výsledky vyšetrení séra a likvoru poukazovali na akútne prebiehajúcu herpetickú infekciu mozgu, pravdepodobne následkom reaktivácie endogénnej latentnej infekcie HSV1 (tab. 2).
Image 2. CT mozgu. 9. deň ochorenia: Obraz encefalitídy obojstranne, herniácia falxu doprava.
Fig. 2. CT of brain. 9th day of illness: Picture of encephalitis on both sides, hernia falx to the right.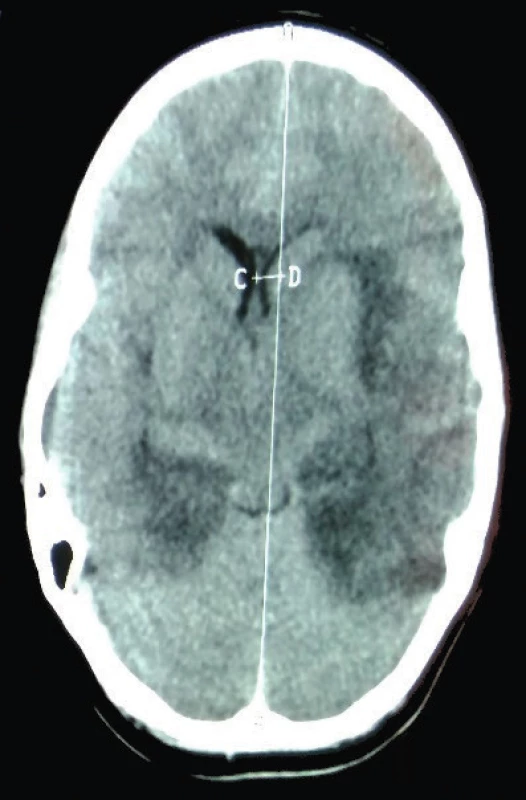
Table 2. Laboratórne parametre pred liečbou a počas liečby acyklovirom u pacientky z kazuistiky č. 2. 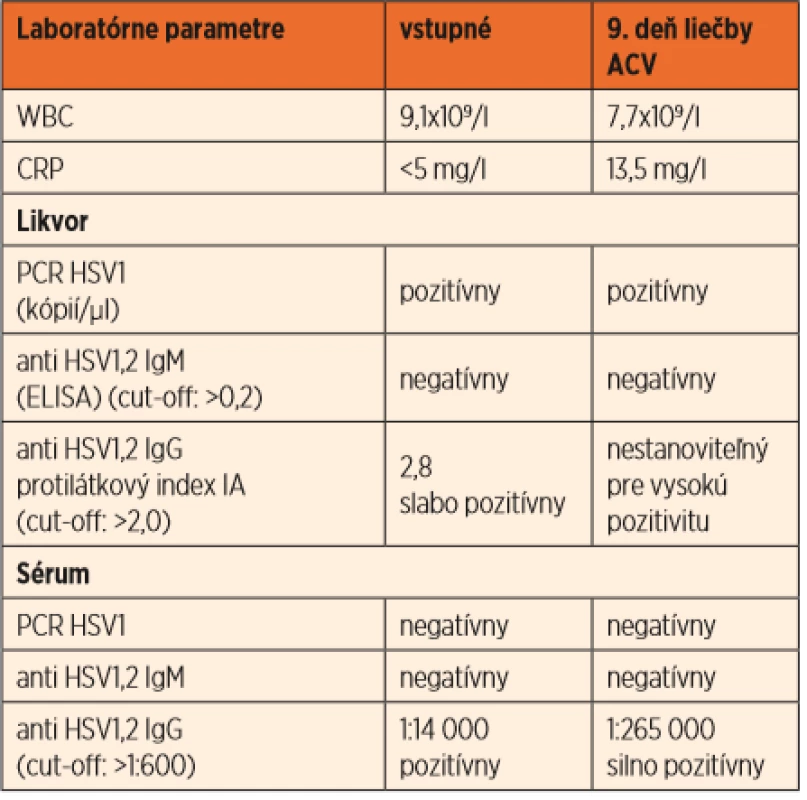
Kontrolné vyšetrenie likvoru na 9. deň liečby acyklovirom vykazovalo zlepšený nález, ale klinicky pretrvávala coma vigile s kvadruparézou. V priebehu niekoľkých týždňov dochádza k nepatrným náznakom veľmi slabých a nekonzistentných „kognitívnych“ odpovedí (minimally consciousness state) sprevádzaných hemibalizmami. Intravenózna liečba acyklovirom v dávke 20 mg/kg à 8 hodín sa pre závažnosť stavu podávala 6 týždňov. Po troch mesiacoch intenzívnej rehabilitácie a oxygenoterapie v hyperbarickej komore sa pozorujú ďalšie pokroky – dievča začína rozumieť, chodiť, obnovuje sa hrubá a jemná motorika. Postupne si osvojuje základné kognitívne funkcie, čiastočne sa obnovuje staro/novo pamäť a ukončuje posledný rok základnej školskej dochádzky.
Pacientka má v súčasnosti 26 rokov, v neurologickom obraze je prítomný horizontálny nystagmus, je bez topickej symptomatológie, má mierne znížené kognitívne funkcie a abstraktné myslenie. Zriedkavo sa objavujú sekundárne epileptické záchvaty. 12 rokov po prekonaní HSE perzistuje na MR mozgu stacionárny nález encefalopatie s výpadkami bielej a šedej hmoty v obidvoch hemisférach (obr. 3).
Image 3. MR FLAIR mozgu. A1 a B1: 6 mesiacov po HSE. V mieste pôvodných hypodenzných ložísk viacpočetné kortiko-subkortikálne malatické ložiská a dilatácia okcipitálneho rohu ľavej bočnej komory. A2 a B2: 8 a 12 rokov po HSE. Zvýraznené pôvodné rozpadové malatické ložiská, progresia šírky okcipitálneho rohu ľavej bočnej komory. Bez podstatných zmien v porovnaní s MR po 18 mesiacoch po HSE.
Fig. 3. MR FLAIR of brain. A1 and B1: 6 months after HSE. Multiple cortical-subcortical malatic lesions in the location of the original hypodense areas. Dilatation of the occipital horn of the left ventricle. A2 and B2: 8 and 12 years after HSE. Highlighted original malatic lesions, width progression of the occipital horn of the left ventricle. No significant changes compared to MR after 18 months of HSE.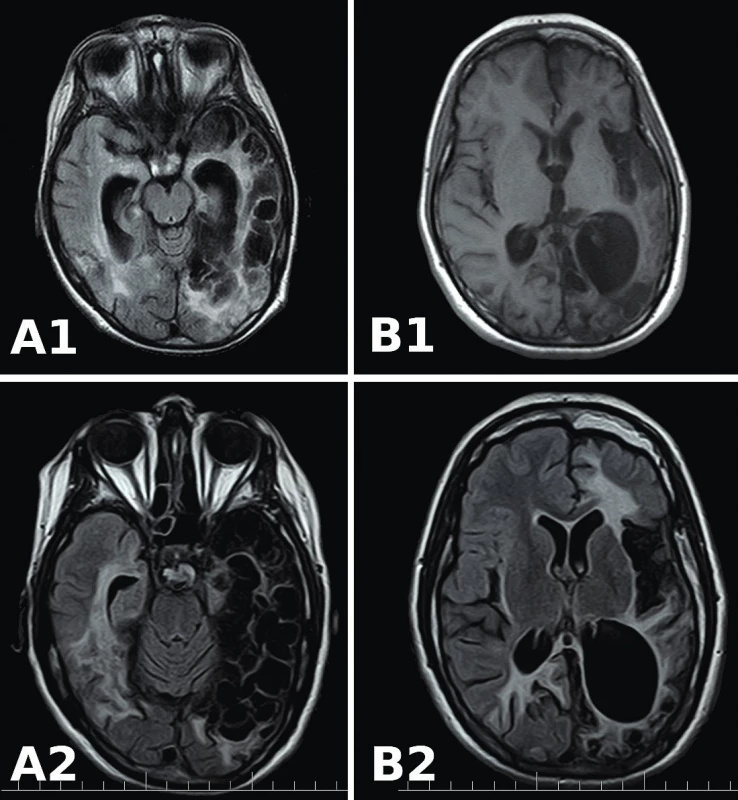
DISKUSIA
Neliečená a/alebo nesprávne liečená HSE má devastujúce následky [9]. Ako ilustrujú obidve kazuistiky našich pacientov, klinický priebeh ochorenia býva rozdielny a trvalé neurologické následky možno z iniciálnych zmien na magnetickej rezonancii len ťažko predikovať. Diferenciálne diagnosticky treba vylúčiť iné infekčné príčiny meningitídy (EBV, CMV, listéria, borélia, varicella zoster vírus, mykoplazma pneumoniae, chlamýdia pneumoniae) a autoimunitnú etiológiu. K najčastejším diagnostickým omylom a zámene s purulentnou meningitídou dochádza v prvých dňoch ochorenia, keď v likvore môže byť pleocytóza s prevahou neutrofilov [1, 3]. Aj v prípade našej druhej kazuistiky bol likvorologický nález v úvode ochorenia vyhodnotený ako purulentná meningitída a HSV sa v cerebrospinálnom moku detegoval až pri opakovanej lumbálnej punkcii.
Zlatým diagnostickým štandardom je dôkaz vírusovej záťaže HSV metódou PCR v likvore a sére. Ak vírus nie je v replikačnom cykle, môže prežiť, najmä, ak sa ACV podáva krátko (10–14 dní) [3, 10]. Počet HSV DNA kópií v likvore počas prvých 5–6 dní antivírusovej liečby ešte stúpa, lebo dochádza k uvoľneniu veľkého množstva malých vírusových fragmentov DNA. Po 2 týždňoch vírusová nálož prudko klesá a po 30 dňoch sa už HSV PCR nedeteguje [4]. Promptná antivírusová liečba môže rozhodovať o prognóze chorého, avšak ako názorne ilustruje prípad mladej ženy, v medicíne na cielenú liečbu „nikdy nie je neskoro“. Hoci terapia ACV dokázala zvrátiť život ohrozujúci priebeh, roky perzistujúce encefalomalatické lézie sú ireverzibilné. Na druhej strane, ani adekvátna liečba acyklovirom „nezaručuje“, že dieťa nebude mať dlhodobé neurologické komplikácie a jeho ďalší osud a prognóza budú priaznivé.
U pacientky opísanej v 1. kazuistike došlo napriek včasnej a dostatočne dlho podávanej liečbe ACV k opätovnému vzplanutiu neurologických príznakov. V publikovaných kohortách sa recidívy HSE pozorovali u 5 až 26 % chorých, s najčastejším výskytom v prvých 3 mesiacoch po ukončení liečby. Relapsy sú častejšie u detí ako u dospelých [9, 10]. Pôvodný predpoklad, že kvantitatívne vyššia vírusová nálož HSV v CNS je spojená so závažnejším stupňom poškodenia mozgového tkaniva, sa v klinických štúdiách nepotvrdil [11].
Usudzuje sa, že pri toxickom poškodení mozgu majú dôležitejšiu patogenetickú úlohu ako replikácia vírusu presne neobjasnené imunopatologické mechanizmy. Názorne to dokumentuje prípad dievčatka z našej prvej kazuistiky, keď sa ACV promptne nasadil a aplikoval 5 týždňov. Napriek kompletnej neurologickej úprave v čase ukončenia terapie, o 5 mesiacov došlo k manifestácií závažnej neuropsychiatrickej symptomatológie. MR nález vykazoval progresiu demyelinizácie šedej aj bielej hmoty mozgu, bez nálezu akútnych lézií. Intravenóznu liečbu acyklovirom sa odporúča podávať 21 dní, v individuálnych prípadoch aj dlhšie [1, 4].
V snahe predchádzať vzniku relapsu HSE sa skúšali tiež vyššie ako štandardné dávky ACV, obavy vyvolávalo najmä poliekové poškodenie obličiek [12, 13]. Kedrick a spol. v retrospektívnej štúdií zahrňujúcej 61 detí vo veku od 3 mesiacov do 18 rokov porovnávali efekt a toxicitu ACV. 32 detí užívalo štandardnú a 29 detí vysokú dávku ACV (60 mg/kg/d). Autori nezistili signifikantný rozdiel medzi účinnosťou terapie ACV či výskytom renálneho poškodenia v obidvoch skupinách. Aj my sme u pacientky opísanej v druhej kazuistike empiricky nasadili maximálnu dávku ACV 60 mg/kg/d pre neskorý začiatok antivirotickej liečby a závažný komatózny stav. Renálne parametre a klírens endogenného kreatinínu boli v priebehu celej dĺžky terapie v norme.
Predikcia relapsov je ťažká, HSE môže relabovať aj pri adekvátnej terapii v akútnej fáze ochorenia. Z japonskej kohorty 27 detí s PCR diagnostikovanou a acyklovirom úspešne liečenou akútnou herpetickou encefalitídou, 7 pacientov prekonalo relaps encefalitídy (26 %), ale HSV v likvore sa pri exacerbácií dokázala len u dvoch detí [6]. Pri relapse ochorenia je často test na PCR HSV v likvore negatívny [4, 15] a nemusí byť prítomná ani intratekálna tvorba protilátok [6, 9]. Podľa dostupných klinických dát sa predpokladá, že relaps môže indukovať aj oneskorená zápalová imunologická odpoveď. Tento patogenetický mechanizmus je najpravdepodobnejší v prípadoch, keď je negatívna HSV PCR v likvore a v MR obraze sa zobrazujú ložiská demyelinizácie. Dôkazy o účasti imunitných mechanizmov viedli k snahe modifikovať cytokínovú odpoveď a zlepšiť tak prognózu ochorenia. Očakávalo sa, že pridanie adjuvantnej liečby, najmä glukokortikoidov, zmierni lokálny zápal v mozgovom tkanive a priaznivo ovplyvní priebeh či neurologické následky encefalitídy.
Kontrolované štúdie u ľudí nepotvrdili signifikantný vplyv glukokortikoidov na mortalitu a morbiditu. Opierajúc sa o tieto dôkazy a recentnú multicentrickú randomizovanú štúdiu (GACHE), ktorá porovnávala efekt ACV/dexametazon verzus ACV/placebo, sa glukokortikoidy v rutinnom manažmente herpetickej encefalitídy neodporúčajú [16]. Avšak môžu mať efekt pri akútnej cerebellárnej ataxii [17]. Podľa EBM (Evidence Based Medicine – medicíny založenej na dôkazoch) sa tiež neodporúča pridávať k antivírusovej liečbe intravenózne imunoglobulíny, interferón alfa, či plazmaferézu, lebo ich aditívny benefit sa nepotvrdil [1, 4].
ZÁVER
Encefalitída vyvolaná herpes simplex typom 1 je celosvetovo najčastejšia sporadická fatálna encefalitída. Včasne indikovaný acyklovir signifikantne znižuje riziko trvalých následkov, avšak aj neskorý začiatok liečby môže čiastočne ovplyvniť priebeh HSE. Kontrolná lumbálna punkcia má dôležitý význam, najmä pre retrospektívnu diagnostiku a dĺžku antivírusovej liečby. HSE sa môže u niektorých pacientov opakovať. Hoci sa relaps najčastejšie vyskytuje v prvých 3 mesiacoch, môže sa dostaviť aj roky po prekonanej HSE.
Možno očakávať, že zlepšenie dlhodobej prognózy HSE prinesú až inovatívne terapeutické postupy.
Zoznam skratiek
ACV – acyklovir
CMV – cytomegalovírus
CRP – C-reaktívny proteín
EBV – Epsteina-Barrovej vírus
GCS – Glasgow Coma Scale
Mo – mononukleáry
MR FLAIR – magnetická rezonancia so sekvenciou Fluid-attenuated inversion recovery
Poly – polymorfonukleáry
Došlo: 10. 9. 2019
Přijato: 25. 10. 2019
Adresa pre korešpondenciu:
Prof. MUDr. Ľudmila Podracká, CSc.
Detská klinika LFUK a NÚDCH
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: ludmila.podracka@dfnsp.sk
Sources
1. Tunkel AR, Glaser CA, Bloch KC, et al. The management of encephalitis: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2008; 47 : 303–327.
2. Sedláček D, Štruncová V, Pizingerová K, et al. Herpetická encefalitida. Pediatr praxi 2004; 7 : 226–230.
3. Opavský R, Herzig R, Kaňovský P. Herpetické infekce centrální nervové soustavy. Neurol praxi 2008; 9 (2): 87–90.
4. Tyler KL. Herpes simplex virus infections of the central nervous system: encephalitis and meningitis, including Mollaret’s. Herpes 2004; 11 (2): 57–64.
5. Hatipoglu HG, Sakman B, Yuksel E. Magnetic resonance and diffusion-weighted imaging findings of herpes simplex encephalitis. Herpes 2008; 15 : 13–17.
6. Ito Y, Kimura H, Yabuta Y, et al. Exacerbation of herpes simplex encephalitis after successful treatment with acyklovir. Clin Infect Dis 2000; 30 : 185–187.
7. Salih M, El Khashab H, Hassan H, et al. A Study on herpes simplex encephalitis in 18 children, including 3 relapses. Open Pediatr Med J 2009; 3 : 48–57.
8. Britton PN, Dale RC, Booy R, et al. Acute encephalitis in children: Progress and priorities from an Australasian perspective. J Paediatr Child Health 2015; 51 : 147–158.
9. Taskin BD, Tanji K, Feldstein NA, et al. Epilepsy surgery for epileptic encephalopathy as a sequela of herpes simplex encephalitis: case report. J Neurosurg Pediatr 2017; 20 (1): 56–63.
10. Basak RB, Malpani V, Kakish K, et al. Poor neurological sequelae of herpes simplex virus encephalitis in an infant despite adequate antiviral and adjunct corticosteroid therapy. Indian J Dermatol 2011; 56 (6): 749–751.
11. Růžek D, Piskunova N, Žampachová E. High variability in viral load in cerebrospinal fluid from patients with herpes simplex and varicella-zoster infections of the central nervous system. Clin Microbiol Infect 2007; 13 : 1217–1219.
12. Gong T, Bingaman W, Danziger-Isakov L, et al. Herpes simplex virus reactivation after subtotal hemispherectomy in a pediatric patient. Pediatr Infect Dis J 2010; 29 (12): 1148–1150.
13. Kendrick JG, Ensom MHH, Steer A, et al. Standard-dose versus high-dose acyclovir in children treated empirically for encephalitis: A retrospective cohort study of its use and safety. Pediatr Drugs 2014; 16 (3): 229–234.
14. Ruderfer D, Krilov LR. Herpes simplex viruses 1 and 2. Pediatr Rev 2015; 36 (2): 86–90.
15. Sköldenberg B, Aurelius E, Hjalmarsson A, et al. Incidence and pathogenesis of clinical relapse after herpes simplex encephalitis in adults. J Neurol 2006; 253 (2): 163–170.
16. Martinez-Torres F, Menon S, Pritsch M, et al. Protocol for German trial of Acyclovir and corticosteroids in Herpes-simplex-virus-encephalitis (GACHE): a multicenter, multinational, randomized, double-blind, placebo-controlled German, Austrian and Dutch trial [ISRCTN45122933]. BMC Neurol 2008; 8 : 40.
17. Roháčová H. Infekce nervového systému vyvolané herpetickými viry. Med pro praxi 2008; 5 (3): 117–118.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2020 Issue 1-
All articles in this issue
- Editorial: Česko-slovenská Pediatrie v roce 2020
- Editorial: Současné možnosti genetické diagnostiky
- Rozšířené testování nosičství recesivních chorob (CarrierTest) v klinické praxi
- Děti narozené po asistované reprodukci v České republice v letech 2013–2015
- Vrodené a geneticky podmienené ochorenia dýchacieho traktu z pohľadu genetika
- Genetické příčiny syndromu náhlého úmrtí kojence. Co přineslo sekvenování nové generace
- Dědičné arytmické syndromy v dětském věku
- Nikdy nie je neskoro – herpetická encefalitída vyvolaná vírusom HSV1
- Oxytocín a obezita
- Poděkování spolupracovníkům za rok 2019
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nikdy nie je neskoro – herpetická encefalitída vyvolaná vírusom HSV1
- Dědičné arytmické syndromy v dětském věku
- Genetické příčiny syndromu náhlého úmrtí kojence. Co přineslo sekvenování nové generace
- Rozšířené testování nosičství recesivních chorob (CarrierTest) v klinické praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

