-
Medical journals
- Career
Hodnotenie elektrickej kôrovej aktivity pomocou amplitúdovej elektroncefalografie u donosených novorodencov počas fototerapie
Authors: Z. Zimová; K. Maťašová; M. Zibolen
Authors‘ workplace: Neonatologická klinika, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Univerzitná nemocnica Martin
Published in: Čes-slov Pediat 2018; 73 (1): 16-22.
Category:
Overview
Amplitúdová elektroencefalografia (aEEG) je neinvazívna metóda kontinuálneho monitorovania elektrickej aktivity mozgu novorodencov. Vďaka pomerne jednoduchému hodnoteniu, menšej časovej náročnosti na prípravu a relatívne malým rozmerom je už v súčasnosti aEEG bežnou súčasťou komplexnej zdravotnej starostlivosti o chorých novorodencov na jednotkách intenzívnej starostlivosti. Incidencia významnej hyperbilirubinémie u donosených novorodencov je približne 10 %. Fototerapia je už viac ako 50 rokov metódou voľby v jej liečbe a absolvuje ju veľký počet detí. Popisujú sa jej mnohé vedľajšie účinky.
V práci sme analyzovali vplyv hyperbilirubinémie a fototerapie na elektrickú kôrovú aktivitu prostredníctvom amplitúdového EEG. Pri porovnaní kontrolného súboru (n = 20) s pacientami s hyperbilirubinémiou (n = 20) nebola zistená významná zmena ani jedného zo sledovaných indikátorov snímaných na a EEG – dolná hranica (p = 0,046), horná hranica (p = 0,088), šírka amplitúdy (p = 0,929) a celková amplitúda (p = 0,356). Rovnako ani liečba fototerapiou u pacientov s hyperbilirubinémiou nespôsobila významné rozdiely v dolnej hranici (p = 0,122), hornej hranici (p = 0,934), šírke amplitúdy (p = 0,580) a amplitúde (p = 0,063). Z predložených výsledkov vyplýva, že hyperbilirubinémia a fototerapia nemajú vplyv na elektrickú aktivitu mozgu novorodencov na úrovni kôry.Kľúčové slová:
amplitúdová elektroencefalografia, novorodenec, hyperbilirubinémia, fototerapiaÚVOD
Kontinuálne monitorovanie mozgových funkcií pomocou aEEG (amplitúdová elektroencefalografia) je pomerne nová metodika, ktorá sa integrovala do rutinnej klinickej praxe v starostlivosti o dospelých a detských pacientov a svoje stabilné miesto získava aj na jednotkách intenzívnej starostlivosti o novorodenca. Podobne ako meranie fyziologických parametrov, ako je elektrokardiogram, frekvencia srdca, kyslíková saturácia, krvný tlak a meranie teploty, ktoré patria k základným prvkom hodnoteným pri lôžku pacienta, tak aj monitorovanie mozgovej činnosti pomocou aEEG môže pomáhať hodnotiť aktuálny stav novorodenca [1]. Využitie aEEG má veľkú perspektívu v klinickej aj experimentálnej oblasti a osvojenie si tejto techniky a jej implementácia do rutinnej praxe môže mať významný vplyv na skvalitnenie cielenej starostlivosti o kriticky chorého novorodenca. Jednoduchosť aplikácie, pomerne ľahké hodnotenie aEEG záznamu a možnosť realizácie neinvazívneho merania predurčujú túto metódu aj na realizáciu klinického výskumu.
Približne u jedného z dvoch detí narodených v termíne a u ôsmych detí z desiatich narodených predčasne sa rozvinie novorodenecká žltačka [2]. Fototerapia je pri jej liečbe metódou voľby už viac ako 50 rokov. Okrem terapeutického efektu má však množstvo potvrdených vedľajších účinkov. Jej vplyv na elektrickú kôrovú aktivitu mozgu je otázny.
VYUŽITIE aEEG U DONOSENÝCH NOVORODENCOV
U donosených novorodencov je aEEG excelentná metóda pre hodnotenie mozgových funkcií a cerebrálneho zotavenia po hypoxicko-ischemických inzultoch. Najčastejšími indikáciami pre použitie aEEG je detekcia kŕčovej aktivity a monitorovanie aktuálneho mozgového stavu, ktorý v určitých prípadoch slúži na hodnotenie krátkodobej a dlhodobej neurologickej prognózy novorodenca. aEEG sa v týchto indikáciách využíva u predčasne narodených detí [3], ale aj u detí narodených v termíne. Ďalšími veľmi častými indikáciami na realizovanie aEEG záznamu sú hypoxicko ischemická encefalopatia, hypoxické a hemoragické lézie, metabolické ochorenia, malformácie a infekcie CNS (centrálny nervový systém) a iné [4].
Novorodenci, ktorí potrebujú intenzívnu starostlivosť, podliehajú väčšiemu riziku mozgových komplikácií vzhľadom na cirkulačnú instabilitu (napr. sepsa), hypoxiu (napr. perzistujúca pľúcna hypertenzia, aspirácia mekónia, srdcové chyby alebo diafragmatická hernia), hypoglykémiu a kŕčovú aktivitu [5]. Klinické symptómy mozgovej dysfunkcie môžu byť náročné na detekciu kvôli základnej diagnóze, alebo pre analgosedáciu. Cyklické zmeny vznikajúce pri spánku a bdení majú veľkú výpovednú hodnotu. Ich prítomnosť svedčí o normálnej mozgovej aktivite a hodnotenie SWC (sleep wake cycle) slúži k stanovaniu aktuálneho stavu mozgu, ale aj k odhadu neurologickej prognózy. Porozumenie vývoju spánkového cyklu u predčasne narodeného novorodenca a jeho zmenám na aEEG poskytuje kľúč k stanoveniu možného neurologického vývoja predčasne narodeného novorodenca, ale aj novorodenca narodeného v termíne po prekonaní hypoxicko-ischemického ataku [6].
aEEG sa u donosených novorodencov v klinickej praxi využíva predovšetkým ako skorý indikátor poškodenia mozgu u detí s hypoxicko-ischemickou encefalopatiou. Kontinuálny vzor na aEEG s amplitúdou v rozmedzí 10–25 mcV, mierne jemné a cyklické variácie, alebo plne rozvinutý cyklus spánok – bdenie je optimálnym ukazovateľom neporušených mozgových funkcií [7]. Viaceré štúdie potvrdzujú, že hodnotenie aEEG počas časovej periódy od 6 do 12 hodín má najväčšiu výpovednú hodnotu. Senzitivita sa v týchto štúdiách pohybuje od 91 do 100 % s pozitívnou prediktívnou hodnotou až 85 %. Kombinácia včasného aEEG merania s klinickým vyšetrením počas prvých 12 hodín po narodení má vyššiu pozitívnu prediktívnu hodnotu a špecificitu ako každá samostatne [8].
V súlade s týmto tvrdením van Rooij a kol. demonštrovali, že 61 % detí so závažne abnormálnym aEEG vzorom popísaným vo veku 6 hodín, ktorý sa normalizoval do 24 hodín, malo žiadne, alebo minimálne neurologické následky [9].
NEKONJUGOVANÁ HYPERBILIRUBINÉMIA A FOTOTERAPIA
Novorodenecká žltačka sa typicky objavuje na 2.–4. deň po pôrode a spontánne vymizne po 7–14 dňoch. U väčšiny novorodencov nevyžaduje terapeutickú intervenciu [2]. V prípade patologického ikteru a v situácii, kedy hodnota hyperbilirubinémie prekročí určitú hranicu, je novorodenec ohrozený bilirubínovou encefalopatiou a rozvojom jej chronickej fázy – jadrového ikteru [10].
Charakteristické žlté sfarbenie buniek spôsobené nekonjugovaným bilirubínom je viditeľné v oblastiach corpus subthalamicum, hippokampe, thalame, globus pallidus, putamen, v kraniálnych nervových jadrách a v mozgovej kôre. Žlté sfarbenie mozgových štruktúr je popisované aj u detí post mortem, ktoré nemali klinické prejavy kernikteru a u ktorých boli zaznamenané len mierne zvýšené hodnoty sérového bilirubínu. V tejto situácii môžu hrať úlohu faktory ovplyvňujúce permeabilitu hematoencefalickej bariéry (napr. acidóza, infekcia) a množstvo nekonjugovaného bilirubínu viazaného na albumín [11]. V neskorej fáze ochorenia sa popisuje strata neurónov, reaktívna glióza a atrofia. Bilirubín v neurónoch inhibuje oxidatívnu fosforyláciu [12].
Účinok svetla na koncentráciu sérového bilirubínu u novorodencov s hyperbilirubinémiou bol prvýkrát popísaný v práci Cremer a spol. v roku 1958. Odvtedy sa fototerapia účinne používa ako pomerne lacná a neinvazívna metóda liečby neonatálnej hyperbilirubinémie [13]. V súčasnosti sú výmenné transfúzie zriedkavé a používajú sa len ako záchranná terapia, aby sa zabránilo jadrovému ikteru u novorodencov so závažnou žltačkou, keď je fototerapia nedostatočná. Vzhľadom na to, že fototerapia je už viac ako 50 rokov metódou voľby pri liečbe novorodeneckej hyperbilirubinémie, je potrebné čo najpresnejšie poznať jej vedľajšie účinky na organizmus novorodenca [2].
Krátkodobé nežiadúce účinky fototerapie predstavujú napríklad insenzibilné straty vody, fototerapia mení tepelné prostredie dieťaťa [14]. Počas fototerapie bol u detí zaznamenaný vyšší počet vodnatých stolíc [15]. Fototerapia môže spôsobiť pokles celkového a ionizovaného kalcia. Žiarenie produkované fototerapeutickou lampou môže pôsobiť na fotoreceptory sietnice. Okrem zdravotných vedľajších účinkov fototerapia negatívne ovplyvňuje väzbu matky a dieťaťa a aj preto sa má vykonávať len v indikovaných prípadoch [16]. Z dlhodobých účinkov sa popisuje asociácia medzi výskytom alergických ochorení a astmy, štúdie tiež potvrdili koreláciu medzi fototerapiou a počtom melanocytárnych névov. U extrémne nezrelých detí sa popisuje prienik fototerapeutického žiarenia cez hrudnú stenu, kde následnou relaxáciou hladkého svalstva môže spôsobiť znovuotvorenie ductus arteriosus Botali [17].
Cieľ práce
Cieľom predloženej práce bolo pomocou aEEG záznamu hodnotiť vplyv hyperbilirubinémie a fototerapie na elektrickú kôrovú aktivitu donoseného novorodenca.
METODIKA
Do súboru sledovaných pacientov bolo zahrnutých dvadsať zdravých donosených eutrofických novorodencov s primeranou popôrodnou adaptáciou s laboratórne potvrdenou hyperbilirubinémiou. Diagnóza hyperbilirubinémie bola stanovená na základe koncentrácie sérového bilirubínu v krvi z venózneho odberu. Liečba fototerapiou bola indikovaná podľa kritérií odporúčaných Neonatologickou sekciou Slovenskej pediatrickej spoločnosti [18]. Každý novorodenec absolvoval dve merania, každé v trvaní dvoch hodín. Jedno meranie pred začatím fototerapie a druhé meranie počas prvých dvoch hodín fototerapie. Na fototerapiu bola použitá fototerapeutická lampa Lullaby TM s intenzitou žiarenia 18 uW/cm2/nm, medzi lampou a dieťaťom bola dodržaná odporúčaná vzdialenosť 35 cm. Pozornosť bola venovaná aj zachovaniu termoneutrality prostredia.
Na meranie mozgovej kôrovej elektrickej aktivity boli použité nalepovacie hydrogélové elektródy. Pre zaistenie optimálneho kontaktu medzi kožou a elektródou sa koža novorodenca pred nalepením elektródy ošetrovala dermoabrazívnym krémom. Dve elektródy boli naložené bilaterálne na čelo novorodenca (podľa systému 10 20 international system of electrode placement). Tretia, uzemňovacia elektróda bola umiestnená pred veľkú fontanelu novorodenca. Záznam sa snímal štandardnou rýchlosťou 6 cm/h. Pre zaistenie identických podmienok boli počas prvého aj druhého merania oči novorodenca prekryté ochrannými okuliarmi na fototerapiu. Prípadná ošetrovateľská starostlivosť bola zaznamenaná pomocou markerov priamo do záznamu aEEG.
Na zázname boli popisované typické charakteristiky v zmysle hodnotenia kontinuity záznamu, šírky pásu, hodnoty maximálnej a minimálnej amplitúdy, prítomnosti cyklu spánok a bdenie. Základný vzor sa klasifikoval podľa kritérií, ktoré navrhli Hellstrom-Westas a kol. v roku 2006 [1]. Na objektivizáciu výsledkov sa použil Burdjalov skórovací systém [19].
V kontrolnom súbore boli zahrnutí dvadsiati zdraví eutrofickí donosení novorodenci s primeranou popôrodnou adaptáciou bez hyperbilirubinémie. Títo pacienti absolvovali jedno meranie za dodržania rovnakých štandardných podmienok.
VÝSLEDKY
Výsledky merania boli po vyhodnotení štatisticky spracované T-testom, kde boli štatisticky testované nulové hypotézy – či hyperbilirubinémia alebo fototerapia neovplyvňujú elektrickú kôrovú aktivitu mozgu novorodenca. Hypotéza bola testovaná pre jednotlivé indikátory – amplitúdu, šírku amplitúdy, hornú a dolnú hranicu amplitúdy (tab. 1).
Table 1. Vyhodnotenie priemerných hodnôt základných indikátorov popisovaných na amplitúdovom EEG analyzovaných u 20 zdravých detí a 20 detí s hyperbilirubinémiou pred a po fototerapii. Hodnoty sú uvádzané v uV. 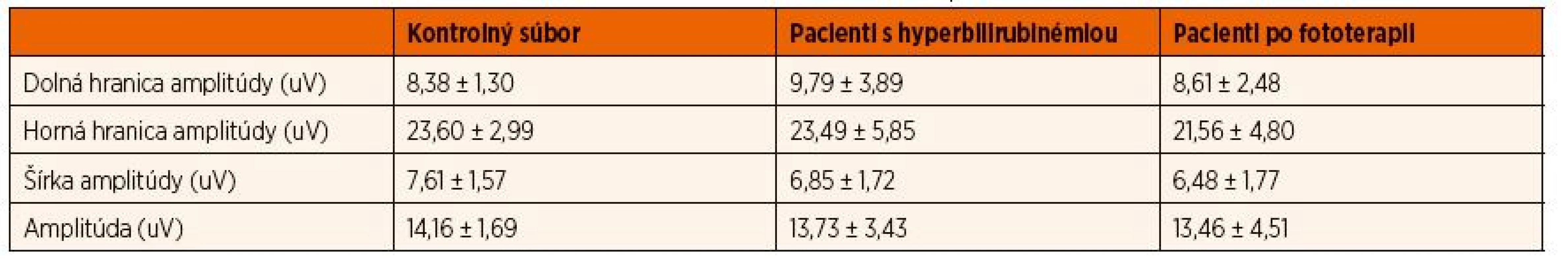
Pri porovnaní aEEG záznamu kontrolného súboru so súborom pacientov s hyperbilirubinémiou, ktorí ešte neabsolvovali fototerapiu, nedošlo k štatisticky významnej zmene v ani jednom z vyhodnocovaných indikátorov – dolná hranica (p = 0,122), horná hranica (p = 0,934), šírka amplitúdy (p = 0,580), amplitúda (p = 0,063). Zmeny neboli prítomné ani v Burdjalov skórovacom systéme a v cykle spánok a bdenie.
Pri porovnaní aEEG záznamu súboru pacientov s hyperbilirubinémiou pred fototerapiou a po fototerapii neboli štatisticky významné rozdiely medzi dolnou (p = 0,046), hornou hranicou (p = 0,088), šírkou amplitúdy (p = 0,929) a celkovou amplitúdou (p = 0,356).
Podľa zistených výsledkov sme nulové hypotézy potvrdili (grafy 1 a 2). Samotná hyperbilirubinémia ani fototerapia nespôsobuje v sledovanom súbore novorodencov štatisticky významné zmeny na úrovni elektrickej aktivity mozgovej kôry. Nepozorovali sme ani rozdiely v Burdjalov skórovacom systéme a ani v spánkovom cykle.
Graph 1. Rozdelenie amplitúdy nameraného signálu kontrolnej skupiny a pacientov. Priemerná hodnota (prerušovaná čiara) je po fototerapii nižšia ako pred fototerapiou. Distribúcie sú pri kontrolách a po fototerapii kvalitatívne podobné; obe rozdelenia majú iba jedno maximum, jeho argument je posunutý doľava oproti priemeru. 
Graph 2. Prehľad nameraných charakteristík elektrickej aktivity. Pre každú charakteristiku je prerušovanou čiarou znázornená jej priemerná nameraná hodnota, farebný pás znázorňuje hodnoty v intervale ύ – σ; ύ + σ, kde σ je štandardná odchýlka. Namerané hodnoty sú zoradené (horizontálna os) vzostupne podľa veľkosti dolnej hodnoty signálu. 
DISKUSIA
Elektroencefalografia je vo všeobecnosti neinvazívna diagnostická metóda, používaná k záznamu elektrickej aktivity mozgu. Zmeny vznikajúce pri polarizácii neurónov sú zachytávané povrchovými elektródami priloženými na povrch hlavičky novorodenca [20]. aEEG na rozdiel od konvenčného EEG je metóda, ktorá je menej náročná na časovú prípravu. Záznam je možné hodnotiť priamo pri lôžku pacienta v reálnom čase. Veľkou výhodou je, že záznam môže byť snímaný počas dlhšieho obdobia, podľa potreby aj niekoľko dní. Tomuto účelu sú prispôsobené snímacie elektródy. Používajú sa tenkoihlové subdermálne elektródy, ktoré môžu byť naložené niekoľko dní. Hydrogélové, lepiace elektródy sa odporúča preliepať každých 24 hodín za účelom získania kvalitného záznamu. O kvalite snímania vypovedá impedancia naložených elektród. V súčasnosti má väčšina aEEG prístrojov zabudovaný alarm, ktorý signalizuje, keď hodnota impedancie prekročí hodnotu považovanú za referenčnú [21].
Reverzibilné depresívne účinky bilirubínu na mozog boli preukázané modernými neurofyziologickými diagnostickými technikami, ako sú vizuálne a somatosenzorické evokované potenciály a analýza plaču. Bilirubín postihuje najmä thalamus a mozgovú kôru.
Prvýkrát bol popísaný vplyv bilirubínu na zmeny EEG v roku 1986. Rytmické oscilácie na EEG vznikajú z interakcie medzi kôrou a thalamom. V štúdii na potkanoch sa simulovala jednostranná encefalopatia, pričom bol pozorovaný pokles amplitúdy a celkové oploštenie vzoru. EEG slúžil ako indikátor vývoja encefalopatie a zmeny na EEG indikovali stupeň permeability hematoencefalickej bariéry a schopnosť vyväzovať bilirubín z krvi [22]. Bolo preukázané, že hyperbilirubinémia má supresívny vplyv na mozgové funkcie. Štúdia z roku 2002 potvrdila, že bilirubín tiež môže ovplyvňovať maturáciu EEG, kde sa zmeny frekvencie a amplitúdy považovali za marker toxicity bilirubínu. V skupine detí s hyperbilirubinémiou popísali pokles amplitúdy o 20 % v porovnaní s kontrolnou skupinou a tiež prechodné oneskorenie v dozrievaní mozgu pri opakovaných meraniach. Medzi skupinami detí neboli rozdiely pri meraní v treťom mesiaci veku. Hyperbilirubinémia teda ovplyvňuje maturáciu mozgových funkcií, ale toto oneskorenie je časovo obmedzené [12]. V našom súbore pacientov s hyperbilirubinémiou sme však v porovnaní so zdravými deťmi pri použití amplitúdovej EEG nezaznamenali zmenu v elektrickej kôrovej aktivite.
U niektorých druhov cicavcov, vrátane človeka sa skúmala penetrácia svetla – väčšinou dlhých vlnových dĺžok – do lebky. U nefixovaných ľudských kadaverov sa pri transkraniálnej aplikácii svetla vlnovej dĺžky 808 nm zistila penetrácia cez kožu, lebku, meningy a mozog až do hĺbky 40 mm [23]. U novorodencov sa predpokladá ešte väčší prienik vzhľadom na otvorenú veľkú a malú fontanelu a tenké kosti lebky v porovnaní s dospelými [24]. Svetlo môže ovplyvniť fyziológiu a fungovanie mozgu cicavcov. Mozgová kôra a sietnica reagujú aj na viditeľné svetlo s nízkou intenzitou. U potkanov sa pozorovalo, že nízke hladiny viditeľného svetla majú schopnosť preniknúť do mozgu tak hlboko, že sú schopné ovplyvniť uvoľňovanie neurotransmiterov. Zistilo sa, že extrakraniálny svetelný stimul pozostávajúci z trojhodinových pulzov svetla evokovaných zariadením na fototerapiu môže ovplyvňovať zmeny cirkadiánnej telesnej teploty pravdepodobne prostredníctvom humorálnej fototransdukcie [25]. Tkanivá mimo sietnice sú schopné fotorecepcie bez vytvárania obrazu. Nevizuálne fotoreceptory prítomné v hlbokých štruktúrach mozgu – hypotalame, epifýze a v sietnici zohrávajú dôležitú úlohu v cirkadiánnej a cirkanuálnej regulácii periodických funkcií. Prítomnosť zložiek fototransdukčnej kaskády bola preukázaná v telencefalických a hypotalamických skupinách neurónov, ktoré sú v kontakte s likvorom v stenách mozgových komôr.
Cirkadiánny rytmus predstavuje endogénne biologické hodiny s rytmycitou procesov približne každých 24 hodín. U cicavcov je cirkadiánny kardiostimulátor umiestnený v suprachiazmatickom jadre (SCJ) predného hypotalamu. Existujú dôkazy, že cirkadiánne rytmy sa rozvíjajú prenatálne. Zistilo sa, že najmenej 12 génov sa podieľa na regulácii cirkadiánneho rytmu; napr. Cry1 je negatívny regulátor, zatiaľ čo Bmal1 je pozitívny regulátor. Tieto gény oscilujú nielen v SCJ, ale aj v periférnych tkanivách, ako sú pečeň, obličky, koža, ústna sliznica, fibroblasty a mononukleárne bunky periférnej krvi [23]. V nedávnej štúdii sa ukázalo, že 24-hodinová fototerapia modrým svetlom výrazne zvyšuje expresiu cirkadiánneho génu Cry1 a znižuje koncentrácie Bmal1 a plazmatického melatonínu. Počas fototerapie sú oči dieťaťa bežne prekryté, aby sa zabránilo poškodeniu sietnice. V dôsledku toho môže expozícia nonokulárneho svetla meniť expresiu cirkadiánnych génov v periférnych tkanivách človeka. Či takéto jemné zmeny expresie cirkadiánneho génu počas fototerapie môžu prechádzať do neonatálnych porúch správania, napr. zvýšený plač, nervozita, zmeny normálnej srdcovej frekvencie a krvného tlaku, ich cirkadiánneho vzoru alebo spánku, si vyžaduje ďalšie štúdie [26].
Úloha melatonínu, pri kontrole cirkadiánneho rytmu, bola podrobne skúmaná. Sérový melatonín je z veľkej časti produkovaný epifýzou. Jeho syntéza a sekrécia je ovplyvnená svetelnými podmienkami – svetlo znižuje a tma zvyšuje jeho produkciu. Melatonín je tiež známy ako „hormón tmy“. Vykonáva funkciu hodín a kalendára v tele. Spolu s antioxidačnými účinkami je melatonín biologickým modulátorom nálady, spánku, sexuálneho správania a cirkadiánneho rytmu. Znížená produkcia melatonínu a zmenená sekrécia nočného melatonínu sú spájané s rôznymi poruchami centrálneho nervového systému. Nízke hladiny melatonínu sa prejavili aj pri obezite, cukrovke, očných ochoreniach, imunitných ochoreniach [27]. Krátkodobé a dlhodobé účinky predĺženého osvetlenia celého tela u novorodencov počas fototerapie a ich vplyv na cirkadiánne rytmy, expresiu génov a funkciu melatonínu nie sú známe.
Fototerapia má preukázané účinky na produkciu melatonínu. Zostáva otázne, ako sa na týchto zmenách podieľa prekrytie očí dieťaťa okuliarmi na fototerapiu, čo ovplyvňuje syntézu melatonínu prostredníctvom vizuálnych fotoreceptorov a na druhej strane stimulácia nonvizuálnych fotoreceptorov v hlbokých štruktúrach mozgu evokovaná modrým svetlom fototerapeutickej lampy [26]. Počas fototerapie možno veľmi často pozorovať zmeny v správaní novorodencov v zmysle zvýšenej dráždivosti, nervozity a plaču, čo sme kazuisticky pozorovali aj v našom súbore pacientov. Tieto zmeny môžu byť spôsobené práve zmenou cirkadiánneho rytmu ovplyvneného melatonínom. Na druhej strane, zmeny v produkcii tohto hormónu sa zaznamenali až po 24-hodinovej expozícii modrému svetlu [26].
Ďalším možným vysvetlením zmien správania novorodencov je odlúčenie od matky, stresujúce prostredie, nepohodlie pri prekrytí očí okuliarmi na fototerapiu. Pri meraní záznamu aEEG boli v našom prípade elektródy umiestnené na čelo novorodenca a snímali predominantne prefrontálnu kôrovú oblasť. Táto časť mozgovej kôry je zodpovedná za behaviorálne funkcie – nálada, správanie, súdnosť, emocionálne reakcie. K zmene správania došlo u detí až počas druhého merania po zapnutí fototerapeutickej lampy. Pritom dieťa bolo počas prvého merania rovnako odlúčené od matky a oči malo prekryté pre zachovanie identických podmienok. Na aEEG zázname v našom súbore pacientov počas fototerapie nedošlo k zmenám aktivity mozgu na úrovni kôry a nezistili sme koreláciu medzi zmenou správania dieťaťa, hyperbilirubinémiou, fototerapiou a elektrickou kôrovou aktivitou.
ZÁVER
Hyperbilirubinémia pri použití konvenčnej elektroencefalografie potláča elektrickú aktivitu mozgovej kôry [22]. Fototerapia má preukázateľný efekt na viaceré fyziologické funkcie v organizme novorodenca. Jej pôsobenie na podkôrové centrá centrálneho nervového systému bolo dokázané prostredníctvom ovplyvnenia autonómneho nervového systému, kde dochádza k zmenám vo variabilite srdcovej frekvencie a k zmenám variability krvného tlaku [28]. Efekt fototerapie a hyperbilirubinémie na kôrovej úrovni zaznamenanej prostredníctvom amplitúdového EEG sme nepotvrdili.
Skratky:
aEEG – amplitúdová elektroencefalografia
CNS – centrálny nervový systém
SWC – sleep wake cycle
SJC – suprachiazmatické jadro
MUDr. Zuzana Zimová
Neonatologická klinika
Jesseniova lekárska fakulta v Martine
Univerzita Komenského v Bratislave
Univerzitná nemocnica Martin
Kollárova 2
036 01 Martin
Slovenská republika
e-mail: zuzina.zimova@gmail.com
Sources
1. Hellstrom-Westas L, DeVries LS, Greisen G. Amplitude-integrated EEG classification and interpretation in preterm and term infants. Neoreviews 2006; 7 (2): 76–87.
2. Yurdakök M. Phototherapy in the newborn: what’s new? JPNIM 2015; 4 (2): 1–26.
3. El-Dib M, Massaro AN, Glass P, et al. Early amplitude integrated EEG and outcome of very low birth weight infants. Pediatr Int 2011; 53 (3): 315–321.
4. El-Dib M, Chang T, Tsuchida TN, et al. Amplitude - integrated electroencephalography in neonates. Pediatr Neurol 2009; 41 (5): 315–326.
5. Reenie JM, Chorley G, Boylan G, et al. Non-expert use of the cerebral function monitor for neonatal seizure detection. Arch Dis Child Fetal Neonatal 2004; 89 (1): 37–40.
6. Toet MC, Lemmers PMA. Brain monitoring in neonates. Early Hum Dev 2009; 85 (2): 77–84.
7. Kidokoro H, Kubota T, Hayashi N, et al. Absent cyclicity on aEEG within the first 24 h is associated with brain damage in preterm infants. Neuropediatrics 2010; 41 (6): 241–245.
8. Osredkar D, Toet MC, van Rooij LG, et al. Sleep-wake cycling on amplitude-integrated electroencephalography in term newborns with hypoxic - ischemic encephalopathy. Pediatrics 2005; 115 (2): 327–332.
9. Van Rooij LG, Toet M, Osredkar D, et al. Recovery of amplitude integrated electroencephalographic background patterns within 24 h of perinatal asphyxia. Arch Dis Child Fetal Neonatal Ed 2005; 90 (3): 245–251.
10. Casnocha-Lucanova L, Matasova K, Zibolen M, et al. Accuracy of transcutaneous bilirubin measurement in newborns after phototherapy. J Perinatol 2016; 36 (10): 858–861.
11. Parashari UC, Singh R, Yadav R, et al. Changes in the globus pallidus in chronic kernicterus. J Pediatr Neurosci 2009; 4 (2): 117–119.
12. Gürses D, Kiliç I, Sahiner T, et al. Effects of hyperbilirubinemia on cerebrocortical electrical activity in newborns. Pediatr Res 2002; 52 (1): 125–130.
13. Matasova K, Zibolen M, Čiljak M, et al. Spoľahlivosť neinvazívnaho merania koncentrácie bilirubínu u zdravých novorodencov. Čes-slov Pediat 2005; 60 (11): 599–605.
14. Matasova K. Neonatológia 1. Bratislava: Univerzita Komenského, 2012 : 1–155.
15. Raimondi F, Crivaro V, Capasso L, et al. Unconjugated bilirubin modulates the intestinal epithelial barrier function in a human-derived in vitro model. Pediatr Res 2006; 60 (1): 30–33.
16. Szucs KA, Rosenman MB. Family-centered, evidence-based phototherapy delivery. Pediatr 2013; 131 (6): 1982–1985.
17. Morris BH, Oh W, Tyson JE, et al. Aggressive vs. conservative phototherapy for infants with extremely low birth weight. N Engl J Med 2008; 359 (18): 1885–1896.
18. Demova K. Liecba novorodencov s patologickou nekonjugovanou hyperbilirubinemiou. http://slovenskaneonatologia.sk/wp-content/uploads/2017/04/Ovori%C5%A5-lie%C4%8Dbu-novorodencov-s-nekonjugovanou-hyperbilirubin%C3%A9miiou.pdf.
19. Burdjalov VF, Baumgart S, Spitzer AR. Cerebral function monitoring: a new scoring system for the evaluation of brain maturation in neonates. Pediatrics 2003; 112 : 855–861.
20. Hellstrom-Westas L, DeVries LS, Rosen I. Atlas of amplitude-integrated EEGs in the newborn. 2nd ed. London, UK: Informa Health Care, 2008 : 1–187.
21. Foreman SW, Thorngate L, Burr LR, et al. Electrode challenges in amplitude-integrated EEG: research application of a novel noninvasive measure of brain function in preterm infants. Biol Res Nurs 2011; 13 (3): 251–259.
22. Wennberg RP, Hance J. Experimental bilirubin encephalopathy: importance of total bilirubin, protein binding, and blood-brain barrier. Pediatr Res 1986; 20 (8): 789–792.
23. Tedford CE, DeLapp S, Jacques S, et al. Quantitative analysis of transcranial and intraparenchymal light penetration in human cadaver brain tissue. Lasers Surg Med 2015; 47 (4): 312–322.
24. Vigh B, Manzano MJ, Zádori A, et al. Nonvisual photoreceptors of the deep brain, pineal organs and retina. Histol Histopathol 2002; 17 (2): 555–590.
25. Fernandes AM, Fero K, Driever W, et al. Enlightening the brain: linking deep brain photoreception with behavior and physiology. Bioessays 2013; 35 (9): 775–779.
26. Chen A, Du L, Xu Y, et al. The effect of blue light exposure on the expression of circadian genes: bmal1 and cryptochrome 1 in peripheral blood mononuclear cells of jaundiced neonates. Pediatr Res 2005; 58 (6): 1180–1184.
27. Singh M, Jadhav HR. Melatonin: functions and ligands. Drug Discov Today 2014; 19 (9): 1410–1418.
28. Uhrikova Z, Zibolen M, Javorka K, et al. Hyperbilirubinemia and phototherapy in newborns: Effects on cardiac autonomic control. Early Hum Dev 2015; 91 (6): 351–356
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2018 Issue 1-
All articles in this issue
- Výsledky péče o extrémně nezralé novorozence v České neonatologické síti
- Přínos inflačního manévru ke zlepšení poporodní stabilizace extrémně nezralých novorozenců porozených v šedé zóně
- Hodnotenie elektrickej kôrovej aktivity pomocou amplitúdovej elektroncefalografie u donosených novorodencov počas fototerapie
- Pneumotorax novorodencov – incidencia a rizikové faktory
-
Včasná intervencia pri ochorení diabetes mellitus 1. typu z hľadiska úrovne metabolickej kompenzácie a využívania inštrumentálnej sociálnej opory
Sociálno-psychologické dôsledky včasnej intervencie u detí s diabetes mellitus 1. typu - Spalničky v dětském věku – zkušenost z epidemie na Ostravsku v roce 2017
- Co se může skrývat za diagnózou erythema nodosum
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Co se může skrývat za diagnózou erythema nodosum
- Pneumotorax novorodencov – incidencia a rizikové faktory
- Výsledky péče o extrémně nezralé novorozence v České neonatologické síti
- Spalničky v dětském věku – zkušenost z epidemie na Ostravsku v roce 2017
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

