-
Medical journals
- Career
Léčba dětí s hemofilií v České republice
Authors: J. Blatný; P. Ovesná
Authors‘ workplace: Institut biostatistiky a analýz, Lékařská fakulta Masarykovy univerzity, Brno ; Oddělení dětské hematologie, FN Brno a Lékařská fakulta Masarykovy univerzity, Brno
Published in: Čes-slov Pediat 2017; 72 (3): 148-153.
Category:
Overview
Hemofilie je vzácné, ale závažné onemocnění. Od druhé poloviny 20. století se rozvinuly možnosti jeho léčby do té míry, že z onemocnění smrtícího v druhé dekádě věku se stala choroba, kterou lze mít velmi dobře pod kontrolou. V České republice je léčba hemofilie garantována Českým národním hemofilickým programem, který sdružuje centra, jež se léčbou hemofilie zabývají.
Léčba hemofilie je komplexní, mezioborová. Data o ní jsou shromažďována v registru ČNHP. V roce 2015 bylo v ČR registrováno 246 dětí s hemofilií. Díky léčbě, která je jim poskytována, je medián počtu krvácení i u těžké formy nemoci jen 3/rok. Všem dětem je nabízena domácí léčba a všechny, které to potřebují, jsou léčeny profylakticky. Žádné dítě v ČR není infikováno virem HIV ani hepatitidou C. Ty děti, u nichž dojde k rozvoji inhibitoru, jsou léčeny imunotoleranční léčbou. I přes současnou dobrou úroveň péče o děti s hemofilií v naší zemi však nelze její rizika podceňovat.KLÍČOVÁ SLOVA:
hemofilie, inhibitor, krvácení, profylaxeHISTORIE
Hemofilie je onemocnění známé lidem od nepaměti, byť název „hemofilie“ použil poprvé až Schoenlein v roce 1820. Již v Talmudu je uvedeno, že se malým chlapcům nesmí provádět obřízka, pakliže jejich dva bratři po tomto zákroku zemřeli. Hemofilií trpělo s jistotou či pravděpodobně i mnoho slavných osobností. Uvažuje se dokonce, že ztrpčovala život i Čingischánovi. Nejznámější rodinou spojovanou s hemofilií (v daném případě s hemofilií B) byla pak rodina anglické královny Viktorie, jejíž děti a vnoučata ji rozsely do mnoha evropských šlechtických rodin. Skrze careviče Alexeje, syna posledního ruského cara Mikuláše II. a jeho ženy Alexandry Fjodorovny, pak hemofilie zasáhla i dějiny Ruska a mnozí spekulují, že měla i podíl na politických změnách a tedy nepřímo přispěla k vítězství komunismu v této zemi. (Mimo jiné i hemofilií těžce zkoušená carská rodina pravděpodobně podcenila závažnost dané historické situace.) To jsou však spekulace, zaměřme se spíše na jednoznačná fakta…
Hemofilie A je dědičný nedostatek/chybění koagulačního FVIII, hemofilie B pak FIX. Název hemofilie C pro nedostatek FXI se již nepoužívá. Incidence hemofilie A je cca 1 : 5000 narozených chlapců, hemofilie B pak cca 1 : 30 000 narozených chlapců. Hemofilií trpí po výtce muži, ženy postižený gen nesou (přenašečky), ale většinou nemají příznaky nemoci. Dědičnost této choroby je gonozomálně recesivní. Všechny dcery postiženého muže jsou přenašečky a všichni jeho synové jsou zdraví. 50 % synů přenašečky jsou hemofilici a 50 % jejich dcer jsou přenašečky.
Jak bylo již řečeno, pojem hemofilie se začal používat až v první polovině 19. století. V roce 1893 bylo poprvé popsáno, že osoby s hemofilií mají prodloužený čas srážení plné krve. Následně bylo zjištěno, že se tento čas normalizuje přidáním krve zdravého jedince. Deficit FVIII jako příčina hemofilie A byl odhalen v roce 1947 a o pět let později byla identifikována i příčina hemofilie B. Začátek průmyslové výroby koncentrátů koagulačních faktorů lze datovat do roku 1965.
KLINICKÉ PROJEVY HEMOFILIE
Co je podstatou krvácení při hemofilii? Stejně jako u zdravého, i u hemofilika je příčinou krvácení poškozená céva. I krvácení, která nazýváme spontánními, nejsou ničím jiným než drobným úrazem či mikrotraumatem, kterého by si zdravý člověk buď ani nevšiml, nebo by mu nepřikládal pozornost, neboť dobře fungující hemostatický systém by rozvoji krvácení zabránil dříve, než by se stačilo klinicky projevit. Hemofilik tedy nekrvácí více než zdravý člověk, ale krvácí déle. Primární hemostáza u hemofilika funguje v podstatě normálně. Dojde tak k tvorbě primární hemostatické (destičkové) zátky. Nedostatek či chybění daného faktoru krevního srážení nicméně nedovolí vzniknout dostatečně pevné fibrinové sraženině a tak nevznikne ani dostatečně pevná definitivní fibrinová zátka. Protože deficit faktoru rovněž zvyšuje fibrinolýzu, je nekvalitní zátka navíc dříve resorbována.
Podle zbytkové hladiny/aktivity postiženého faktoru se hemofilie dělí na těžkou formu (pod 1 IU/dl), střední formu (1–5 IU/dl) a lehkou formu (5–40 IU/dl). Zatímco osoby s lehkou formou často nemusí po dlouhou dobu o své nemoci ani vědět, osoby s těžkou formou onemocnění mají četná „spontánní“ krvácení. Nejčastější jsou u hemofilie krvácení do kloubů a svalů, nejzávažnější jsou pak krvácení do CNS, případně do zažívacího traktu. Bez léčby osoby s těžkou hemofilií mívaly desítky až stovky krvácení ročně a umíraly většinou ve druhé dekádě života, v té době již upoutány na invalidní vozík.
Hemofilický kloub
Nejčastějším místem, kam osoby s hemofilií krvácí, je kloubní dutina. Nejvíce jsou postiženy kotníky, kolena a lokty [1]. Při krvácení dochází k opakované depozici krve do kloubu. Bez následku si organismus poradí s maximálně 2–3 krváceními do stejného kloubu za rok [2]. Jsou-li krvácení častější, dochází k progresivní depozici železa v kloubu, k rozvoji chronického zánětu kloubní výstelky (synovie), která se stává křehčí a zbytnělou a tím se dále zvyšuje pravděpodobnost opakovaného krvácení. Bludný kruh se uzavírá a vzniká tzv. hemofilická artropatie. Klouby, do kterých hemofilik krvácí nejčastěji (2 a vícekrát za 3 měsíce nebo 4x během 6 po sobě jdoucích měsíců), nazýváme cílovými klouby [3], viz obrázek 1.
Image 1. Dítě s hemofilií A, rozvinutou hemofilickou artropatií a cílovými klouby (laskavostí archivu prim. MUDr. V. Komrsky, CSc., a prof. O. Hrodka, DrSc., FN Motol, Praha). 
Léčba
První léčebné snahy spočívaly v léčbě podpůrné. Ta měla žádný nebo nedostatečný efekt. Snad právě s výjimkou již zmíněného careviče Alexeje. Ruský mnich Rasputin získal velký vliv na carském dvoře mimo jiné proto, že mladému careviči dokázal pomoci. Mladý Romanovec měl pochopitelně přístup k nejmodernější léčbě své doby. Byl mu tak, na tišení bolestí plynoucích z opakovaných kloubních krvácení, podáván i tehdy nově objevený lék – aspirin. Rasputin prý po svém příchodu ke dvoru careviči veškeré léky zakázal používat. Tím paradoxně přispěl ke zmírnění krvácení a tak mu nejspíše opravdu pomohl. O nežádoucích účincích kyseliny acetylsalicylové na krvácení u hemofilie neměl tehdy nikdo potuchy.
Moderní léčba hemofilie byla založena na poznatku, že přidání plné krve nebo plazmy zdravých jedinců k plazmě osoby s hemofilií koriguje prodloužený čas krvácení. Ve třicátých letech minulého století pak byly započaty první klinické léčebné pokusy s podáváním transfuze plné krve hemofilikům. Objev kryoprecipitátu v roce 1964 pak umožnil počátek opravdové, klinicky použitelné léčby hemofilie (kryoprecipitát/kryoprotein – frakce lidské plazmy obsahující především FVIII, fibrinogen, von Willebrandův faktor a FXIII). V roce 1965 byl poprvé použit koncentrát obsahující pouze FVIII a VWF. S hemofilií je nerozlučně spjata choroba AIDS. V 80. letech se velká část celosvětové populace hemofiliků nakazila virem HIV, přeneseným koncentráty faktorů vyrobenými z krve nakažených dárců. Tehdejšímu Československu se tato epidemie téměř vyhnula, protože přes „železnou oponu“ se virus, ani léky jím kontaminované, nedostaly. Po tragédii, kterou vyvolalo celosvětové rozšíření infekce virem HIV, se výroba koncentrátů faktorů krevního srážení stávala stále bezpečnější. Zvýšila se čistota preparátů a byly vloženy kroky k inaktivaci virů. V roce 1985 byly klonovány geny pro FVIII/FIX a v roce 1989 byl poprvé použit rekombinantní FVIII. rFIX následoval nedlouho poté.
V našich podmínkách však byly ČZP (čerstvě zmra-žená plazma) a kryoprecipitát používány až do 90. let 20. století, neboť dřívější politický režim nedovolovat import zahraničních léků. Bylo to frustrující pro pacienty i zdravotníky. Věděli jsme, jak lépe léčit, ale nebylo to možné. Se změnou režimu se však rychle změnily i léčebné možnosti a od druhé poloviny 90. let jsou koncentráty faktorů krevního srážení používány i u nás.
Profylaxe a léčba „on-demand“
V 60. a 70. letech minulého století přišla švédská profesorka Inga Marie Nilssonová s revoluční myšlenkou profylaxe u osob s hemofilií. Se svým týmem si všimla, že osoby se střední hemofilií (tedy s hladinou trvale nad 1 %) mají významně méně krvácení než osoby s těžkou formou. Prokázala, že opakovaným podáváním chybějícího faktoru do žíly pacienta lze dosáhnout trvalého navýšení postiženého faktoru nad 1 % aktivity a tak zabránit téměř všem spontánním a velké části traumatických krvácení. Byl tak položen základ profylaktické léčby [4], která je dnes považována za zlatý standard. Benefit profylaxe následně potvrdily i mnohé další studie, včetně velmi recentních, randomizovaných [5]. Profylaxi v současné době dělíme na primární (zahájena před rozvojem postižení pohybového aparátu, většinou ne později než po prvním kloubním krvácení a před ukončeným druhým rokem života), profylaxi sekundární (profylaxe zahájena později než primární) a terciální profylaxi (profylaxe u dospělých s již rozvinutým poškozením pohybového aparátu) [6, 7]. Osoby s hemofilií, které nejsou léčeny profylakticky – ať již proto, že k tomu nejsou indikovány, nebo z jiných důvodů – jsou léčeny až při krvácení (léčba „on demand“).Léčba „on-demand“ však již jen léčí vzniklá krvácení a zmírňuje jejich následky. Není jim pochopitelně schopna předcházet.
Nejzávažnější komplikací léčby je rozvoj tzv. „inhibitorů“. Jedná se o neutralizující protilátky, které se vytvoří jako reakce na léčebně podávané koncentráty faktoru. Častější je u hemofilie A, u hemofilie B je vzácná. Nejčastěji se inhibitory objeví u PUPs (Previously Untreated Patients) s těžkou hemofilií A v průběhu prvních 20–100 ED (expozičních dní) [8]. Jejich incidence v této skupině pacientů je udávána mezi 20–35 %. V ČR je incidence inhibitorů 26,2 % [9], patříme tak k zemím s nižším výskytem této komplikace. Existuje mnoho faktorů, které se mohou na vzniku inhibitorů podílet. Některé jsou genetické, jiné získané a lze je ovlivnit. Uvažovalo se například o tom, že léčba rekombinantními preparáty je jedním z rizikových faktorů. Nebylo to prokázáno, ale diskuse na toto téma stále probíhá [10]. Dítě, u kterého k rozvoji inhibitorů dojde, je indikováno k imunotoleranční léčbě (ITT – Immune Tolerance Treatment), jejímž cílem je inhibitor definitivně eliminovat [11].
Hodnocení léčby a skórovací systémy
Základním parametrem, který lze použít ke sledování a hodnocení léčby hemofilie, je počet krvácení za rok (ABR – annual bleeding rate). Ideálem je, aby ABR bylo nižší než dva, alespoň pokud se týká kloubních krvácení. Pro celkové hodnocení pohybového aparátu – a tím nepřímo k hodnocení efektu léčby – lze použít i různé skórovací systémy. U dospělých jsou stále rozšířena skóre založená na rentgenologickém vyšetření (Pettersonovo score a Hilgatnerovo score) [12], u dětí pak HJHS (Haemophilia Joint Health Score) posuzující hybnost kloubů (nejčastěji bývá hodnoceno fyzioterapeutem) [13] a/nebo IPSG score založené na vyšetření šesti nejčastěji postižených kloubů magnetickou rezonancí [14]. K hodnocení léčby hemofiliků patří také posouzení kvality života (např. Hem-A-QoL [15] a další).
Systém hemofilické péče v ČR
V naší zemi je systém péče o osoby s hemofilií dvoustupňový a probíhá na platformě Českého národního hemofilického programu (ČNHP, www.cnhp.cz). Pokud se týká pediatrické hemofilické péče, existuje 5 hemofilických léčebných center (HTC – Haemophilia Treatment Centres) v Plzni, Českých Budějovicích, Ústí nad Labem, Hradci Králové a Olomouci a 3 komplexní hemofilická centra (CCC – Comprehensive Care Centres) v Praze, Brně a Ostravě. Všechna centra podstupují pravidelný audit Českou hematologickou společností a ČNHP, komplexní centra navíc i audit v rámci CVSHP (Centra vysoce specializované hematologické péče) pod záštitou MZ ČR. Některá z uvedených center jsou rovněž certifikována na evropské úrovni (www.EUHANET.org). Dětská centra jsou navíc sdružena v rámci Pracovní skupiny pro dětskou hematologii (PSDH).
Český národní hemofilický program (ČNHP)
Od konce minulého století začala centra sdružená v PSDH systematicky shromažďovat data o léčbě dětí s hemofilií. Na základě tohoto pilotního projektu pak v roce 2007 vznikl ČNHP. Toto mezioborové grémium odborníků sdružuje na národní úrovni všechna pediatrická a většinu dospělých center zabývajících se léčbou hemofilie a podobných onemocnění. Ve spolupráci s odbornými společnostmi (zejména Českou hematologickou společností, Českou pediatrickou společnost a Českou společností pro trombózu a hemostázu ČLS JEP) metodicky vede a koordinuje léčbu těchto chorob v České republice. Pro diagnostiku a léčbu hemofilie rovněž ČNHP připravuje a vydává konsensuální odborná doporučení [16, 17, 18] (více na stránkách http://cnhp.registry.cz/index.php?pg=guidelines).
Registr ČNHP
Registr ČNHP je založen na elektronickém systému pro sběr dat CLADE-IS (Clinical Data Warehousing Information System). Do registru jsou implementovány validace, které zajišťují kvalitu sbíraných dat. Lékaři a zadavatelé přistupují do registru zabezpečenou cestou přes webový prohlížeč. Vložená data jsou vyhodnocována na roční bázi v Institutu biostatistiky a analýz LF MU, který pro ČNHP registr spravuje.
Současný stav péče o děti s hemofilií v ČR (data registru ČNHP za rok 2015)
V České republice jsou k léčbě osob s hemofilií používány koncentráty faktorů krevního srážení vyrobené z plazmy dárců (plazmatické koncentráty), nebo rekombinantní technologií (rekombinantní koncentráty). Pro osoby s lehkou formou hemofilie A lze použít i DDAVP, po jehož podání dojde k dočasnému zvýšení hladin FVIII v plazmě pacienta vyplavením jeho zásob [19].
V současné době jsou lékem volby pro (zejména nově diagnostikované) děti s hemofilií rekombinantní preparáty. Všem dětem s fenotypem těžké hemofilie je nabídnuta primární profylaxe, která typicky začíná kolem dovršeného prvního roku života. Léčba je vedena dle režimu Bremen//Munich [20] a je zahájena nízkou dávkou (cca 25 IU/kg FVIII u hemofilie A) 1x týdně. Podle klinických projevů se frekvence a následně i dávka zvyšuje, až je dosaženo standardního profylaktického dávkování 25–40 IU/kg 3x týdně u hemofilie A a 2x týdně u hemofilie B. Tento způsob nejen předchází poškození pohybového systému, ale zdá se, že je schopen snižovat i riziko vzniku inhibitorů u nově diagnostikovaných dětí s hemofilií A. S pomocí farmakokinetického vyšetření se snažíme individualizovat léčbu tak, abychom ji nastavili optimálně pro každé jednotlivé dítě [21]. Všechny děti mají možnost domácí léčby s cílem dosáhnout ABR kloubních krvácení <2. Léčba dětí s hemofilií je komplexní, mezioborová v duchu doporučení WFH (https://www.wfh.org/en/resources/wfh-treatment-guidelines) a Evropských principů hemofilické péče [22] a probíhá v dedikovaných hemofilických centrech.
V roce 2015 bylo v ČR registrováno 246 dětí s hemofilií (obr. 2), jejich průměrný věk se pohybuje kolem 10 let (obr. 3). Během roku 2015 došlo u 110 z nich (44,9 %) k 595 krvácením. Většina z krvácení (307) byla do kloubu. 135 dětí (55,1 %) nekrvácelo v roce 2015 ani jednou (obr. 4). Z dětí, které byly léčeny (138 dětí), jich většina (69,6 %) byla léčena rekombinantními koncentráty faktorů krevního srážení (obr. 5).
Image 2. Typ a tíže hemofilie u dětí v České republice. 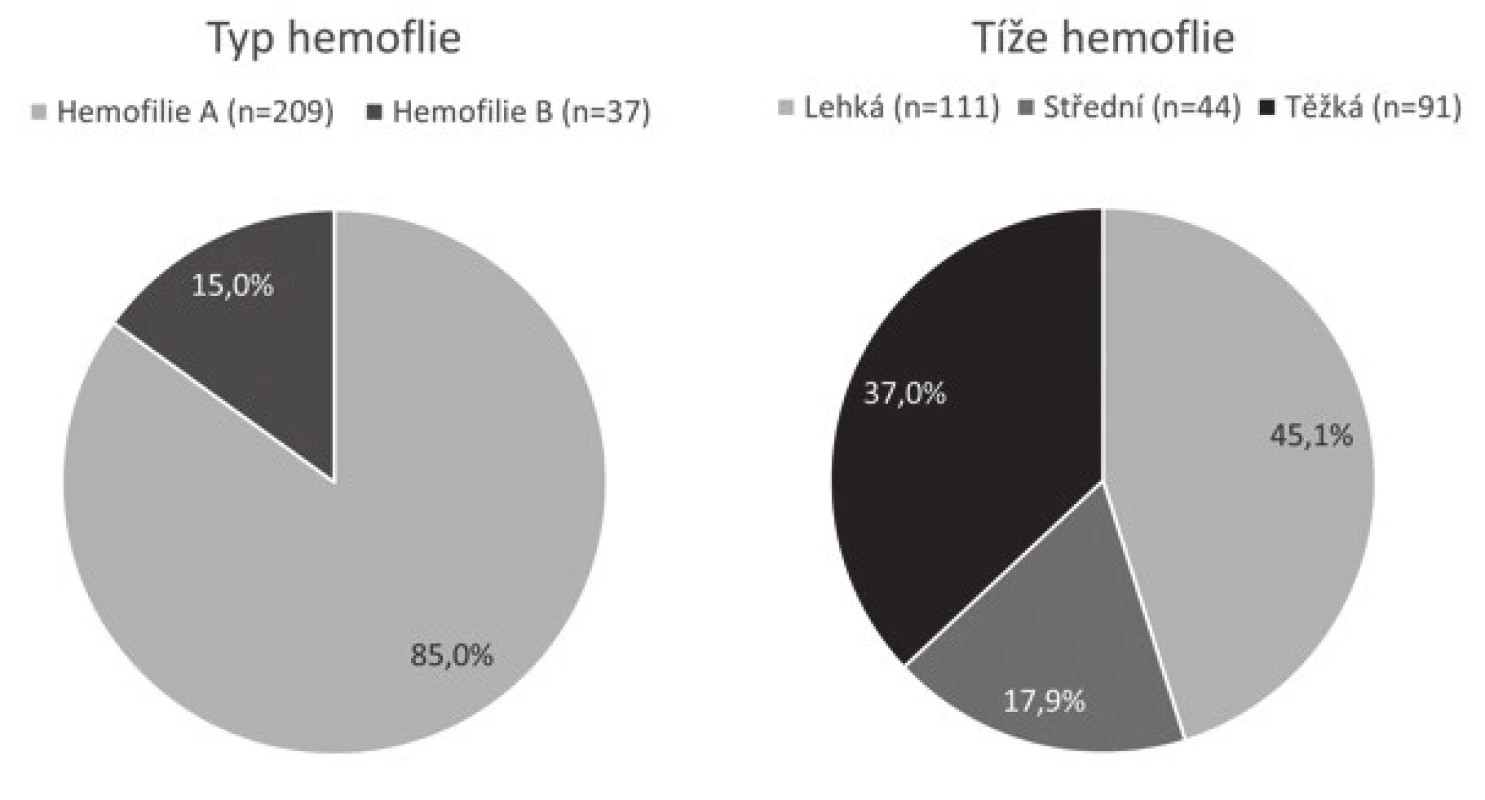
(85 % dětí trpí hemofilií A. Více než 1/3 ze všech dětí onemocní těžkou formou choroby. Tyto děti vyžadují většinu léčebné péče) Image 3. Aktuální věk dětí s hemofilií. 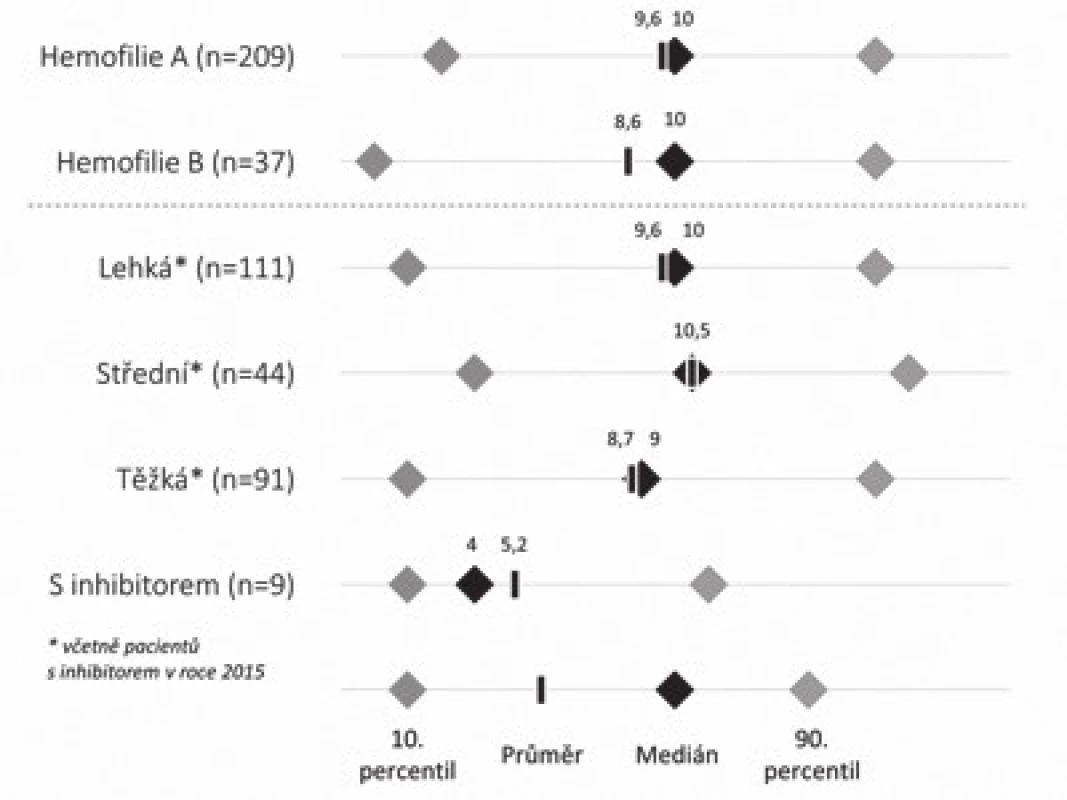
Medián věku dětí s hemofilií je v ČR cca 10 let. Děti s inhibitory jsou mladší, protože inhibitor se vyvíjí nejčastěji v průběhu druhého roku života a následně bývá zahájena imunotoleranční léčba trvající až 3 roky. Image 4. Lokalizace krvácení u dětí s hemofilií. 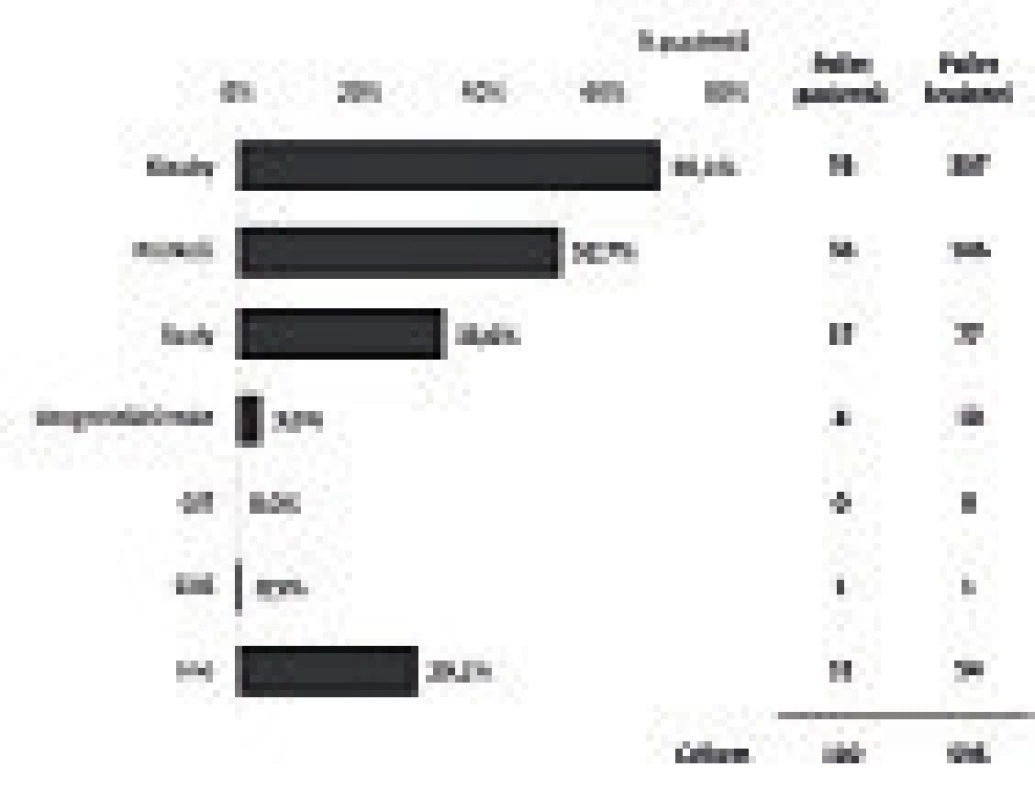
Děti nejčastěji krvácí do kloubů a svalů. Podkožní krvácení (většinou po drobných traumatech) jsou rovněž častá. Nejzávažnější jsou krvácení do CNS. Image 5. Léčba dětí s hemofilií. 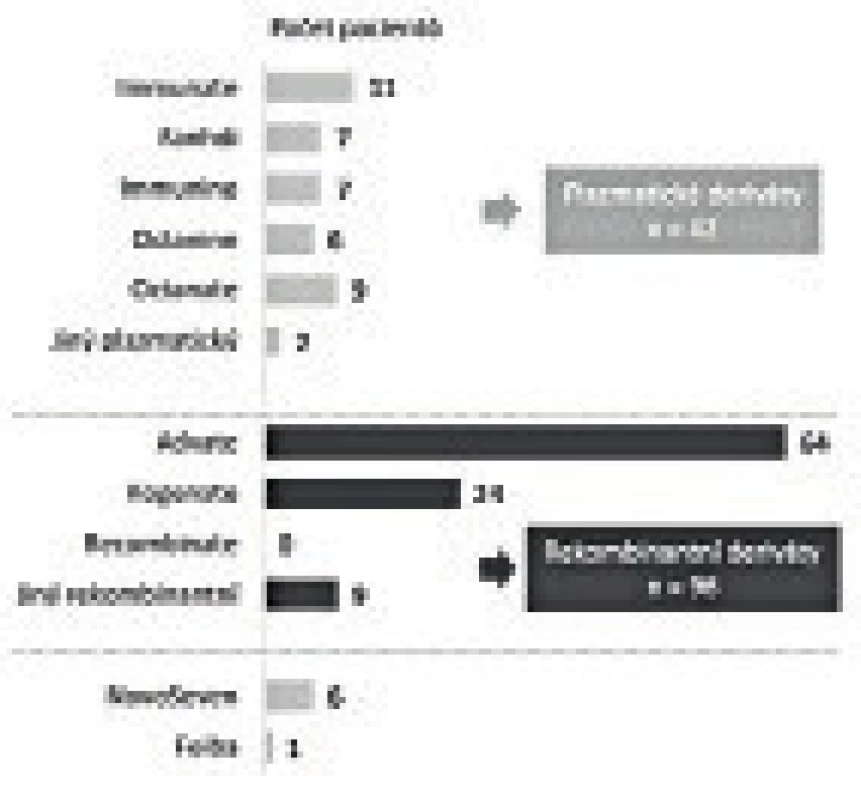
Léčbou volby dětí s hemofilií jsou v České republice rekombinantní deriváty. Při zvolené a výše popsané léčbě, jejímž základem je primární profylaxe u dětí s těžkou formou nemoci, byl medián počtu krvácení 3/rok. To, že medián ABR u dětí s těžkou hemofilií na profylaxi a bez ní není odlišný, lze interpretovat tak, že děti, které profylaxi potřebují, ji mají zavedenu. Pokud se týká počtu kloubních krvácení, pak u dětí s těžkou hemofilií na profylaxi je jeho medián 2/rok (tab. 1 a 2).
Table 1. ABR (Annual Bleeding Rate) českých dětí s hemofilií (A i B) v roce 2015. 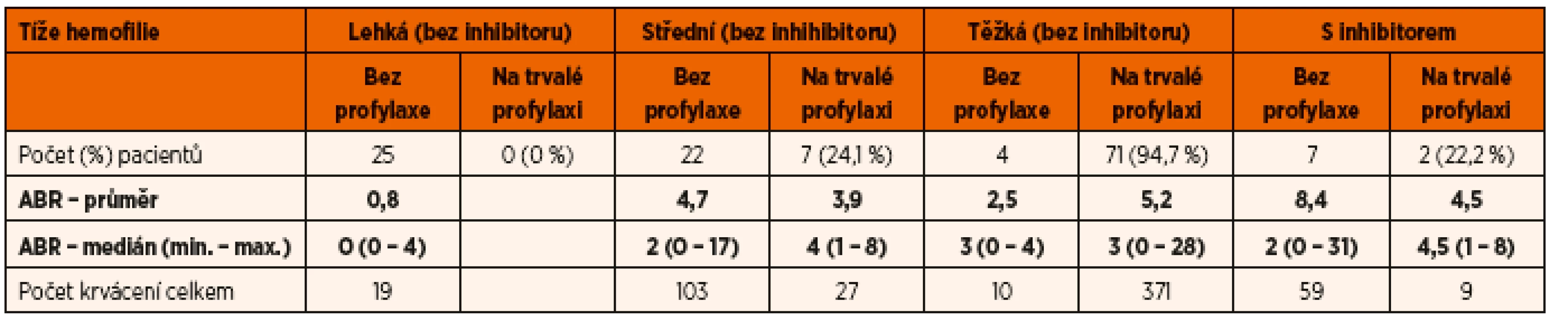
Poznámka: Díky profylaxi je medián počtu krvácení i u dětí s těžkou hemofilií 3/rok. Vyšší je u dětí s inhibitory. Ideálním cílem je zabránit všem krvácením. Table 2. Počet kloubních a mimokloubních krvácení u českých dětí s těžkou hemofilií (A i B) v roce 2015. 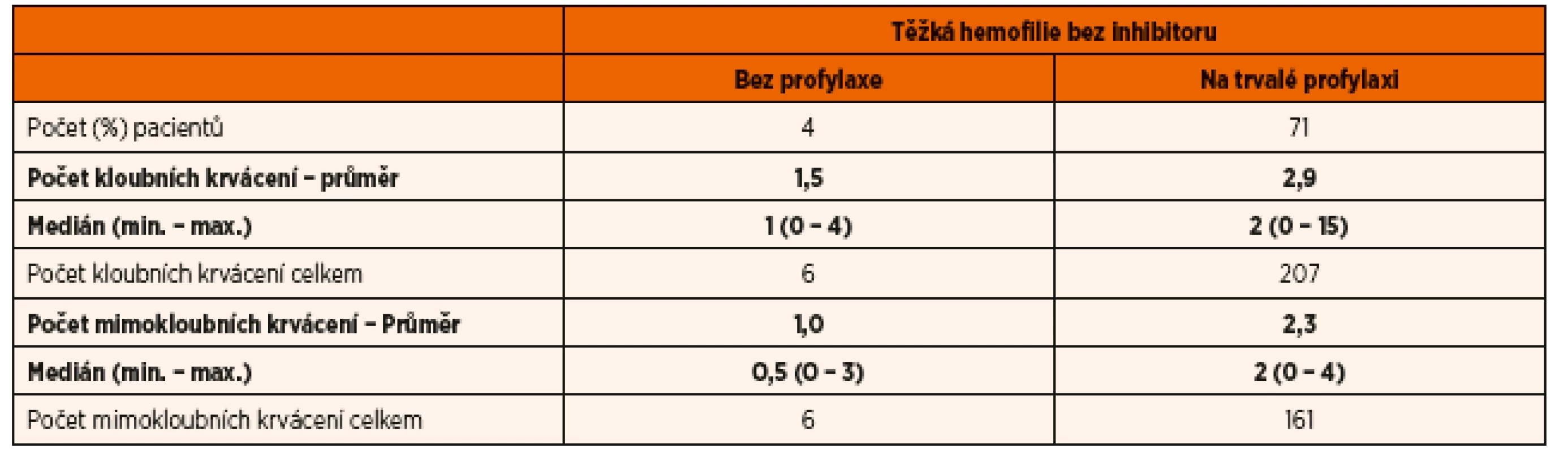
Poznámka: Medián počtu kloubních krvácení u dětí s těžkou hemofilií na profylaxi je 2/rok. Jsou však i pacienti, kteří i při profylaktické léčbě krvácí častěji. Žádné dítě s hemofilií v České republice není infikováno virem HIV ani virem hepatitis C. V roce 2015 bylo v ČR 9 dětí s inhibitory. Pět z nich bylo v roce 2015 léčeno imunotoleranční léčbou (ITT). Úspěšnost ITT je v ČR vyšší než 80 %.
BUDOUCNOST LÉČBY HEMOFILIE
V současné době probíhají klinické studie s koncentráty faktorů krevního srážení, které jsou modifikovány tak, aby byl prodloužen jejich biologický poločas. Pro léčbu hemofilie A se nebude jednat o změnu zásadní (poločas FVIII lze s ohledem na jeho vazbu s vWF (von Willebrandovým faktorem) prodloužit max. 1,5x), ale u hemofilie B se jedná o násobky původního poločasu [23]. Tím dojde k prodloužení intervalu mezi jednotlivými intravenózními aplikacemi léku, což významně zvýší kvalitu života dětí s hemofilií a jejich rodin. Cílem rovněž je, s použitím těchto preparátů, dosahovat vyšších hladin chybějícího faktoru v plazmě pacienta a tak zlepšit zejména efekt profylaktické léčby a zvýšit kvalitu života těchto dětí.
Již delší dobu se mluví také o tom, že „za rohem“ je léčba genetická. Nikdo však bohužel zatím neví, za jakým rohem na nás čeká. Tato definitivní a kurativní forma léčby hemofilie je nám zatím, z klinického pohledu, bohužel zřejmě ještě vzdálena, byť u hemofilie B se snad už blýská na lepší časy.
ZÁVĚR
Hemofilie je vzácná, ale závažná nemoc. Její včasná a kvalitní léčba, zejména v dětském věku, je základem a předpokladem jejího úspěchu. I když je v současné době v naší zemi na velmi dobré úrovni, nelze její rizika podceňovat. To, co bychom zanedbali v péči o dítě s hemofilií, by již v pozdějším věku nebylo možno napravit. Péče o děti s hemofilií patří do rukou zkušených mezioborových týmů v dedikovaných hemofilických centrech.
Poděkování
Poděkování patří všem lékařům, sestrám, laborantům, fyzioterapeutům, datamanažerům a ostatním pracovníkům dětských hemofilických center v České republice, bez jejichž podpory by nebylo možno data o léčbě hemofilie v naší zemi získat.
MUDr. Jan Blatný, Ph.D.
Oddělení dětské hematologie
Fakultní nemocnice Brno
Černopolní 9
613 00 Brno
e-mail: blatny.jan@fnbrno.cz
Sources
1. Oldenburg J. Optimal treatment strategies for hemophilia: achievements and limitations of current prophylactic regimens. Blood 2015; 125 (13): 2038–2044.
2. Gringeri A, Ewenstein B, Reiniger A. The burden of bleeding in haemophilia: is one bleed too many? Haemophilia 2014; 20 (4): 459–463.
3. Blanchette VS, Schrivastava A. Definitions in hemophilia: resolved and unresolved issues. Semin Thromb Hemost 2015; 41 (8): 819–825.
4. Nilsson IM, Blombäck M, Ahlberg A. Our experience in Sweden with prophylaxis on haemophilia. Bibl Haematol 1970; 34 : 111–124.
5. Manco-Johnson MJ, et al. Prophylaxis versus episodic treatment to prevent joint disease in boys with severe hemophilia. N Engl J Med 2007; 357 (6): 535–544.
6. Gringeri A, et al. Tertiary prophylaxis in adults: is there a rationale? Haemophilia 2012; 18 (5): 722–728.
7. Blanchette VS, Schrivastava A. Definitions in hemophilia: resolved and unresolved issues. Semin Thromb Hemost 2015; 41 (8): 819–825.
8. Haya S, et al. Inhibitors in haemophilia A: current management and open issues. Haemophilia 2007; 13 (Suppl 5): 52–60.
9. Blatný J, et al. Inhibitors incidence rate in Czech previously untreated patients with haemophilia A has not increased since introduction of recombinant factor VIII treatment in 2003. Blood Coagul Fibrinolysis 2015; 26 (6): 673–678.
10. Fischer K, Blatny J. Do the SIPPET study results apply to the patients I treat Haemophilia 2016; in press.
11. Rocino A, et al. Immune tolerance induction in patients with haemophilia a and inhibitors: effectiveness and cost analysis in an European Cohort (The ITER Study). Haemophilia 2016; 22 (1): 96–102.
12. De Kleijn P, Heijnen L, Van Meeteren NL. Clinimetric instruments to assess functional health status in patients with haemophilia: a literature review. Haemophilia 2002; 8 (3): 419–427.
13. Feldman BM, et al. The Haemophilia Joint Health Score (HJHS) international validation study. XXVIIIth International Congress of the World Federation of Hemophilia, Istanbul, Turkey. Haemophilia 2008; 14 (Suppl 2): 83.
14. Lundin B, et al. An MRI scale for assessment of haemophilic arthropathy from the International Prophylaxis Study Group. Haemophilia 2012; 18 : 962–970.
15. von Mackensen S, et al. Measurement properties of the Haem-A-QoL in haemophilia clinical trials. Haemophilia 2016; in press.
16. Smejkal P, et al. Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s vrozenou hemofilií a s inhibitorem FVIII/FIX. Transfuze Hematol dnes 2016; 22 (1): 44–54.
17. Hrdličková R, et al. Konsenzuální doporučení českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií. Transfuze Hematol dnes 2016; 22 (1): 39–43.
18. Smejkal P, et al. Diagnostika a léčba hemofilie. Transfuze Hematol dnes 2013, 19 (2): 100–114.
19. Svensson PJ, et al. Desmopressin in treatment of haematological disorders and in prevention of surgical bleeding. Blood Rev 2014; 28 (3): 95–102.
20. Kurnik K, Auerwald G, Kreuz W. Inhibitors and prophylaxis in paediatric haemophilia patients: focus on the German experience. Thromb Res 2014; 134 (Suppl 1): S27–32.
21. Blatný J, et al. Farmakokinetika jako nástroj k optimalizaci léčby osob s hemofilií. Transfuze Hematol dnes 2014; 20 (4): 103–106.
22. Colvin B, et al. European principles of haemophilia care. Haemophilia 2008; 14 (2): 361–374.
23. Peyvandi F, Gargiola I, Biguzzi E. Advances in the treatment of bleeding disorders. J Thromb Haemost 2016; 14 (11): 2095–2106.
Labels
Haematology Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2017 Issue 3-
All articles in this issue
- Pepsín v sekrétoch horných dýchacích ciest u detí ako marker extraezofágového refluxu
- Syndróm Cri du chat u novorodenca diabetickej matky
- Onemocnění v oblasti patelofemorálního kloubu u dětí
- Legg-Calvé-Perthesova choroba
- Infekcie RS vírusom u ľahko nezrelých (late preterm) novorodencov
- Febrilní křeče – informace pro rodiče
- Léčba dětí s hemofilií v České republice
- Kvalita života dětských hemofiliků v České republice – zkušenosti jednoho centra
- Riziko pozdní diagnózy hemofilie
- Korelácia rinoendoskopiou stanoveného stupňa hypertrofie adenoidných vegetácií so stupňom nosovej obštrukcie objektivizovaným rinomanometriou
- Vplyv adenoidných vegetácií a endoskopickej adenoidektómie na priechodnosť nosa u pediatrických pacientov
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Onemocnění v oblasti patelofemorálního kloubu u dětí
- Legg-Calvé-Perthesova choroba
- Pepsín v sekrétoch horných dýchacích ciest u detí ako marker extraezofágového refluxu
- Infekcie RS vírusom u ľahko nezrelých (late preterm) novorodencov
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

