-
Medical journals
- Career
Primární (autoimunitní) sklerozující cholangitida u pacienta s nespecifickým střevním zánětem
Authors: Ľ. Podracká; A. Šuláková
Authors‘ workplace: Klinika dětského lékařství, Fakultní nemocnice Ostrava-Poruba přednosta doc. MUDr. M. Hladík, Ph. D.
Published in: Čes-slov Pediat 2015; 70 (6): 329-332.
Category: Case Report
Overview
Primární sklerozující cholangitida (PSC) je chronické cholestatické onemocnění způsobené zánětem a následnou difuzní fibrotickou přestavbou extra a/nebo intrahepatálních žlučových cest, které vedou k cirhóze jater a jejich následnému selhání. Incidence a prevalence PSC u dětí není přesně známa, udává se 0,23 případů/100 000 pacientů, což je asi 5krát méně než u dospělých. Choroba je v 85 % případů u dětí spojena s nespecifickým střevním zánětem (IBD, inflammatory bowel disease). V případě, že je sklerozující cholangitida asociována s autoimunitním projevem nemoci, je nutné pomýšlet na overlap syndrom PSC/AIH (autoimunní hepatitida), tzv. autoimunní sklerozující cholangitidu (ASC). Zásadní diagnostickou metodou je cholangiogram (magnetická rezonance žlučových cest (MRCP) a histologické vyšetření jater.
Uvádíme případ 13letého chlapce vyšetřovaného pro hepatopatii. Elevace ALP, GMT, vysoké hodnoty IgG, cirkulujících imunokomplexů (CIK) a přítomnost ANCA (anti-neutrophil cytoplasmic antibodies) protilátek vedly k podezření na PSC. Jaterní biopsie potvrdila současnou přítomnost autoimunního zánětu a vedla k diagnóze overlap syndromu (autoimunní sklerozující cholangitidy). Při kolonoskopickém vyšetření bylo nalezeno postižení céka a Bauhinské chlopně a na MR enterografii i aborální části terminálního ilea. Histologické hodnocení potvrdilo přítomnost nespecifického střevního zánětu.Klíčová slova:
primární sklerozující cholangitida, overlap syndrom, nespecifický střevní zánět, cholestázaÚvod
Primární sklerozující cholangitida (PSC) je chronické cholestatické onemocnění způsobené zánětem a následnou difuzní fibrotickou přestavbou extra a/nebo intrahepatálních žlučových cest, které vedou k cirhóze jater a jejich následnému selhání [1]. Incidence a prevalence PSC u dětí není přesně známá, udává se 0,23 případů/100 000 pacientů, což je asi 5krát méně než u dospělých [2]. PSC je u dětí spojována s některými chorobami, jako jsou histiocytóza z Langerhansových buněk, cystická fibróza, některé primární či sekundární imunodeficity, psoriáza, trauma, tumor, hemolyticko-uremický syndrom, srpkovitá anémie či portální biliopatie. V těchto případech mluvíme o tzv. „asociované“ neboli sekundární sklerozující cholangitidě. O PSC, u které je žlučový systém postižen primárně na podkladě imunopatologického procesu, hovoříme až po vyloučení výše uvedených onemocnění. PSC je u dětí na rozdíl od dospělých často provázena klinickými, laboratorními i histologickými znaky, které jsou charakteristické pro autoimunitní hepatitidu. V těchto případech se jedná o překryvný (overlap) syndrom PSC/AIH, tzv. autoimunitní sklerozující cholangitidu (ASC) [3, 4].
Klinický obraz je většinou nespecifický, objevují se únava, slabost, bolesti břicha, hmotnostní úbytek, pruritus a nechutenství [5]. Průměrný věk pacientů je 13–14 let, u PSC převažují chlapci v poměru 2 : 1, v případě ASC je poměr vyrovnán [6, 7].
Choroba je ve většině případů spojena s nespecifickým střevním zánětem (IBD, inflammatory bowel disease). Onemocnění (PSC-IBD) se nejčastěji manifestuje ulcerózní kolitidou (UC, 85–94 %) s mírným průběhem a dominantním postižením pravého kolon [8]. Pouze asi 4 % nemocných s UC trpí současně PSC [11]. Kolitida předcházející PSC (IBD → PSC) se projeví spíše pankolitidou, zatímco PSC předcházející IBD (PSC → IBD) izolovaným postižením pravého kolon [9]. Typickým znakem je současné postižení terminálního ilea („backwash“ ileitida) charakterizované inflamací ilea při zánětlivém postižení céka. Dalším typickým znakem je současné ušetření rekta („rectal sparing“) [10].
Kazuistika
Uvádíme případ 13letého chlapce, který byl vyšetřován pro podezření na autoimunní hepatitidu. Jeho rodinná i osobní anamnéza byla negativní a nemocnost byla nízká.
V srpnu 2013 byl chlapec vyšetřen pediatrem pro bolesti v mezogastriu a subfebrilie, které přetrvávaly po proběhlém respiračním infektu. Opakovaně byla zachycena zvýšená hodnota aminotransferáz (ALT 2,98 mkat/l, AST 0,99 mkat/l) i GMT 4,78 mkat/l. Při pátrání po příčině hepatopatie byly vyšetřeny virové hepatitidy A, B, C i panel herpetických virů s negativním nálezem. V základním imunologickém screeningu byla zachycena vyšší hodnota cirkulujících imunokomplexů (CIK) a pozitivita ANCA (anti-neutrophil cytoplasmic antibodies) protilátek. Chlapec byl odeslán do spádové gastroenterologické ambulance. Zde byla potvrzena elevace aminotransferáz, ceruloplazmin, alfa 1 antitrypsin, svalové enzymy, hodnoty železa i feritinu v séru byly v normě.
Chlapec byl odeslán v lednu 2014 na naši kliniku k jaterní biopsii. V tuto dobu měl nadále zvýšené aminotransferázy i markery cholestázy, proteosyntetická funkce jater byla v normě (ALT 1,65 mkat/l, AST 0,93 mkat/l, ALP 6,82 mkat/l, GMT 4,5 mkat/l, bilirubin 9,1 mmol/l, INR 1,07). V imunologickém screeningu bylo hraničně vyšší IgG 15,7 g/l, CIK 81 arb. j.(norma do 47 arb. j.) a pozitivní ANA (anti-nuclear antibodies) a ANCA protilátky. V klinickém obraze dominovala občasná bolest břicha, jinak byl chlapec bez potíží. Ikterus ani pruritus nebyl u chlapce pozorován.
Po přípravě byla provedena jaterní biopsie. Vzhledem k podezření na PSC a intermitentním bolestem břicha jsme doplnili endoskopické vyšetření trávicího traktu. Při kolonoskopii bylo zjištěno zánětlivé postižení céka a Bauhinské chlopně s nálezem zarudlé sliznice s vymizelou cévní kresbou a edématózní Bauhinskou chlopní, terminální ileum se nepodařilo intubovat. Nález při gastroduodenoskopii byl bez patologie. Doplnili jsme vyšetření o MR (magnetickou rezonanci) enterografii, na které bylo popsáno zesílení stěny aborálního úseku terminálního ilea v délce do cca 5 cm. Histologický nález disperzní kulatobuněčné celulizace místy splývající, s porušenou architektonikou krypt, mírnou fibrotizací v lamina propria, s lymfocytárními shluky se zárodečnými centry v intersticiu a neutrofily penetrujícími do krypt byl suspektní z Crohnovy nemoci, granulomy nebyly prokázány. Histologické vyšetření jaterní tkáně pak potvrdilo cholestatické postižení jater s jizevnatým zánikem interlobulárních žlučovodů a periportální/fokální portoportální a perivenulární fibrózou a interface hepatitidou. Byla doplněna magnetická rezonance žlučových cest (MRCP) s nálezem mnohočetných stenóz obou hepatiků a jejich větví bez dilatace žlučových cest (obr. 1).
Image 1. MRCP s obrazem mnohočetných stenóz ductus hepaticus communis, ductus hepaticus dexter a sinister a jejich větví. Fig. 1. MRCP with multiple stenoses ductus hepaticus communis, ductus hepaticus dexter et sinister and their branches. 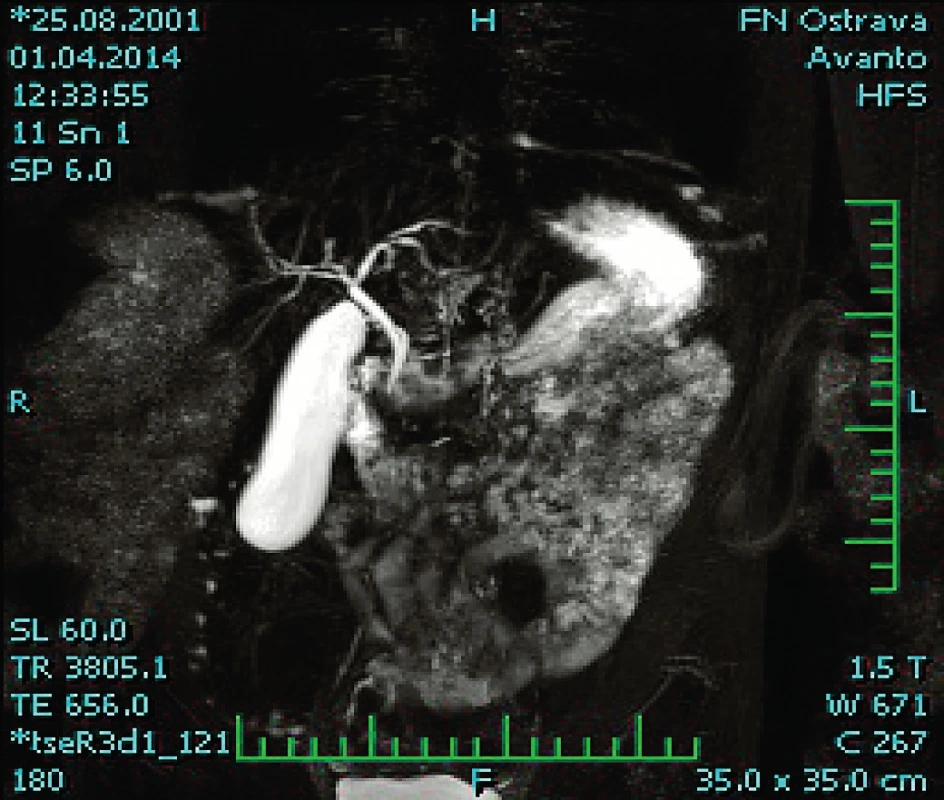
Stav jsme uzavřeli jako overlap syndrom PSC/AIH se současně probíhajícím nespecifickým střevním zánětem. S ohledem na výsledky vyšetření jsme přistoupili k terapii ursodeoxycholovou kyselinou (UDCA) v dávce 15 mg/kg//den, dále azathioprinu zpočátku v dávce 1 mg/kg/den, po vyšetření aktivity thiopurin S-metyltransferázy (TPMT) byla dávka navýšena na 2 mg/kg/den a Pentaze v dávce 2 g/den. Současně je pacient v remisi.
Diskuse
Diagnóza IBD bývá diagnostikována současně s PSC u 85 % dětí, jaterní onemocnění se ale může rozvinout měsíce až roky po manifestaci nespecifického střevního zánětu [11]. Jelikož IBD u pacientů s PSC má většinou mírný průběh, nebo dokonce může probíhat asymptomaticky, měla by se u všech dětí s prokázanou PSC provést kolonoskopie s etážovitým odběrem bioptických vzorků [3, 6, 7]. Z histologického hlediska je IBD v těchto případech klasifikován jako ulcerózní kolitida (UC) v 79–91 %, méně často pak Crohnova nemoc (CN) v 6,3–7 % či jako indeterminovaná kolitida v 2,5–4,8 % [12].
Základními pilíři diagnózy PSC jsou cholangiogram (magnetická rezonance žlučových cest (MRCP) [14], event. ERCP (endoskopická retrográdní cholangio-pankreatografie), pokud je MRCP nediagnostické, histologické vyšetření jater a laboratorní obraz cholestázy s řadou abnormit imunitních parametrů [22].
V laboratorních nálezech jsou známky cholestázy, nejpřínosnější je hodnota GMT, která bývá zvýšená v 95 % případů, ALP asi v 50 % [11]. Aminotransferázy jsou zvýšené v 95 % případů, hodnota bilirubinu je většinou normální, vyšší hodnoty nacházíme u pacientů s autoimunitními projevy. Trombocytopenie a leukopenie jsou přítomné u dětí s pokročilým jaterním onemocněním [6]. U pacientů s PSC či ASC bývají pozitivní protilátky proti cytoplazmě neutrofilů (ANCA), které se vyskytují u 80–90 % nemocných [13]. U významné části pacientů jsou v laboratorním vyšetření přítomné změny charakteristické pro autoimunitní hepatitidu, jako je hypergamaglobulinémie a přítomnost dalších autoprotilátek (antinukleární protilátky 43 %, protilátky proti hladkému svalu (SMA) 28 %, výjimečně protilátky proti mikrozomálním antigenům jater a ledvin) [7].
U našeho pacienta se laboratorní nálezy s těmito údaji shodovaly. Dominovala elevace GMT s hodnotou 4,5násobku horní hranice normy. Aminotransferázy dosahovaly hodnot 3–4násobku horní hranice normy, ALP maximálně do 1,1násobku normy. Nikdy neměl zvýšenou hodnotu bilirubinu. Má prokázanou pozitivitu ANCA a intermitentní pozitivitu ANA protilátek. Také histologický nález odpovídal změnám popisovaným u ASC.
Histologicky je popisován chronický destruující zánět drobných interlobulárních a septálních žlučovodů s intrahepatální cholestázou a fibrózou. Tzv. koncentrická periduktální fibróza („onion-skin“) je vzácná. Většinou jsou zachyceny nespecifické zánětlivé změny portálního pole obstrukčního rázu s postižením žlučovodů a fibrózou [7]. U 35 % dětí je při biopsii jater nalézán obraz periportální („interface“) hepatitidy [2].
Současná přítomnost PSC a laboratorních a histologických známek charakteristických pro AIH (hypergamaglobulinémie, přítomnost autoprotilátek ANA, SMA, histologický obraz interface hepatitidy) je typický pro overlap syndrom (ASC). Z celkového počtu dětí s PSC se na diagnóze podílí overlap syndrom asi 50 % [3, 6, 7].
Overlap syndrom léčíme stejně jako autoimunitní hepatitidu, tzn. kortikoidy v kombinaci s azathioprinem. Azathioprin, který je indikovaný u IBD k indukci a udržení remise i u pacientů s ASC, by měl být vždy dobře zvážen pro jeho hepatotoxický efekt [15]. U PSC-IBD je až desetinásobný (41 %) ve srovnání s non PSC-IBD (4 %). Toxický efekt se velmi špatně hodnotí. Elevace jaterních testů může svědčit jak pro tuto toxicitu, tak pro progresi PSC. Před zahájením terapie thiopuriny je nutné vyšetřit hladinu thiopurin S-metyltransferázy (TPMT) a během léčby pečlivě monitorovat jaterní testy [16]. Terapii dále doplňujeme o ursodeoxycholovou kyselinu (UDCA). V léčbě PSC vystačíme s monoterapií UDCA. Při léčbě UDCA dochází k zlepšení klinických i laboratorních známek cholestázy, ale vliv na průběh nemoci a prodloužení doby do transplantace nejspíše nemá [17]. Podle některých studií má UDCA protektivní vliv na vznik kolorektálních neoplazií [18]. Ten spočívá ve zvýšení poměru primárních žlučových kyselin vůči sekundárním [19]. Nejlepších výsledků bylo dosaženo při dávkování 15 mg/kg/den [18]. Jediným kurativním postupem pro pacienty s PSC je ale transplantace jater. Těžký průběh PSC vyžadující transplantaci jater je většinou spojen s klidovým průběhem střevního zánětu [20]. Po transplantaci však bývá klinický průběh IBD závažnější. Důvodem mohou být potransplantační změny v imunitním systému [21] nebo cytomegalovirová infekce při probíhající imunosupresivní terapii [20].
Na celkovém počtu transplantací jater u dětí se podílí PSC 3,5 % [11]. Medián do transplantace se udává 12,7 let od stanovení diagnózy PSC a ASC [6]. Prognóza PSC je ve srovnání s AIH horší [3]. Mezi nepříznivé prognostické markery u dětí v době stanovení diagnózy patří vyšší věk, trombocytopenie, zvýšená hodnota bilirubinu a prodloužené INR. V dospělosti je onemocnění provázeno zvýšeným rizikem cholangiogenního karcinomu a u nemocných s IBD vznikem kolorektálního karcinomu [6].
Závěr
Primární sklerozující cholangitida se u dětí vyskytuje vzácně. Musíme však na ni myslet u nemocných s hepatopatií a laboratorním obrazem nejasné cholestázy, a to především v případech vzniku nebolestivého ikteru, pruritu a probíhajícího nespecifického střevního zánětu. Základními diagnostickými nástroji jsou MRCP a jaterní biopsie. U nemocných s diagnostikovanou PSC je vždy nutné doplnit endoskopické vyšetření tlustého střeva k vyloučení střevního zánětu.
Došlo: 19. 8. 2015
Přijato: 1. 9. 2015
MUDr. Lenka Podracká
Klinika dětského lékařství FN
17. listopadu 1790
708 00 Ostrava-Poruba
e-mail: lenkakosnovska@seznam.cz
Sources
1. Sokol H, Cosnes J, Chazouilleres O, et al. Disease activity and cancer risk in inflammatory bowel disease associated with primary sclerosing cholangitis. World J Gastroenterol 2008; 14 (22): 3497–3503.
2. Kaplan GG, Laupland KB, Butzner D, et al. The burden of large and small duct primary sclerosing cholangitis in adults and children: a population-based analysis. AM J Gastroenterol 2007; 102 : 1042–1049.
3. Gregorio GV, Portmann B, Karani J, et al. Autoimmune hepatitis/sclerosing cholangitis overlap syndrome in childhood: a 16-year prospective study. Hepatology 2001; 33 : 544–553.
4. Nevoral J, a kol. Praktická pediatrická gastroenterologie, hepatologie a výživa. 1. vyd. Praha: Mladá fronta, 2013 : 366–367.
5. Boonstra K, Weersma RK, van Erpecum KJ, et al. Population-based epidemiology, malignancy risk, and outcome of primary sclerosing cholangitis. Hepatology 2013; 58 (6): 2045–2055.
6. Feldstein AE Perrault J, EL-Youssif, et al. Primary sclerosing cholangitis in children: a long-term follow-up study. Hepatology 2003; 38 : 210–217.
7. Miloh T, Arnon R, Shneider B, et al. A retrospective single-center rewiev of primary sclerosing cholangitis in children. Clin Gastroenterol Hepatol 2009; 7 : 239–245.
8. Schaeffer DF, Win LL, Hafezi-Bakhtiari S, et al. The phenotypic expression of inflammatory bowel disease in patiens with primary sclerosing cholangitis differs in the distribution of colitis. Dig Dis Sci 2013; 58 (9): 2608–2614.
9. Boonstra K, van Erpecum KJ, van Nieuwkerk KM, et al. Primary sclerosing cholangitis is associated with a distinct phenotype of inflammatory bowel disease. Inflamm Bowel Dis 2012; 18 (12): 2270–2276.
10. Lamberts LE, Janse M, Haagsma EB, et al. Immune-mediated diseases in primary sclerosing cholangitis. Dig Liver Dis 2011; 43 (10): 802–806.
11. Alvarez F. Autoimmune hepatitis and primary sclerosing cholangitis. Clin Liver Dis 2006;10 : 89–107.
12. Takikawa H, Takamori Y, Tanaka A, et al. Analysis of 388 cases of primary sclerosing cholangitis in Japan; presence of subgroup without pancreatic involvement in older patients. Hepatol Res 2004; 29 (3): 153–159.
13. Vergani D, Alvarez F, Bianchi FB, et al. Liver autoimmune serology of the International Autoimmune Hepatitis Group. J Hepatol 2004; 41 : 677–683.
14. Tipnis NA, Dua KS, Welin SL. A retrospective assessment of magnetic resonance cholangiopankreatography in children. J Pediatr Gastroenterol Nutr 2008; 46 : 59–64.
15. Pallavicino F, Pellicano R, Reggiani S, et al. Inflammatory bowel diseases and primary sclerosing cholangitis: hepatic and pancreatic side effects due to azathioprine. Eur Rev Med Pharmacol Sci 2013; 17 (1): 84–87.
16. Rojas-Feria M, Castro M, Suárez E, et al. Hepatobiliary manifestations in inflammatory bowel disease: the gut, the drugs and the liver. World J Gastroenterol 2013; 19 (42): 7327–7340.
17. Lindor KD, Kowdley KV, Luketic VA, et al. High-dose ursodeoxycholic acid for the treatment of primary sclerosing cholangitis. Hepatology 2009; 50 : 808–814.
18. Tung BY, Emond MJ, Haggitt RC, et al. Ursodiol use is associated with lower prevalence of colonic neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis. Ann Intern Med 2001; 134 (2): 89–95.
19. Batta AK, Salen G, Holubec H, et al. Enrichment of the more hydrophilic bile acid ursodeoxycholic acid in the fial water-soluble fraction after feeding to rats with colon polyps. Cancer Res 1998; 58 (8): 1684–1687.
20. Marelli L, Xirouchakis E, Kalambokis G, et al. Does the severity of primary sclerosing cholangitis influence the clinical course of associated ulcerative colitis? Gut 2011; 60 (9): 1224–1228.
21. Drastich P, Bajer L, Wohl P, et al. Transplantace jater pro primární sklerozující cholangitidu. Gastroent Hepatol 2013; 67 (5): 413–420.
22. Horák J, Vaňásek T. PBC (primární biliární cirhóza), PSC (primární sklerozující cholangoitida). Doporučený postup České hepatologické společnosti ČLS JEP. 2010, www.ces-hep.cz.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2015 Issue 6-
All articles in this issue
- Vliv valgozity paty na pohyb nohy při chůzi u dětí ve věku 3 až 8 let
- Primární (autoimunitní) sklerozující cholangitida u pacienta s nespecifickým střevním zánětem
- Molekulárna genetika, fenotypová variabilita a súčasné trendy v personalizovanej medicíne fenylketonúrie
- Aspergillus fumigatus a plicní postižení u cystické fibrózy – přehled problematiky
- Etanolová zátka v terapii a prevenci katetrové sepse
- Nikotin ovlivňuje vývoj mozku
- Pěstounská péče na přechodnou dobu: psychologické aspekty
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Primární (autoimunitní) sklerozující cholangitida u pacienta s nespecifickým střevním zánětem
- Nikotin ovlivňuje vývoj mozku
- Vliv valgozity paty na pohyb nohy při chůzi u dětí ve věku 3 až 8 let
- Aspergillus fumigatus a plicní postižení u cystické fibrózy – přehled problematiky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

