-
Medical journals
- Career
Antimikrobiálna rezistencia uropatogénov u detí s febrilnými infekciami močových ciest
Authors: G. Koľvek 1; Ľ. Podracká 1; K. Čurová 2; L. Siegfried 2
Authors‘ workplace: I. Klinika detí a dorastu UPJŠ LF a DFN, Košice prednostka prof. MUDr. Ľ. Podracká, CSc. 1; Ústav lekárskej mikrobiológie a klinickej mikrobiológie UPJŠ LF, Košice prednosta prof. MUDr. L. Siegfried, CSc. 2
Published in: Čes-slov Pediat 2009; 64 (9): 392-399.
Category: Original Papers
Overview
Febrilné infekcie močového traktu patria k najčastejším bakteriálnym infekciám v detskom veku. O tom, či dôjde k vzniku renálnych jaziev, rozhodne rýchla diagnostika a promptná empirická antibiotická liečba. Voľba antibiotika sa opiera o epidemiologické údaje a prehľady mikrobiálnej rezistencie najčastejších uropatogénov.
Cieľom retrospektívnej štúdie bola analýza mikrobiologických pôvodcov a efektívnosť antimikrobiálnej terapie febrilných infekcií močových ciest u 68 detí. Výsledky sa hodnotili podľa veku dieťaťa a prítomnosti vrodenej vývojovej chyby (VVCH). Najčastejším vyvolávateľom febrilnej IMC vo všetkých vekových skupinách bola Escherichia coli (E. coli) (56 detí, 82,4 %). Pacienti s VVCH mali signifikantne vyššie zastúpenie non-Escherichia coli (non-E. coli) infekcií (p <0,033), signifikantne vyššiu rezistenciu na testované antibiotiká (CIP 18,8 % vs. 2,8 %, p <0,025; resp. CTX 21,9 % vs. 5,6 %, p <0,047) a stúpajúci trend rezistencie najmä na COT (46,9 % vs.19,4 % p <0,024) a GEN (28,1 % vs. 0 %, p <0,001) ako deti bez anomálií. V skupine chorých s E. coli infekciou bez VVCH bola rezistencia na antibiotiká s výnimkou COT (18,2 %) a AMP (28,1 %) minimálna (GEN 0 %, CTX 3,0 % a CIP 0 %).Záver:
Empirická liečba akútnej pyelonefritídy cefalosporínmi tretej generácie a aminoglykozidmi je vhodná, lebo bakteriálne kmene na tieto antibiotiká vykazujú dobrú citlivosť. Pacienti s VVCH uropoetického traktu majú častejšie non-E. coli infekcie a vyššiu rezistenciu voči antimikrobiálnym látkam.Kľúčové slová:
akútna pyelonefritída, antibiotická rezistencia, vrodené vývojové chyby uropetického traktuÚvod
Akútne pyelonefritídy patria k najčastejším bakteriálnym infekciám detí. Ich prevalencia kolíše s vekom dieťaťa. Najvyšší výskyt sa zaznamenáva v prvom roku života, čo sa vysvetľuje asociáciou s vrodenými vývojovými chybami uropoetického traktu [1]. Závažnosť febrilných infekcií močového traktu spočíva v „hrozbe“ obličkového jazvenia, ktoré je obávanou komplikáciou najmä v populácií malých detí [2, 3, 4].
Diagnóza akútnej pyelonefritídy sa opiera o klinické príznaky s dominujúcou horúčkou, vysoké zápalové parametre, aktívny močový sediment a signifikantnú bakteriúriu, ktorá diagnózu infekcie močových ciest (IMC) definitívne potvrdí. Najčastejším pôvodcom infekcií močového traktu je rod Escherichia, nasledovaný rodmi Pseudomonas, Enterococcus, Klebsiella, Proteus, Enterobacter a Serratia.
Prakticky všetky infekcie močových ciest vznikajú ascendentnou cestou. Pôvodcami sú zvyčajne baktérie črevnej flóry a baktérie kolonizujúce perineum či okolie vonkajšieho orifícia uretry, ktoré preniknú do močového mechúra, eventuálne až do vyšších častí močových ciest [5].
Z patogenetického hľadiska je kľúčovým momentom pre vznik infekcie močového traktu adherencia baktérií na uroepitelové bunky. Fenomén adherencie je najdôkladnejšie (pre)študovaný na bakteriálnom modeli Escherichia coli (E. coli). Adherenciu E. coli na epitel močového traktu sprostredkujú fimbrie (fimbrie P, fimbrie S) a nefimbriové adhezíny. Virulentné kmene, nesúce na svojom povrchu fimbrie, sú schopné priľnúť na urotel tak pevne, že ich nestrhne ani silný prúd moču. Adherenciou mikroorganizmu sa spúšťa zápalová slizničná odpoveď vedúca k produkcii proteínov akútnej fázy a chemotaxii granulocytov. Intenzita zápalovej odpovede je silnejšia, ak má vyvolávajúci patogén na svojom povrchu fimbriové adhezíny. Z klinického aspektu sú najagresívnejšie fimbrie P. Kmene, ktoré majú na svojom povrchu fimbrie P, sú invazívne a vyvolávajú pyelonefritídu. V genóme vysoko virulentných uropatogénnych E. coli (UPEC) sa okrem génov pre adhezíny nachádzajú aj gény pre toxíny, z ktorých najvýznamnejšie sú α-hemolyzín a cytotoxický nekrotizujúci faktor 1.
Na druhej strane, menej virulentné UPEC netvoria toxíny a adhezíny, keďže im korešpondujúce gény virulencie chýbajú alebo sú mutované. Preto aj celková reakcia organizmu je minimálna, infekcia ostáva ohraničená na úrovni dolných močových ciest, alebo je prítomná len signifikantná bakteriúria (asymptomatická bakteriúria) [6]. Baktérie E. coli, vrátane UPEC, vytvárajú tiež siderofory, ktoré pomáhajú baktérií získavať železo. Inými slovami, odlišnosti virulencie baktérií podmieňujú variabilitu klinických foriem infekcie močového traktu.
Prebiehajúci zápal, ktorého primárnym cieľom je eliminácia patogénneho vyvolávateľa, môže pri pyelonefritíde účinkom enzýmov neutrofilov ako aj bakteriálnych toxínov v konečnom dôsledku poškodiť obličkové tkanivo, výsledkom čoho je tvorba jaziev [7]. Príčina vzniku renálnych jaziev nie je presne vysvetlená. Známym faktorom, ktorý má dokázaný priamy vplyv na vznik jaziev, je včasné započatie liečby prebiehajúcej pyelonefritídy. Tento dôkaz sa opiera o prospektívne aj retrospektívne klinické štúdie, ktoré prekvapivo zistili, že „časový interval“ od nástupu febrilného intervalu až po započatie liečby má väčšiu prediktívnu hodnotu pre vznik renálneho jazvenia ako samotná dĺžka antibiotickej terapie (3 dni versus 10 dní), či dokonca spôsob aplikácie farmaka (p.o. versus i.v.). Klinicky vzaté, najväčšiu „šancu“ na vznik jaziev majú chorí s oneskoreným začiatkom antibiotickej liečby.
Z praktického aspektu sú najviac ohrozené dojčatá a batoľatá, u ktorých infekcia močových ciest prebieha často nepoznane, čo sa môže „podpísať“ na oneskorenom začiatku liečby a zvýšenej náchylnosti k jazveniu. Druhým faktorom, ktorý zásadným spôsobom môže ovplyvniť prognózu IMC, je správna voľba antibiotika. Údaje o antimikrobiálnej rezistencii uropatogénov u detí sú iba sporadické, preto súčasne terapeutické odporúčania sa opierajú viac o empíriu ako o vedecky podložené dôkazy.
Tieto dôležité a pre pediatrickú prax zásadné pozorovania nás podnietili k študovaniu vzájomných vzťahov medzi hostiteľom a vyvolávateľom močovej infekcie.
Cieľ práce
Retrospektívne sme analyzovali mikrobiologických pôvodcov a efektívnosť antimikrobiálnej terapie febrilnej infekcie močových ciest u pacientov hospitalizovaných na I. Klinike detí a dorastu LF UPJŠ a DFN v Košiciach za obdobie január 2006 až december 2008.
Cieľom práce bolo:
- zistiť zastúpenie uropatogénov v jednotlivých vekových skupinách podľa (ne)prítomnosti vývojovej anomálie uropoetického traktu,
- vyšetriť faktory virulencie E. coli a
- vyhodnotiť antimikrobiálnu rezistenciu baktérií vo vzťahu ku klinickej efektívnosti empirickej terapie.
Pacienti a metódy
V sledovanom období od januára 2006 do decembra 2008 sme hospitalizovali spolu 68 detí (41 dievčat a 27 chlapcov) vo veku od jedného mesiaca života do 19 rokov (medián veku 4,8 roka) s klinicky manifestnou febrilnou infekciou močových ciest (telesná teplota viac ako 38,5 °C, sedimentácia erytrocytov viac ako 25 mm za hodinu, CRP viac ako 20 mg/L, pyúria viac ako 10 leukocytov v zornom poli a signifikantná bakteriúria, t.j. viac ako 105 mikroorganizmov/ml moču) [8]. Zo súboru sme vylúčili pacientov s kultivačným nálezom viacerých baktériálnych druhov v moči a deti s neurogénnym mechúrom.
Súbor 68 chorých sme rozdelili do troch skupín podľa veku dieťaťa v čase manifestácie infekcie. Prvú skupinu (skupina A) tvorili deti do 1 roku (n = 35), v druhej skupine (skupina B) boli deti od 1 do 5 rokov (n = 15), staršie deti od 5 do 19 rokov (n = 18) sme zaradili do tretej skupiny (skupina C) (tab. 1, 2).
Table 1. Charakteristika súboru. 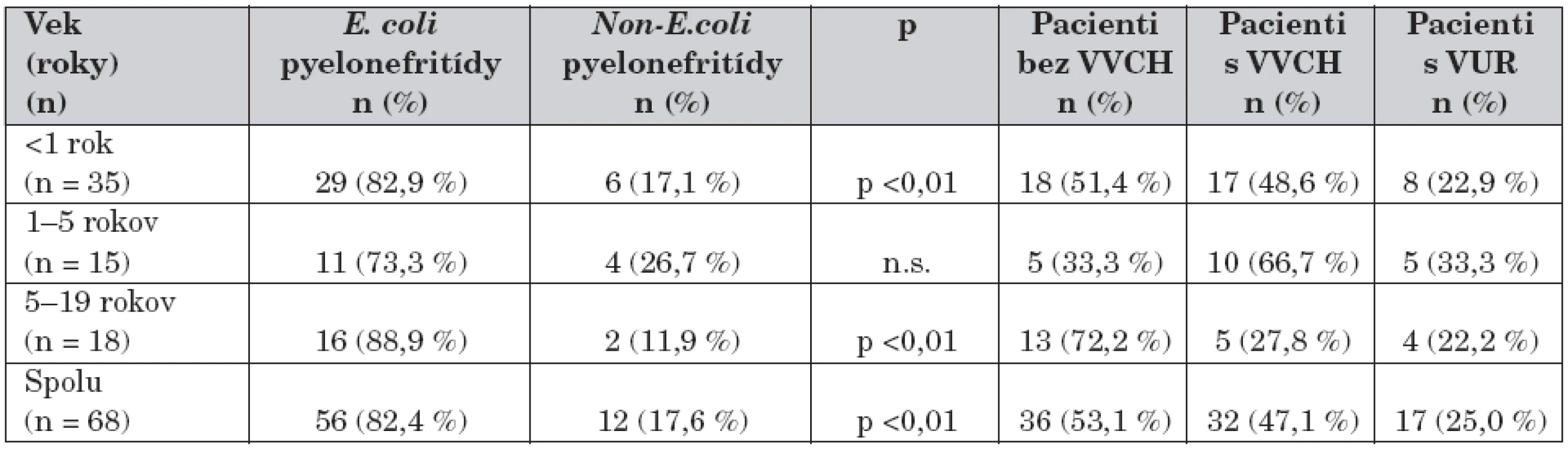
E. coli: Escherichia coli Non–E. coli: Non–Escherichia coli VVCH: vrodená vývojová chyba VUR: vezikoureterový reflux Table 2. Zastúpenie uropatogénov podľa veku. 
Vyšetrenie moču
Moč na mikrobiologické vyšetrenie sme u dojčiat zbierali do nalepených plastikových vrecúšok, u starších detí sme odoberali stredný prúd moču. U novorodencov sa v prípade pochybností vykonala suprapubická punkcia.
Vzorky moču sme hneď po odobratí transportovali do laboratória Ústavu lekárskej mikrobiológie a klinickej mikrobiológie LF UPJŠ, kde sa inokulovali na tuhé a tekuté kultivačné pôdy (krvný agar a MacConkey agar, resp. 2 ml LB média v skúmavke) a kultivovali sa v termostate pri teplote 37 °C po dobu 18–24 hodín. Pri pozitívnej aeróbnej kultivácii sme bakteriálne kultúry diagnostikovali klasickými bakteriologickými identifikačnými postupmi.
Biochemické vlastnosti izolovaných gramnegatívnych baktérií sme testovali pomocou identifikačných testov Enterotest 16 a EnteroRapid 24 (Lachema). U izolovaných bakteriálnych kmeňov E. coli sme zisťovali ich kvantitatívnu citlivosť na vybrané antibiotiká (ATB). Minimálnu inhibičnú koncentráciu antibiotík (MIC) sme stanovovali štandardnou dilučnou mikrometódou (v mikrotitračnej platničke) v sérii dvojnásobných koncentrácií vybraných ATB (0,06 μg/ml – 128 μg/ml) podľa noriem CLSI (Clinical and Laboratory Standards Institute) [9]. Panel testovaných ATB zahŕňal ampicilin/sulbactam (AMP + IB), piperacilin/tazobactam (PIP + IB), cotrimoxazol (COT), cefepim (FEP), cefotaxim (CTX), ceftazidin (CAZ), cefuroxim (CXM), ciprofloxacin (CIP), kolistin (COL), gentamicin (GEN), amikacin (AMI) a meropenem (MEM). Z kmeňov E. coli sme izolovali templátovú DNA [10], ktorú sme použili pri polymerázovej reťazovej reakcii (PCR). K detekcii génov hly, afa, aer, cnf1, sfa a pap, ktoré kódujú faktory virulencie UPEC, sme použili multiplexnú PCR [11]. PCR produkty vyšetrovaných génov sme analyzovali pomocou agarózovej elektroforézy v 2% agarózovom géli. Počas elektroforézy, ktorá prebiehala 60 minút pri 80 V, došlo k separácii fragmentov DNA (vyšetrovaných génov) v géli. Gél sme farbili fluorescenčným farbivom etídiumbromid (1 μg/ml) a následne sme ho premyli destilovanou vodou. Separované fragmenty sme vizualizovali pod UV svetlom a analyzovali softvérovým systémom GelQuant a GelCapture.
Liečba
U všetkých pacientov sme antibiotiká podávali spočiatku parenterálne. Terapiu sme započali empiricky cefalosporínmi III. generácie (cefotaxim, ceftizoxim, resp. ceftriaxon) (n = 35) alebo gentamicinom (n = 24), zriedkavejšie sme indikovali ako liek prvej voľby fluorochinolóny (n = 2), resp. na základe už známeho výsledku kultivácie a citlivosti iné ATB (ampicilin, piperacilin + tazobaktam, n = 4). U 3 pacientov sme vzhľadom na závažnosť klinického stavu liečbu započali kombináciou antibiotík (gentamicin + cefotaxim).
Za účelom diagnostiky VVCH sme u všetkých pacientov štandardne vykonali USG vyšetrenie. Šesť týždňov po prekonaní infekcie sme indikovali mikčnú cystouretrografiu (MCUG). V každej vekovej skupine sme osobitne vyhodnotili výskyt VVCH uropoetického traktu a vezikoureterového refluxu (VUR) vo vzťahu k vyvolávajúcemu uropatogénu.
Získané výsledky sme štatisticky vyhodnotili pomocou softwaru SPSS (verzia 16.0). Na zistenie významnosti rozdielu výskytov sledovaných znakov medzi vybranými skupinami sme použili χ2test, resp. Fisherov exaktný test. Za štatisticky významnú sme považovali hladinu p <0,05.
Výsledky
1. Klinické charakteristiky
Dominantným uropatogénom vo všetkých vekových skupinách detí bola E. coli, ktorá vyvolala až 82,4 % febrilných uroinfekcií v celom sledovanom súbore. Zostávajúce percento pyelonefritíd vyvolali Enterococcus sp. (n = 5,9 %), Pseudomonas sp. (n = 4,4 %), Klebsiella sp. (n = 4,4 %) a Proteus sp. (n = 2,9 %) (graf 1).
Graph 1. Proporcionálne zastúpenie uropatogénov. 
Vrodenú vývojovú chybu (VVCH) uropoetického traktu malo 32 pacientov (47,1 %), z nich viac ako polovicu (53,1 %, n = 17) tvorili dojčatá. VUR bol prítomný u 17 chorých (25,0 %) z celého súboru, pričom najvyšší výskyt sme zaznamenali v skupine detí od 1 do 5 rokov (33,3 %, n = 5) (tab. 1, 3).
Table 3. Výskyt pyelonefritíd spôsobených E. coli a non-E. colimikroorganizmami u pacientov s/bez VVCH uropoetického traktu. 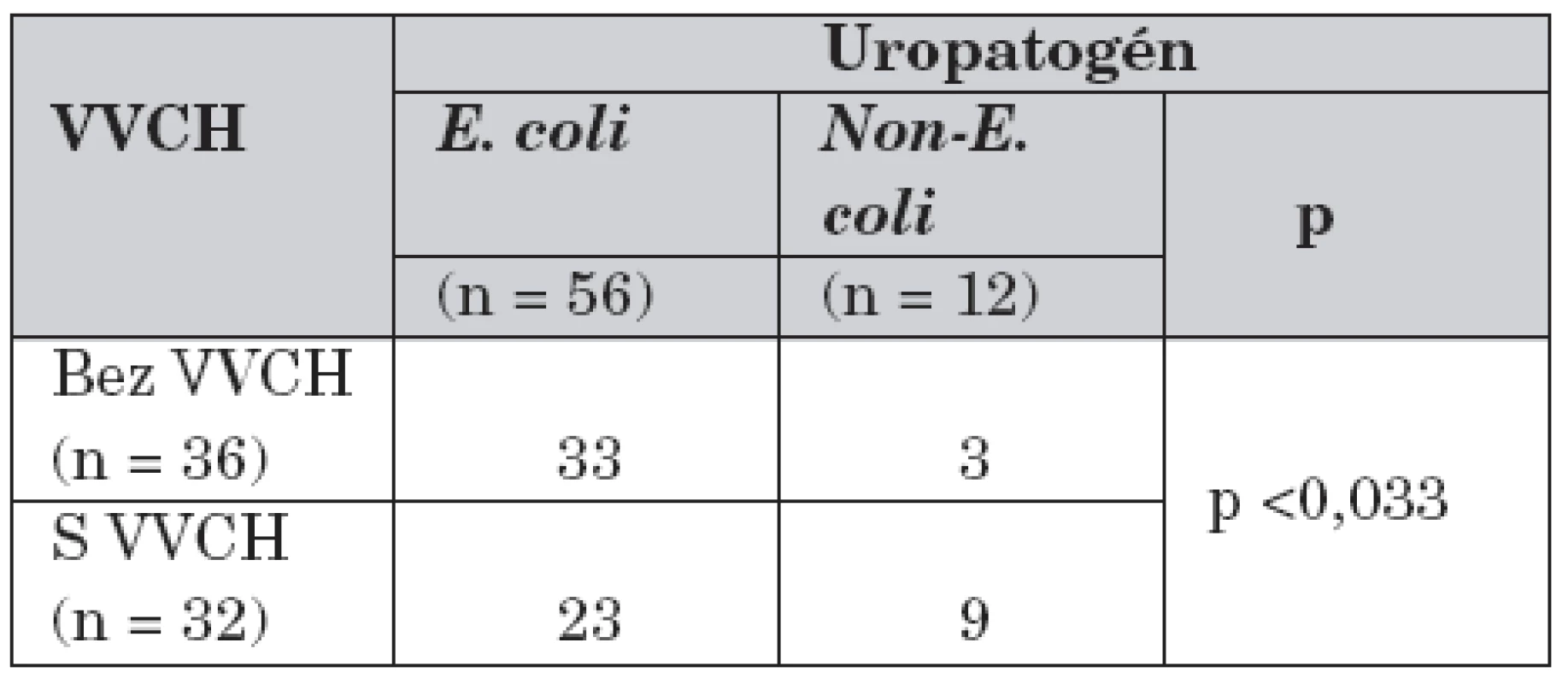
E. coli: Escherichia coli Non–E. coli: Non–Escherichia coli VVCH: vrodená vývojová chyba 2. Faktory virulencie E. coli
U 21 pacientov s E. coli infekciou sme vyšetrili faktory patogenity, a to fimbrie (fimbrie P, fimbrie S) ako aj nefimbriové adhezíny, toxíny (cytotoxický nekrotizujúci faktor 1, α-hemolyzín) a siderofor aerobaktín. Zastúpenie jednotlivých faktorov patogenity uvádza tabuľka 4.
Table 4. Faktory virulencie E. coli. 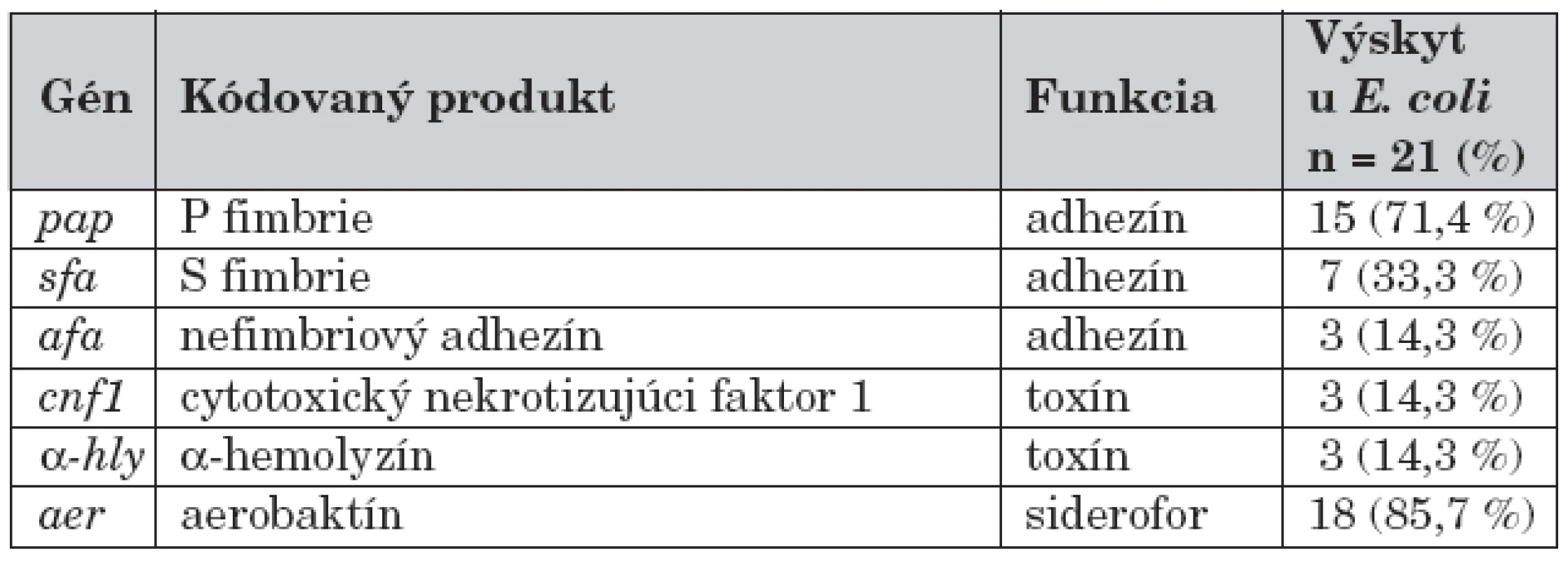
Z analýzy vyplynulo, že u väčšiny vyšetrených pacientov s febrilnou E. coli infekciou išlo o invazívne bakteriálne kmene, ktoré mali na povrchu exprimované fimbrie, pričom častejšie išlo o P fimbrie než o S fimbrie (71,4 % vs. 33,3 %). Za zaujímavé zistenie považujeme, že u 14,3 % kmeňov E. coli vykultivovaných z moču detí s VVCH sme nedokázali adhezín. V protiklade k tomu, u pacientov bez vývojovej anomálie sa ani raz nevyskytol kmeň E. coli, ktorému by chýbal na svojom povrchu exprimovaný adhezín. Signifikantné rozdiely medzi faktormi virulencie a vekom, či pohlavím dieťaťa sa nezistili.
3. Rezistencia na antibiotiká
Rezistenciu sme hodnotili podľa výskytu VVCH (s/bez VVCH) a podľa bakteriálnych kmeňov (E. coli/non-E. coli). Vo všeobecnosti sme signifikantne vyššiu rezistenciu na antibiotiká zistili u detí s vrodenými chybami obličiek ako u detí bez anomálií.
Deti s VVCH mali stúpajúci trend rezistencie najmä na COT (46,9 % vs. 19,4 %, p <0,024) a GEN (28,1 % vs. 0 %, p <0,001) v porovnaní s chorými bez VVCH. Za závažný nález považujeme štatisticky významný rozdiel v rezistencii baktérií na CIP a CTX (18,8 % vs. 2,8 %, p <0,025, resp. 21,9 % vs. 5,6 %, p <0,047) u detí s a bez VVCH.
Antimikrobiálna rezistencia E. coli baktérií
Súbor pacientov s E. coli pyelonefritídou tvorí 35 dievčat a 21 chlapcov. 23 prípadov pyelonefritídy (spôsobenej E. coli) sa rozvinulo u pacientov s VVCH (13 dievčat, 10 chlapcov), v zostávajúcich 33 prípadoch vznikla infekcia v teréne močového traktu bez VVCH (22 dievčat, 11 chlapcov). U pacientov s E. coli infekciou bez VVCH bola rezistencia na antibiotiká s výnimkou COT (18,2 %) a AMP (28,1 %) minimálna (GEN 0 %, CTX 3,0 % a CIP 3,0 %).
Na druhej strane, v skupine detí s VVCH bola až tretina kmeňov (34,8 %) rezistentných na COT a takmer polovica kmeňov (43,5 %) rezistentných na AMP. 26,1 % kmeňov z tejto skupiny bolo rezistentných na GEN, 8,7 % kmeňov na CTX a u 17,4 % kmeňov bola prítomná rezistencia na CIP (graf 2).
Graph 2. Prehľad rezistencie E. coli u pacientov s/bez VVCH. 
Diskusia
U dojčiat a batoliat sa infekcia močového traktu zvyčajne diagnostikuje o niečo obtiažnejšie, čo môže viesť k oneskorenému začiatku liečby a zvýšenej náchylnosti k jazveniu [12, 13]. Zistilo sa, že niektoré deti môžu byť citlivejšie na poškodenie obličiek infekciou, a to bez ohľadu na vek, VUR či dokonca počet infekcií [13].
V svetle dnešných poznatkov sa však za kľúčový moment pre vznik renálnych jaziev považuje „kritický“ interval medzi prvými klinickými prejavmi infekcie a začiatkom antibiotickej liečby. Tieto dôležité klinické pozorovania, ktoré sú podporené aj exaktnými výskumami na zvieracích modeloch, podčiarkujú opodstatnenosť včasného započatia liečby febrilnej infekcie močových ciest [14].
Pre správnu voľbu empirickej liečby infekcie močových ciest v čase, keď ešte nie sú známe výsledky kultivačného vyšetrenia, je dôležité nielen správne „odhadnúť“ vyvolávajúci mikroorganizmus, ale aj predikovať citlivosť baktérie na jednotlivé antimikrobiálne liečivá. Prevažnú väčšinu prvoinfekcií vyvoláva vo všeobecnosti E. coli.
Túto, už roky dobre známu skutočnosť potvrdzujú aj naše klinické výsledky. Zo súboru 68 detí s febrilnou IMC sme až u 56 (82,4 %) vykultivovali v moči E. coli, pričom častejšie boli postihnuté dievčatá. Z patogenetického hľadiska sa na vyššom zastúpení kmeňov E. coli podieľa nielen okolitá periuretrálna či intestinálna flóra, ale aj genetická „výbava“ baktérií rôznymi faktormi virulencie, ktoré uľahčujú ich priľnutie na uroepitel. Prítomnosť fimbrií na povrchu uropatogénnych kmeňov E. coli determinuje prienik baktérií do prostredia hostiteľa, klinický priebeh a lokalizáciu infekcie (infekcia horných versus infekcia dolných močových ciest), zatiaľ čo vývoj antimikrobiálnej rezistencie je podmienený inými génmi.
Uvedenú skutočnosť podporujú aj naše nálezy. U všetkých detí s akútnou pyelonefritídou sme identifikovali adhezíny a/alebo toxíny či aerobaktín. Dominujúcim adhezínom boli P fimbrie, ktoré sa vyskytovali až u 71,4 % kmeňov izolovaných z moču chorých detí, pričom sme nezistili signifikantné rozdiely v citlivosti na testované antibiotiká podľa výskytu jednotlivých faktorov virulencie E. coli. Na druhej strane, pri náleze „nezvyčajných“ baktérií treba vždy pátrať po štruktúrovej alebo funkčnej anomálii močového traktu. Uropatogény ako Pseudomonas sp. a Enterococcus sp. sa častejšie vykultivujú u pacientov s recidivujúcou infekciou, najmä u detí s anomáliami uropoetického traktu a po urologických operáciách.
V súlade s publikovanými údajmi sme aj u našich pacientov zistili zvýšený výskyt pseudomonádových, enterokokových a klebsielových infekcií v skupine detí s kongenitálnymi malformáciami močového traktu či recidívujúcimi IMC [15]. Navyše sme u týchto pacientov pozorovali aj zvýšenú rezistenciu na ATB. Na tieto jednoduché ale z hľadiska klinickej praxe veľmi dôležité „pravidlá“ treba vždy myslieť a zohľadniť ich pri rozhodovaní o voľbe empirickej liečby.
Rezistencia voči antimikrobiálnym látkam predstavuje v dnešnej klinickej pediatrii čoraz závažnejší problém. Baktérie si v snahe o zachovanie vlastného druhu vytvorili voči pôsobeniu antimikrobiálnych liečiv viaceré obranné mechanizmy (v závislosti od druhu mikroorganizmu a liečiva), čo vedie v konečnom dôsledku k vzniku rezistencie na mnohé antibiotiká. Epidemiologické štatistiky z niektorých pediatrických centier varujú, že za posledné desaťročie došlo u detí až k 3-násobnému nárastu rezistencie kmeňov E. coli na COT a AMP [16]. Túto znepokojujúcu správu čiastočne podporujú aj naše výsledky.
Jedným z vysvetlení je v nefrologickej praxi široko zaužívané profylaktické podávanie kotrimoxazolu u detí s VUR. V nami sledovanom súbore sme (u pacientov s VUR) zaznamenali až 35,3% rezistenciu voči COT. K podobným záverom dospeli aj rakúski autori [17], ktorí testovali citlivosť uropatogénov na antimikrobiálne látky vo veľkej skupine 694 detí s infekciami močových ciest. Zistili, že pacienti profylakticky liečení trimetoprimom, ampicilínom a cefalosporínmi si vypestovali rezistenciu baktérií na uvedené farmaká. Preto upozorňujú, že zvýšenie dávky dlhodobo užívaných liekov nie je vhodnou ani účinnou alternatívou terapie akútnej infekcie močových ciest. Takmer 40% rezistenciu gramnegatívnych baktérií na COT uvádzajú aj Haller a spol., ktorí však na rozdiel od nášho súboru neselektovali pacientov na akútnu pyelonefritídu a infekciu dolných močových ciest.
Obavy klinikov vzbudzuje aj nárast rezistencie gramnegatívnych baktérií na perorálne cefalosporíny, a to najmä so zreteľom na ich časovo relatívne krátke „udomácnenie“ v bežnej pediatrickej praxi. V pozadí tejto obávanej rezistencie je produkcia betalaktamáz mikroorganizmom, z ktorej sa „obviňuje“ favorizácia cefalosporínov v liečbe komunitne získaných infekcií. Exaktne to dokumentuje štatisticky precízne spracovaná retrospektívna analýza nemeckých autorov mapujúca antimikrobiálnu rezistenciu v dvoch časových intervaloch [18], ktorá uvádza takmer 30% rezistenciu uropatogénov na cefaklor. Je zaujímavé, že vysoký nárast rezistencie na orálne cefalosporíny sa v sledovaných rokoch 1997 a 1999–2001 signifikantne nemenil. Bakteriálne kmene u našich chorých vykázali v priemere dobrú citlivosť na cefotaxim. Za priaznivý údaj možno považovať minimálnu rezistenciu E. coli na CTX u detí bez vrodenej anomálie obličiek/močových ciest. Skryté riziko rezistencie na CTX predstavujú deti s febrilnou IMC a vrodenými anomáliami (21,9 % vs. 5,6 %, p <0,047).
Naše predbežné závery o vývoji rezistencie na CTX nemôžeme konfrontovať s inými prácami, lebo buď sa v dizajne publikovaných štúdií nečlenili pacienti podľa výskytu VVCH, alebo sa CTX v danom antibiograme netestoval [17, 18]. Z tohto aspektu poskytujú naše výsledky zaujímavé klinické údaje, ktoré môžu byť prínosné aj pre širšiu pediatrickú prax. Avšak na ich definitívne overenie sú potrebné prospektívne sledovania na väčšom počte detí.
Výskyt mikrobiálnych agens a rezistenciu jednotlivých uropatogénov môžu zásadne ovplyvňovať viaceré lokálne faktory, ako je aktuálna epidemiologická situácia v danom regióne, či preferencia a praktické zvyklosti v preskripcii antibiotík („preskripčná antibiotická politika“). Aj to sú pádne argumenty, prečo je žiadúce štandardne monitorovať aktuálnu mikrobiologickú „situáciu“ a pravidelne analyzovať antimikrobiálnu rezistenciu izolovaných bakteriálnych kmeňov. Bez týchto, pre pediatra mimoriadne cenných informácií, nie je možné riadiť stratégiu či taktiku empirickej antibiotickej liečby a docieliť žiadúcu klinickú odpoveď ešte skôr, ako je známa antibiotická rezistencia izolovaných močových baktérií.
Ako vyplynulo z našich ďalších výsledkov, ani potencované aminopenicilíny nie sú vzhľadom na pomerne vysokú rezistenciu vhodné na empirickú liečbu febrilných močových infekcií. Hlavnou indikáciou pre použitie ampicilínu a ampicilin/sulbaktamu ostáva cielená terapia infekcie vyvolanej Enterococcus sp., proti ktorému si udržujú výbornú antimikrobiálnu citlivosť. Aj v našom súbore boli všetky kmene enterokokov izolované z moču chorých detí dobre vnímavé na (potencované) aminopenicilíny.
Z komplexnej analýzy antimikrobiálnej rezistencie u našich chorých s IMC možno zhrnúť, že u detí s prvou infekciou močových ciest, ktoré nemajú VVCH, je rezistencia E. coli na GEN, CTX a CIP minimálna. Preto empirická liečba cefotaximom a gentamicinom je správnou voľbou. Výborný klinický efekt tejto antibiotickej liečby sme potvrdili u 97,6 % chorých. Po 2 dňoch terapie cefotaximom, resp. gentamicinom došlo k signifikantnému poklesu telesnej teploty a CRP.
„Záložnými“ antibiotikami s vynikajúcou citlivosťou zostávajú cefalosporíny vyšších generácií (cefepim) a karbapenémy (meropenem), ktorých použitie je rezervované pre stavy urosepsy. Limitáciou našej štúdie je jej retrospektívny charakter. Detailnejší obraz o vývojovom trende rezistencie jednotlivých uropatogénov môžu priniesť prospektívne štúdie na početnejšom súbore detí. Na druhej strane, naša štúdia poskytuje užitočné klinické údaje, ktoré sú aplikovateľné v širšom kontexte, keďže sme pacientov s IMC stratifikovali podľa veku, pohlavia, výskytu organickej a funkčnej anomálie UPT vo vzťahu k mikrobiologickým charakteristikám bakteriálnych kmeňov.
Na dosiahnutie priaznivého a rýchleho efektu terapie majú nezanedbateľný vplyv aj farmakodynamické vlastnosti zvoleného antibiotika. Len stručne uvedieme, že účinok betalaktámových antibiotík je závislý na časovom intervale, kedy sérová koncentrácia voľného antibiotika prevyšuje MIC. Aby sa udržali kontinuálne vyššie sérové koncentrácie antibiotika ako minimálna inhibičná koncentrácia, liek sa musí aplikovať v pravidelných časových intervaloch.
V prípade aminoglykozidov je situácia odlišná. Výsledný účinok závisí od maximálnej sérovej hladiny aminoglykozidu. Pre dosiahnutie spoľahlivého účinku je teda podstatný pomer maximálnej koncentrácie k MIC. Intenzitu baktericídneho pôsobenia aminoglykozidov preto zvyšujú krátkodobé, avšak relatívne vysoké maximálne koncentrácie antibiotika. Najčastejším mechanizmom vzniku rezistencie je enzymatická modifikácia aminoglykozidu baktériou.
Vychádzajúc z našich výsledkov môžeme podobne ako iní autori konštatovať, že citlivosť baktérií na gentamicin ostáva napriek desiatky rokov trvajúcemu používaniu aminoglykozidov dobrá. Preto gentamicin napriek svojej potenciálnej toxicite patrí medzi lieky prvej voľby v liečbe febrilnej infekcie močového traktu.
Veľký terapeutický problém predstavujú močové infekcie vyvolané vysokovirulentnými kmeňmi. Vysoká invazivita týchto kmeňov ich v dôsledku intenzívnejšej systémovej zápalovej odpovede predurčuje k potenciálne ťažšiemu či dokonca dramatickému klinickému obrazu infekcie. Avšak najťažší terapeutický „oriešok“ predstavujú kmene, ktorých vysoká virulentnosť sa zároveň kombinuje so značnou rezistenciou voči antibiotikám. V týchto komplikovaných situáciách je často potrebné na eradikáciu infekcie upraviť liečbu podľa antibiogramu.
Záver
Febrilné infekcie močových ciest patria k najčastejším hospitalizáciu vyžadujúcim infekciám v detskom veku. Obávaným dôsledkom akútnych pyelonefritíd je renálne jazvenie, ktoré môže v konečnom dôsledku ireverzibilne poškodiť funkciu obličiek. Infekcie močových ciest sú preto „horúcim“ klinickým problémom a predstavujú otvorenú výzvu pre pediatrov a detských nefrológov. O tom, či dôjde k vzniku renálnych jaziev, rozhodne rýchla diagnostika a promptná empirická antibiotická liečba.
Infekciu najčastejšie vyvoláva E. coli. Pri primoinfekciách s nálezom iných bakteriálnych kmeňov než E. coli je nutné cielene pátrať po možnej anomálii uropoetického traktu. V našich podmienkach sa osvedčila empirická liečba cefalosporínmi tretej generácie a aminoglykozidmi, lebo na tieto antibiotiká bakteriálne kmene vykazujú dobrú citlivosť. K úprave liečby podľa antibiogramu treba častejšie siahnuť u detí s vrodenými chybami po urologických operáciách.
Optimálna empirická liečba febrilnej infekcie močových ciest by sa mala odvíjať od lokálnych podmienok. Preto je veľmi žiadúce a užitočné pravidelne mapovať antimikrobiálnu rezistenciu izolovaných bakteriálnych kmeňov a „reevaluovať“ ich vnímavosť na antibiotiká.
Práca bola podporená grantom VEGA 1/4234/07.
Došlo: 8. 3. 2009
Přijato: 5. 6. 2009
Prof. MUDr. Ľudmila Podracká, CSc.
I. Klinika detí a dorastu UPJŠ LF a DFN
Tr. SNP 1
040 66 Košice
Slovenská republika
e-mail: ludmila.podracka@upjs.sk
Sources
1. Shaikh N, Morone NE, et al. Prevalence of urinary tract infection in childhood: a meta-analysis. Pediatr. Infect. Dis. J. 2008;27(4): 302–308.
2. Stockland E, Hellstrom M, et al. Renal damage one year after first urinary tract infection: role of dimercaptosuccinic acid scintigraphy. J. Pediatr. 1996;129 : 815–820.
3. Benador D, Neuhaus T, et al. Randomised controlled trial of 3 day versus 10 day intravenous antibiotics in acute pyelonephritis: effect on renal scarring. Arch. Dis. Child. 2001;84 : 241–246.
4. Rushton HG, Majd M. Renal scarring following reflux and nonreflux pyelonephritis in children: a follow-up study using 99mTc DMSA renal scintigraphy. J. Urol. 1992;147 : 1327–1332.
5. Wiswell TE. The prepuce, urinary tract infections and the consequences. Pediatrics 2000;105 : 860–862.
6. Svanborg C, Bergsten G, Fischer H, et al. Uropathogenic Escherichia coli as a model of host–parasite interaction. Current Opinion Microbiol. 2006;9 : 33–39.
7. Dolezel Z, Mach V, Kopecna L, Starha J, Dostalkova D. Diagnosis of acute pyelonephritis in childhood: comparison of ultrasonographic examination and renal scintigraphy using 99mTc DMSA. Bratisl. lek. Listy 2000;101(9): 495–498.
8. Jodal U, Lindberg U, Lincoln K. Level diagnosis of symptomatic urinary tract infections in childhood. Acta Paediatr. Scand. 1975;64 : 201–208.
9. Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. 16th informational supplement. M100-S16. CLSI, Wayne, P.A., 2006.
10. Garcia MI, Labigne A, Le Bougenec CL. Nucleotide sequence of the afimbrial-adhesin-encoding afa-3 gene cluster and its translocation via flanking IS1 insertion sequences. J. Bacteriol. 1994;176 : 7601–7613.
11. Yamamoto S, Terai A, Yuri K, et al. Detection of virulence factors in Escherichia coli by multiplex polymerase chain reaction. FEMS Immuno. Med. Microbiol. 1995;12 : 85–90.
12. Kovács L, Podracká Ľ, Jankó V. Infekcia močových ciest u detí. Pediatr. pre Prax 2008; 4 : 220–224.
13. Jahnukainen T, Chen M. Mechanisms of renal damage owing to infection. Pediatr. Nephrol. 2005;20(8): 1043–1053.
14. Beetz R, Bachmann H, et al. Urinary tract infections in infants and children – a consensus on diagnostic, therapy and prophylaxis. Urologe A 2007;46(2): 114–118, 120–123.
15. Feber J, Špatenka J, Seeman T, et al. Urinary tract infections in pediatric renal transplant recipients – a two center risk factors study. Pediatr. Transplantation DOI: 10.1111/j.1399-3046.2008.01079.x.
16. Fanos V, Khoory BJ. Antimicrobial survey of urinary tract isolates from a pediatric department. J. Chemother. 1999;11(4): 255–259.
17. Prelog M, Schiefecker D, Fille M. Febrile urinary tract infection in children: ampicillin and trimethoprim insufficient as empirical mono-therapy. Pediatr. Nephrol. 2008;23 : 597–602.
18. Haller M, Brandis M, Berner R. Antibiotic resistance of urinary tract pathogens and rationale for empirical intravenous therapy. Pediatr. Nephrol. 2004;19 : 982–986.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2009 Issue 9-
All articles in this issue
- Antimikrobiálna rezistencia uropatogénov u detí s febrilnými infekciami močových ciest
- Význam předoperačního vyšetření hemostázy u dětí před adenotomií a tonzilektomií
- „Café-au-lait“ makuly v diagnostike detských nádorových ochorení
- Návrh pokynov pre prevenciu, diagnostiku a liečbu detskej tučnoty
- Nová klinická jednotka DSD (Disorders of Sexual Development) – poruchy sexuálního vývoje
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- „Café-au-lait“ makuly v diagnostike detských nádorových ochorení
- Nová klinická jednotka DSD (Disorders of Sexual Development) – poruchy sexuálního vývoje
- Antimikrobiálna rezistencia uropatogénov u detí s febrilnými infekciami močových ciest
- Význam předoperačního vyšetření hemostázy u dětí před adenotomií a tonzilektomií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

