-
Medical journals
- Career
Up-to-date Situation with Gonorrhoea:
Prague STI Center Results – Antimicrobial Susceptibility Monitoring
Authors: M. Kojanová 1; I. Kuklová 1; M. Slováčková 2; J. Běláček 3; J. Štork 1
Authors‘ workplace: Dermatovenerologická klinika 1. LF UK a VFN, Praha přednosta prof. MUDr. Jiří Štork, CSc. 1; Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN, Praha přednosta prof. MUDr. Tomáš Zima, DrSc., MBA 2; Ústav biofyziky a informatiky 1. LF UK přednosta prof. MUDr. RNDr. Jiří Beneš, CSc. 3
Published in: Čes-slov Derm, 89, 2014, No. 5, p. 240-248
Category: Venereology
Overview
V České republice došlo v roce 2012 k výraznému nárůstu počtu případů gonorey o 62,1 % oproti roku 2011, v průběhu let se zhoršuje citlivost N. gonorrhoeae na antimikrobiální látky a současně se zvyšuje počet nově zjištěných HIV infekcí. Sledování citlivosti N. gonorrhoeae na antimikrobiální látky v souboru pacientů Dermatovenerologické kliniky VFN a 1. LF UK prokázalo vysoký podíl rezistentních kmenů. Při porovnání vývoje rezistence z let 2006 až 2010 a 2012 až 2013 došlo ke zvýšení rezistence na azitromycin z 3,9 % na 22,9 %, na cefotaxim z 0,6 % a 10,0 %, na penicilin z 86,5 % na 100,0 % a trvá vysoký podíl rezistence na ciprofloxacin v 71,3 % a 68,6 % i na tetracyklin v 80,3 % a 71,4 %. Přes tyto údaje se použití antibiotik v praxi dle statistik výrazně nemění. Článek poskytuje přehled o výskytu HIV a gonorey v ČR, ukazuje souvislosti jejich přenosu, informuje o citlivosti N. gonorrhoeae na antimikrobiální látky a o doporučených postupech léčby gonorey. Sledování epidemiologických souvislostí výskytu gonorey a její účinná léčba je zároveň preventivním opatřením proti šíření HIV.
Klíčová slova:
STI – gonorea – N. gonorrhoeae – MSM – rezistence – HIVÚVOD
Pohlavně přenosné infekce (STI – Sexually transmitted infection) představují celosvětově závažný zdravotní problém [14]. Mnoho studií potvrzuje hypotézu o vzájemné interakci STI a HIV infekce (Human Immunodeficiency Virus). STI mohou zvyšovat infekčnost osoby, která je zdrojem nákazy a zvyšují vnímavost u osoby, která je exponována. Z rozsáhlé metaanalýzy, která zkoumala vliv pohlavních infekcí na detekci a koncentrace HIV-1 v genitálním traktu vyplývá, že přítomnost STI zvyšuje přítomnost a vylučování viru HIV. Detekce HIV-1 se podstatně zvýšila při uretritidě (OR – odds ratio – 3,1), cerviciditě (OR 2,7), gonoree (OR 1,8) i chlamydiové infekci (OR 1,8). Tato analýza ukazuje, že u infekcí, které jsou spojeny s výrazným zvýšením koncentrace leukocytů v genitálním traktu, je současně zvýšené vylučování HIV-1 [21, 31] a uvedená fakta dokazují nutnost pečlivého sledování STI jako preventivního prostředku proti rozvoji šíření infekce HIV. K vyšší infekčnosti nemocného může přispívat i kombinace dalších STI. Ve studii mladých žen s gonoreou bylo prokázáno, že současná koinfekce s Chlamydia trachomatis je spojena s vyšší koncentrací původce gonorey a tím může zvyšovat riziko přenosu infekce kapavky. Současně více než 80 % žen bylo asymptomatických i při kombinované infekci, což vede k dalšímu možnému šíření infekce zejména v rizikových skupinách [36].
Ze sledování prováděných na našem pracovišti, z evropských i světových dat vyplývá stoupající počet STI ve skupině homosexuálních mužů (MSM – „Men who have Sex with Men“). Vzhledem k vysokému množství anonymních kontaktů nejsou dohledatelní depistáží a zůstávají tak zdrojem k šíření infekce [19, 20, 23, 29]. Ze systematického přehledu, který zjišťoval prevalenci sexu mezi muži v celkové mužské populaci, stejně jako mezi homosexuálními muži a prevalenci heterosexuálních aktivit s ohledem na výskyt STI bylo zjištěno, že zhruba 50 % MSM mělo někdy sex se ženou [6]. Střídání mužských a ženských partnerů přináší, zejména při nedostatečném užití kondomu, další rizika přenosu a šíření infekcí i ve skupině žen a heterosexuálních mužů (MSW – „Men who have Sex with Woman“).
Znepokojivý je vývoj počtu HIV infekcí v České republice (ČR). Od počátku sledování v roce 1985 do konce roku 2013 bylo v ČR diagnostikováno 2 248 případů HIV pozitivity, z toho 2 122 u občanů ČR a rezidentů se zastoupením 83,1 % mužů a 16,9 % žen. V posledních deseti letech došlo k více než trojnásobnému zvýšení incidence HIV (18 případů/1 milion obyvatel). Do roku 2011 byla ČR řazena do kategorie zemí s nejnižším výskytem HIV v Evropě. Vzhledem k nárůstu v roce 2012 byla překročena hranice výskytu dvou případů na 100 000 obyvatel a tímto nárůstem ČR své pozitivní prvenství ztratila. Počet nově diagnostikovaných případů v roce 2013, kdy bylo zjištěno 235 nových případů, představuje nejvyšší zaznamenaný výskyt v ČR (graf 1). Nejčastějším přenosem je pohlavní styk, celkem 95,3 % v roce 2013 se 76,6% zastoupením MSM. Vysoký podíl homosexuálního a bisexuálního přenosu je dlouhodobým a výrazně převažujícím trendem HIV infekce v ČR a od roku 2005 je ČR zemí s nejrychlejším nárůstem podílu nově hlášených případů HIV/AIDS mezi MSM v Evropě. Ačkoliv v roce 2011 došlo k mírnému poklesu počtu nově diagnostikovaných infekcí, rok 2012 potvrdil, že trend výskytu infekce HIV v ČR je dlouhodobě výrazně narůstající a bohužel pokračuje i nadále. Za první 3 měsíce roku 2014 bylo zjištěno 74 nových případů HIV pozitivity [24–27, 30, 35].
Graph 1. Počet nových případů HIV v ČR v jednotlivých letech 
Gonorea je po chlamydiové infekci druhou nejčastěji hlášenou bakteriální STI. Původcem onemocnění je gramnegativní diplokok Neisseria gonorrhoeae (NG) a k přenosu dochází přímou inokulací při kontaktu sliznic (přenos genito-genitální, genito-anorektální, oro-genitální, oro-anální) nebo z matky na dítě během porodu. U mužů se onemocnění obvykle projevuje 2–5 dní od nákazy symptomatickou uretritidou s výtokem (přítomný u více než 80 % nemocných) a dysurií (u více než 50 %) s méně častými komplikacemi, jako je epididymitida nebo prostatitida. Asymptomatické urogenitální infekce se objevují u méně než 10 % mužů. Infekce u žen je obvykle asymptomatická. U méně než 50 % žen může být přítomen vaginální fluor, bolesti podbřišku (< 25 %), dysurie (10–15 %) a vzácně metroragie či intermenstruální krvácení. Endocervikální infekce jsou z více než 50 % asymptomatické. Neléčená infekce může vést ke komplikacím, jako je chronická pánevní bolest, pánevní zánětlivé onemocnění (PID – Pelvic Inflammatory Disease), infertilita a mimoděložní gravidita. Extragenitální formy infekce (proktitida, faryngitida) jsou obvykle asymptomatické, a infikovaní pacienti jsou proto častým rezervoárem infekce. Diseminované formy infekce (např. tendosynovitida, artritida, meningitida, endokarditida, febrilie) jsou vzácné a objevují se méně než u 1 % infekcí. U novorozenců může vyvolavatel infekce zapříčinit infekci oka, která může vést k trvalé slepotě [4, 10, 16, 37]. Riziko přenosu gonorey při jednom sexuálním styku z infikovaného muže na neinfikovanou ženu je 50–60%, z infikované ženy na neinfikovaného muže 20%, kde riziko přenosu stoupá na 60–80 % po čtyřech a více expozicích [1, 15, 22].
Podle údajů WHO (World Health Organization) se ročně vyskytuje více než 106 miliónů gonokokových infekcí, ve Spojených státech se odhaduje každoročně 700 000 nových nákaz a hlášena je méně než polovina případů [8, 9, 28, 41]. V Evropě nemá počet hlášených případů gonorey jednotný trend. V západoevropských státech dochází, po přechodném poklesu v průběhu 70. a 80. let minulého století, k opakovanému nárůstu incidence zejména v severských zemích [32, 39]. Ve Velké Británii došlo v roce 2011 k zvýšení počtu případů o 25 % [33]. Počet hlášených případů kolísal v roce 2007 napříč Evropou od 0,3 případů/100 000 obyvatel v Itálii do 30,8 případů/100 000 obyvatel ve Velké Británii [34]. Podle dat ECDC (Center for Disease Control and Prevention) bylo v roce 2010 hlášeno 32 028 případů gonorey s průměrnou incidencí 10,4 případů/100 000 obyvatel. Incidence byla nejvyšší ve Velké Británii s 30 případy/100 000 a nejnižší s 0,6 případy/100 000 obyvatel v Lucembursku, což představuje celkově 18 580 a 3 případy gonorey v uvedených státech. [13].
V ČR pozorujeme pokles počtu případů gonorey od poloviny 90. let minulého století. V roce 1992 bylo hlášeno 7 455 případů (incidence 72,3/100 000 obyvatel). Od roku 1997 se incidence pohybuje od 7 do 10 případů na 100 000 obyvatel se vzestupem v roce 2007, po kterém dochází opět k mírnému poklesu a incidence se pohybuje okolo 7 případů/100 000 obyvatel. Historicky nejnižší počet onemocnění v ČR za desítky let byl zaznamenán v roce 2011, ačkoli došlo k meziročnímu poklesu o pouhých 6 % hlášených případů. V roce 2012 bylo zjištěno 1 151 infekcí, a dochází tak k výraznému zvýšení incidence na 11 případů/100 000 obyvatel, které představuje nárůst o 62,1 % oproti roku 2011 (graf 2). Počet infekcí tradičně převyšoval u mužů oproti ženám (16,5 a 5,6 případů/100 000). Nejvyšší nárůst incidence byl u mužů zjištěn ve věkové skupině 20–24 let (57,6 případů/100 000), kde byl dokonce o třetinu vyšší než v předchozích pěti letech, nicméně ke zvýšení došlo i v ostatních věkových kategoriích [30]. Nejvyšší počet hlášených případů onemocnění v ČR přichází z Prahy. Během jedenácti let (rok 2000 až 2010) bylo v Praze průměrně hlášeno 31,1 % ze všech případů v celé ČR, což představovalo 200–378 případů za rok, s průměrnou incidencí 23,8 případů/100 000 obyvatel (data zpracována podle údajů ÚZIS [30]). V roce 2012, s počtem 399 případů v hlavním městě, se incidence zvýšila na 32,1/100 000 obyvatel a u mužů dokonce na 52,5 případů při přepočtu na 100 000 [30].
Graph 2. Gonorea v ČR v absolutních počtech v průběhu let 
Při hodnocení výskytu gonorey v roce 2007 byla ČR ve „vůdčí pozici“ mezi evropskými státy a umístila se s incidencí 11,1 případů/100 000 obyvatel na 4. místě [34]. V roce 2010 hodnotilo ECDC incidenci gonorey v 21 evropských státech a ČR „klesla“ na 10. místo s počtem 7,1 případů/100 000 obyvatel [13]. Je zřejmé, že současný výskyt gonorey v ČR pozice změní.
Předpokládá se, že počet hlášených případů neodpovídá skutečnému výskytu infekce v populaci, nejčastěji z důvodu podhlášenosti, nedůsledností při vyplňování povinných hlášení, léčbou bez cíleného venerologického vyšetření i dispenzarizace nebo samoléčbou. Z těchto důvodů jsou epidemiologické studie důležité k posouzení výskytu nemoci ve vybraných populacích.
Celosvětově narůstajícím problémem je zvyšující se rezistence NG k antimikrobiálním látkám [5, 7, 28]. Již ve 40. letech minulého století se objevila rezistence na sulfonamidy a lékem volby léčby gonorey se stal penicilin s mnohaletou účinností. Pro vývoj rezistence se od poloviny 80. let doporučovaly chinolony s rychlou ztrátou účinnosti v 90. letech, kdy se nadějným lékem stal azitromycin. Pro zvyšující se rezistenci popsanou v mnoha zemích se azitromycin v monoterapii nedoporučuje a po roce 2000 jsou v léčbě preferovány cefalosporiny 3. generace (cefixim a ceftriaxon) [5, 28, 40, 41]. Bohužel, v posledních letech se objevuje zvyšující se rezistence i na tyto preparáty [10, 12]. Podle mezinárodního programu GISP (Gonococcal Isolate Surveillance Project), který sleduje prevalenci antimikrobiální rezistence NG, vzrostl podíl kmenů, u kterých je zvýšená minimální inhibiční koncentrace u ceftriaxonu, od roku 2006 z 0,05 % na 0,50 % v roce 2011 (mezi MSM z 0,0 % na 1,0 %) a u cefiximu z 0,1 % na 1,7 % (mezi MSM z 0,2 % na 4,7 %) [17]. Pro zvyšující se rezistenci není cefixim od roku 2012 k léčbě v monoterapii doporučen [11]. Obecně se podle GISP doporučuje při překročení hranice 5% rezistence změnit léčbu na jiný, efektivní preparát [17]. V rámci Evropské unie je citlivost NG k antimikrobiální terapii sledována v programu Euro-GASP (European Gonococcal Antimicrobial Surveillance Programme). V roce 2009 se u 5 % kmenů snížila citlivost na cefixim, dochází k vzestupu MIC ceftriaxonu a je vysoká prevalence rezistence na ciprofloxacin (63 %) a azitromycin (13 %) [12]. Tyto geografické a demografické ukazatele jsou velmi varující a připomínají v minulosti pozorované změny u kmenů NG rezistentních na chinolony. Snížená citlivost na antimikrobiální látky umožňuje šíření infekce, vznik multirezistentních kmenů a možnost vzniku komplikovaných gonoroických infekcí.
V posledních letech se výrazně rozšířilo testování NG pomocí moderních metod, které zvýšily záchytnost, ale neumožňují stanovení antimikrobiální rezistence, snižují počet prováděných gonokultivací a tím mohou způsobit ztrátu schopnosti tato vyšetření rutinně provádět. Například ve Spojených státech došlo mezi rokem 2004 a 2007 k navýšení počtu provedených vyšetření NAATs (Nucleic Acid Amplification Tests) z 11 % na 61 % a ke snížení počtu provedených gonokultivací z 18 % na 8 % [40, 41].
Vzhledem k pozorovanému vývoji rezistence byla v srpnu 2012 vydána aktualizace guidelines CDC z roku 2010 podle doporučení GISP [11] a došlo ke změně strategie léčby gonorey. Vzhledem ke snížení citlivosti cefiximu během let 2006–2011 se doporučuje léčit nekomplikovanou gonoreu ceftriaxonem (250 mg intramuskulárně – i. m.) a současně azitromycinem (1 g perorálně – p. o.) nebo doxycyklinem (100 mg 2x denně p. o.). Cefixim již není doporučen jako lék první volby a v případě, že je použitý jako alternativní lék, doporučuje se po týdnu kontrolní vyšetření. Snížená citlivost cefiximu a jeho další používání může urychlit vznik rezistence na ceftriaxon, který je posledním účinným preparátem na všechny lokalizace infekce. Na základě zkušeností s jinými mikroby, které rychle vyvinuly antimikrobiální rezistenci, se doporučuje kombinovaná léčba pomocí dvou antimikrobiálních látek s různými mechanismy účinku s cílem zlepšit účinnost léčby a případně oddálit vznik a šíření rezistence na cefalosporiny. Z tohoto důvodu je vhodné použití druhého antibiotika (azitromycin či doxycyklin). Použití azitromycinu jako druhého léku je oproti doxycyklinu výhodnější vzhledem k pohodlnější aplikaci a podstatně vyšší prevalenci rezistence gonokoků na tetracykliny. Jestliže není dostupný ceftriaxon, je alternativou léčby podání cefiximu (400 mg p. o.) v kombinaci s azitromycinem (1 g p. o.) nebo doxycyklinem (100 mg dvakrát denně p. o. po dobu 7 dnů). V případě alergie na cefalosporiny se doporučuje monoterapie azitromycinem ve zvýšené jednorázové dávce (2 g p. o.). U všech pacientů s kapavkou je nezbytné vyšetřit a případně léčit všechny partnery z předcházejících 60 dnů. Jestliže partner pacienta nemůže být vyšetřen, je vhodné zvážit kombinovanou léčbu cefiximem (400 mg) a azitromycinem (1 g) p. o. [11].
Evropské guidelines z roku 2012 doporučují u nekomplikované gonorey léčbu ceftriaxonem (250 mg i. m.) společně s azitromycinem, ale v dávce 2 g p. o. Jako alternativní režim v případě, že ceftriaxon není dostupný, se doporučuje cefixim (400 mg p. o.) a azitromycin (2 g p. o.). V případě rezistence či alergii na cefalosporiny, případně anafylaktické reakci na penicillin, se doporučuje spectinomycin (2 g i. m.) spolu s azitromycinem (2 g p. o.) [4, 38].
Při selhání léčby ceftriaxonem se podle WHO doporučuje léčba azitromycinem 2 g p. o. společně s gentamycinem 240 mg i. m. nebo spektinomycinem 2 g i. m. nebo monoterapie spektinomycinem či gentamycinem i. m. [41].
SOUBOR A METODY SLEDOVÁNÍ VE STI CENTRU
Venerologické oddělení (STI centrum) Dermatovenerologické kliniky 1. LF UK a VFN v Praze je pravděpodobně největším centrem pro diagnostiku STI v ČR. Ročně provádí 11 000–14 000 vyšetření na STI a diagnostikuje největší počet infekcí způsobených NG v Praze. Při porovnání počtu hlášených onemocnění kapavkou v Praze podle ÚZIS a počtu diagnostikovaných případů gonorey v STI centru, je možno údaje z tohoto oddělení považovat za dostatečný vzorek k hodnocení (tab. 1, graf 3).
Table 1. Počet případů gonorey v České republice, Praze a STI centru VFN 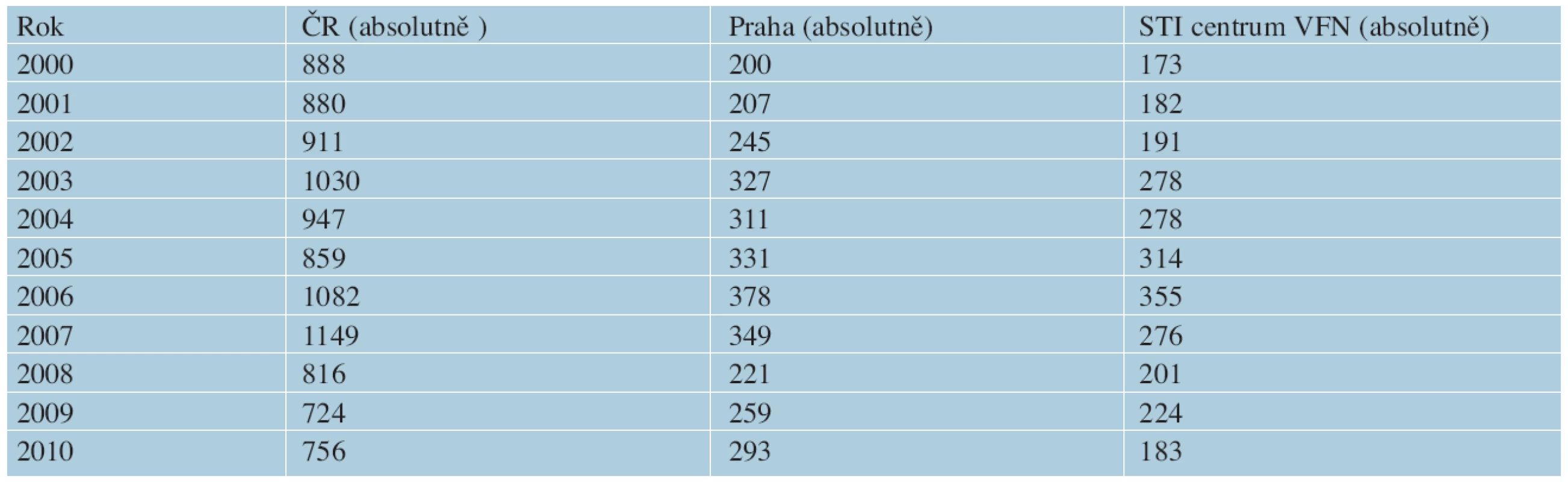
Graph 3. Poměr případů gonorey v Praze a v STI centru VFN 
V tomto centru byl během 3,5 roku, od prosince roku 2006 do konce května roku 2010, vyšetřen soubor 508 nemocných (Soubor I), kteří měli potvrzenou gonoreu, souhlasili s účastí a samostatně vyplnili anonymní dotazník. Dotazník sestával z 22 otázek a zahrnoval demografická data, otázky týkající se pohlavního života a rizik ve vztahu k STI, další částí sledování byl průběh samotného onemocnění. Shromážděná data potvrdila vysokou prevalenci gonorey u MSM (43,6 % z celkem 392 mužů), převahu symptomatických infekcí u mužů oproti ženám (73,7 % vs. 26,7 %), vysoký počet náhodných nechráněných styků (46,9 % mužů vs. 9,5 % žen) a nedostatečné používání kondomů (důsledně kondom používá pouze 12,2 % osob a nikdy nepoužívá 9,3 % osob). Pro účely tohoto sdělení se zaměřujeme na stanovení citlivosti NG na antimikrobiální látky.
Pro porovnání vývoje citlivosti NG jsme použili data pacientů vyšetřených již mimo dotazníkového šetření z období od září 2012 do května 2013 (Soubor II).
Metody diagnostiky N. gonorrhoeae
Podle subjektivních potíží nemocných a typu sexuálních praktik jsme prováděli výtěry z uretry, cervixu, rekta, orofaryngu, či odebírali vzorky moče. Kultivační vyšetření bylo provedeno na selektivním kultivačním médiu (modifikovaný krevní agar s přídavkem linkomycinu a kolistinu) v inkubátoru za teploty 37 °C v atmosféře obohacené 8,5 % CO2 po dobu 48 hodin s následným provedením oxidázové reakce a odečtem preparátu ve světelném mikroskopu s barvením podle Grama. Stanovení citlivosti NG na antimikrobiální látky (penicilin, tetracyklin, ciprofloxacin, azitromycin a cefotaxim) bylo provedeno pomocí difuzního diskového testu, od roku 2010 pomocí Etestu a u srovnávacího souboru v roce 2012 opět difúzním diskovým testem.
Výsledky citlivosti N. gonorrhoeae na antimikrobiální látky
Citlivost NG na antimikrobiální látky byla provedena u 248 kmenů.
Soubor I: u 178 pozitivních gonokultivací byla rezistence prokázána ve 3,9 % na azitromycin, v 0,6 % na cefotaxim, v 71,3 % na ciprofloxacin, v 80,3 % na tetracyklin a v 86,5 % na penicilin.
Soubor II: u 70 pozitivních gonokultivací, došlo ke zvýšení rezistence u azitromycinu na 22,9 %, u cefotaximu na 10,0 %, mírnému snížení rezistence u ciprofloxacinu na 68,6 % a tetracyklinu na 71,4 % a vývoji 100% rezistence na penicilin (tab. 2, graf 4).
Table 2. Citlivost N. gonorrhoeae na antimikrobiální látky v souboru I (2006–2010) a II (2012–2013) STI centra VFN 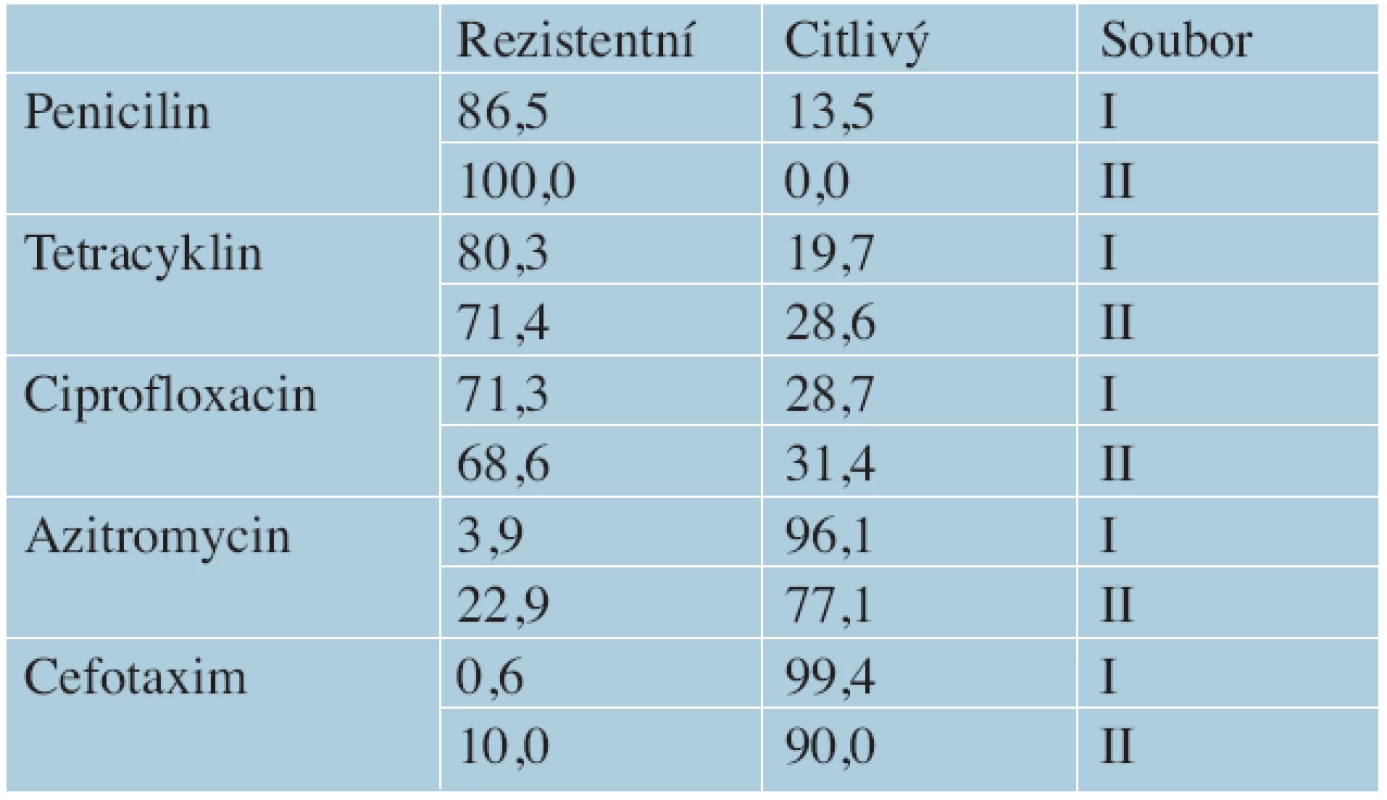
Graph 4. Citlivost N. gonorrhoeae na antimikrobiální látky v souboru I (2006–2010) a II (2012–2013) STI centra VFN 
ZÁVĚR
Uváděná selhání léčby, z minulosti prokázaná schopnost NG mutovat a vyvíjet rezistenci, spolu s laboratorními výzkumy naznačují možnost dalšího rozvoje cefalosporin-rezistentních kmenů v nadcházejících letech. Není zřejmé, jak rychle se bude rezistence vyvíjet, ale je nezbytné se na tuto situaci připravit. Vznik cefalosporinové rezistence by podstatně omezil možnosti léčby gonorey. Výskyt multirezistentních kmenů přináší značné zdravotní důsledky. Infikované osoby zůstávají infekční po delší časové období, perzistující infekce mohou zvyšovat počet komplikací (PID u žen a epididymitida u mužů) a zároveň usnadňují přenos HIV. Z těchto důvodů může zvýšená prevalence gonorey vést ke zvýšení počtu nových infekcí HIV [11]. Gonokoky jsou obvykle citlivé na málo používané antimikrobiální látky (např. kanamycin, gentamicin a spectinomycinu), nicméně se předpokládá, že rozšířené používání těchto antibiotik povede opět k vývoji rezistence. Dostupné údaje jasně ukazují velmi omezený výběr antimikrobiálních látek k léčbě gonorey a naléhavou potřebu nových možností léčby [11, 40].
Multirezistentní kapavka, kromě zdravotních komplikací, zvyšuje i ekonomickou zátěž na celý systém zdravotní péče. Odolné infekce prodražují léčbu i nutnou dobu zdravotní péče o nemocné. Modelová studie naznačila, že prevalence se v důsledku antimikrobiální rezistence zvýší o 7–40 % za rok, s předpokládaným sedmiletým trváním než se vývoj ustálí, což představuje 5,9 milionů nových infekcí v důsledku rezistence. Předpokládaný počet 5,9 milionu nových případů by měl za následek 255 000 případů PID u žen, které zahrnují zhruba 51 000 případů tubární infertility s předpokládanou cenou nákladů 585 milionů dolarů a odhadovaný počet 50 000 případů epididymitid u mužů s náklady 15 milionů dolarů. Současně se předpokládá vývoj 775 nových případů HIV za 7 let, zejména ve skupině MSM, s náklady 180 milionů dolarů [18].
Ačkoliv ve světě existují výše zmiňované programy sledující prevalenci antimikrobiální rezistence NG [12, 17], ČR nebyla do těchto programů zapojena a zároveň v ČR nejsou dostatečná data o sledování citlivosti NG na antibiotika. Na rozdíl od doporučených postupů k léčbě gonorey v jiných zemích [2, 3, 10, 11], podobná doporučení nebyla v ČR dosud vytvořena. Podle údajů GISP bylo v roce 2010 léčeno 96,5 % pacientů cefalosporiny, 0,5 % chinolony a pouze 1,7 % azitromycinem v monoterapii [17]. Z údajů zpracovaných z ÚZIS [30] vyplývá, že léčba gonorey v ČR neodpovídá doporučeným světovým, ani evropským postupům. Mezi roky 2007–2012 byla gonorea v ČR léčena ve 29,9 % azitromycinem, ve 22,9 % doxycyklinem a pouze ve 4,7 % ceftriaxonem. Zároveň značné procento (29,4 %) použitých antibiotik není specifikováno, a chybí tak důležitá data ke sledování (tab. 3).
Table 3. Léčba hlášených případů gonorey podle druhů užitých antibiotik ČR 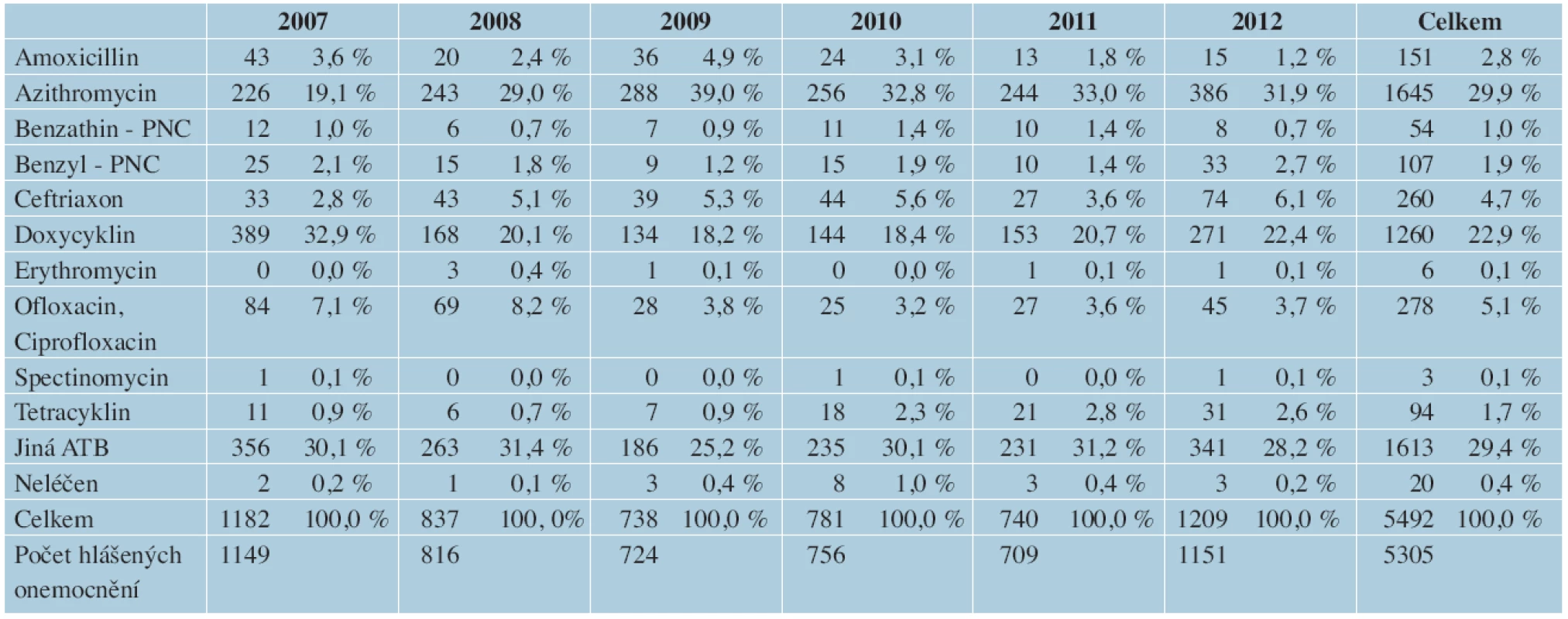
(zpracováno z údajů ÚZIS [30]) Pozn. Od roku 2004 je možno v hlášení PN uvádět více druhů užitých antibiotik u jednoho případu. Nárůstem rezistentních kmenů se gonorea stává obtížně léčitelnou, ztráta cefalosporinů může být velkým zdravotním problémem a nebezpečí, že se kapavka může stát neléčitelná je skutečné. Racionální používání antimikrobiálních látek a zajištění odpovídající léčby má zásadní význam k uchování léčebných možností a mělo by být podporováno poskytovateli zdravotní péče. Z tohoto důvodu je nutné i na území našeho státu přednostně testovat pomocí gonokultivace a sledovat citlivost původce k antimikrobiálním látkám. K omezení výskytu gonorey je nanejvýše důležité sledovat jak vlivy šíření infekce, zejména s ohledem na rizikové faktory, tak změny v antimikrobiální citlivosti a používat odpovídající léčbu. Bylo by přínosem přiklonit se k preventivním postupům doporučeným jak na evropské, tak světové úrovni a rozšířit testování pohlavně přenosných infekcí v rizikové populaci. Zároveň by tyto aktivity měly být podporovány složkami veřejného zdraví.
Přestože se jedná o výstupy z jednoho pracoviště a data mohou být ovlivněna i skladbou vyšetřených pacientů z hlavního města, vzhledem k dlouhodobě nejvyššímu záchytu pohlavních nemocí v této oblasti doufáme, že výstupy sledování mohou být přínosem i pro další regiony.
Do redakce došlo dne 30. 6. 2014.
Adresa pro korespondenci:
MUDr. Martina Kojanová
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 2
128 08 Praha 2
e-mail: kojanova.martina@vfn.cz
Sources
1. ARAL, S. O., FENTON, K. A., HOLMES, K. K. Sexually transmitted diseases in the USA: temporal trends. Sex. Transm. Infect, 2007, 83, p. 257–266.
2. BIGNELL, C. 2009 European (IUSTI/WHO) guideline on the diagnosis and treatment of gonorrhoea in adults. Int. J. STD AIDS, 2009, 20, p. 453–457.
3. BIGNELL, C., FITZGERALD, M. UK national guideline for the management of gonorrhoea in adults, 2011. Int. J. STD AIDS, 2011, 22, p. 541–547.
4. BIGNELL, C., UNEMO, M. 2012 European guideline on the diagnosis and treatment of gonorrhoea in adults. Dostupná na: http://www.iusti.org/regions/europe/pdf/2012/Gonorrhoea_2012.pdf
5. BOLAN, G. A., SPARING, P. F., WASSERHEIT, J. N. The Emerging Threat of Untreatable Gonococcal Infection. N. Engl. J. Med., 2012, 366, p. 485–487.
6. CÁCERES, C. F., KONDA, K., SEGURA, E. R., LYERLA, R. Epidemiology of male same-sex behaviour and associated sexual health indicators in low - and middle-income countries: 2003–2007 estimates. Sex. Transm. Infect., 2008, 84 (Suppl), p. 49–56.
7. CAMPOS-OUTCAL, D. CDC update on gonorrhea: expand treatment to limit resistance. J. Fam. Pract., 2011, 60, p. 736–740.
8. Centers for disease control and prevention (CDC). 2009 Sexually Transmitted Diseases Surveillance. Gonorrhea. Dostupné na: http:// www.cdc.gov/STD/stats09/gonorrhea.htm.
9. Centers for disease control and prevention (CDC). 2010 Sexually Transmitted Diseases Surveillance: Gonorrhea. 10. Centers for disease control and prevention (CDC). Sexually transmitted disease treatment guidelines. 2010, MMWR, 59, p. 1-110.
11. Centers for disease control and prevention (CDC): Update to CDC’s Sexually Transmitted Diseases Treatment Guidelines. 2010 Oral cephalosporins no longer a recommended treatment for gonococcal infections. MMWR, 2012, 61, p. 590–594.
12. COLE, M. J., UNEMO, M., HOFFMANN, S. et al. The European gonococcal antimicrobial surveillance programme. Euro. Surveill., 2009, 16, p. 19995.
13. European centre for (ECDC): Sexually transmitted infections in Europe 1990 disease prevention and control – 2010. ECDC Surveillance report, 2012, p. 1–69.
14. FENTON, K. A., LOWNDES, C. M. Recent trends in the epidemiology of sexually transmitted infections in the European Union. Sex. Transm. Infect., 2004, 80, p. 255–263.
15. FOWLER, T., CALAY, M., JOHAL, R. et al. Previous history gonococcal infection as a risk factor in patients presenting with gonorrhoea. Int. J. STD AIDS, 2010, 21, p. 277–278.
16. FUNG, M., SCOTT, K. C., KENT, C. K. Chlamydial and gonococcal reinfection among men: a systematic review of data to evaluate the need for retesting. Sex. Transm. Infect., 2007, 83, p. 304–309.
17. GONOCOCCAL ISOLATE SURVEILLANCE PROJECT (GISP). Dostupné na: http://www.cdc.gov/std/GISP.
18. CHAN, C. H., McCABE, C. J., FISMAN, D. N. Core groups, antimicrobial resistance and rebound in gonorrhoea in North America. Sex. Transm. Infect., 2012, 88, p. 200–204.
19. JAKOPANEC, I., GRJIBOVSKI, A. M., NILSEN, O. et al. Syphilis epidemiology in Norway, 1992–2008: resurgence among men who have sex with men. BMC Infect. Dis., 2010, 10, p. 1–9.
20. JACOPANEC, I., GRJIBOVSKI, A. M., NILSEN, O. et al. Trends in HIV infection surveillance data among men who have sex with men in Norway, 1995–2011. BMC Public Health, 2013, 13, p. 1–10.
21. JOHNSON, L. F., LEWIST, D. A. The Effect of Genital Tract Infections on HIV-1 Shedding in the Genital Tract: A Systematic Review and Meta-Analysis. Sex. Transm. Dis., 2008, 35, 11, p. 946–959.
22. KUKLOVÁ, I., KOJANOVÁ, M.,VELČEVSKÝ, P. Současný stav problematiky sexuálně přenosných onemocnění. Čes.-slov. derm., 2008, 83, s. 115–121.
23. KUKLOVÁ, I., VELČEVSKÝ, P., KOJANOVÁ, M. et al. Analýza příčin stoupající incidence syfilidy v pražské populaci. Čes.-slov. derm., 2009, 84, s. 350–355.
24. MALÝ, M., NĚMEČEK, V., STAŇKOVÁ, M. et al. Trendy vývoje a výskyt HIV/AIDS v ČR v roce 2012. Tisková zpráva Národní referenční laboratoře pro HIV/AIDS. Zprávy centra epidemiologie a mikrobiologie, SZÚ, 2012, 21, s. 398–399.
25. MALÝ, M., NĚMEČEK, V., ZÁKOUCKÁ, H. et al. Výskyt a šíření HIV/AIDS v ČR v roce 2011. Zprávy centra epidemiologie a mikrobiologie, SZÚ, 2012, 21, s. 388–398.
26. Národní referenční laboratoř pro HIV/AIDS, Tisková zpráva, Trendy vývoje a výskyt HIV/AIDS v ČR v roce 2013. Dostupné na: http://www.szu.cz/uploads/documents/CeM/HIV_AIDS /rocni_zpravy/2013/Tiskova_zprava_NRL_pro_HIVAIDS_Trendy_a_vyskyt_HIVAIDS_CR_2013.pdf
27. Národní referenční laboratoř pro HIV/AIDS: Zpráva k 31. 4. 2014. Dostupné na: http://www.szu.cz/uploads/documents /CeM/HIV_AIDS/rocni_zpravy/2014/HIV_AIDS_03_2014.pdf
28. NDOWA, F., LUSTI-NARASIMHAN, M., UNEMO, M. The serious threat of multidrug-resistant and untreatable gonorrhoea: the pressing need for global action to control the spread of antimicrobial resistance, and mitigate the impact on sexual and reproductive health. Sex. Transm. Infect., 2012, 88, p. 317–318.
29. NICOLL, A., HAMERS, F. F. Are trends in HIV, gonorrhoea, and syphilis worsening in western Europe? BMJ, 2002, 324, p. 1324–1327.
30. Pohlavní nemoci, UZIS. Dostupné na: http://www.uzis.cz/katalog/zdravotnicka-statistika/pohlavni-nemoci.
31. RęTTINGEN, J. A., CAMERON, W., GARNETT, G. Systematic Review of the Epidemiologic Interactions Between Classic Sexually Transmitted Diseases and HIV: How Much Really Is Known? Sex. Transm. Dis., 2001, 28, p. 579–597.
32. SAVAGE, E. J., HUGHES, G., ISON, C. et al. Syphilis and gonorrhoea in men who have sex with men: a European overview. Euro. Surveill., 2009, 14, p. 1–9.
33. SAVAGE, E. J., MARSH, K., DUFFELL, S. et al. Rapid increase in gonorrhoea and syphilis diagnoses in England in 2011. Euro. Surveill., 2012, 17, p. 20224.
34. Sexually transmitted infections surveillance in Europe (ESSTI). Annual Report, 2008, 3, p. 1–86.
35. STEHLÍKOVÁ, D., STUPKA, J. Ročenka Národního programu HIV/AIDS v České republice 2009–2010. ÚZIS, 2011, s. 1–175.
36. STUPIANSKY, N. W., VAN DER POL, B., WILLIAMS J. A. et al. The natural history of incident gonococcal infection in adolescent women. Sex. Transm. Dis., 2011, 38, p. 750–754.
37. TAO, G., IRWING, K. L. Gonorrhea prevention and clinical care in the private sector: Lessons learned and priorities for quality improvement. Sex. Trans. Dis., 2006, 33, p. 652–662.
38. UNEMO, M. The 2012 European guideline on the diagnosis and treatment of gonorrhoea in adults recommends dual antimicrobial therapy. Euro. Surveill., 2012, 17, p. 20323.
39. VELICKO, I., UNEMO, M. Increase in reported gonorrhoea cases in Sweden, 2001–2008. Euro. Surveill., 2009, 14, 34, p. 19315.
40. World Health Organization 2011, Report of the expert consultation and review of the latest evidence to update guidelines for the management of sexually transmitted infections. p. 1–36. Dostupné na: http://www.who.int/reproductivehealth/publications/rtis/rhr_11_37/en/
41. World Health Organization, Department of Reproductive Health and Research, Global action plan to control the spread and impact of antimicrobial resistance in Neisseria gonorrhoeae. p. 1–40. Dostupné na: http://www.who.int/reproductivehealth/publications/rtis/9789241503501/en/
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2014 Issue 5-
All articles in this issue
- Pretibiální myxedém
- Cheyletiellóza – málo známá parazitóza
-
Up-to-date Situation with Gonorrhoea:
Prague STI Center Results – Antimicrobial Susceptibility Monitoring - Struktura a funkce ekrinních potních žláz a možnosti ovlivnění produkce potu
- Závažná reakce typu generalizovaného bulózního fixního lékového exantému po nimesulidu – popis případu
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Struktura a funkce ekrinních potních žláz a možnosti ovlivnění produkce potu
- Pretibiální myxedém
- Cheyletiellóza – málo známá parazitóza
- Závažná reakce typu generalizovaného bulózního fixního lékového exantému po nimesulidu – popis případu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

