-
Medical journals
- Career
Úspěšná léčba pacientky s metastazujícím melanomem ipilimumabem
Authors: M. Arenbergerová 1; P. Šefrnová 1; E. Pojezná 1; E. Sticová 2; P. Arenberger 1
Authors‘ workplace: Dermatovenerologická klinika 3. LF UK a FNKV, Praha přednosta prof. MUDr. Petr Arenberger, DrSc., MBA 1; Ústav patologie 3. LF UK a FNKV Praha přednosta prof. MUDr. Václav Mandys, CSc. 2
Published in: Čes-slov Derm, 87, 2012, No. 5, p. 190-193
Category: Case Reports
Overview
Kazuistika popisuje případ ženy s metastazujícím melanomem. Vzhledem k progresi onemocnění při terapii dakarbazinem jí byl aplikován ipilimumab, plně humánní monoklonální protilátka IgG1, která se selektivně váže na antigen CTLA-4. U pacientky došlo ke kompletní remisi onemocnění, která přetrvává 12 měsíců.
Klíčová slova:
metastazující maligní melanom – dakarbazin – ipilimumab – kompletní remiseÚVOD
Metastazující maligní melanom patří mezi nejobtížněji léčitelné diagnózy s mediánem přežití mezi 6 a 9 měsíci. Přežití 5 a více let se uvádí pouze v 1–2 % případů. Ročně na melanom v ČR umírá téměř 350 osob. Na první pohled se toto číslo nezdá dramatické, ale značně nabývá na významu při skutečnosti, že se jedná obvykle o jedince v produktivním věku. Dosavadním standardem léčby, který slouží k hodnocení účinnosti nových preparátů, je již 35 let dakarbazin, jehož léčebná odpověď se pohybuje mezi 15 a 20 %.
Výsledky klinických studií posledních dvou let zásadně změnily přístup k léčbě metastazujícího melanomu. Jako účinná se ukázala imunomodulační léčba ipilimumabem zaměřená na aktivaci T-lymfocytů (a celého imunitního systému). Ipilimumab, monoklonální protilátka namířená proti CTLA-4 antigenu, dokázal jako první molekula v historii statisticky signifikantně prodloužit celkové přežívání pacientů s metastazujícím melanomem v klinických studiích.
POPIS PŘÍPADU
Pacientka (51 let) byla v péči naší melanomové ambulance. V osobní anamnéze uvedla, že v r. 2003 prodělala hlubokou žilní trombózu pravé dolní končetiny a trpí chronickou žilní insuficiencí.
V r. 2008 jí byl diagnostikován nodulární maligní melanom na vnější straně levého stehna s hodnotou Breslowa 2,4 mm a ulcerací, proto byla následně provedena biopsie sentinelové uzliny. Histologicky a imunohistochemicky byla v subkapsulárním splavu uzliny detekována mikrometastáza melanomu a pacientka podstoupila exenteraci lymfatických uzlin v levém třísle. Nález odpovídal stadiu IIIA, proto pacientka podstoupila roční imunoterapii interferonem alfa v dávkování 3 x 9 MIU s. c. týdně. V letech 2008–2010 byla v dispenzární péči naší kliniky. V r. 2010 byla při pravidelném stagingovém vyšetření objevena makrometastáza v lymfatické uzlině ve spádové oblasti levého třísla. Po její exstirpaci byla pacientka adjuvantně léčena rekombinantní vakcínou MAGE-A3+AS15 ASCI. V r. 2011 jí byla terapie vakcínou při vzniku několika podkožních metastáz v levém třísle a na levém stehně a následné generalizaci do plic ukončena.
Nemocná následně podstoupila léčbu dakarbazinem 850 mg/m2 i. v. á 3 týdny, která byla pro další progresi onemocnění po 3. cyklu přerušena.
Vzhledem k selhání systémové chemoterapie jsme pacientku začali léčit ipilimumabem, monoklonální protilátkou proti antigenu CTLA-4. Pacientka splňovala kritéria pro nasazení této imunoterapie – byla ve velmi dobré fyzické kondici, netrpěla žádným autoimunním onemocněním a předpokládaná doba přežití u ní překračovala 4 měsíce. Krevní odběry byly v mezích normy s výjimkou elevace laktátdehydrogenázy – 4,15 µkat/l. Ipilimumab byl aplikován intravenózně ve 4 infuzích á 3 týdny v dávce 3 mg/kg. První infuze proběhla za hospitalizace, ostatní v našem denním stacionáři. Z běžných nežádoucích účinků se objevily artralgie, únava, subfebrilie a lehký pruritus kůže. Žádný z těchto nežádoucích účinků nedosahoval stupně 3 nebo 4.
V průběhu léčby jsme pozorovali makroskopicky zvětšování podkožních nodulů na levém stehně (obr. 1). Jejich změna velikosti byla sledována i ultrazvukem (obr. 2). Ve 12. týdnu imunoterapie jsme jednu z metastáz excidovali a vyšetřili histologicky a imunohistochemicky (obr. 3 a 4). Vzhledem k masivnímu lymfocytárnímu infiltrátu a pozitivitě CD8 a CD4 T lymfocytů jsme předpokládali, že se nejedná o progresi, ale o tzv. pseudoprogresi onemocnění. Ta představuje nově popsaný jev u systémové imunoterapie, kdy před regresí metastáz může dojít k jejich přechodnému zvětšení – „pseudoprogresi“, která je vysvětlována infiltrací nádorové tkáně T lymfocyty. Při kontrolním vyšetření v 16. týdnu došlo nejen ke kompletnímu vymizení podkožních metastáz na levém stehně, ale i ke kompletní regresi plicních metastáz (obr. 5). Pacientka je po terapii ipilimumabem v dispenzární péči, pravidelné kontroly a zobrazovací metody probíhají za 2–3 měsíce a dosud 12 měsíců přetrvává kompletní remise onemocnění.
Image 1. Podkožní noduly – kožní metastázy na levém stehně pacientky 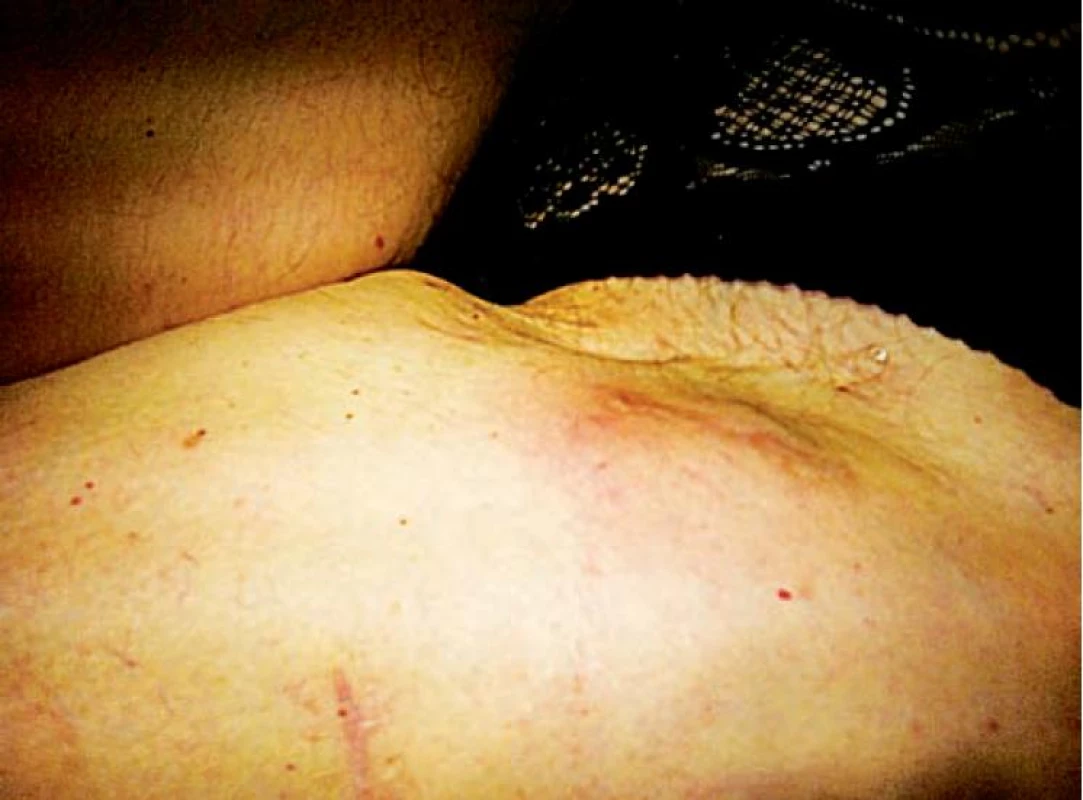
Image 2. Ultrazvukové vyšetření podkožní metastázy podléhající „pseudoprogresi“ a ve 4., B v 8. a C ve 12. týdnu 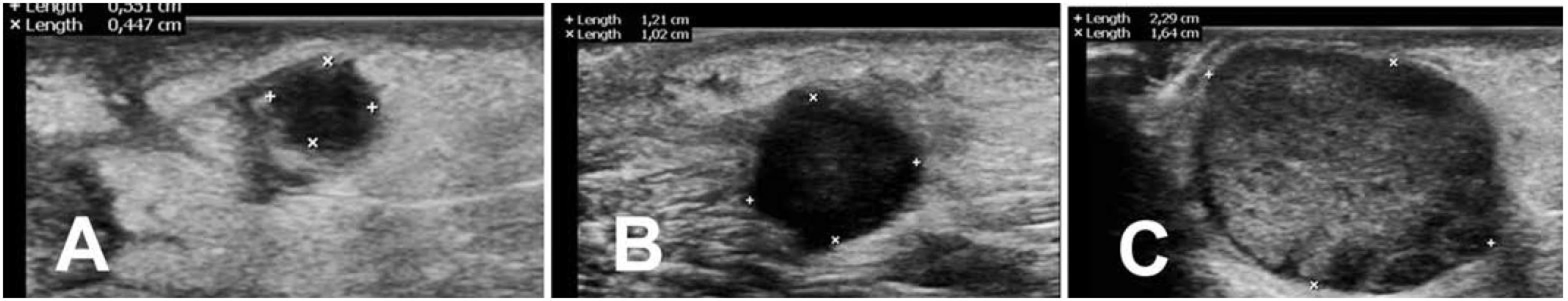
Image 3. Histologické vyšetření metastázy s masivním lymfocytárním infiltrátem (a – kožní metastáza, B – lymfocytární infiltrát) 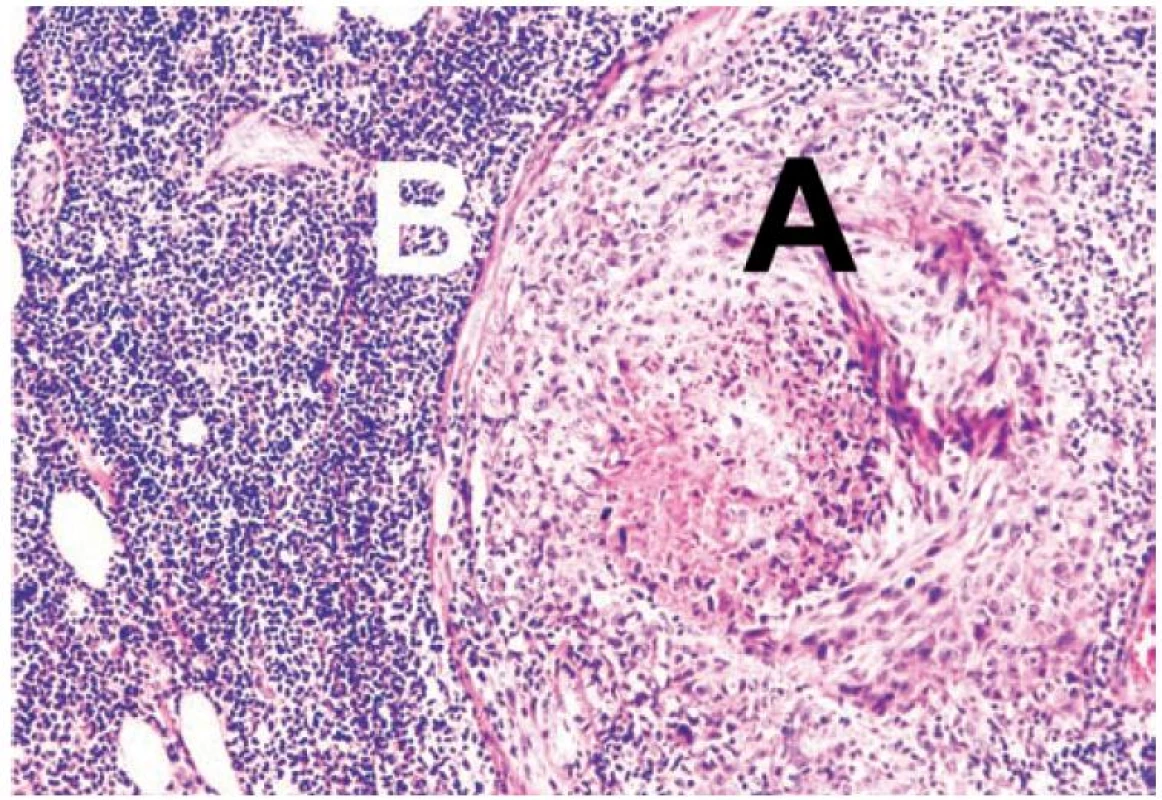
Image 4. Pozitivita Cd8 lymfocytů při imunohistochemickém vyšetření metastázy 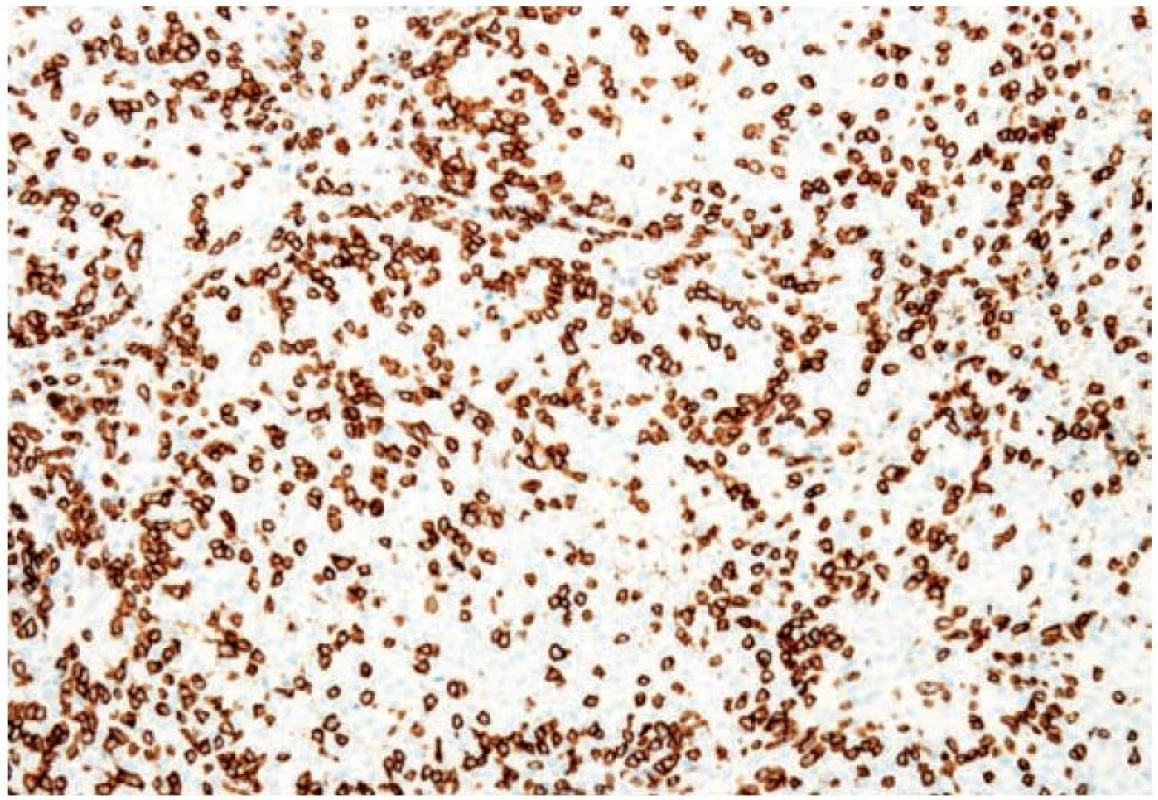
Image 5. Kompletní regrese plicních metastáz před a po terapii ipilimumabem (a týden 0, B týden 16) v Ct vyšetření 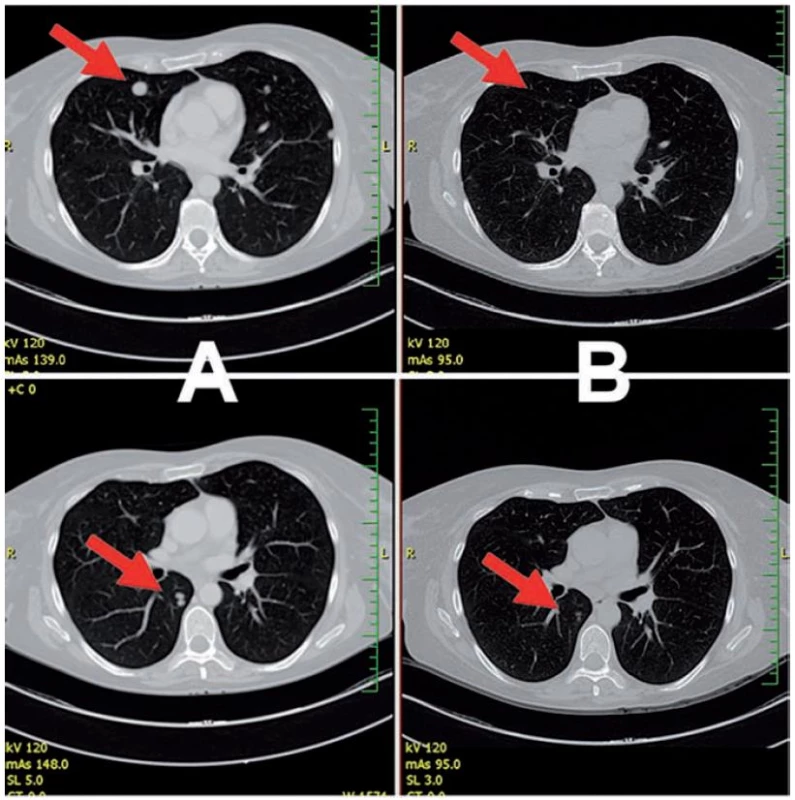
DISKUSE
Ipilimumab je plně humánní monoklonální protilátka IgG1, která se selektivně váže na antigen CTLA-4 (cytotoxic T-lymphocyte-associated antigen 4) nacházející se na povrchu T lymfocytů. CTLA-4 je klíčovým negativním regulátorem adaptivní imunitní odpovědi. Pro lepší představu funguje jako brzda imunitní reakce. Jeho zablokování vede „k odbrzdění“ imunitní protinádorové aktivity, k delší a silnější aktivaci T-lymfocytů a v ideálním případě k napadení a destrukci nádorové tkáně [3].
Na podkladě výsledků klinických studií, kdy ipilimumab dokázal jako první molekula v historii statisticky signifikantně prodloužit celkové přežívání pacientů s metastazujícím melanomem, byl 25. 3. 2011 v USA schválen Food and Drug Administration (FDA) pro léčbu pokročilého maligního melanomu ve 2. a následně i v 1. linii léčby. Později i evropská organizace European Medicines Agency (EMA) registruje ipilimumab pro 2. linii léčby, tedy po selhání chemoterapie. Ipilimumab jsme v ČR dosud mohli používat v rámci specifického léčebného programu nebo klinických studií. Momentálně v České republice probíhá řízení o stanovení úhrady z veřejného zdravotního pojištění.
Léčebné odpovědi u ipilimumabu jsou vyvolané aktivací imunitního systému a nádorová tkáň pak může zareagovat na terapii různými způsoby. Na podkladě jiných typů léčebných odpovědí při imunoterapii byla vypracována nová doporučení pro jejich posuzování nazvaná immune related response kriteria – irRC [4, 11]. Respektují fakt, že před regresí metastáz může dojít k jejich přechodnému zvětšení, tzv. „pseudoprogresi“, která je vysvětlována infiltrací nádorové tkáně T lymfocyty. Tento jev jsme zaznamenali i u kožních a podkožních metastáz popsané pacientky. Ani vznik nových metastáz při zmenšení stávajících nemusí znamenat progresi onemocnění. Tento jev je vysvětlován tím, že tyto metastázy existovaly již před počátkem léčby, ale měly rozměry pod hranicí detekce. Rozpoznání T lymfocyty vede k jejich infiltraci a zvětšení. Vzhledem k fenoménu pseudoprogrese a pozdějšímu nástupu léčebného účinku se první hodnocení provádí ve 12. týdnu léčby. Pokud je zaznamenána v tomto období progrese (a pacient je klinicky bez obtíží), měla by být tato progrese potvrzena v odstupu alespoň 4–6 týdnů.
V uvedeném případu jsme u pacientky zaznamenali kompletní remisi onemocnění po terapii ipilimumabem. Četnost kompletních remisí u ipilimumabu v monoterapii se pohybuje kolem 2 %. Přes velmi intenzivní výzkum v oblasti možných prediktorů odpovědi (FoxP3, IDO, ICOS, Th17, EOMES, CXCL11, CXCR3, NY-ESO-1 a další) zatím neexistuje prospektivně validovaný marker, který by pomohl predikovat, který pacient na léčbu zareaguje částečnou nebo kompletní remisí, či kdo bude k terapii rezistentní [1, 2, 6–10]. Pomyslným vodítkem může být výskyt nežádoucích účinků, jejichž intenzita a frekvence podle některých autorů koresponduje s dobrými odpověďmi na terapii [5]. Popsaná pacientka netrpěla typickými nežádoucími účinky ipilimumabu, jako jsou enteritidy, kožní exantém, vitiligo, endokrinopatie či hepatotoxicita, ale po celou dobu terapie i po ní si stěžovala na subfebrilie, bolesti hlavy, kloubů a masivní únavu. Stejné příznaky doprovázely i dvě imunoterapie, které prodělala před ipilimumabem – interferon alfa a rekombinantní vakcína recMAGE-A3+AS15 ASCI.
Nástup účinku léčby ipilimumabem nebývá rychlý jako u chemoterapie, aktivace imunitního systému může trvat řádově týdny až měsíce. K léčbě ipilimumabem je proto vhodné indikovat pacienty s předpokládanou dobou přežití alespoň 4 měsíce.
Léčebné odpovědi u ipilimumabu se pohybují okolo 15 %. Objevují se později než u chemoterapie nebo cílené léčby. Toto procento není vysoké, ale velmi slibná je doba trvání léčebných odpovědí. Jsou dokumentováni pacienti, kteří žijí i 4 roky od začátku terapie. Dalších přibližně 20 % pacientů profituje z léčby tím, že u nich dochází k dlouhodobé stabilizaci choroby. Efekt léčby na rozdíl od chemoterapie bývá často dlouhodobý a promítá se významně do prodloužení celkového přežití. Spekuluje se, že dochází k prolomení tolerance vůči nádorovým antigenům a k navození dlouhodobé imunitně zprostředkované kontroly onemocnění.
Do specifického léčebného programu na Dermatovenerologické klinice 3. LF UK a FNKV v Praze vstoupilo celkem 42 pacientů (22 žen a 20 mužů) s metastazujícím a neresekovatelným kožním melanomem nebo metastazujícím očním melanomem. Z hodnotitelných údajů jsme zatím zaznamenali 2 kompletní remise, 4 parciální remise a 6 stabilizací onemocnění.
Poděkování: Děkujeme MUDr. Bohumilu Sosnovi z Bioptické laboratoře, s. r. o., za spolupráci při zpracování imunochemických preparátů.
Do redakce došlo dne 10. 9. 2012.
Kontaktní adresa:
MUDr. Monika Arenbergerová, PhD.
Dermatovenerologická klinika 3. LF UK a FNKV
Šrobárova 50
100 34 Praha 10
e-mail: arenbergerova@email.cz
Sources
1. FU, T., HE, Q., SHARMA, P. The ICOS/ICOSL Pathway Is Required for Optimal Antitumor Responses Mediated by Anti-CTLA-4 Therapy. Cancer Research, 2011, 71, p. 5445–5454.
2. HAMID, O., SCHMIDT, H., NISSAN, A. et al. A prospective phase II trial exploring the association between tumor microenvironment biomarkers and clinical activity of ipilimumab in advanced Melanoma. Journal of Translational Medicine, 2011, 9, p. 204.
3. HODI, F. S., O’DAY, S. J., MCDERMOTT, D. F. et al. Improved Survival with Ipilimumab in Patients with Metastatic Melanoma. NEJM, 2010, 363, 8, p. 711–723.
4. KLENER, P., ŠŤASTNÝ, M. Posuzování léčebné odpovědi u zhoubných nádorů a potřeba úpravy kritérií pro hodnocení účinnosti imunoterapie. Remedia, 2010, 20, 5, p. 332–336.
5. MAKER, A. V., YANG, J. C., SHERRY, R. M. et al. Intrapatient dose escalation of anti-CTLA-4 antibody in patients with metastatic melanoma. J. Immunother., 2006, 29, 4, p. 455–463.
6. POSTOW, M. A., CALLAHAN, M. K., BARKER, C. A. et al. Immunologic correlates of the abscopal effect in a patient with melanoma. N. Engl. J. Med., 2012, 366, 10, p. 925–931.
7. RIBAS, A., COMIN-ANDUIX, B., ECONOMOU, J. S. et al. Intratumoral immune cell infiltrates, FoxP3, and indoleamine 2,3-dioxygenase in patients with melanoma undergoing CTLA4 blockade. Clinical Cancer Research, 2009, 15, p. 390–399.
8. YUANA, J., ADAMOWA, M., GINSBERGA, B. A. et al. Integrated NY-ESO-1 antibody and CD8+ T-cell responses correlate with clinical benefit in advanced melanoma patients treated with ipilimumab. Proc. Natl. Acad. Sci. USA, 2011, 108, 40, p. 16723–16728.
9. WANG, W., YU, D., SARNAIK, A. A. et al. Biomarkers on melanoma patient T Cells associated with ipilimumab treatment. Journal of Translational Medicine, 2012, 10, p. 146.
10. WEBER, J. S., HAMID, O., CHASALOW, S. D. et al. Ipilimumab increases activated T cells and enhances humoral immunity in patients with advanced melanoma. J. Immunother., 2012, 35, 1, p. 89–97.
11. WOLCHOK, J. D., HOOS, A., O’DAY, S. et al. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin. Cancer Res., 2009, 15, 23, p. 7412–7420.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2012 Issue 5
Most read in this issue- Kožní melanom: diagnostika, léčba a pooperační sledování
- Úspěšná léčba pacientky s metastazujícím melanomem ipilimumabem
- Sarkoidóza – případ s málo obvyklými klinickými projevy
- Fotodynamický antiseptický efekt fotoaktivních nanovláken při léčbě bércových vředů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

