-
Medical journals
- Career
Sarkoidóza
Authors: L. Lacina 1; K. Kubínková 2; G. Dostálová 3; P. Dundr 4; M. Kojanová 1; J. Štork 1
Authors‘ workplace: Dermatovenerologická klinika 1. LF UK a VFN, Praha přednosta prof. MUDr. Jiří Štork, CSc. 1; Oddělení TRN, Nemocnice Tábor přednosta: prim. MUDr. Kamil Kleňha 2; II. interní klinika 1. LF UK a VFN, Praha přednosta prof. MUDr. Aleš Linhart, DrSc. 3; Ústav patologie 1. LF UK a VFN, Praha přednosta prof. MUDr. Ctibor Povýšil, DrSc. 4
Published in: Čes-slov Derm, 84, 2009, No. 6, p. 303-316
Category: Reviews (Continuing Medical Education)
Overview
Sarkoidóza je závažné multisystémové onemocnění, které se u 25–50 % pacientů manifestuje i postižením kůže. Klinický význam úvahy o sarkoidóze v diferenciální diagnostice kožních projevů vyplývá z možného vztahu postižení kůže k postižení dalších orgánových systémů a současně i z dostupnosti kůže k histologickému vyšetření. Vzhledem k mimořádné variabilitě klinických projevů je sarkoidóza jedním z velkých „imitátorů“ jiných chorob a k správnému stanovení diagnózy je třeba zvážit klinický obraz, epidemiologická data, rentgenologický nález, laboratorní a histologická vyšetření. Autoři předkládají přehled literatury a osobní zkušenosti s diagnostikou a terapií.
Klíčová slova:
sarkoidóza – granulom – diagnóza – terapieÚvod
Sarkoidóza je chronické zánětlivé onemocnění charakterizované tvorbou epiteloidních granulomů. Přesto, že jde o granulomatózní onemocnění dlouho známé, které bylo v posledních více než sto letech intenzivně studováno, není do současnosti vytvořeno jednotné a všeobecně akceptované patofyziologické schéma a představy o etiologii se výrazně rozcházejí. Proto není přijata ani jednoznačná definice sarkoidózy jako nozologické jednotky, a proto je velmi obtížné validně hodnotit její incidenci (44). Vzhledem k multiorgánovému postižení musí být sarkoidóza chápána jako závažné systémové onemocnění a péče o pacienty by měla být striktně interdisciplinární.
Etiologie a epidemiologie
Úvahy o etiologii sarkoidózy pro její histologickou podobnost s tuberkulózou dlouhou dobu zahrnovaly zejména pátrání po infekčních původcích. Klasické histologické a kultivační metody ale dlouho selhávaly v demonstraci mykobakterií, či jim podobných mikroorganismů. S rozvojem molekulárně biologických metod byla opakovaně publikována sdělení týkající se nálezu DNA Mycobacterium tuberculosis, či M. avium intracellulare a jiných atypických (netuberkulózních) mykobakterií. Role zastižených nukleových kyselin je do současné doby nejasná. Jednotlivé studie udávají výskyt nukleových kyselin mykobakterií u 0–80 % testovaných vzorků, současně však i kontrolní vzorky byly pozitivní v 0–30 % (28). Za stávající situace nesplňuje žádný z těchto patogenů Kochovy postuláty, a tak nemůže být s jistotou prohlášen za původce sarkoidózy. Podle některých expertů nelze vyloučit u zmiňovaných studií ani možnost kontaminace. Obdobné úvahy vyvolávalo sledování i Propionibacterium acnes (30), nicméně pozdější sledování prokázalo častý výskyt této bakterie v uzlinách i u pacientů, kteří sarkoidózou netrpěli (18). Další úvahy byly vedeny k roli humánního herpetického viru 8 (11, 22), cytomegaloviru a coxsackie B viru (16), viru Epsteina-Barrové (31), Borrelia burgdorferi (58), Mycoplasma sp. (19), viru hepatitidy C (32). V mnoha studiích byl udáván natolik statisticky signifikantní rozdíl, který evokuje otázku, zda infekční agens nespouští pouze netypickou zánětlivou odpověď predisponovaného jedince. Nejspíše jedním z antigenů, který by takovou reakci spouštěl, by mohla být například specifická Mycobacterium tuberculosis kataláza-peroxdiáza (protein MKatG). Sarkoidóza by pak představovala následnou reakci na antigenní pozůstatky po proběhlé úspěšné imunologické destrukci mykobakterií (32).
Jinou podobnost lze nalézt mezi sarkoidózou a granulomatózním onemocněním vyvolaným expozicí beryliu, beryliózou (39). Rozsáhlá pátrání ale nebyla schopna prokázat asociaci ani mezi expozicí například beryliu, ani zirkonu (např. v deodorantech a antiperspirantech – 56), či aluminiu, a ani částicím jílu (41). Naopak se zdá, poněkud paradoxně, že choroba je častější u celoživotních nekuřáků (14). Incidence sarkoidózy v mnoha zemích má v průběhu roku kolísavý charakter, nejvíce případů bývá v Evropě popisováno na konci zimy a časně na jaře (3 a 34). Ve Skandinávii bylo rovněž neúspěšně pátráno po spojitosti s expozicí pacientů pylu borovic (37), který se v tomto období objevuje. Podle některých studií byl zjištěn vyšší výskyt sarkoidózy u pracovníků ve zdravotnictví (14). Výskyt sarkoidózy je znám na celém světě, existují však významné regionální rozdíly (45). Vzhledem k poměrně složité diagnostice představují publikovaná kazuistická sdělení, či dokonce přehledy sledovaných souborů, patrně v mnoha zemích jen fragment celkového počtu pacientů. Sarkoidóza zpravidla nepatří ani mezi povinně hlášené choroby, což dále ztěžuje odhady incidence a prevalence v populaci. I v rámci Evropy existují velmi dramatické rozdíly, incidence kolísá mezi 1,2 – 60/100 000 obyvatel (Španělsko vs. Švédsko). Onemocnění postihuje s lehkou převahou více ženy, nejčastěji mezi 25–35 lety, druhé maximum výskytu je zaznamenáváno mezi 45–55 lety (45). Onemocnění je velmi vzácné u dětí zejména do 6. roku života (46). Přesto se zdá, že v některých etnických skupinách je výskyt tohoto onemocnění, či dokonce některé jeho specifické formy, relativně častější (např. Skandinávci, Irové, Afroameričané, Japonci), i když ani zde není zcela vyloučen i spolupodíl socioekonomických faktorů zatěžujících určitou minoritu (57). Byl rovněž sledován familiární výskyt sarkoidózy a vyšší výskyt mezi jednovaječnými dvojčaty (48). Je současně známo, že u pacientů se sarkoidózou se častěji vyskytují některé alely HLA systému (41). Výrazná je tato asociace zejména s alelou HLA-DRB1, nejčastěji u Löfgrenova syndromu s haplotypem HLA-DRB1*0301/DQB1*0201. Byly vysledovány i vazby orgánového postižení na určitou variantu HLA DR1 (DRB1*0401 ve spojitosti s očním postižením, DRB3 s postižením kostní dřeně u Afroameričanů, DPB1*0101 ve spojitosti s hyperkalcémií u bělochů – 40). Zdá se, že některé z těchto haplotypů mohou mít v budoucnosti i význam pro predikci průběhu onemocnění (7).
Mezi další, méně časté, patří například polymorfismus v genu pro chemokinový receptor (butyrophilin-like 2) BTNL2 (48), ale i mnohé další. Do současnosti není zcela objasněno, jakým způsobem jsou spojeny tyto genetické vlohy s aktivací imunitního systému, zejména CD4+ T-lymfocytů (15). Určité zvláštnosti byly zjištěny i v jiných komponentách jak buněčné, tak i humorální imunity, např. TNF-α, IL7R (32,27). Lze tedy prozatím shrnout stávající poznatky tak, že sarkoidóza a její průběh představuje výslednici spolupůsobení komplikovaných faktorů vnitřních (genetická predispozice) i zevních (environmentální vlivy – 8, 43), které vedou k zánětlivé odpovědi blízké svým buněčným i humorálním charakterem reakci typu Th1.
Histologický obraz
Za typický histologický obraz sarkoidózy je považován granulom tvořený epiteloidně seskupenými makrofágy. Granulom může být zastižen kdekoli od papilární dermis až do hlubokého podkožního tuku (obr. 1). Na rozdíl od tuberkulózy v centru tohoto uzlíku nebývá zpravidla nekróza (pokud je vůbec přítomna, nebývá kaseózního typu, ale může mít rysy fibrinoidní nekrózy, chybí typický jaderný poprašek a její rozsah bývá limitovaný). Přítomnost nekrózy tedy ale sarkoidózu jistě nevylučuje. Bývají přítomny i obrovské mnohojaderné buňky Langhansova typu (obr. 2). V nich můžeme zastihnout inkluze, tzv. asteroidní inkluze, a Schaumanova konchoidní tělíska. Schaumanova tělíska, bazofilní podlouhlé útvary, představují patrně degenerující lysozómy a asteroidní inkluze zase pohlcené části kolagenu (obr. 3). Jejich výskyt není zcela specifický pro sarkoidózu. Granulom je obklopen jen řídkým, či téměř zanedbatelným lymfocytárním infiltrátem, což mu propůjčuje charakter tzv. „nahého granulomu“.
Image 1. Nekaseifikující „nahé“ granulomy v dermis, obrovské mnohobuněčné buňky Langhansova typu s věncem jader. 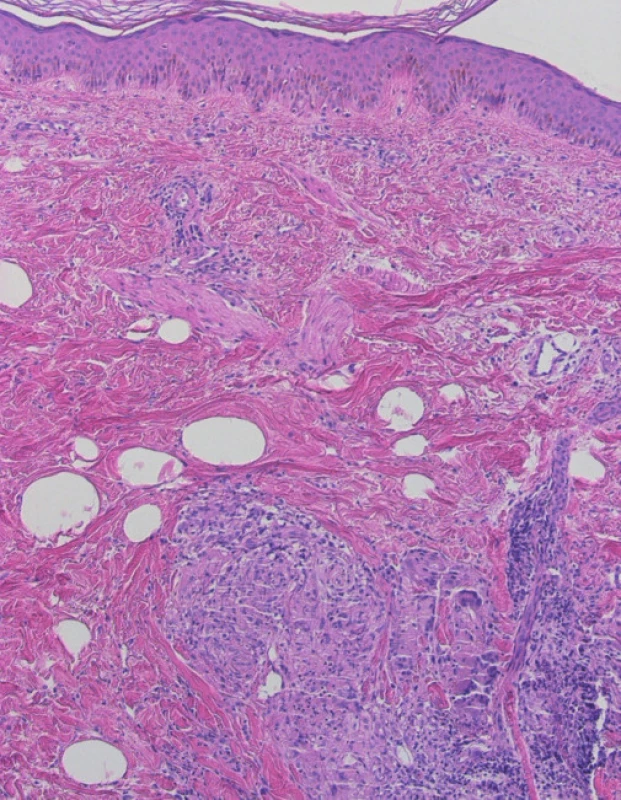
Image 2. Sarkoidóza v lymfatické uzlině, vícečetné nekaseifikující granulomy, nápadné obrovské mnohojaderné buňky Langhansova typu s věncem jader. 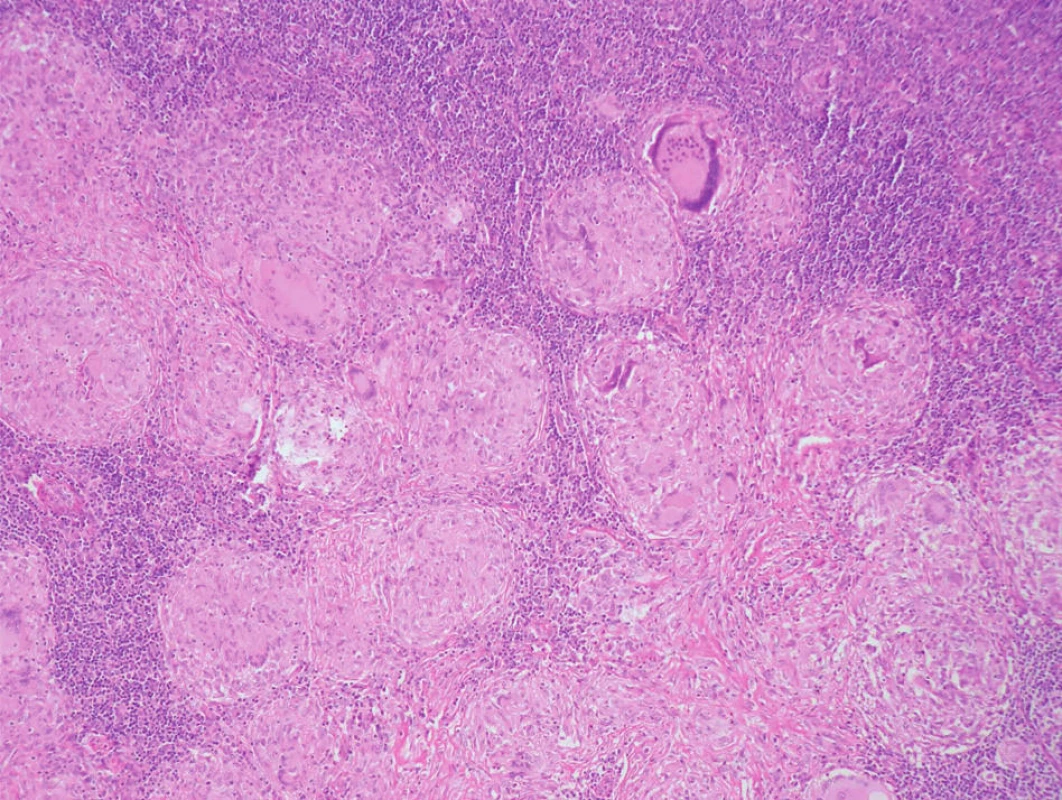
Image 3. Obrovská mnohojaderná buňka s asteroidní inkluzí 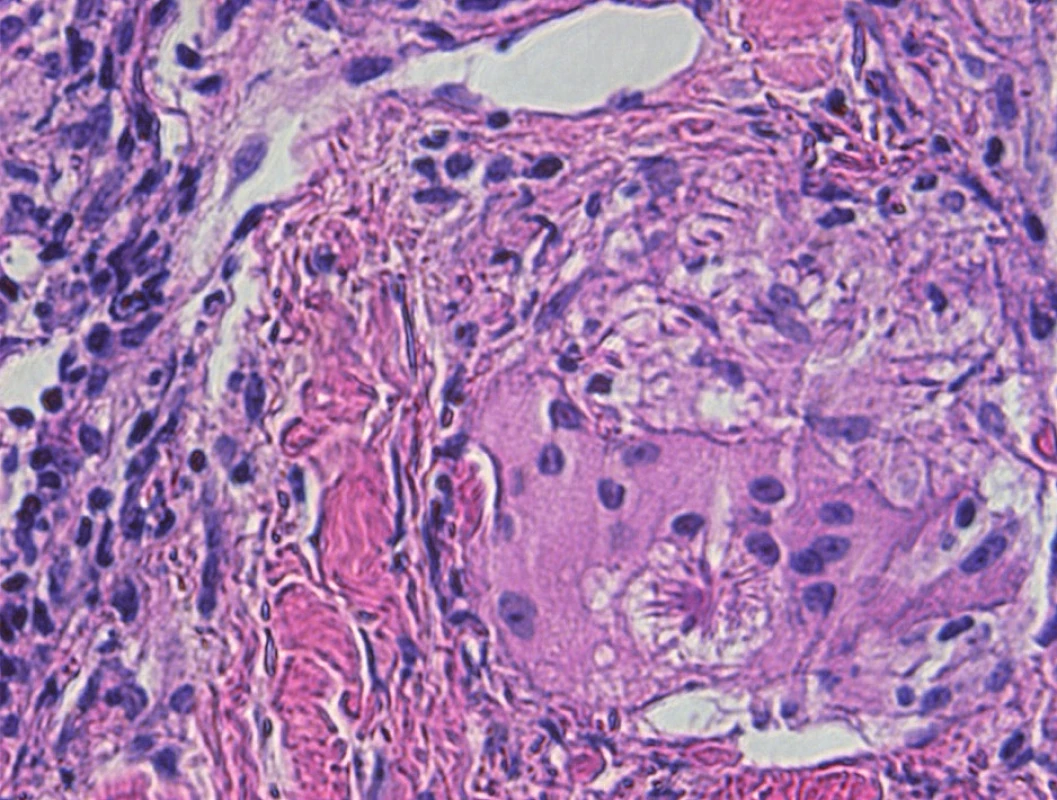
Změny epidermis bývají přítomny jen asi v polovině biopsií. Jedná se o změny druhotné, zastižena může být atrofie, jindy akantóza, až pseudoepiteliomatózní hyperplázie, někdy bývá přítomna i parakeratóza. V některých případech bývají nápadné i ektatické cévy (14).
Kožní projevy sarkoidózy
Kožní postižení, které je hlavním předmětem zájmu dermatologa, se vyskytuje až u čtvrtiny či poloviny všech pacientů, je tedy výrazně méně časté než postižení plicní (14). Nápadná a mnohdy až dramatická symptomatologie ale často předurčuje právě dermatologa alespoň k vyslovení podezření na toto onemocnění. Bohužel jsou kožní manifestace sarkoidózy velmi pleomorfní a i ona bývá (obdobně jako syfilis a erythematodes) označována jako „velký imitátor“ (50).
Kožní projevy sarkoidózy představují jednak projevy specifické, tzn. histologicky charakterizované sarkoidním granulomatózním zánětem, jednak projevy nespecifické.
Nespecifické projevy sarkoidózy
Erythema nodosum (obr. 4) je nejčastějším nespecifickým projevem sarkoidózy, který přivádí pacienta k dermatologovi často jako prvnímu odbornému lékaři. Tyto projevy se vyskytují asi u třetiny pacientů se sarkoidózou, zejména v akutně probíhajících případech s postižením plic (viz dále Löfgrenův syndrom). Histologicky ale nepředstavuje erythema nodosum granulomatózní projevy sarkoidního charakteru v užším slova smyslu. Typicky se jedná o septální panikulitidu, i když v některých případech mohou být v biopsii ze starších projevů zastiženy i drobné granulomy, které ale nemají rysy typické pro sarkoidózu. Erythema nodosum tedy musíme považovat za projev pouze nespecifický, vzhledem k jeho polyetiologickému charakteru, ale nesmíme sarkoidózu v úvahách opomíjet a musíme ji vyloučit (9).
Ostatní nespecifické nálezy zahrnují exantémy připomínající parainfekční nebo toxoalergické projevy, či dokonce erythema multiforme, dále i otoky dolních končetin, kalcifikace – ani v jednom případě však není histologie patognomická a jejich vztah k sarkoidóze je zčásti pochybný.
Specifické projevy sarkoidózy
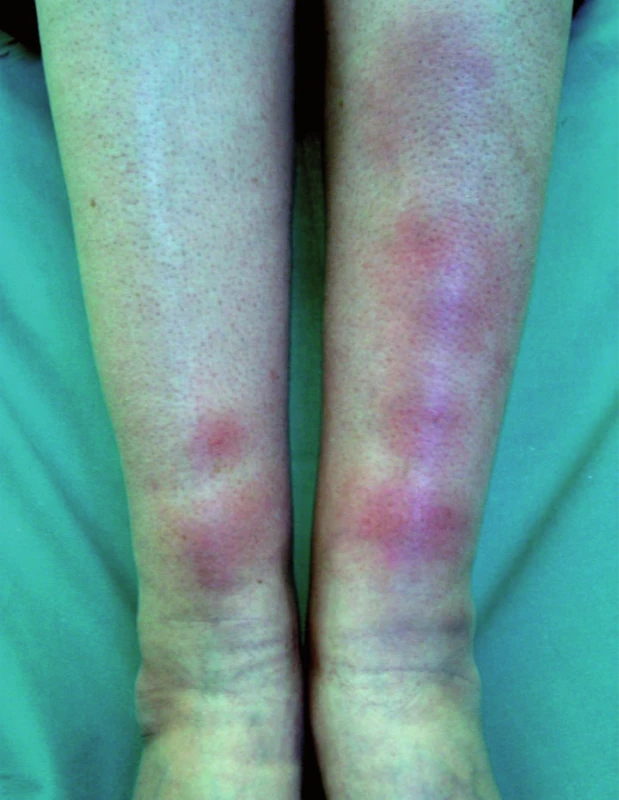
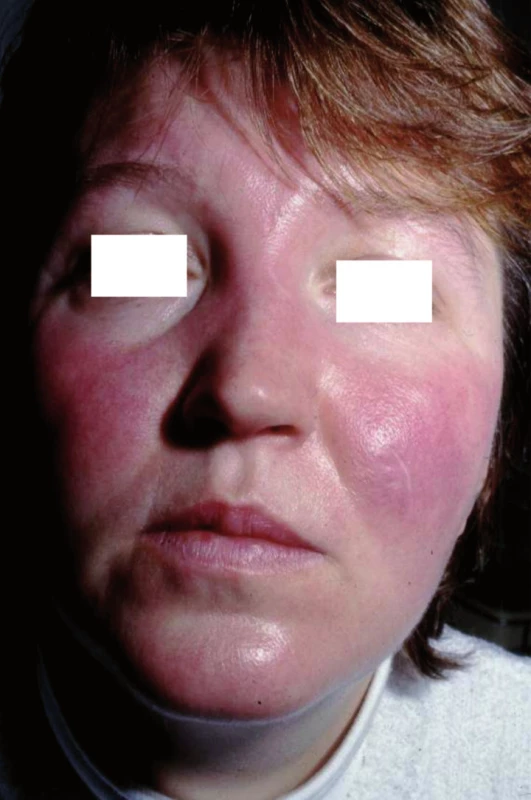
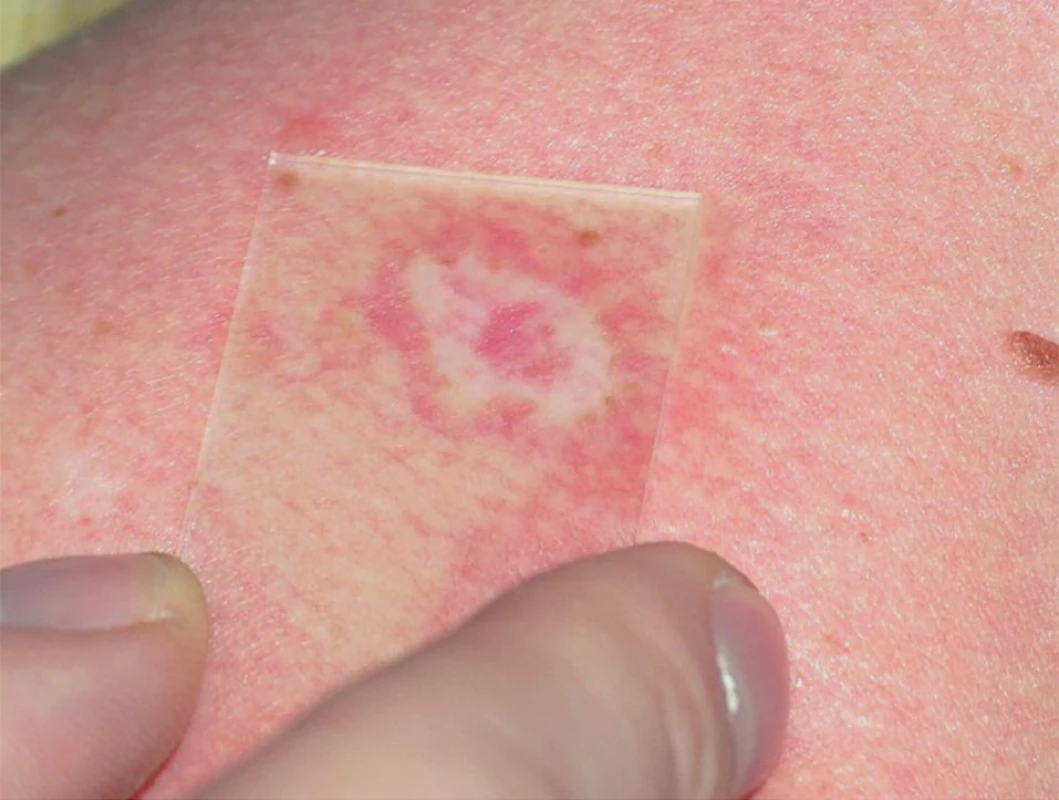
Specifické projevy s typickým histologickým obrazem vykazují nálezy u takzvané velkouzlové (seu nodulární, obr. 5) a ložiskové formy, které se projevují jako červenohnědavé, či až nafialovělé lividní uzly a ložiska postihující předvším obličej, extenzorové partie končetin, záda a hýždě. V některých případech lividní zbarvení tváří a nosu (vzácně akrálních partií končetin) je natolik výrazné, že svádí pomýšlet na poškození těchto partií chladem (perniones). Tato forma sarkoidózy, historicky označovaná pro klinickou podobnost s lupus vulgaris jako lupus pernio (obr. 6), bývá často spojena s chronickým průběhem a postižením drobných kostí rukou. V některých případech může být patrná i centrální regrese granulomu. Projevy tak mohou nabývat anulární či circinární konfigurace, někdy bývají i kryté šupinami; při vitropresi (obr. 7) nalézáme žlutavé zbarvení jen v okrajích. Diferenciálně diagnosticky přichází v úvahu psoriáza i choroby ze skupiny figurátních erytémů.
Image 5. Velkouzlová forma sarkoidózy. 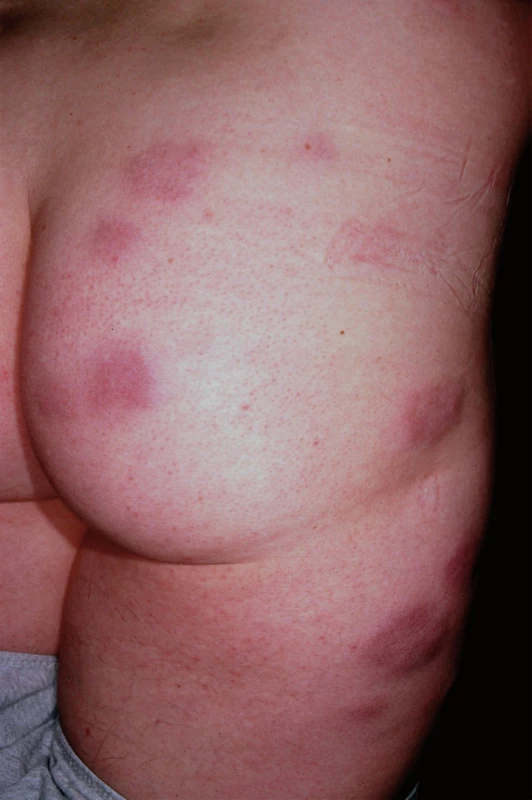
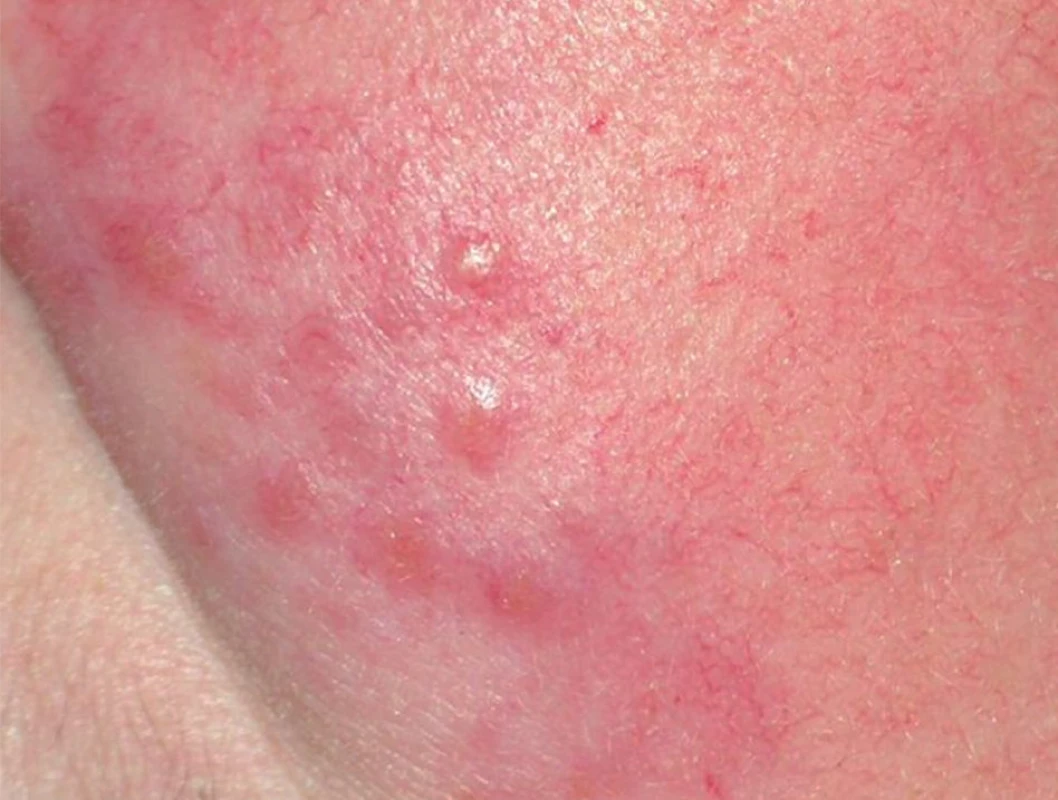
V některých případech, zejména na obličeji, je na povrchu projevů patrná velmi výrazně zmožená síť teleangiektazií, hovoříme pak o angiolupoidní formě (obr. 8). Při vitropresi po stlačení cév prosvítají tyto léze žlutohnědavě, barevný odstín bývá připodobňován k jablečnému želé. Toto vyšetření je velmi snadno dostupné a výsledek může mnoho napovědět, i když není zcela specifický a obdobný nález můžeme zaznamenat i u tuberculosis cutis, granulomatózní rozacey, granulomatózní periorificiální dermatitidy a lupus miliaris disseminatus faciei. Z dalších dermatóz pomýšlíme na erythematodes, benigní lymfocytární infiltraci, maligní lymfomy, necrobiosis lipoidica, morfeu, lichen planus, eczema nummulare, Kaposiho sarkom, erythema elevatum et diutinum, ale i sekundární syfilis. V některých případech připomínají proliferativní změny měkkých tkání až rhinophyma a otophyma (phyma řecky nádor), zde ze vzácnějších jednotek uvažujeme zejména při pozitivní cestovatelské anamnéze o lepře a leishmanióze. Jsou známy i vzácné případy, kdy velkouzlové postižení vedlo k výrazné mutilaci, v těchto případech pomýšlíme i na Wegenerovu granulomatózu a terciární syfilis, tvář někdy nabývá až charakteru facies leontina.
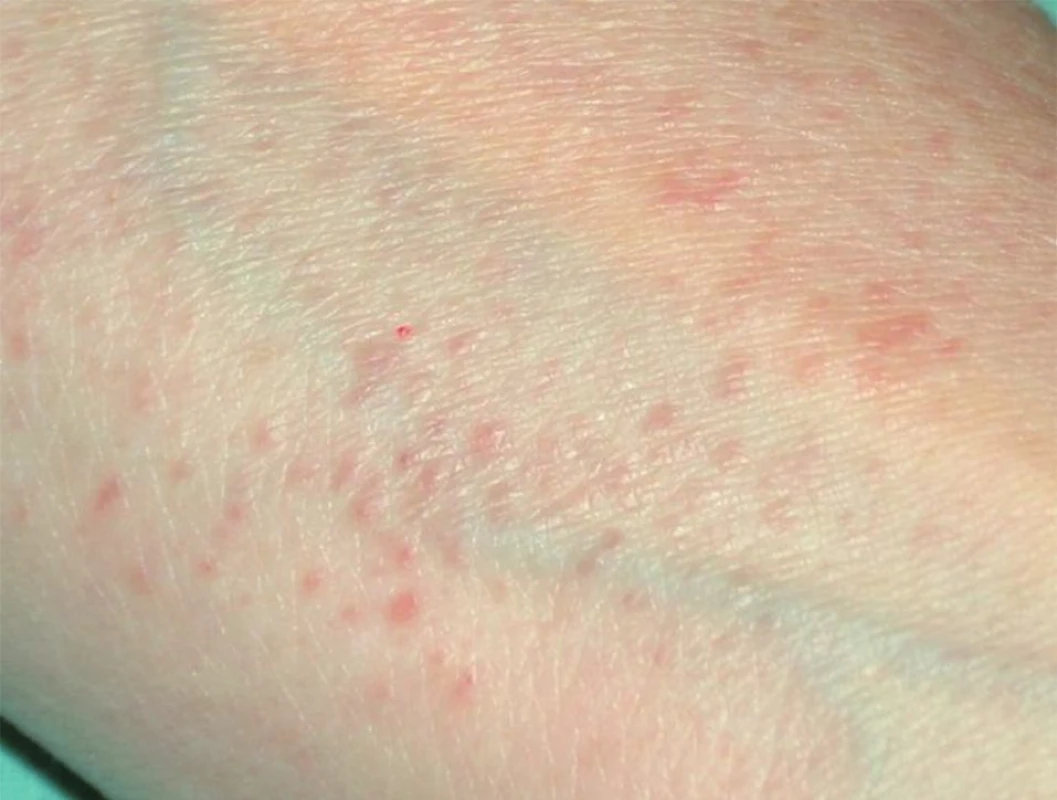
Oproti těmto větším a převážně nepříliš početným projevům může sarkoidóza velmi často klinicky imponovat jako drobné červenohnědožluté, či lividní papuly a makulopapuly o průměru do 10 mm (papulózní seu malouzlová forma, obr. 9). Diferenciálně diagnosticky zvažujeme zejména ve tváři akné, rozaceu, xanthelasmata, trichoepiteliomy, syringomy, adenoma sebaceum, sekundární syfilis, polymorfní světelnou erupci, erythematodes, lichen planus a granuloma anulare.
Při extenzivním postižení pak bývá používán termín miliární sarkoidóza (seu diseminonavaná malouzlová či mikropapulární forma), diferenciálně diagnosticky pak odlišujeme lichen nitidus a lichen scrofulosorum (při TBC).
Dosti vzácná je podkožní forma s tvorbou sarkoidních granulomů v podkožní tukové tkáni. Výsledkem pak bývá vtažení povrchových struktur a palpačně citlivá rezistence (tzv. sarkoid Darier – Roussy, obr. 10 a 11). Jinak ovšem specifické projevy sarkoidózy způsobují pacientům subjektivní obtíže spíše zřídka, jen menšina pacientů udává pruritus. Diferenciálně diagnosticky se snažíme odlišit podkožní metastázy nejrůznějšího původu, endometriózu, epidermoidní cysty, lipomy, revmatoidní uzly, erythema induratum, sklerodermii.
Image 10. Podkožní sarkoidóza – granulomy nahrazující lalůček podkožní tukové tkánů s četnými obrovskými mnohojadernými Langhansovými buňkami a membranocystickou degenerací podkožní tukové tkánů. 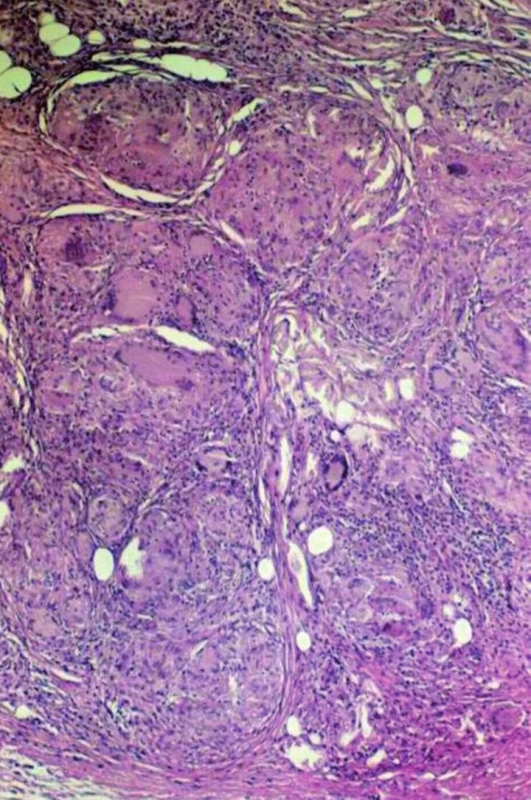
Image 11. Podkožní sarkoidóza. 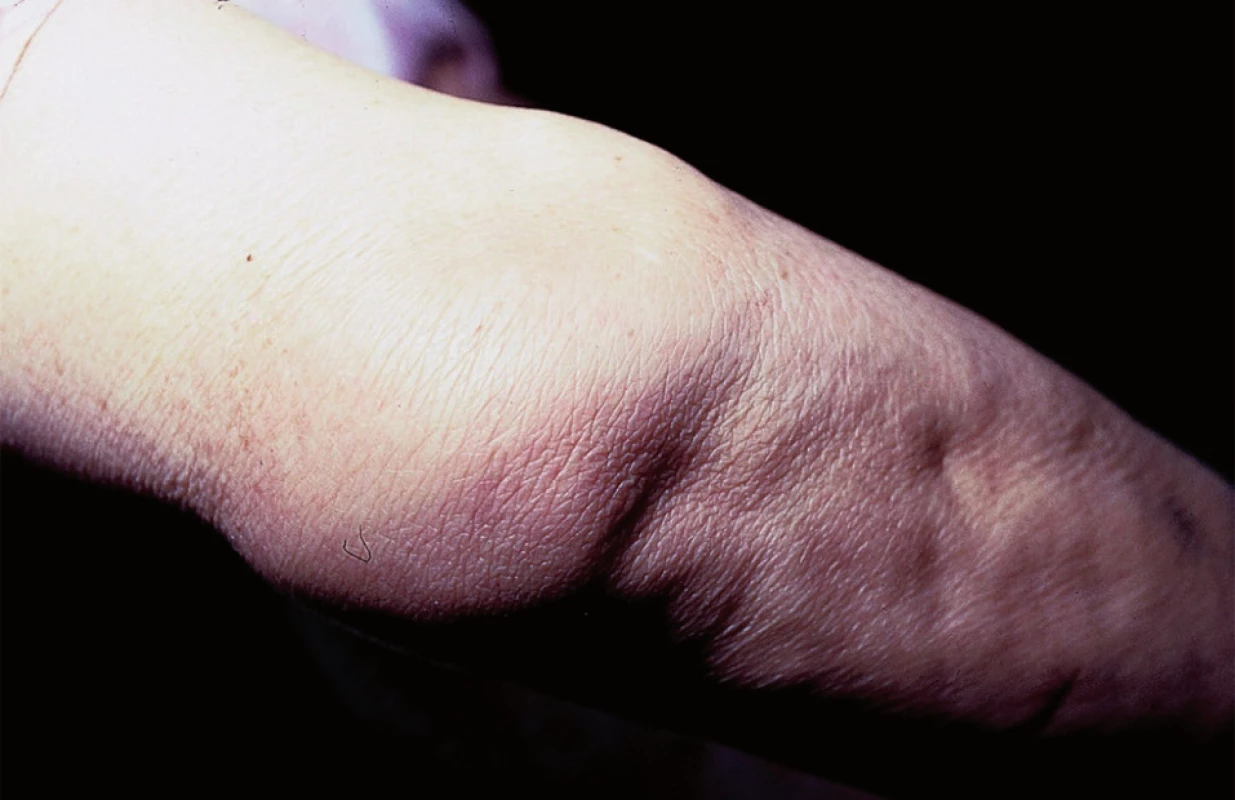
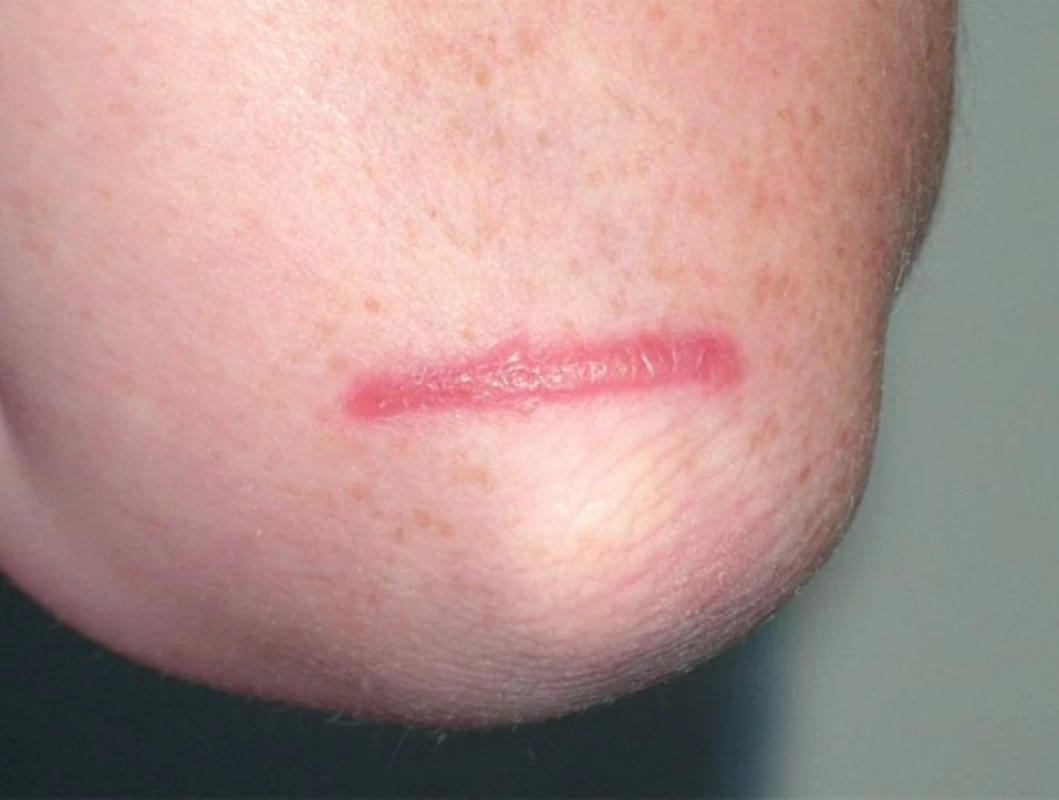
Velmi problematickým nálezem může být sarkoidní granulom v oblasti jizvy (obr. 12), zejména staršího data. Předpokladem všech úvah je, že v histologické laboratoři musí být materiál dokonale zpracován a dostatečně prokrájen. Pacienti s prokázanou sarkoidózou jeví velkou tendenci k tvorbě sarkoidních granulomů v oblasti poranění. Nemusí se vždy jednat o velkou operační jizvu, ke stejnému jevu může dojít i v oblasti například po venepunkci, či drobném traumatu, vzácností není ani lokalizace ve staré tetováži. Proto někdy i dodatečný nález cizího tělesa v tkáňovém bloku po prokrájení nevylučuje úplně sarkoidózu. Neocenitelným vyšetřením je z tohoto pohledu vyšetření preparátu ve fázovém kontrastu. Pokud tedy histologický závěr operuje s diagnózou sarkoidózy, je třeba pátrat pečlivě po postižení v jiných orgánových soustavách tak, aby mohla být definice onemocnění naplněna. Zdá se, že aktivita ložisek v jizvě do jisté míry odráží i aktivitu onemocnění.
Vzácně se sarkoidóza může manifestovat i jako atrofická, či naopak verukózní léze s tendencí k ulceracím (obr. 13). Raritní jsou formy projevující se ložiskovou hypopigmentací, častěji se vyskytují u jedinců tmavé pleti, či formy lichenoidní, ichtyoziformní, psoriaziformní, či erytrodermická (14).
Image 13. Sarkoidóza – ulcerózní typ. 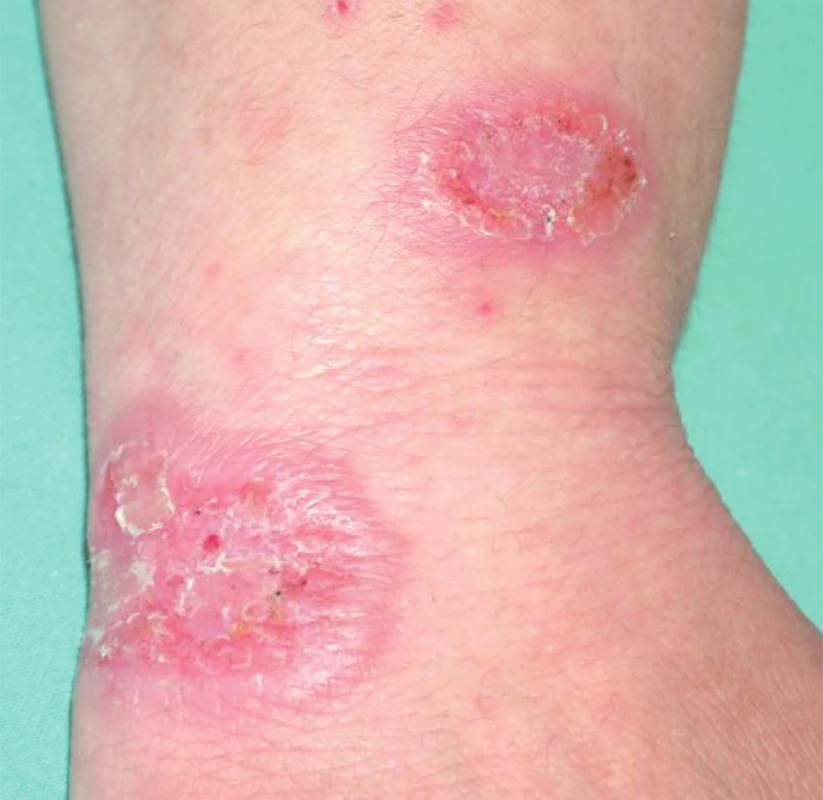
Sarkoidóza se může manifestovat i na kožních adnexech a sliznicích. Postižení kštice může být diskrétní, představované mírným erytémem a lehkou deskvamací, pak zvažujeme diferenciálně diagnosticky i dermatitis seborrhoica, či psoriázu. Někdy může vyústit i v ložiskovou, či difúzní ztrátu vlasů. Alopecie při sarkoidóze může být v některých případech spojena s jizvením. Diferenciálně diagnosticky pak odlišujeme alopecia areata, erythematodes, pseudopelade, paraneoplastickou alopecii, mucinosis follicularis a lichen planopillaris.
Poměrně vzácně postihuje i nehty (zde často v důsledku kostní změny cystického charakteru na distálním článku prstu). Na nehtech zastihujeme ztluštění nehtové ploténky, podélné rýhování, dyskoloraci, třískovité hemoragie, onychorexi, onycholýzu, onychodystrofii. Postižené nehty jsou křehké a lamelovitě se třepí. Mohou být přítomny i paličkovité prsty a s rozvojem plicního onemocnění i nehty tvaru hodinových sklíček. Diferenciálně diagnosticky musíme vyloučit mykotické infekce, psoriázu, lichen planus, trauma, virové akantomy a polékové poškození.
Slizniční postižení je v evropské populaci relativně častější než u jiných ras a manifestuje se převážně v orální lokalizaci papulami, noduly, někdy výraznějším otokem. Vyloučeny nejsou ale ani léze na jiných sliznicích. Diferenciálně diagnosticky zvažujeme Crohnovu chorobu, infekce nejrůznějších etiologií včetně mykóz a mykobakterióz, granulomy z cizích těles a syndrom Melkerssohnův-Rosenthalův a Miescherovu cheilitidu.
V genitální oblasti u obou pohlaví může být sarkoidóza vzácně příčinou ulcerací, kromě obligátní lues zvažujeme i tuberkulózu, lymphogranuloma venereum, Crohnovu chorobu, ale i granulomy z cizích těles a exulcerované tumory.
Jiné orgánové manifestace sarkoidózy
Sarkoidóza může postihnout prakticky kterýkoli orgán v lidském těle (tab.1). Klinické manifestace postižení tedy mohou nabývat značně variabilního charakteru a mohou se lišit jak rozsahem, tak závažností. Obecné symptomy jsou neurčité, zahrnují zvýšenou únavu, ztrátu tělesné hmotnosti, letargii. Pacient i lékař si ale těchto příznaků nemusí prakticky vůbec v některých případech povšimnout.
Table 1. Orgánové manifestace sarkoidózy (podle 14, 36, 40) 
U zhruba poloviny pacientů se vyskytuje suchý kašel, dušnost, občasná bolest na hrudi. I tyto příznaky bývají přehlíženy a zanedbávány.
Postižení horních dýchacích cest je relativně časté, zahrnuje nejrůznější stavy od obstrukce paranazálních sinů, destrukce chrupavek a kostí (včetně často bolestivého postižení ossa nasalia), někdy může napodobovat i vleklou infekci.
Postižení dolních cest dýchacích, ať již ve formě nitrohrudní lymfadenopatie (bilaterální hilové a mediastinální), či postižení plic, nebo dokonce kombinace obého, je přítomno u více než 90 % pacientů. Jedná se o nejčastější orgánovou manifestaci vůbec. Průběh plicního onemocnění může být akutní, či chronický. I rozsáhlé postižení může být zcela asymptomatické.
Akutní stav se vyznačuje obrazem infekčního onemocnění s febriliemi, artralgiemi, faryngitidou. Při postižení plicního intersticia se objevuje kašel, dušnost a bolesti na hrudi. Formu s bilaterální hilovou adenopatií (obr. 14) kombinovanou s erythema nodosum eventuálně s febrilií, artralgií a negativní tuberkulinovou reakcí označujeme jako Löfgrenův syndrom.
Image 14. Bilaterální hilová lymfadenopatie – stadium I. 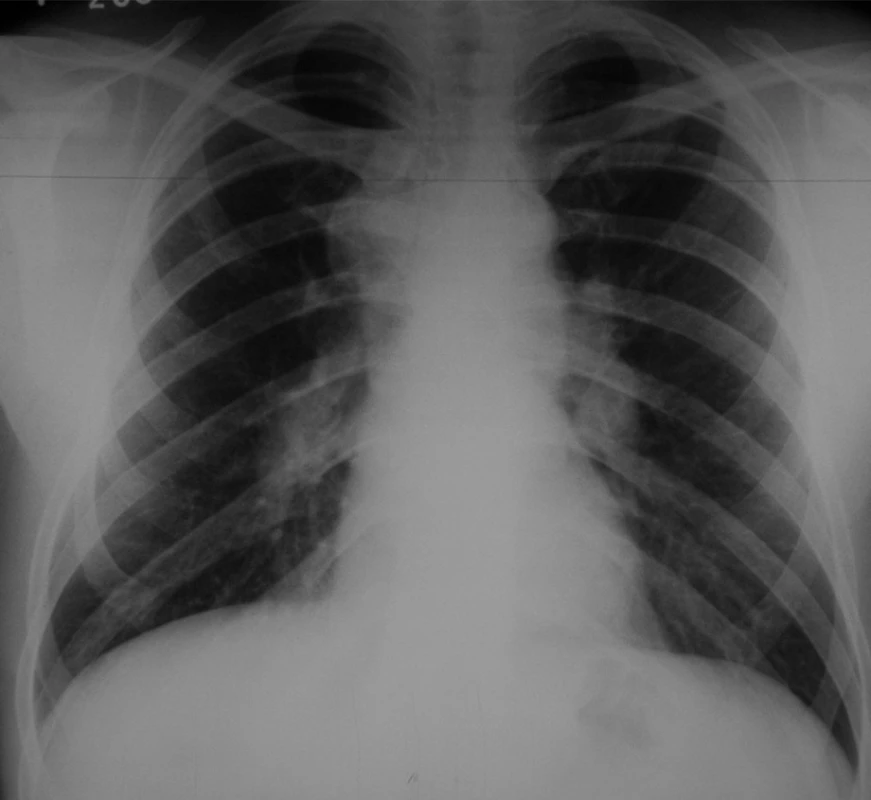
Chronická forma nemoci je charakterizována pozvolným nástupem. Dominuje zhoršující se intersticiální postižení plic (až plicní fibróza) s možným rozvojem respirační insuficience a cor pulmonale. Podle závažnosti nálezu na předozadním snímku je možno určit stagingová stadia 0 - IV.
Výrazné obtíže může pacientům přinášet artritida. Klinicky je někdy velmi obtížné při erythema nodosum bolest vycházející z postižených kloubů odlišit od bolesti vycházející z často přilehlých zánětlivých nodulů. Někdy, zejména v počátcích, kloubní postižení nabývá charakteru oligoartritidy a zejména při delším průběhu může nabývat až charakteru polyartritidy. Monoartritida je při sarkoidóze spíše neobvyklá. Náhlé zvýraznění kloubních obtíží je někdy prodromem zvýšené aktivity onemocnění i v ostatních systémech. Plíživý nástup progresivních kloubních změn jako u revmatoidní artritidy nebývá u sarkoidózy typický. U dětí může být sarkoidóza velmi vzácně rovněž příčinou revmatologických obtíží, zejména při velmi časném nástupu zvažujeme hereditární autosomálně dominantní tzv. syndrom Blau (granulomatózní polyartritida s tendosynovitidou, uveitida, kožní projevy) a pátráme po eventuálních dalších postižených příbuzných (46).
Postižení kostí je podle některých studií přítomno v 1–13 % případů (29). Klasicky bývají postiženy krátké kosti zejména rukou a nohou tvorbou kostních cyst patrných při rentgenovém vyšetření, postižení axiálního skeletu a velkých kostí je vzácné. Tento obraz byl popsán nejprve jako osteitis tuberculosa multiplex cystica v roce 1920 Junglingem (20). Klasická je asociace těchto kostních změn ve středních a distálních článcích prstů s obrazem lupus pernio, ale i jiných kožních změn. Obecně dominují při sarkoidních kostních lézích změny osteolytické, osteosklerotické změny jsou výrazně vzácnější. Tak vznikají klinicky patrné deformity a někdy i patologické fraktury. Tyto změny bývají někdy patrné i na konvenčním rentgenovém snímku, magnetická rezonance ale dokáže detekovat i subtilnější změny. Užitečná je tato zobrazovací metoda i při diferenciální diagnostice daktylitid. Léze dlouhých kostí bývají často asymptomatické, nicméně bolestivost není vyloučena. Postižení kostí axiálního skeletu včetně kalvy může být často zdrojem diagnostických rozpaků, zvažovat je třeba eozinofilní kostní granulom, vaskulární léze, ale i metastatické postižení (49, 4).
Klinicky manifestní postižení svalů je relativně málo časté (asi 1,5 %), i když sarkoidní granulomy byly ve svalech post mortem zastiženy u mnohem většího počtu pacientů (33). Nodulární sarkoidóza svalů může být někdy klinicky patrná při palpaci, jednoznačně vhodným vyšetřením je ovšem magnetická rezonance. Laboratorně může být přítomno v séru zvýšení kreatinkinázy a ostatních svalových enzymů, patologické změny může detekovat elektromyografie, klinicky v některých případech může být přítomna proximální svalová slabost, často chronicky pozvolna progredující. Akutní sarkoidní myozitida s myalgiemi je vzácná (25).
Postižení kardiovaskulárníhoaparátu je nyní považováno za mnohem rozšířenější, než jak se zdálo dříve (21). Často jsou přítomny změny i u mladých jedinců, někdy byly zjištěny i post mortem jako příčina neočekávaného úmrtí (36). Sarkoidní granulomy mohou infiltrovat převodní systém srdeční a způsobovat tak dysrytmii, abnormální EKG bylo popsáno až u 14 % pacientů se sarkoidózou. Mezi další komplikace může patřit dysfunkce papilárních svalů, srdeční selhání, perikarditida, ale i akutní koronární syndrom (24). Tyto projevy mohou být často asymptomatické, jen někdy jsou doprovázeny např. bolestí na hrudi, či jiným varovným příznakem. Neshoda mezi patologickoanatomickým nálezem při pitvě a klinicky dokladovanou sarkoidózou kardiovaskulárního aparátu je značná (36). U všech pacientů s jakoukoli manifestací sarkoidózy by tedy mělo být vzhledem k potenciálně fatálním následkům standardně prováděno podrobné vyšetření kardiologem.
Postižení trávícího ústrojí při sarkoidóze je rovněž dobře známo, i když nepatří mezi nejčastější (44). Dlouho známou formu představuje postižení slinných žláz, často doprovázené xerostomií (někdy včetně postižení slzných žláz tvoří až obraz sicca syndromu). Sarkoidóza může být dokonce i jednou z příčin tzv. Mikuliczova syndromu, tj. zvětšení slinných a slzných žláz a někdy i uzlin v oblasti hlavy a krku. Postižení dutých orgánů je vzácné a nebývá symptomatické. Ve stěně těchto orgánů bývají občas zastiženy typické granulomy, nejčastěji v antrum pylori, ale nezpůsobují funkční poruchy. Porucha pasáže ale může být vyvolána útlakem zvětšených lymfatických uzlin v blízkém okolí, podobně mohou být utlačeny venae hepaticae při Buddově-Chiariho syndromu. Postižení parenchymových orgánů bývá častější a významnější. Časté a primárně zcela asymptomatické granulomy bývají zastiženy v játrech, ve větším množství mohou vést k portální hypertenzi, i když vzhledem k obrovské rezervě jaterního parenchymu nejsou zpravidla dlouho patrny poruchy jaterních funkcí, laboratorně může být ale zvýšení jaterních testů patrné. V konečném důsledku může raritně granulomatózní proces nahradit až 90 % funkčního parenchymu (10). Méně často již při fyzikálním vyšetření, ale zejména na CT je možno zjistit hepatomegalii, či následně hepatosplenomegalii. Splenomegalie vyvolává sekvestraci některých krevních elementů s následnými změnami v krevním obraze (částečně lze ale připustit normochromní anémii a trombocytopenii i sníženou tvorbou při postižení kostní dřeně). Ascites bývá přítomen zejména v kombinaci s městnavým srdečním selháním, ale může doprovázet i vznikající jaterní cirhózu. Jen vzácně doprovází ascites granulomatózní postižení peritonea. Granulomy mohou být přítomny vzácně i v pankreatu, dále pak s jejich růstem může docházet k obstrukci pankreatického vývodu, či k obstrukci žlučových cest (17). Postižený pankreas nabývá nodulárního charakteru a bývá indurován, což může vést k mylné diagnóze neoplázie (5).
Renální postižení u sarkoidózy per se nebývá považováno za časté, i zde, stejně jako např. u jater, jsou patologickoanatomické nálezy mnohem častější než klinické podezření (36). Jsou známy i případy renálního selhání u jedinců mladšího věku (1). Kromě vlastního granulomatózního procesu (tubulointersticiální nefritis) jsou ledviny poškozovány poměrně často i hyperkalcémií a často i následnou nefrolitiázou.
Neurosarkoidóza patří mezi další méně časté, ale závažné, formy postižení. Jeho nejběžnější variantou (tj. 50–70%) jsou poruchy hlavových nervů, zejména nervus facialis (26). Útlak těchto nervů může být nejrůznějšího původu, může být výsledkem vzrůstajícího intrakraniálního tlaku, přímé intraneurální či perineurální tvorby sarkoidních granulomů, běžně i granulomatózní meningitidou při bázi lební. Poškození bývá unilaterální, ale může být i dokonale symetrické. V případě všech hlavových nervů je nutno odlišit lézi centrální od léze periferní (např. léze n.facialis při sarkoidóze glandula parotis). Mononeuritida bývá spojena s lepší prognózou než mnohočetné postižení. Někdy bývá paréza lícního nervu spojena s uveitidou, horečkou a zvětšením příušních žláz (febris uveoparotica), hovoříme pak o Heerfordtově syndromu. U pacientů s neurosarkoidózou bývá častější i závažná kardiovaskulární forma sarkoidózy. Mezi další významné projevy mohou patřit i epileptické záchvaty, které mohou poukazovat na morfologicky pokročilejší změny CNS. Rozsáhlé granulomy mohou být příčinou i obstrukce likvorových cest s rozvojem intrakraniální hypertenze a hydrocefalu. Samotná expanze nenádorové hmoty v intrakraniálním prostoru může mít fatální následky. Velmi komplikované mohou být následky poškození hypothalamu a hypofýzy. Výsledkem bývá hyperprolaktinémie, galaktorea, amenorea, hypothalamický hyperthyroidismus nebo diabetes insipidus. Diagnosticky cenná je v těchto případech magnetická rezonance, i když odlišení periventrikulární granulomatózní zánětlivé reakce od postižení při sclerosis cerebrospinalis disseminata nebývá jednoduché. Laboratorní endokrinologické testy mohou být i při morfologicky výrazném poškození normální a nemohou tedy diagnózu sarkoidního postižení vyvrátit.
Postižení míchy bývá různého charakteru, bývá přítomno postižení intramedulární, intradurální, či extradurální. Ani na nejlepších zobrazovacích metodách (CT, NMR, PET) není vždy možno sarkoidózu spolehlivě odlišit od neoplastických změn, situaci může komplikovat i terén kostních změn popsaných výše. Postižení periferního nervstva představuje jen menšinu případů. Může být přítomno poškození jednoho nervu, či naopak polyneuritida, vzácně až nabývající charakteru syndromu Guillain-Barré.
S postižením struktur CNS úzce souvisí i postižení zrakového ústrojí včetně tractus opticus a vizuální kůry mozkové. Může být přítomna diplopie nejčastěji plynoucí z parézy nervus oculomotorius (26). Poškozen může být ale samotný nervus opticus, v souvislosti se vzrůstajícím intrakraniálním tlakem bývá i edém papily optického nervu (23). Granulomatózní proces v orbitě může vést k exoftalmu, či obliteraci iridokorneálního úhlu s rozvojem glaukomu.
Postižena mohou být i víčka, spojivky a slzné ústrojí, což vede k rozvoji xeroftalmie. Závažné je zejména postižení živnatky – uveitida, která představuje jednu z velmi častých forem. Ať se jedná o přední, či zadní formu uveidity, někdy dokonce předchází ostatním příznakům systémového postižení (42).
Protokol vyšetřovacího postupu
K naplnění podmínek definice onemocnění je třeba kombinace několika vyšetřovacích postupů. Pro dermatologa je v mnoha případech základem histologické vyšetření, které je dále spojeno s pátráním po dalším prokazatelném postižení jiných systémů. Správné provedení biopsie (zejména vhodný typ projevu, velikost odebrané částky a hloubka, do které zasahuje) je klíčovým faktorem. I při technicky optimálním odběru je někdy nezbytné biopsii opakovat. V dalších krocích je vhodné vždy začínat od prostého předozadního rentgenového snímku hrudníku, který nepředstavuje pro pacienta velkou zátěž. Jedná se o velmi diagnosticky cenné vyšetření, které může odhalit změny i u jinak asymptomatických pacientů, nicméně vzácně je nutno připustit, že u některých pacientů s výraznou symptomatologií může být nález normální. Dermatolog by na něj měl pamatovat zejména v případech, u kterých by byla provedená histologie nespecifická (viz erythema nodosum). V některých případech je rentgenový obraz natolik typický, že je považován za diagnostický, snímek by měl vždy hodnotit rentgenolog ve spolupráci s pneumologem. Při pochybnostech je třeba provádět další zobrazovací metody (CT respektive HRCT, nebo magnetickou rezonanci, sonografii). Pneumolog provádí funkční vyšetření plic. Při nitrohrudní sarkoidóze bývá zjišťována především restrikční ventilační porucha (snížení hodnot statických plicních objemů – vitální kapacity a celkové plicní kapacity). Až u 60 % nemocných s plicním postižením bývá snížena difúzní plicní kapacita pro oxid uhelnatý (DLCO). Bývá snížena plicní poddajnost a u pokročilých forem nacházíme alveolokapilární blok. Můžeme prokázat i obstrukční ventilační poruchu a to nejčastěji jako projev postižení v periferních dýchacích cestách (granulomy, změny v peribronchiu). Stupeň funkční plicní poruchy ale nemusí korelovat se stadiem dle radiologického nálezu, i u stadií II a III mohou být ventilační parametry normální, s hypoxémií zhoršující se po zátěži.
Pro velmi typický obraz bývá literárně oceňována i galiová scintigrafie (znamení lambda a panda, tj. vychytávání radioizotopu v plicních hilech nebo slzných žlázách), i když v našich podmínkách nebývá vyšetření na některých pracovištích snadno dostupné.
S první představou o zjištěných změnách je možné v případě nutnosti dále vytipovat vhodnou tkáň pro histologickou verifikaci procesu, v případě kožního nálezu nejlépe lymfatickou uzlinu. V další etapě je možné uvažovat i o biopsii z dalších orgánů (např. játra), eventuálně v jiných případech je velmi cenná bronchoskopie s bioptickým vyšetřením sliznice a transbronchiální biopsií, bronchoalveolární laváž s určením poměru CD4/CD8. Cytolog posuzuje množství lymfocytů (až u 90 % pacientů se sarkoidózou zvýšené), eozinofilů a neutrofilů, charakteristický je poměr CD4+/CD8+. Poměr vyšší než 3,5 je specifický v 94–96 %, jeho senzitivita je však nízká a pohybuje se v rozmezí 52–59 %. Z dalších invazivních metod přichází v úvahu transbronchiální aspirace jehlou pod endobronchiální kontrolou ultrazvukem (EBUS TBNA) a mediastinoskopie, či videotorakoskopie.
Součástí vyšetřovacího protokolu by mělo být klinické vyšetření na oftalmologii a štěrbinovou lampou, dále i na kardiologii (vhodně rozšířené o holterovské monitorování a echokardiografii), na neurologii a u dalších specialistů podle stavu jednotlivých pacientů.
V laboratorním sledování se nelze spolehnout na určitý marker. Často uváděna byla hladina angiotenzin konvertujícího enzymu v séru (s-ACE), který bývá zvýšen. Nález ale není specifický pro sarkoidózu, objevuje se i u ostatních granulomatózních chorob (enzym je tvořen v makrofázích, které formují granulomy), nejde tedy o vyšetření diagnostické. Tento nástroj ale může do jisté míry sloužit k monitorování průběhu onemocnění. Z ostatních parametrů je vhodné sledovat renální funkce (urea a kreatinin) společně s kalcémií (častá je hyperkalcémie, tj. nad 2,6 mmol/l), která bývá zvýšena a může tak vést k závažným orgánovým změnám, zejména při hyperkalciurii (tj. odpad v moči nad 7,5 mmol/den). Dále vyšetřujeme moč chemicky a močový sediment, monitorujeme jaterní enzymy (alaninaminotrasferázu, aspartátaminotransferázu, alkalickou jaterní fosfatázu). V krevním obraze nalézáme nejrůznější změny, jakými jsou normocytární normochromní anémie, trombopenie, eozinofilie, leukopenie, lymfopenie, monocytóza.
Pacientům by měl být proveden tuberkulinový test (Mantoux II), u pacientů se sarkoidózou je patrná jen malá reaktivita až anergie. Obecně je tento fenomén platný i pro ostatní intradermálně aplikované antigeny (např. kandidin, trychophytin aj.)
Kveimův test bývá v souvislosti se sarkoidózou často do současnosti uváděn a dříve patřil mezi cenné diagnostické nástroje, falešná pozitivita byla udávána jen 1–3% (47). Podstatou testu byla iatrogenní iniciace imunologické reakce pacienta na intradermálně podávaný „Kveimův“ antigen. Touto substancí byla suspenze připravená z lidské sarkoidní tkáně (granulom z kůže, uzliny, ale převážně používán byl materiál ze sleziny). Po laboratorní úpravě (homogenizace, zahřátí, sonikace) následovalo podání intradermálně do kůže předloktí. Výsledek testu se odečítal za 4–6 týdnů, případně vzniklý uzlík v místě aplikace byl excidován a histologicky vyšetřen. Za pozitivní výsledek byl považován průkaz nekaseifikujících granulomů identické struktury jako u sarkoidózy. Vzhledem k riziku interhumánního přenosu infekčních agens (zejména viry, např. HIV, HCV aj., či priony, bakterie) při použití klasického antigenu je Kveimův test v Evropské unii již zcela opuštěn a neprovádí se. Pokusy o standardizaci a in vitro přípravu méně rizikových preparátů se nikdy úplně nezdařily (28).
Jako shrnutí výše uvedených diagnostických postupů je ale nutné připomenout, že sarkoidóza zůstává vždy diagnózou stanovenou „per exclusionem“ po vyloučení diagnóz ostatních.
Terapie
Bohužel, literárně uváděná léčebná doporučení jsou v případě sarkoidózy pouze empirická a velké klinické studie nebyly provedeny a nejde tedy zpravidla o medicínu založenou na důkazech (2). Volba terapie a její načasování je téměř stejně náročné jako stanovení správné diagnózy. Je třeba pamatovat na nutnost poměřování rizika a prospěchu plynoucích z eventuální léčby pro pacienta. Mnoho pacientů může i po stanovení diagnózy zůstat zcela bez rizika i bez systémové léčby.
Lokální kortikosteroidy
Lokální aplikace kortikosteroidů patří celosvětově mezi metody první volby při léčbě kožní manifestace sarkoidózy. Ačkoli je tento postup považován za základní, dodnes chybí velké kontrolované klinické studie hodnotící účinnost kortikoidů v této indikaci. Jasný není ani mechanismus jejich působení. Obecně lze předpokládat jejich vliv na buněčné populace účastnící se formování sarkoidního granulomu, následně pak i jejich vliv na změny cytokinů a chemokinů jako mediátorů zánětu.
Doporučována je zejména aplikace silných lokálních kortikoidů (např. Clobetasol propionát, Bethametason dipropionát, Prednikarbát, dvakrát denně v tenké vrstvě), případně v kombinaci s okluzívním krytím (např. potravinová fólie, 52). Byly publikovány i uspokojivé výsledky okluze provedené hydrokoloidním krytem (53). Výhodou tohoto postupu byla výměna po několika dnech, byla tedy snížena dávka kortikoidů a zároveň i jejich potenciální nežádoucí účinky, které ale obecně při léčbě sarkoidózy nebývají časté. U pacientů s převahou kožního postižení může být tato léčba zcela dostačující. Výhodná je zejména malá systémová absorpce účinné látky, i když riziko poškození regulace hypothalamo-hypofyzární osy se s dobou používání a velikostí postižené plochy teoreticky zvětšuje.
Za účinnou, i když poněkud náročnější, je považována u rekalcitrantních projevů intralezionální aplikace kortikoidů. Ve světě doporučovaný triamcinolon acetonid je ve vhodné formě registrován v ČR jen jako veterinární farmakum, podle našich zkušeností lze velmi dobrého efektu dosáhnout i aplikací bethamethasonu či methylprednisolonu. Při aplikaci do kůže je třeba počítat s určitou bolestivostí, tu lze podle našich zkušeností snížit buď předchozím opichem lokálním anestetikem, či podáním směsi s anestetikem v poměru 1 : 1. Doporučováno je podání nejvýše 0,2 ml kortikoidní suspenze na cm2 plochy ložiska. Intralezionální podání nebývá zatíženo rizikem útlumu hypothalamo-hypofyzární osy. Pacienta je však třeba předem v informovaném souhlasu s aplikací upozornit, že k dosažení efektu může být nutná opakovaná aplikace v odstupu několika týdnů. Pro léčbu kožní sarkoidózy jsou uvedené lokální aplikace bezpečné a většinou dostatečně efektivní, i když musíme počítat s delší dobou léčby. Z jiných lokálních prostředků jsou známa i ojedinělá úspěšná užití kalcineurinových inhibitorů.
Systémové kortikosteroidy
V některých případech je indikováno podání kortikoidů celkově. Možno je podávat perorální, či depotní preparáty. Perorální podání může lépe simulovat diurnální rytmus endogenní produkce kortikoidů, což je považováno za fyziologičtější. Depotní preparát naopak zajišťuje trvalou kontrolu bez ohledu na compliance pacienta. Indikace tedy musí být provedena po zralé úvaze a s ohledem na osobnost pacienta a přidružené choroby. Většinou se doporučuje její použití při závažném plicním nálezu (zejména při rentgenovém nálezu spadajícím do III. nebo IV. stadia, ale i ve stadiu II, je-li přítomna porucha ventilace, či perfúze). Stejně tak si terapii vyžadují závažné formy postižení CNS a srdce, postižení oka nereagující na lokálně aplikované kortikoidy a stavy spojené s hyperkalcemickými komplikacemi. Kožní postižení zpravidla samo o sobě není indikací k systémové léčbě, pokud není mutilující, či pokud nezpůsobuje pacientovi jiné výrazné obtíže. Za standardní metodu první volby je považováno podávání prednisonu v dávce 0,5 – 1,0 mg/kg, tato dávka je krokově snižována o cca 5 mg/týden. Odpověď kožních lézí může poskytovat přibližnou představu o reakci i ve vnitřních orgánech a jejich sledování může být určitým návodem k vedení terapie. Celková léčba je dlouhodobá, při úvaze o úplném vynechání je třeba mít jistotu založenou na dlouhodobé stabilitě pacienta při nízkých dávkách, např. 10–15 mg ob den. V prvním půlroce sledování se doporučuje vyšší frekvence kontrol, tj. 1x za cca 4 týdny, později 1x za 3–6 měsíců. První celkové přešetření doporučujeme po 3 měsících léčby, celkově se většinou doporučuje léčbu neukončovat dříve než za 12 měsíců. Pokud není dosaženo při prvním přešetření alespoň částečného terapeutického úspěchu, je vhodné pomýšlet na terapii druhé volby (viz dále). Při terapii je třeba pamatovat na běžné nežádoucí účinky kortikosteroidů (např. osteoporóza, žaludeční vřed, hypertenze, hyperglykémie, steroidní akné, protrahované hojení ran, psychóza, cushingoidní habitus) a profylakticky jim bránit. Závěrem zbývá podotknout, že podle zásad hodnocení „evidence based medicine“ spadají systémové kortikoidy v indikaci sarkoidózy pouze do kategorie C – tedy je ověřena účinnost jen na jednotlivých případech, či sériích případů a chybí doposud kvalitní klinické studie (2).
Antimalarika
Další běžně podávanou skupinou léků jsou antimalarika, většinou počítaná mezi systémové léky druhé volby. Ani v případě sarkoidózy není mechanismus jejich účinku plně objasněn, předpokládá se zásah do mechanismu prezentace antigenů (13). Tímto způsobem lze vysvětlit známý fakt, že jejich podávání spíše omezuje tvorbu nových granulomů, po ukončení medikace se tvoří granulomy nové. Nejde tedy o kurativní postup, ale jejich efekt může být cenný v managementu aktivního onemocnění. Běžně dostupné léky z této skupiny představuje chlorochin a hydroxychlorochin. Pro indikaci antimalarik u sarkoidózy neexistují velké randomizované klinické studie, jejich efekt byl však kazuisticky opakovaně publikován. Mohou být podávány i v kombinaci, v tomto případě lze u komplikovaných pacientů snížit rychleji podávanou dávku kortikoidů. Maximální doporučená dávka chlorochinu je 3,5 mg/kg/den, obvykle postačuje dávkování 2 mg/kg/den (v ČR je registrován pouze Delagil tbl, tj. 1 tableta/den), u hydroxychlorochinu 6,5 mg/kg/den (registrován pouze preparát Plaquenil, postačí obvykle 2 až 3 tablety/den). Lék je podáván společně s jídlem, což snižuje riziko gastrointestinálních komplikací (nauzea apod.) Nástup účinku může být patrný i za 4–6 týdnů, není proto dobře spěchat s hodnocením dosaženého efektu. Před podáváním antimalarik je vhodné provést základní laboratorní monitoring jaterních a renálních funkcí, tyto testy je třeba při léčbě opakovat po 6–12 měsících k vyloučení orgánové toxicity. Možné oftalmologické komplikace (korneální depozita, retinopatie) vyžadují před začátkem a pak 2–3krát ročně kontrolu bez ohledu na podávanou látku, výskyt těchto nežádoucích reakcí u hydroxychlorochinu je poněkud méně častý. Oční vyšetření s nižší frekvencí má následovat i po ukončení terapie.
Závěrem zbývá opět podotknout, že podle zásad hodnocení „evidence based medicine“ spadají antimalarika v indikaci sarkoidóza také pouze do kategorie C (2).
Metotrexát
Metotrexát je další systémovou možností v léčbě sarkoidózy, spadá spíše mezi léky druhé volby u pacientů neodpovídajících na systémové kortikoidy, či u pacientů, kde je není možno podávat. Využívány jsou nízce dávkované režimy, u nichž se předpokládá imunosupresivní působení. Podobně jako u antimalarik je znám vliv na potlačení tvorby granulomů, po vynechání však může následovat recidiva, opět tedy nejde o kurativní lék. Metotrexát je možno použít i u komplikovaných pacientů jako kortikoidy šetřící lék. Počet pacientů léčených metotrexátem je ale podle dostupné literatury zatím malý a opět chybějí kontrolované klinické studie. Ve většině případů bylo podáváno 10–30 mg/týden, nástup terapeutické odpovědi je pozvolný. I pro metotrexát platí, že spadá do doporučení kategorie C, navíc jde o známý teratogen a je tedy nutná opatrnost ve fertilním věku (2).
Nežádoucích účinků metotrexátu je mnoho, pro jejich možnou závažnost je vhodné zahajovat terapii po podpisu informovaného souhlasu. Součástí léčby je vždy den po podání substituce kyselinou listovou. Ze závažných nežádoucích účinků je třeba zmínit dřeňový útlum, proto je vhodné alespoň každých 8 týdnů kontrolovat krevní obraz. Hypersenzitivní pneumonitida se může rozvinout po měsících i létech dříve jinak nekomplikované léčby. Hepatotoxicita by měla být paralelně kontrolována laboratorními testy, žádný z běžně prováděných testů (ALT, AST, ALP, sérový albumin) nemá prokázanou prediktivní schopnost k určení možného jaterního poškození. Při dosažení kumulativní dávky 1,0–1,5 g (tj. přibližně po 1–2 letech) je vhodné zvážit provedení jaterní biopsie (2). Metotrexát je eliminován zejména ledvinami, proto doplňujeme pravidelné sledování i o renální funkce.
Další metody léčby
Pentoxyfilin
Pentoxyfilin, methylxantinový neselektivní inhibitor fosfodiesterázy, je znám současně jako inhibitor produkce TNF-α po stimulaci lipopolysacharidem. Protože cytokin TNF-α sehrává zásadní úlohu při formování sarkoidního granulomu, předpokládá se, že jeho inhibice může mít klinický význam. Obdobně pentoxyfilin ovlivňuje i některé jiné cytokiny (např. interleukin 12), tento vliv je ale prozkoumán méně. Pentoxyfilin je podáván v dávkách 400 mg 3krát denně, obvykle v kombianci s kortikoidy. I zde je možno v kombinaci s kortikoidy snižovat rychleji, dosažený efekt bývá velmi uspokojivý, remise bývá někdy i dlouhodobá. Z těchto poznatků se ale zdá, že pentoxyfilin může být jedním z nejlepších kortikoidy šetřících prostředků, protože sám o sobě bývá spojován jen s minimálními nežádoucími účinky. Bohužel stále není podán důkaz účinku podložený velkou klinickou studií, proto se prozatím dostupné znalosti opírají o jednotlivá sdělení, či pozorování na malých kohortách zejména u plicní fibrózy, zkušenost s léčbou kožních projevů sarkoidózy touto látkou ale chybí (59).
Inhibitory TNF-α (infliximab, adalimumab)
Tyto monoklonální protilátky byly opakovaně testovány v posledních letech i u pacientů se sarkoidózou. Infliximab byl úspěšně podáván v dávkách 3–10 mg/kg tělesné hmotnosti (35), podání bylo opakováno po 2 a 6 týdnech. Adalimumab byl zkoušen v dávce 40 mg podávané podkožně (51). V České republice jsou tato biologika registrována a užívána terapeuticky, ale jsou schválena pro jiné indikace. Přestože ve světové literatuře existuje nezanedbatelný počet úspěšných aplikací i u sarkoidózy, je namístě opatrnost. Jsou známy i případy, kdy byla sarkoidóza vyvolána právě podáním těchto biologik z jiné indikace (2).
Tetracyklinová antibiotika
Historicky byla u sarkoidózy věnována pozornost i etiologické úloze Propionibacter sp. a terapeutické pokusy s tetracyklinovými antibiotiky vycházely z tohoto paradigmatu. Dlouhodobě se spekuluje o možnosti, že tetracyklinová antibiotika působí i imunomodulačním mechanismem (55), tedy zcela odlišným od klasicky udávané interakce s bakteriálními ribosomy. V malých publikovaných skupinách pacientů bylo dosaženo alespoň přechodně remise při podávání 200 mg/den minocyklinu či doxycyklinu. Otázkou zůstává i úplnost a správnost diagnózy ve sledovaných případech, tetracyklinová antibiotika mohou fungovat velmi uspokojivě u jiných granulomatózních chorob, jako jsou například granulomatózní rozacea či lupus miliaris disseminatus faciei. Léky z této skupiny jsou pochopitelně kontraindikovány u dětí a těhotných žen.
Leflunomid
Z novějších registrovaných léků patří do terapeutického rejstříku ještě leflunomid. Jde o chorobu modifikující antirevmatikum (DMARD - disease-modifying antirheumatic drug) s antiproliferativními vlastnostmi. Mechanismus účinku spočívá v inhibici enzymu dihydroorotátdehydrogenázy vedoucí k redukci syntézy pyrimidinu. Jeho velké množství potřebují aktivované lymfocyty. Dochází tedy ke snížení aktivace a proliferace T i B lymfocytů, následkem je snížení produkce imunoglobulinů. Kromě jiného interferuje leflunomid i s buněčnou adhezí a působí snížení aktivity enzymu tyrozinkinázy. Lék je primárně určen k léčbě dospělých pacientů s aktivní revmatoidní artritidou a s aktivní psoriatickou artritidou. Předchozí nebo současná léčba hepatotoxickými nebo hematotoxickými látkami (např. metotrexátem) může vést ke zvýšenému riziku výskytu vážných nežádoucích účinků a je třeba tyto léky podávat v určitém časovém odstupu – minimálně 1–2 týdny (2).
Ostatní
Z ostatních léků (12), které již nejsou v ČR registrovány, lze uvést thalidomid, podávaný v širokém terapeutickém rozmezí 50 až 400 mg i více/den. Lék je ovšem významným prokázaným teratogenem. Podobné nebezpečí je spojeno i s podáváním isotretinoinu v dávkách 0,5 až 2 mg/kg/den, i zde je zkušenost značně limitovaná.
Melatonin (v dávce 20 mg/den), v některých zemích dostupný i bez lékařského receptu, je znám jako účinný lék jen z ojedinělých kazuistických sdělení, obdobně je znám i účinek allopurinolu (100–300 mg/den), u obou látek ale není lépe známa efektivita na kožní projevy. Z léků s cytostatickým účinkem byl užíván i cyklosporin A a chlorambucil, jejich užití je vzhledem k nežádoucím účinkům již značně omezeno. Pouze u případů refrakterních na standardní léčbu přichází v úvahu ještě azathioprin (50–200 mg/den), cyklofosfamid (50–150 mg per os/den, nebo 500–2000 mg jako i.v. bolus à 2 týdny), mykofenolát mofetil (60). Kosmeticky rušivé kožní projevy sarkoidózy je možno ošetřit s určitým rizikem laserem (38).
Prognóza
Přes všechny uvedené možné závažné komplikace vede sarkoidóza přímo k úmrtí pouze v 1–5 % případů (36). Obecně bývá průběh sarkoidózy, zejména plicní, poměrně příznivý, a to mnohdy i bez léčby. Spontánní remise u mnoha pacientů bývá dosažena během 6 měsíců od vypuknutí choroby, i když variabilita je velká. Zvláště u pacientů s Löfgrenovým syndromem bývá v 80 % doba do dosažení remise krátká, průměrně pouze 4–6 týdnů a výhled bývá optimistický. Obdobně dobrá je prognóza při postižení jater a periferních uzlin. Papulózní a makulopapulózní kožní projevy sarkoidózy často předcházejí systémové manifestaci a bývají spojeny s mírnějším průběhem, ze systémových manifestací je nejčastěji doprovází hilová lymfadenopatie. Kožní projevy vykazují pomalou tendenci ke spontánní regresi a mohou perzistovat i roky. Po odeznění mohou někdy zůstávat trvale jako reziduum jizvy po odhojených projevech. Velkouzlová a ložisková sarkoidóza jsou spojeny s dlouhodobým průběhem, často po zhojení zanechávají jizvy a posuny pigmentace. Lupus pernio bývá přítomen zejména při déle probíhajícím chronickém onemocnění a to hlavně ve spojení s postižením horních dýchacích cest, a plicní fibrózou. Podkožní sarkoidóza bývá spojována jen s mírným systémovým postižením. Příčinou smrti u pacientů se sarkoidózou bývá ve 3/4 případů plicní komplikace, zejména fibróza, o zbytek se dělí kardiovaskulární a nervové postižení (36). Dlouhodobé sledování pacientů v prvních dvou letech od stanovení diagnózy je nezbytné, stejně jako jejich dispenzarizace alespoň 3 roky po ukončení léčby. Obezřetnosti je třeba v případě rychlých remisí navozených kortikoidy pro vysoké riziko recidivy či exacerbace onemocnění (které byly pozorovány i u biologik a dalších léků). Kromě vlastního sledování sarkoidózy nadále provádíme i základní onkologický screening. Podle některých údajů je u pacientů trpících sarkoidózou zvýšen, často v prvních dvou letech, výskyt některých hematologických malignit (lymfomy), solidních nádorů (melanomové i nemelanomové nádory kůže, nádory děložního čípku, dělohy, varlat). V některých případech je otázkou, zda zastižená sarkoidní reakce nepředstavuje paraneoplastický syndrom (6).
Došlo do redakce: 22. 10. 2009
MUDr. Lukáš Lacina, Ph.D.
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 2
128 08 Praha 2
E-mail: lukas.lacina@lf1.cuni.cz
Sources
1. Awasthi, A, Nada, R, Malhotra, P, Goel, R, et al. Fatal renal failure as the first manifestation of sarcoidosis diagnosed on necropsy in a young man: a case report. J Clin Pathol, 2004, 57, (10), p.1101-3.
2. Badgwell, C, Rosen, T. Cutaneous sarcoidosis therapy updated. J Am Acad Dermatol, 2007, 56(1), p.69-83.
3. Bardinas, F, Morera, J, Fite, E, Plasencia, A. Seasonal clustering of sarcoidosis. Lancet, 1989; 2, p. 455–56.
4. Binicier, O, Sari, I, Sen, G, Onen F, et al. Axial sarcoidosis mimicking radiographic sacroiliitis. Rheumatol Int, 2009, 29(3), p.343-5.
5. Caceres, M., Sabbaghian, MS., Braud, R., Wilks, S., et al. Pancreatic sarcoidosis: unusual presentation resembling a periampullary malignancy. Curr Surg, 2006, 63(3), p.179-85.
6. Cohen, PR., Kurzrock, R. Sarcoidosis and malignancy. Clin Dermatol, 2007, 25(3), p.326-33.
7. Costabel, U., Ohshimo, S., Guzman, J. Diagnosis of sarcoidosis. Curr Opin Pulm Med, 2008, 14(5), p.455-61.
8. Culver, DA., Newman, LS., Kavuru, MS. Gene-environment interactions in sarcoidosis: challenge and opportunity. Clin Dermatol, 2007, 25(3), p.267-75.
9. Dejmková, H., Lacina, L., Šedová, L., Gatterová, J., et al. Diagnóza, diferenciální diagnóza a terapie erythema nodosum Čes. Revmatol, 2006, 14 (4), s. 154-158.
10. Devaney, K., Goodman, ZD., Epstein, MS., Zimmerman, HJ. et al. Hepatic sarcoidosis. Clinicopathologic features in 100 patients. Am J Surg Pathol, 1993, 17(12), p.1272-80.
11. Di Alberti, L., Piattelli, A., Artese, L., Favia, G. et al. Human herpesvirus 8 variants in sarcoid tissues. Lancet, 1997, 350(9092), p. 1655-61.
12. Doherty, CB., Rosen, T. Evidence-based therapy for cutaneous sarcoidosis. Drugs, 2008; 68(10), p.1361-83.
13. Fox, RI., Kang, HI. Mechanism of action of antimalarial drugs: inhibition of antigen processing and presentation. Lupus, 1993;2(suppl 1), p.9-12.
14. Freedberg, IM., Eisen, AZ., Wolf, K. et al. Fitzpatrick’s dermatology in general medicine. United States of America: McGraw Hill; 2003.
15. Grunewald J, Eklund A. Role of CD4+ T cells in sarcoidosis. Proc Am Thorac Soc, 2007 Aug 15;4(5):461-4
16. Hillerdal, G., Frisk, G., Nettelbladt, O., Diderholm, H. High frequency of IgM antibodies to coxsackie B virus in sarcoidosis patients and patients with asbestos-related lesions. Sarcoidosis,1992, 9(1), p.39-42.
17. Ishak, KG. Sarcoidosis of the liver and bile ducts. Mayo Clin Proc, 1998, 73(5), p.467-72.
18. Ishige, I., Eishi, Y., Takemura, T., Kobayashi, I. et al. Propionibacterium acnes is the most common bacterium commensal in peripheral lung tissue and mediastinal lymph nodes from subjects without sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis, 2005, 22(1), p.33-42.
19. Johnson, LA., Edsall, JR., Austin, JH., Ellis, K. Pulmonary sarcoidosis: could mycoplasma-like organisms be a cause? Sarcoidosis Vasc Diffuse Lung Dis, 1996, 13(1), p.38-42
20. Jungling, O. Osteitis tuberculosa multiplex cystica. Fortschr Röntgenstr, 1920, 21 (27), p. 375–83.
21. Kim, JS., Judson, MA., Donnino, R., Gold, M. et al. Cardiac sarcoidosis. Am Heart J, 2009, 157(1), p. 9-21.
22. Knoell, KA., Hendrix , JD. Jr, Stoler, MH., Patterson, JW. et al. Absence of human herpesvirus 8 in sarcoidosis and crohn disease granulomas. Arch Dermatol, 2005, 141(7), p. 909-10.
23. Koczman, JJ., Rouleau, J., Gaunt, M., Kardon, RH. et al., Neuro-ophthalmic sarcoidosis: the University of Iowa experience. Semin Ophthalmol, 2008, 23(3), p. 157-68.
24. Lam, CS., Tolep, KA., Metke, MP., Glockner, J. et al. Coronary Sarcoidosis Presenting as Acute Coronary Syndrome. Clin Cardiol, 2009, 32(6), p. 67-70.
25. Matsui, K., Adachi, M., Kawasaki, Y. et al. Sarcoidosis acutely involving the musculoskeletal system. Intern Med, 2007, 46(17), p. 1471-4.
26. Menezo, V., Lobo, A., Yeo, TK., du Bois, RM. et al. Ocular features in neurosarcoidosis. Ocul Immunol Inflamm, 2009, 17(3), p. 170-8.
27. Moller, DR. Cells and cytokines involved in the pathogenesis of sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis, 1999,16(1), p. 24-31.
28. Moller, DR. Potential etiologic agents in sarcoidosis. Proc Am Thorac Soc, 2007, 4(5), p.465-8.
29. Moore, SL., Teirstein, AE. Musculoskeletal sarcoidosis: spectrum of appearances at MR imaging. Radiographics, 2003, 23(6), p. 1389-99.
30. Nakata, Y., Kataoka, M., Kimura, I. Sarcoidosis and Propionibacterium acnes. Nippon Rinsho, 1994,52(6), p. 1492-7.
31. Nikoskelainen, J., Hannuksela, M., Palva, T. Antibodies to Epstein-Barr virus and some other herpesviruses in patients with sarcoidosis, pulmonary tuberculosis and erythema nodosum. Scand J Infect Dis, 1974, 6(3), p. 209-16.
32. Noor, A., Knox, KS. Immunopathogenesis of sarcoidosis. Clin Dermatol, 2007, 25(3), p. 250-8.
33. Otake, S., Ishigaki, T. Muscular sarcoidosis. Semin Musculoskelet Radiol, 2001, 5(2), p. 167-70.
34. Panayeas, S., Theodorakopoulos, P., Bouras, A., Constantopoulos, S. Seasonal occurrence of sarcoidosis in Greece. Lancet, 1991, 338, p. 510–11.
35. Panselinas, E., Rodgers, JK., Judson, MA. Clinical outcomes in sarcoidosis after cessation of infliximab treatment. Respirology, 2009, 14(4), p.522-8.
36. Perry, A., Vuitch, F. Causes of death in patients with sarcoidosis. A morphologic study of 38 autopsies with clinicopathologic correlations. Arch Pathol Lab Med, 1995, 119(2), p.167-72.
37. Purriel, P., Navarrete, E., Piaggio, A. Sarcoidosis and sensitivity to pine pollen. Torax, 1966, 15(2), p. 103-9.
38. Roos, S., Raulin, C., Ockenfels, HM., Karsai, S. Successful treatment of cutaneous sarcoidosis lesions with the flashlamp pumped pulsed dye laser: a case report. Dermatol Surg, 2009, 35(7), p. 1139-40.
39. Rossman, MD., Kreider, ME. Is chronic beryllium disease sarcoidosis of known etiology? Sarcoidosis Vasc Diffuse Lung Dis, 2003, 20(2), p. 104-9.
40. Rossman, MD., Kreider, ME. Lesson learned from ACCESS (A Case Controlled Etiologic Study of Sarcoidosis). Proc Am Thorac Soc, 2007, 4(5), p. 453-6.
41. Rossman, MD., Thompson, B., Frederick, MC., Maliarik, MJ. et al. ACCESS Research Group. HLA-DRB1*1101: a significant riskfactor for sarcoidosis in blacks and whites. Am J Hum Genet, 2003;73, p.720–735.
42. Rothova, A. Ocular involvement in sarcoidosis. Br J Ophthalmol, 2000, 84(1), p. 110-6.
43. Rybicki, BA., Maliarik, MJ., Major, M. et al., Epidemiology, demographics, and genetics of sarcoidosis. Semin Respir Infect, 1998, 13(3), p. 166-73.
44. Scadding, JG., Mitchell, DN. Sarcoidosis, 2nd edn. London: Chapman & Hall, 1985, p. 1–12.
45. Sharma. OP. Sarcoidosis around the world. Clin Chest Med, 2008, 29(3), p.357-63.
46. Shetty, AK., Gedalia, A. Childhood sarcoidosis: A rare but fascinating disorder. Pediatr Rheumatol Online J, 2008, 23, p. 6-16.
47. Siltzbach, LE. The Kveim test in sarcoidosis: a study of 750 patients. JAMA, 1961, 178, p. 476 - 482.
48. Spagnolo, P., du Bois, RM. Genetics of sarcoidosis. Clin Dermatol, 2007, 25(3), p. 242-9.
49. Talmi, D., Smith, S., Mulligan, ME. Central skeletal sarcoidosis mimicking metastatic disease. Skeletal Radiol, 2008, 37(8), p. 757-61.
50. Tchernev, G. Cutaneous sarcoidosis: the “great imitator”: etiopathogenesis, morphology, differential diagnosis, and clinical management. Am J Clin Dermatol, 2006, 7(6), p. 375-82.
51. Traczewski, P., Rudnicka, L. Adalimumab in dermatology. Br J Clin Pharmacol, 2008, 66(5), p. 618-25.
52. Volden, G., Kragballe, K., Van De Kerkhof, PC., Aberg, K. et al. Remission and relapse of chronic plaque psoriasis treated once a week with clobetasol propionate occluded with a hydrocolloid dressing versus twice daily treatment with clobetasol propionate alone. J Dermatolog Treat, 2001, 12(3), p. 141-4.
53. Volden, G. Successful treatment of chronic skin diseases with clobetasol propionate and a hydrocolloid occlusive dressing. Acta Derm Venereol, 1992, 72, p. 69-71.
54. WASOG/ ATS/ERS Committee. Statement on Sarcoidosis. Am J Respir Crit Care Med, 1999; 160, p. 735 - 755.
55. Webster, G., Del Rosso, JQ. Anti-inflammatory activity of tetracyclines. Dermatol Clin, 2007, 25(2), p. 133-5.
56. Werfel, U., Schneider, J., Rödelsperger, K., Kotter, J., et al. Sarcoid granulomatosis after zirconium exposure with multiple organ involvement. Eur Respir J, 1998, 12(3), p. 750.
57. Westney, GE., Judson, MA. Racial and ethnic disparities in sarcoidosis: from genetics to socioeconomics. Clin Chest Med, 2006, 27(3), p. 453-62,
58. Xu, Z., Ma, D., Luo, W., Zhu, Y. Detection of Borrelia burgdorferi DNA in granulomatous tissues from patients with sarcoidosis using polymerase chain reaction in situ technique. Chin Med Sci J, 1996, 11(4), p. 220-3.
59. Zargari, O. Pentoxifylline: a drug with wide spectrum applications in dermatology. Dermatol Online J, 2008, 14(11), p. 2.
60. Zwerner, J., Fiorentino, D. Mycophenolate mofetil. Dermatol Ther, 2007, 20(4), p. 229-38.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2009 Issue 6-
All articles in this issue
- Analýza příčin stoupající incidence syfilidy v pražské populaci
- Sarkoidóza
- Kontaktní přecitlivělost na alergeny Evropské standardní sady
- Význam atopických epikutánních testů a dalších vyšetřovacích metod v diagnostice potravinové alergie na arašídy u pacientů s atopickým ekzémem starších 14 let. Význam pylové alergie u této skupiny pacientů
- Extraintestinální forma Crohnovy choroby
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sarkoidóza
- Extraintestinální forma Crohnovy choroby
- Analýza příčin stoupající incidence syfilidy v pražské populaci
- Kontaktní přecitlivělost na alergeny Evropské standardní sady
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career