-
Medical journals
- Career
Kardiotoxicita cyklofosfamidu při léčbě mikroskopické polyangiitidy
Authors: A. Jansová 1; M. Podhola 2; H. Medková 1; J. Řezáčová 3; T. Soukup 1
Authors‘ workplace: Fingerlandův ústav patologie LF UK a FN, Hradec Králové 2; Radiologická klinika LF UK a FN, Hradec Králové 3
Published in: Čes. Revmatol., 28, 2020, No. 4, p. 240-246.
Category: Case Report
Overview
Úvod: Cyklofosfamid (CFA) je lék ze skupiny alkylačních cytostatik s významnými imunosupresivními účinky. Těch se využívá v léčbě závažných orgánových projevů u nekrotizujících vaskulitid a difuzních onemocnění pojiva. Podávání CFA může být komplikováno jeho nežádoucími účinky (NÚ). Některé jsme schopni predikovat a ovlivnit, ale výskyt vzácných NÚ předpovědět nedokážeme. Jedním z nich je kardiální toxicita.
Popis případu: Jedná se o kazuistiku 61leté ženy, u které se mikroskopická polyangiitida (MPA) v úvodu manifestovala těžkým pulmorenálním syndromem. Po dobré reakci na indukční léčbu došlo k rozvoji akutního levostranného srdečního selhání v časové návaznosti na podání CFA. Po vyloučení jiných důvodů akutního srdečního selhání byla stanovena příčina v toxickém působení CFA a léčba byla změněna na rituximab.
Závěr: Zhoršení stavu u nemocného s vaskulitidou, který je léčený CFA, je složitým diferenciálně diagnostickým problémem. Může se jednat o projev základního nebo souběžně probíhajícího onemocnění, anebo o toxicitu podávané léčby. Při toxickém působení CFA může být alternativní medikací rituximab.
Klíčová slova:
cyklofosfamid – kardiotoxicita – srdeční selhání – rituximab – vaskulitida
ÚVOD
Mikroskopická polyangiitida (MPA) je nemocí ze skupiny ANCA asociovaných vaskulitid (Anti-Neutrophile Cytoplasmic Antibodies, česky protilátky proti cytoplazmě neutrofilů), které se nejčastěji z nich projevuje pulmorenálním syndromem vyznačujícím se difuzní alveolární hemoragií a selháním ledvin. Pacient s těmito projevy je přímo ohrožen na životě a vyžaduje péči ve specializovaném centru se zkušenostmi s touto nemocí. Indukční léčba onemocnění zahrnuje podání vysokých dávek glukokortikoidů, plasmaferézy a následně podání imunosupresiv (cyklofosfamidu /CFA/ nebo rituximabu) (1). V České republice bývá lékem první volby CFA, neboť podání rituximabu k léčbě ANCA asociovaných vaskulitid (AAV) je možné pouze po selhání CFA.
Cyklofosfamid je lék ze skupiny cytostatik, tzv. alkylační činidlo. Jeho imunosupresivního účinku se využívá v léčbě závažných orgánových projevů u nekrotizujících vaskulitid a difuzních onemocnění pojiva. V těchto indikacích se používá nižších dávek než při léčbě leukemií, lymfomů či solidních tumorů. I při nižších dávkách se mohou projevit některé nežádoucí účinky (NÚ) tohoto léku. Nejznámějšími jsou nevolnost, zvracení a hemoragická cystitida. Jejich výskytu předcházíme doprovodnou medikací a také způsobem podání (pulzní intravenózní léčba má menší rizika než kontinuální perorální terapie). Vyskytnout se mohou i další NÚ, jako je zvýšené riziko sekundárních malignit nebo pneumonitida (2). Jedním ze vzácných NÚ je kardiotoxicita, která má mnoho podob lišících se klinickými projevy i závažností. Obvykle se projevuje 2–10 dní po podání CFA, spíše po podání vysokých dávek užívaných v onkologii, ale závislost na dávce jednoznačně prokázána nebyla (3). Běžnými projevy kardiotoxicity jsou tachyarytmie, hypotenze, srdeční selhání, myokarditida a postižení perikardu. Hemoragická myokarditida je vzácnou komplikací, která je ve většině případů fatální. Vede od akutního srdečního selhání přes nárůst perikardiálního výpotku k srdeční tamponádě a kardiogennímu šoku (4). Možný mechanismus vzniku kardiálního postižení popisuje diagram na obrázku 1 (4, 5). Přesná prevalence kardiální toxicity není známá.
Image 1. Patofyziologie a klinické projevy cyklofosfamidem indukovaného postižení srdce (upraveno dle Dhesi et al. (4) 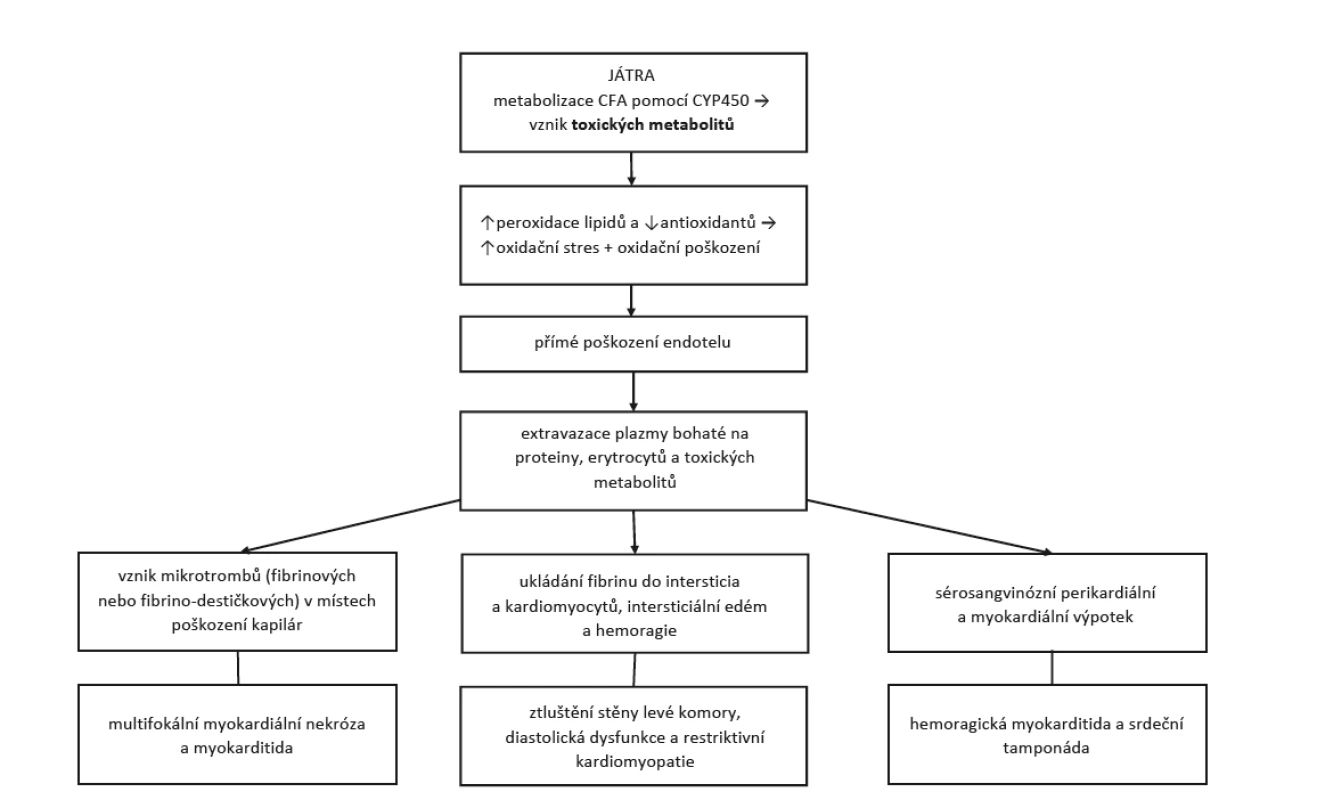
CFA – cyklofosfamid, CYP450 – cytochrom P450 POPIS PŘÍPADU
Žena, 61 let, byla původně přijata na okresní interní oddělení pro 3 týdny trvající únavu, subfebrilie, průjmy, váhový úbytek a suchý kašel, který se 2 dny před přijetím změnil na produktivní s příměsí krve. Pacientka se dosud léčila s arteriální hypertenzí, diabetem mellitem II. typu, vředovou chorobou žaludku, měla cholecystolitiázu a sporný byl anamnestický údaj o idiopatickém střevním zánětu. Při přijetí dominovala dušnost a známky anemického syndromu, objektivně byla verifikována hypoxemie a laboratorně bylo nově zjištěna významná renální insuficience, mikrocytární anemie a elevace známek zánětu (tab. 1). Na akutně provedeném předozadním rentgenovém snímku hrudníku byly zjištěny oboustranné infiltráty, které vedly k provedení akutní výpočetní tomografie (CT) plic (obr. 2), kde byly potvrzeny rozsáhlé infiltrace v obou plicích vedoucí k podezření na difuzní alveolární hemoragii, která byla potvrzena akutní bronchoskopií. Po bronchoskopii došlo k alteraci životních funkcí s nutným zahájením umělé plicní ventilace a oběhové podpory a pacientka byla přeložena do Fakultní nemocnice Hradec Králové. Její stav byl natolik závažný, že si vyžádal dlouhý pobyt na jednotce intenzivní péče s kontinuální hemodialýzou a opakovanými bronchoskopickými toaletami dýchacích cest, které byly obturované koaguly. Diagnózu systémové vaskulitidy (MPA) potvrdil vysoký titr ANCA protilátek, konkrétně proti myeloperoxidáze (MPO) (viz tab. 1), v kombinaci s klinickým obrazem. Biopsii ledviny v akutním stavu nefrolog pro rizika kontraindikoval. Indukční léčba byla zahájena ihned v podobě glukokortikoidů (metylprednisolon i.v. 3krát 500 mg, 3krát 250 mg, 1krát 125 mg a následně 80 mg i.v. jako udržovací dávka po dobu neschopnosti perorálního příjmu) doprovázených sérií pěti plasmaferéz s následným přechodem na perorální kortikoterapii a pulzní i.v. léčbu cyklofosfamidem v režimu podle Evropské společnosti pro studium vaskulitid (EUVAS, tj. European Vasculitis Study Group) s redukcí dávky při renální insuficienci na 8,3 mg/kg. To vše vedlo ke zlepšení klinického stavu s postupným ukončením oběhové i ventilační podpory. Reparace renálních funkcí byla pozvolná, ale umožnila nejdříve změnu kontinuální hemodialýzy na intermitentní a cca po 1 měsíci i její ukončení.
Image 2. HRCT hrudníku (příčný řez): v plicním parenchymu jsou bilaterálně mnohočetné denzity mléčného skla a disperzně rozmístěné konsolidace, je přítomno zesílení zejména centrálního peribronchovaskulárního intersticia a místy i centrilobulární denzity mléčného skla – obraz difuzní alveolární hemoragie 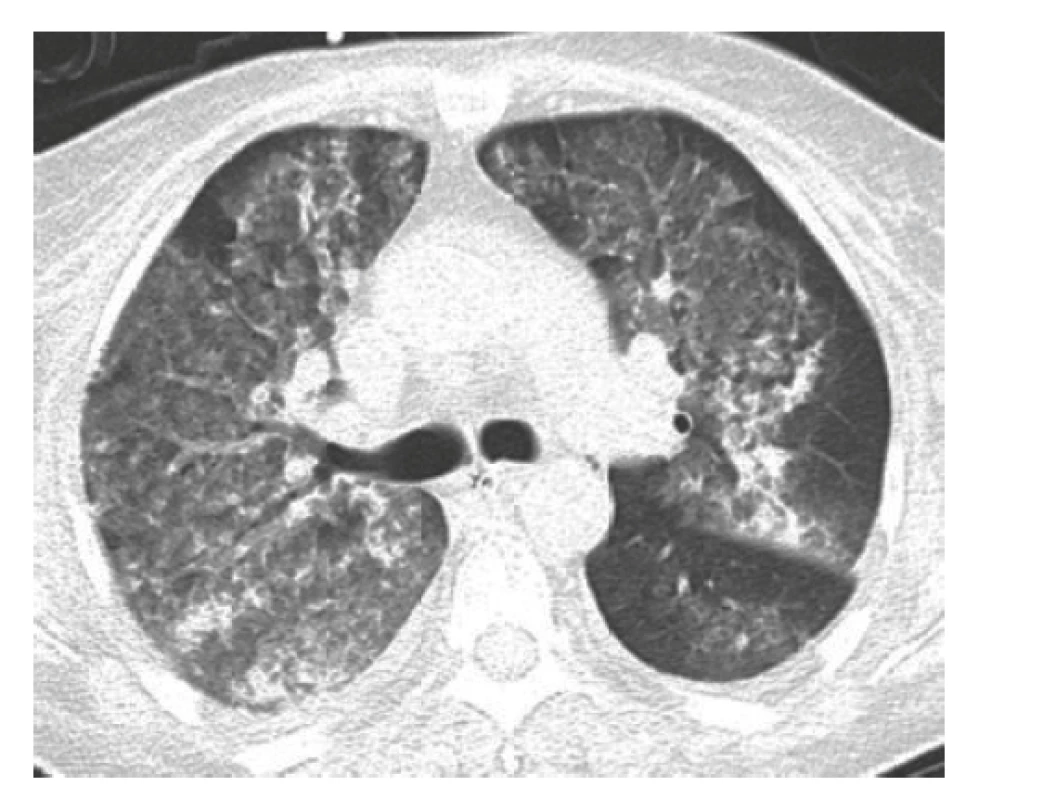
HRCT – výpočetní tomografie s vysokým rozlišením Tři týdny po zahájení imunosupresivní terapie a 2 dny po druhém podání cyklofosfamidu se rozvinula akutní dušnost se známkami selhání levé komory srdeční. Na elektrokardiogramu (EKG) (obr. 3) v akutní fázi byla blokáda levého Tawarova raménka (LBBB), která byla přítomná i při přijetí, a nově sinusová tachykardie (115/min). Při echokardiografickém vyšetření byla zjištěna nově vzniklá systolická dysfunkce levé komory s ejekční frakcí (EF LK) 30–35 % s velkou mitrální insuficiencí (s regurgitací krve dosahující dna levé síně). Diferenciálně diagnosticky bylo nutné vyloučit řadu možných příčin od postižení srdce při základním onemocnění (MPA může postihnout koronární tepny, myokard i endokard) přes akutní ischemickou chorobu srdeční, akutní zhoršení dosud nediagnostikované chronické ischemické choroby srdeční, hypertenzní krizi či destrukci srdeční chlopně endokarditidou u imunosuprimované pacientky. Pro klinický obraz akutní dušnosti připadala v úvahu také plicní embolie nebo recidiva alveolární hemoragie.
Image 3. Elektrokardiogram nemocné po podání cyklofosfamidu: patologickými nálezy jsou sinusová tachykardie s chronickým blokem levého Tawarova raménka a prodloužený QTc interval 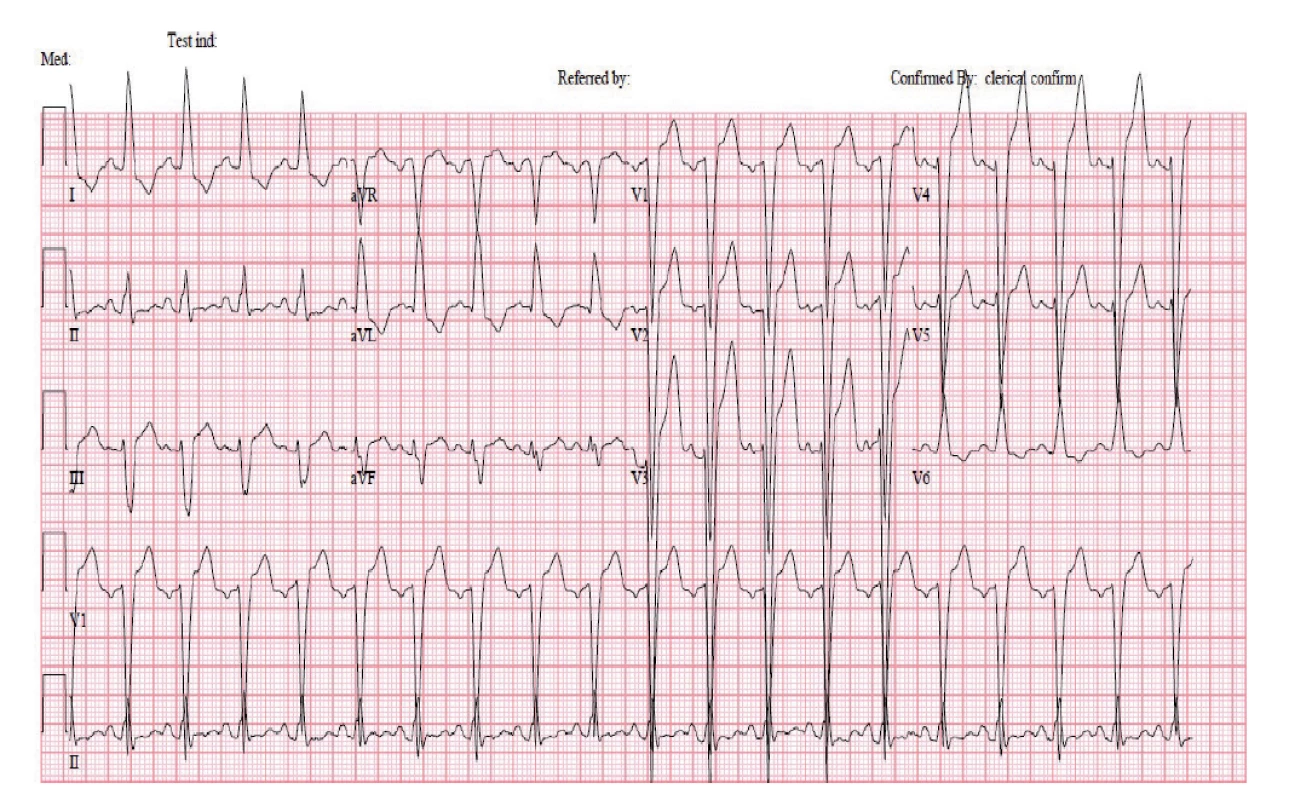
Pozn.: Hodnocení QT intervalu je při ramínkových blokádách sporné, neboť jej ovlivňuje rozšířený QRS komplex. Postižení srdce nekrotizující vaskulitidou neodpovídala magnetická rezonance (MR) srdce (obr. 4), na které byl obraz normálního myokardu. Na provedené koronarografii byly věnčité tepny bez stenóz a bez angiografických známek vaskulitidy, ventrikulografie byla obtížně hodnotitelná pro salvy extrasystol, ale s nepochybnou dysfunkcí levé komory s EF LK max. 30 %. Hypertenzní krizi neodpovídaly hodnoty krevního tlaku naměřené před rozvojem dušnosti (156/68 a 158/85 mmHg) ani za následné monitorace na jednotce intenzivní péče. Transezofageální ultrazvuk srdce, negativní hemokultury a absence periferních embolizací vyloučily infekční postižení srdečních chlopní, CT angiografií plicnice nebyla prokázána plicní embolie. Recidiva difuzní alveolární hemoragie byla vyloučena pomocí bronchoskopie. Po komplexním vyšetření jsme stav uzavřeli jako akutní levostranné srdeční selhání vzniklé na základě kardiotoxického působení cyklofosfamidu. Stav pacientky se zlepšil při negativní tekutinové bilanci a po nastavení léčby srdečního selhání (ACE inhibitor, diuretika, betablokátor a ivabradin). Terapie základního onemocnění CFA byla ukončena a pacientka byla následně léčena rituximabem v dávce 1000 mg podané v jednom dvoutýdenním sledu.
Image 4. MR srdce u pacientek s MPA. Na obrázku vlevo je normální nález zjištěný u naší pacientky po podání cyklofosfamidu, vpravo je viditelné postižení myokardu při MPA (dilatace levé komory (1) s okrskovitou opacifikací stěny LK v bazálních a středních segmentech s převahou mid-wall lokalizace (šipka) 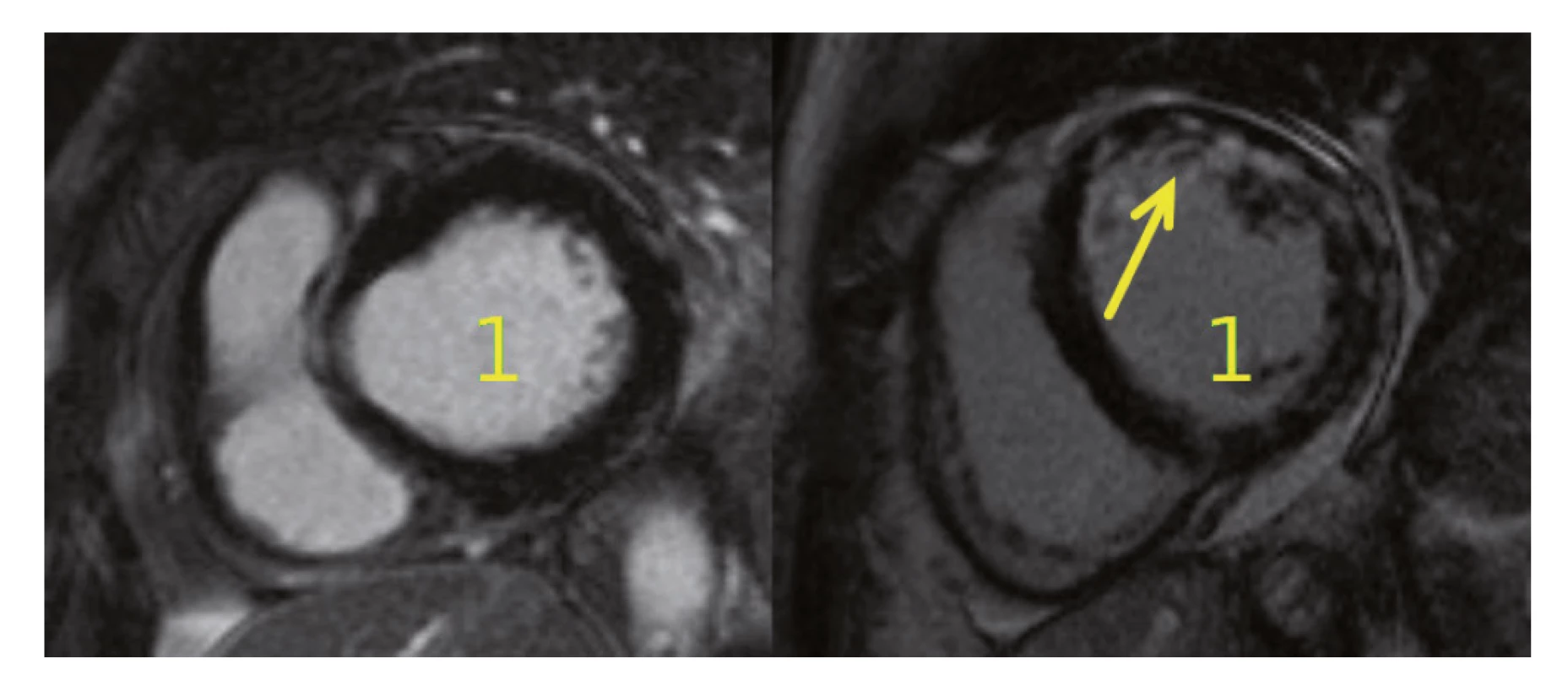
LK – levá komora, MPA – mikroskopická polyangiitida, MR – magnetická rezonance Během měsíce od projevů akutního levostranného srdečního selhání došlo k úpravě funkce levé komory srdeční (poslední EF LK 55 % – vývoj viz tab. 1) a k poklesu gradientu na mitrální chlopni.
Další cyklus rituximabu dosud nebyl podán pro jeho přetrvávající imunosupresivní efekt (deplece CD19 a CD20 pozitivních T-lymfocytů s plazmatickou koncentrací imunoglobulinu G při dolní mezi normy), pacientka byla ponechána na monoterapii glukokortikoidy (prednison v dávce 0,14 mg/kg/den).
V dalším průběhu onemocnění bylo jednou podezření na relaps choroby při zhoršení renálních funkcí (viz tab. 1). Tehdy byla provedena biopsie ledviny, kde byl obraz glomerulosklerózy bez aktivních změn odpovídající proběhlé atace ANCA vaskulitidy (obr. 5). Progrese renální insuficience byla uzavřena jako sekundární následek poškození glomerulů vaskulitidou. Při pokračující dispenzarizaci jsou renální funkce dosud stabilní, titr ANCA protilátek nízký (viz tab. 1), relaps choroby zachycen nebyl.
Image 5. Biopsie ledviny, zachycený glomerulus je částečně postižen sklerotizací, je vidět fibrózní srpek (1), není přítomný polymorfonukleární infiltrát, který by znamenal aktivní postižení 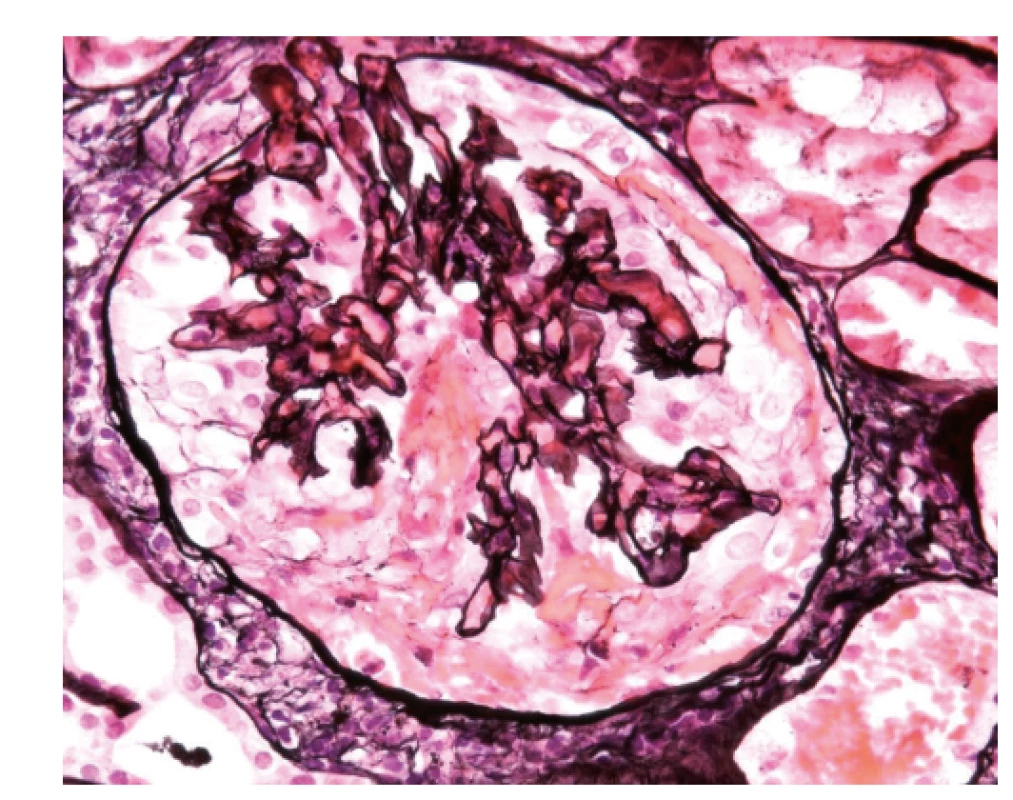
DISKUZE
V literatuře je dobře doložený kardiotoxický vliv cyklofosfamidu ve vysokých dávkách zejména v onkologických indikacích (4, 5). I podle souhrnu údajů o přípravku (SPC) byla akutní kardiální toxicita zachycena i při jednorázovém podání dávek nižších než 20 mg/kg, což byl i náš případ. Podobných případů ale není popsáno mnoho, jedná se o jednotlivá kazuistická sdělení. Právě nedostatek dat o toxicitě CFA v nízkých dávkách v kombinaci s širokou paletou možných příčin srdečního selhání činil potíže i v našem případě. Po rozsáhlém pátrání v databázích PubMed a Web Of Science se nám podařilo najít celkem pět popsaných případů kardiotoxického působení CFA u pacientů se systémovými vaskulitidami, z nichž jeden text je dostupný pouze ve španělštině (6) a k jednomu velmi často citovanému článku nelze dohledat fulltext (7). Ve třech popsaných případech se jednalo o pacienty s granulomatózou s polyangiitidou, jeden případ byl smrtelný, ale úmrtí nastalo pro infekční komplikace imunosupresivní léčby (8). V jednom případě byla u pacienta s popisovaným pulmorenálním syndromem zachycena fibrilace síní ještě v den prvního podání CFA. Paroxysmus fibrilace síní byl vertován farmakologicky (podáním diltiazemu). V tomto případě není z dostupného sdělení jasná diagnóza, můžeme se pouze domnívat, že se jednalo o AAV (65letý muž, hemoptýza, renální selhání s biopticky prokázanou fokálně segmentální glomerulosklerózou, léčba i.v. methylprednisolonem a cyklofosfamidem) (9). V dalších dvou případech kardiální toxicity CFA zachycených u pacientů s granulomatózou s polyangiitidou (7, 10) a v jednom případě u pacientky s mikroskopickou polyangiitidou (6) se jednalo o projevy levostranného srdečního selhání stejně jako v našem případě. I v těchto třech sděleních byly projevy reverzibilní (viz přehled tab. 2)
Diferenciální diagnostiku akutního srdečního selhání u pacientů AAV ztěžuje přítomnost základního onemocnění, které samo o sobě může způsobit postižení srdce, i možnost ovlivnění klinických příznaků probíhající léčbou. Ačkoliv je postižení srdce spíše typické pro eozinofilní granulomatózu s polyangiitidou, může se vyskytnout i při mikroskopické polyangiitidě a granulomatóze s polyangiitidou. Základním zobrazovacím vyšetřením je echokardiografie, kterou je při podezření na postižení srdce vaskulitidou nutné doplnit o další vyšetření. Neinvazivní MR srdce je poměrně náročná na zkušenosti provádějícího pracoviště (hodnocení probíhá ve spolupráci kardiologa a radiologa) i spolupráci pacienta. V našem případě kardiální toxicity CFA byl na MR nález dilatace LK s její systolickou dysfunkcí s obrazem normálního myokardu, zatímco při postižení vaskulitidou se na MR zobrazuje edém myokardu, který typicky nerespektuje cévní zásobení a vyskytuje se často ve střední vrstvě myokardu (viz obr 2). Další možné nálezy při postižení vaskulitidou jsou projevy postižení chlopní, nebo perikardu (11). Dalším přínosným vyšetřením je koronarografie, s možným odběrem myokardiální biopsie, který je ale často technicky komplikovaný, ne-li nemožný. Limitující je také povrchovost odběru, vzhledem ke které nemusí být zachycené změny uložené v hlubších než subendokardiálních vrstvách.
Známými rizikovými faktory kardiotoxického působení cyklofosfamidu je předchozí radioterapie srdeční oblasti, předchozí nebo souběžná léčba jinými kardiotoxickými léky (zejména antracykliny), nejasná je role již přítomného onemocnění srdce. V našem případě měla pacientka ještě před zahájením léčby malou mitrální insuficienci se známkami převodní poruchy na EKG (LBBB), která je samostatným rizikovým faktorem srdečního selhání (12).
Monitorace 12-svodového EKG může podle Dhesiho být jednou z metod umožňujících časnou detekci kardiotoxického efektu CFA. Prvními změnami zachytitelnými na EKG jsou abnormality QT úseku (prodloužení nebo disperze, tedy rozdíl maximálního a minimálního QTc větší než 10 ms). Dalšími možnými změnami na EKG je pokles voltáže QRS komplexu a změny ST úseku a vlny T. Postižení srdce způsobené CFA lze detekovat i echokardiograficky. Mezi časné změny patří diastolická dysfunkce LK, ztluštění mezikomorového septa v diastole, dilatace LK a časná mitrální regurgitace, v pozdějších stadiích i s poklesem ejekční frakce LK. V případě hemoragické myokarditidy pak nalezneme hypertrofii hyperechogenního myokardu a pokles ejekční frakce normálně velké levé komory (4).
ZÁVĚR
Zhoršení stavu u nemocného s AAV při léčbě CFA nemusí být projevem nemoci, ale může být projevem toxicity podávané léčby. Ze snadno dostupných vyšetření nám může pomoci EKG a echokardiografie, velmi přínosná je i MR srdce, která odhalí změny typické pro vaskulitidu. Diagnózu toxického postižení myokardu lze potvrdit histologicky z bioptického vzorku odebraného během koronarografie. Při nejistotě, zda se jedná o kardiotoxické působení cyklofosfamidu, je vhodné tuto léčbu přerušit a uvažovat o jiné imunosupresi v závislosti na klinickém stavu pacienta a projevech daného onemocnění. Pacient, u kterého je riziko kardiotoxického působení CFA vyšší, je ten, který již má strukturálního postižení myokardu, prodělal radioterapii srdeční oblasti a který dostal či dostává jinou kardiotoxickou medikaci.
Práce vznikla za podpory PROGRES Q 40-15 (Univerzity Karlovy).
Konflikt zájmů: žádný.
adresa pro korespondenci:
doc. MUDr. Tomáš Soukup, Ph.D.
Klinika zobrazovacích metod LF UK a FN
II. interní klinika FNHK
Sokolská 581, 500 05 Hradec Králové
e-mail: tomas.soukup@fnhk.cz
Sources
1. Erratum: EULAR/ERA-EDTA recommendations for the management of ANCA-associated vasculitis. Ann Rheum Dis 2017; 76(8): 1480.
2. McCune JW CBM. General principles of the use of cyclophosphamide in rheumatic diseases. In: Furst DE, editor. UpToDate. UpToDate, Waltham, MA, Accessed on August 06, 20192019.
3. Floyd JD, Morgan JP. Cardiotoxicity of non-anthracycline cancer chemotherapy agents. In: Reed E Drews M, David G Poplack, MD. (ed). UpToDate. Waltham, MA, Accessed on March 14, 20192019.
4. Dhesi S, Chu MP, Blevins G, Paterson I, Larratt L, Oudit GY, et al. Cyclophosphamide-induced cardiomyopathy: A case report, review, and recommendations for management. J Investig Med High Impact Case Rep 2013; 1(1): 2324709613480346.
5. Morandi P, Ruffini PA, Benvenuto GM, Raimondi R, Fosser V. Cardiac toxicity of high-dose chemotherapy. Bone Marrow Transplant 2005; 35(4): 323–334.
6. Fontanals S, Canete C, Soy D, Castro P, Nicolas JM. Low dose of cyclophosphamide related to myocardiopathy. Farm Hosp 2007; 31(6): 379–380.
7. Manthorpe R, Svensson O. Cardiomyopathy following intravenous cyclophosphamide therapy in a patient with Wegener’s granulomatosis. Clin Exp Rheumatol 1996; 14(6): 702–703.
8. Ernst E, Girndt M, Pliquett RU. A case of granulomatosis with polyangiitis complicated by cyclophosphamide toxicity and opportunistic infections: choosing between Scylla and Charybdis. BMC Nephrology 2014; 15(1): 28.
9. Ejaz K, Raza MA, Maroof S, Haider MW. Cyclophosphamide-induced atrial fibrillation with rapid ventricular rate. Cureus 2018; 10(5): e2633.
10. Shanahan EM, Sheahan K, McDonald K, Bresnihan B. Dilated cardiomyopathy in Wegener’s granulomatosis. Rheumatology 1999; 38(11): 1164–1166.
11. Broncano J, Vargas D, Bhalla S, Cummings KW, Raptis CA, Luna A. CT and MR imaging of cardiothoracic vasculitis. Radiographics 2018; 38(4): 997–1021.
12. Jensen JR, Kragholm K, Bodker KW, Mortensen R, Graff C, Pietersen A, et al. Association between T-wave discordance and the development of heart failure in left bundle branch block patients: Results from the Copenhagen ECG study. J Electrocardiol 2019; 52 : 39–45.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2020 Issue 4-
All articles in this issue
-
Něco staré končí,
něco nové začíná…. - Stanovisko České revmatologické společnosti k léčbě revmatických onemocnění a očkování v kontextu infekce SARS-CoV-2
- Klinické zkušenosti z dlouhodobé léčby axiální spondyloartritidy secukinumabem
- Validace české verze dotazníků hodnotících funkční omezení pacientů se systémovou sklerodermií
-
Nízkodávková výpočetní tomografie s cínovou filtrací v diagnostice sakroiliitidy –
naše první zkušenosti - Kardiotoxicita cyklofosfamidu při léčbě mikroskopické polyangiitidy
- Úskalí diagnostiky ANCA asociovaných vaskulitid – kazuistika
-
Něco staré končí,
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Úskalí diagnostiky ANCA asociovaných vaskulitid – kazuistika
- Validace české verze dotazníků hodnotících funkční omezení pacientů se systémovou sklerodermií
- Stanovisko České revmatologické společnosti k léčbě revmatických onemocnění a očkování v kontextu infekce SARS-CoV-2
- Klinické zkušenosti z dlouhodobé léčby axiální spondyloartritidy secukinumabem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



