-
Medical journals
- Career
Reaktivní artritidy
Authors: M. Žurek; P. Horák
Authors‘ workplace: III. interní klinika nefrologická, revmatologická, endokrinologická, FN a LF UP, Olomouc
Published in: Čes. Revmatol., 25, 2017, No. 2, p. 91-98.
Category: Review Article
Overview
Reaktivní artritida (ReA) je artritida ze skupiny spondyloartritid následující po infekci gastrointestinálního nebo urogenitálního traktu způsobené specifickými bakteriálními patogeny. Diagnóza ReA je založena na klinickém obraze oligoartritidy velkých kloubů především dolních končetin, vyloučení ostatních možných diferenciálně diagnostických možností a průkazu vyvolávající infekce. V léčbě ReA se na prvním místě využívají nesteroidní antiflogistika, u refrakterních případů glukokortikoidy a chorobu modifikující léky. Výsledky studií a metaanalýz zabývajících se ATB léčbou ReA vyznívají spíše nejednoznačně v případě chlamydiemi indukované ReA a negativně u ReA navazující na enterobakteriální infekci. Prognóza ReA je u značné části nemocných příznivá, u části pacientů může být průběh protrahovaný a mohou se vyvinout znaky charakteristické pro další choroby ze skupiny spondyloartritid.
Klíčová slova:
Spondyloartritidy, reaktivní artritida, patogeneze, diagnostika, léčba, prognózaÚvod
Reaktivní artritida (ReA) je systémové zánětlivé onemocnění charakterizované aseptickou artritidou vzniklou 1–6 týdnů po extraartikulární infekci, nejčastěji gastrointestinální, urogenitální či respirační. Termín reaktivní v názvu choroby vyjadřuje historické a tradiční vnímání choroby jako neseptické artritidy vzniklé autoimunitními mechanismy jako odpověď na extraartikulární bakteriální infekci. Tento koncept vychází z faktu, že u tohoto typu artritidy nelze patogen přímo kultivovat z kloubního výpotku. Je pozoruhodné, že přes významný posun ve výzkumu ReA není současné porozumění mechanismům adaptivní imunity na bakteriální antigeny z pohledu choroby stále konkluzivní. Reaktivní artritida bývá typicky akutní mono nebo oligoartikulární, méně často polyartikulární a převážně jsou postiženy klouby dolních končetin, někdy je přítomna entezitida a daktylitida. ReA trvající více jak 6 měsíců je považována za chronické onemocnění. ReA bývala dříve nazývána Reiterovým syndromem (klasická triáda příznaků uretritida, konjunktivitida a artritida) nebo séronegativní, postinfekční, postdyseneterickou artritidou. ReA je obecně chápána jako onemocnění se skupiny spondyloartritid, pro které jsou charakteristické axiální (páteř a sakroiliakální skloubení) a periferní záněty kloubů, entezopatie, daktylitida i extraartikulární projevy (nespecifické střevní záněty, psoriáza, uveitida). Do tohoto konceptu však nezapadají reaktivní artritidy po respiračních onemocněních, jejichž typickým představitelem je revmatická horečka či jiná poststreptokoková reaktivní artritida, která nemá žádný vztah k antigenu HLAB27. Pro klasifikaci onemocnění ze skupiny spondyloartritid jsou nejčastěji využívána klasifikační kritéria podle European Spondyloarthropathy Study. Kritéria mají 78,4% senzitivitu a 89,6% specificitu, přičemž radiograficky potvrzená sakroilitida zvyšuje senzitivitu na 87 %, ale poněkud snižuje specificitu na 86,7 % (1). Pro axiální spondyloartritidu se používají klasifikační kritéria Assessment of Spondylarthritis International Society (ASAS).
Výskyt onemocnění a rizikové faktory
ReA nejčastěji postihuje dospělé ve věku 20–40 let, ReA s anamnézou urogenitální infekce je častější u mužů, výskyt ReA po gastrointestinální infekci je stejný u obou pohlaví. Incidence onemocnění se pohybuje mezi 9–27 případů na 100 000. ReA po urogenitální infekci Chlamydia trachomatis se vyvine u 0–30 % případů. Antigen HLA B27 je významným rizikovým faktorem pro vznik tohoto onemocnění, je pozitivní u 30–50 % pacientů a choroba pak bývá závažnější s větším rizikem chronického průběhu. Kromě projevů artritidy mají často nemocní přítomny známky entezitidy, sakroilitidy a řadu mimokloubních projevů jako je konjunktivitida, uveitida, uretritida, cervicitida, prostatitida, keratoderma blenorhagicum, hyperkeratózy, karditida, nefritida nebo příznaky nespecifických střevních zánětů (3, 4, 5).
Patogeneze
Infekční agens způsobující reaktivní artritidy jsou uvedena v tabulce 1. I přes známý spouštěcí moment není patogeneze ReA plně objasněna. Je zřejmě, že se na jejím vzniku podílí souhra environmentálních a genetických faktorů. Po průniku sliznicemi nejčastěji urogenitálního nebo gastrointestinálního traktu mohou mikroby perzistovat v epiteliích nebo v asociovaných lymfatických tkáních, v játrech a ve slezině. Bakterie či spíše jejich antigeny jsou disseminovány do kloubů a způsobují lokální zánětlivou reakci (6). Porucha eliminace patogenů a imunitní odpovědi organismu vede k dlouhodobé přítomnosti mikroorganismů nebo jejich částí ve tkáních. Mikroorganismy, jejich RNA nebo DNA či některé jejich antigeny mohou být identifikovány v různých tělesných tekutinách ještě několik let po infekci, což poukazuje na významnou roli infekčních agens v patogenezi ReA (7–9). Při po-salmonelové ReA byly specifické produkty salmonell nalezeny v kloubech s projevy artritidy (10). RNA Chlamydia trachomatis byla prokázána v biopsii synoviální membrány u pacientů s reaktivní artritidou (11). V jiném sledování byly dokonce nitrokloubně zjištěny viabilní a metabolicky aktivní formy chlamydií (12), které však měly odlišné vlastnosti od bakterií v normálním infekčním cyklu. Antigeny Yersinií aribozomální RNAbyla identifikována v synoviální tekutině pacientů s infekcí Yersinia pseudotuberculosis (13). Není dořešena otázka, zda jsou příznaky ReA způsobeny reakcí imunitního systému na perzistující infekci nebo zda infekční patogen spouští autoimunitní odpověď, která dále probíhá bez ohledu na jeho přítomnost v organismu. Snížená exprese hlavního proteinu vnější membrány (MOMP – mitochondrial outer membrane permiabilization) antigeny a down regulace hlavního histokompatibilního systému proteiny a apoptóza T-lymfocytů hostitele jsou možnými mechanismy neefektivního odstraňování mikroorganismů z organismu (14). V malé studii u pacientů s časným nástupem reaktivní artritidy převažovala odpověď CD8 T-buněk v synovii bez ohledu na vyvolávající patogen (15). Konfliktní jsou údaje o úloze Th1 a Th2 cytokinů u reaktivní artritidy. U vnímavého kmene myší se vyvíjí chlamydiemi indukovaná ReA v důsledku nedostatečné kontroly intracelulárních patogenů. Při reakci na chlamydiové antigeny byla v T-lymfocytech pozorována snížená produkce interferonu-γ a interleukinu-17, produkce tumor nekrotizujícího faktoru α byla naopak zvýšena (16).
Table 1. Infekční agens způsobující reaktivní artritidy 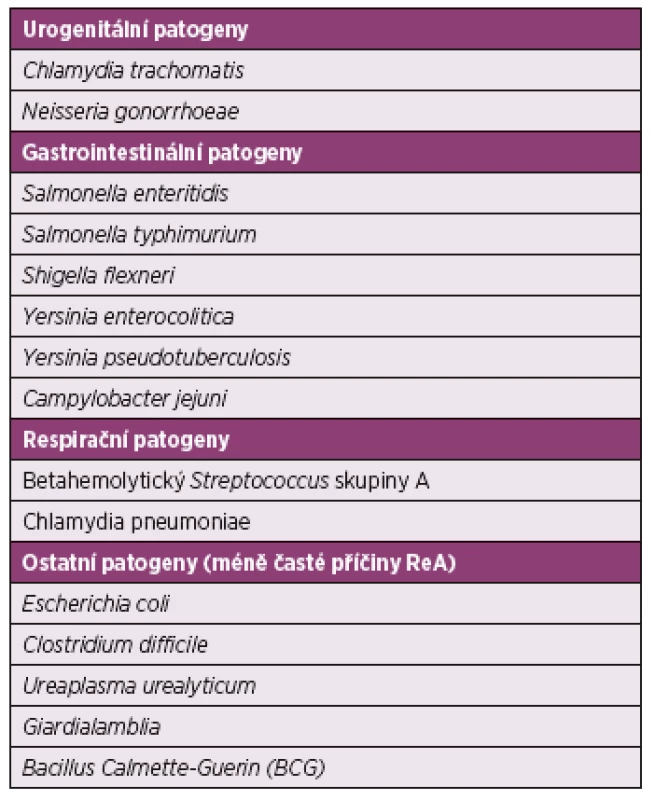
Klinický obraz
Průběh ReA je heterogenní od mírných, limitovaných forem až po těžké multisystémové formy choroby. U 95 % pacientů je přítomna asymetrická mono – oligoartritida kloubů dolních končetin (koleno, kotníky, metatarsofalangeální klouby), méně obvyklé je postižení kloubů horních končetin. Entezitida je projevem zánětlivého postižení úponů šlach a ligament na kost. Zánětlivé změny Achillovy šlachy a plantární aponeurózy jsou příčinou bolestí paty a obtíží při chůzi. Entezopatické potíže se mohou objevit také v oblasti pánve a kolenního kloubu. Objevit se může i daktylitida s charakteristickým otokem prstů nohou a rukou. Dále může být přítomen zánětlivý typ bolesti bederní páteře charakterizovaný zlepšením po rozcvičení, neustupující v klidu a vyskytující se i v noci. Velmi agresivní artritida může způsobit erozivní poškození kloubů a vést k sekundární artróze a deformitám, také se může vyvinout omezení hybnosti páteře podobné ankylozující spondylitidě. Mimokloubní projevy ReA jsou velmi časté. Keratoderma blenorhagicum na chodidlech je přítomno u 5–10 % pacientů a je prakticky neodlišitelné od pustulózní formy psoriázy. Konjunktivitida manifestující se pálením a překrvením oka je většinou mírná a může předcházet vzniku artritidy. Vzácnější je zrak ohrožující uveitida, keratitida či retinitida. V oblasti zevního genitálu se může objevit circinátní balanitida manifestující se jako polycyklické červené mapovité eroze na glans penis nebo prepuciu. Postižení sliznice uretry vede ke sterilní uretritidě. Orální ulcerace jsou nebolestivé, mělké aftózní léze na sliznici dutiny ústní a hrdla, na jazyku bývá popisována benigní migrující glositida (3, 9). Zcela vzácně může dojít ke vzniku karditidy manifestující se projevy od pouhých elektrokardiografických abnormalit po obraz manifestní perikarditidy či myokarditidy. Proximální aortitida byla pozorována u 1 % až 2 % pacientů s těžkou, recidivující erozivní ReA. Aortitida může způsobit sekundární aortální regurgitaci a případně i srdeční selhání vyžadující kardiochirurgickou intervenci. Ve velmi vzácných případech může dojít k vzniku aneuryzmatu hrudní aorty (3–5).
Postižení ledvin je mírné a přechodné a obvykle se projeví lehkou proteinurií, mikroskopickou hematurií nebo sterilní leukocyturií. Zažívací potíže mohou být projevem nespecifického střevního zánětu. Občas jsou přítomny i nespecifické systémové příznaky ReA jako je horečka, únava a váhový úbytek. V anamnéze lze někdy vystopovat příznaky spouštěcí gastrointestinální nebo urogenitální infekce. V rodinné anamnéze se může vyskytovat onemocnění ze skupiny spondyloartritid, např. psoriáza nebo nespecifické střevní záněty (7–9).
Stanovení diagnózy
Pro diagnózu ReA lze využít klasifikační kritéria Fourth International Workshop on Reactive Arthritis (Berlin, Germany 1999) (17), viz tabulka 2.
Table 2. Klasifikační kritéria Fourth International Workshop on Reactive Arthritis (Berlin, Germany 1999) 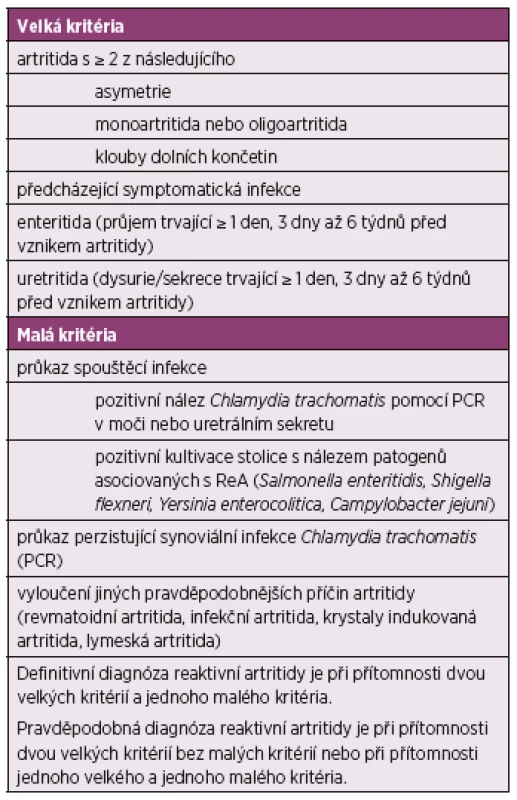
Diferenciální diagnostika
Diferenciální diagnostika reaktivní artritidy se zaměřuje na ostatní možné artritidy. V případě přítomnosti mimokloubních příznaků vyskytujících se také u reaktivní artritidy je třeba zvažovat další možná infekční a systémové onemocnění.
Průjem a artritida – virová onemocnění, např. enterovirové infekce, mohou být provázena výraznými, ale pouze přechodnými artralgiemi. Na rozdíl od ReA jsou zpravidla také přítomny: prchavý exantém, vysoká horečka, pleuritida či myokarditida. Jako artritida s gastrointestinálními symptomy se mohou rovněž manifestovat idiopatické střevní záněty, Behçetův syndrom, celiakie (sprue), Whippleova nemoc, parazitární infekce a střevní bypass. Diseminovaná gonokoková infekce (DGI) je příkladem kombinace artritidy a urogenitálních symptomů. V diferenciální diagnostice je přínosná kultivace synoviální tekutiny, sekretu močové trubice či děložního čípku. DGI se projevuje jako purulentní artritida, mnohočetná tendosynovitida s kožními vesikulopustulózními projevy. Neléčená infekce streptokokem je známým spouštěcím faktorem akutní revmatické horečky po streptokokové faryngitidě. V tomto případě nejsou přítomny charakteristické příznaky společné pro spondyloartritidy (např. entezitidy, zánětlivá bolest zad). Klinické projevy ostatních onemocnění ze skupiny spondyloartritid jsou obtížně odlišitelné od projevů ReA, anamnéza a průkaz předcházející infekce obvykle chybí, často je pozitivní rodinná anamnéza těchto onemocnění.
Vyšetřovací metody
Jako v mnoho ostatních případech revmatických chorob, neexistuje zlatý diagnostický standard či vysoce specifický test, který by byl schopen s vysokou pravděpodobností diagnózu ReA potvrdit či vyloučit. Z pomocných vyšetřovacích metod je provedeno základní laboratorní vyšetření (krevní obraz, jaterní testy, vyšetření funkce ledvin, markery zánětu, antigen HLA B27, revmatoidní faktor, protilátky proti citrulinovanému proteinu. Sérologická vyšetření mohou být užitečná k odhalení proběhlé asymptomatické urogenitální nebo gastrointestinální infekce, u symptomatických pacientů je třeba vyšetření uretrálního nebo cervikálního sekretu metodou polymerázové řetězové reakce (PCR) k průkazu chlamydiového antigenu, v případě gastrointestinální symptomatologie je zlatým standardem kultivace stolice pro záchyt enterobakterií. Kloubní výpotek je obvykle zánětlivý a obsahuje leukocyty 2000–64 000/mm3. PCR k průkazu bakteriální RNA nebo DNA v synoviálním výpotku může napomoci k identifikaci infekčních patogenů, které byly spouštěcím faktorem ReA. Při histologickém vyšetření bioptického vzorku synovie bývá popisován polymorfonukleární leukocytární infiltrát. Radiografické metody nejsou v časných fázích onemocnění příliš přínosné, magnetickou rezonanci lze využít k časné diagnostice sakroilitidy.
Table 3. Choroby, které je třeba diferenciálně diagnosticky odlišit od ReA nejčasněji 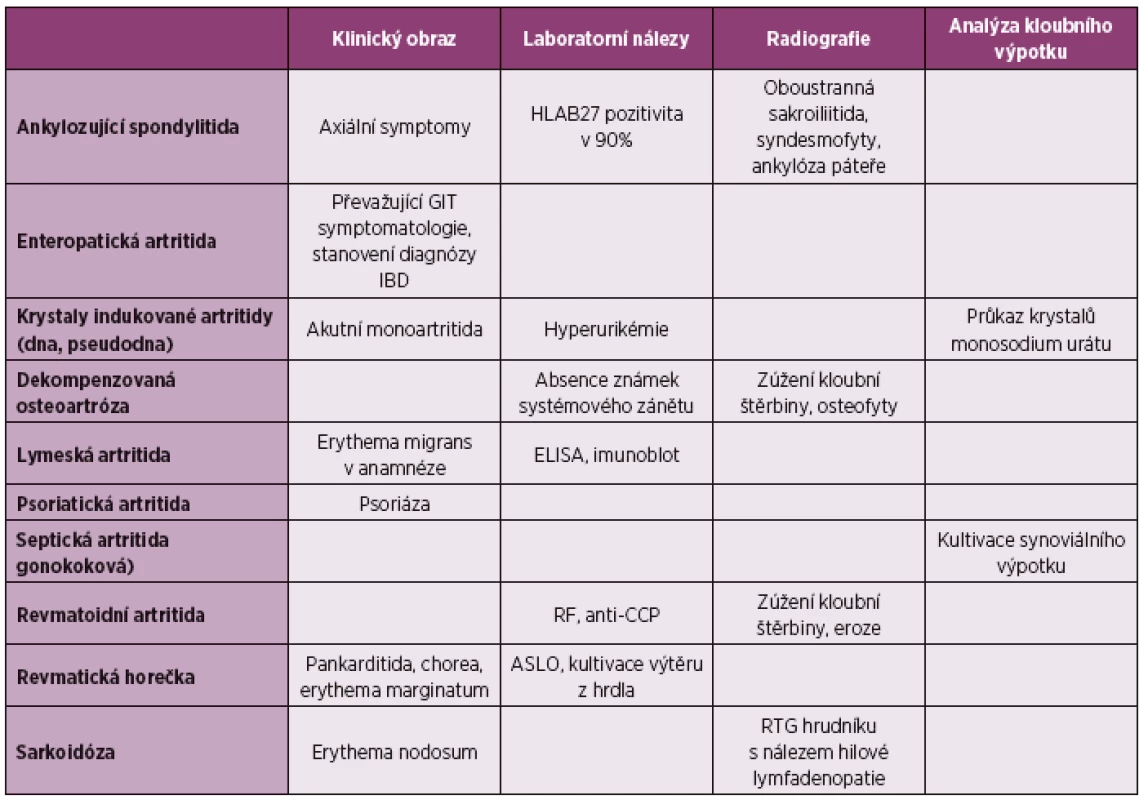
Léčba
ReA je často onemocnění, jehož příznaky spontánně odezní i bez léčby („self limited“). Fyzioterapie může pomoci zmírňovat symptomy zvýšením svalové síly, zlepšením mobility a funkce.
Nesteroidní antirevmatika jsou základním lékem v léčbě akutní fáze ReA. Vyšší dávky mají obvykle větší účinnost, preferovány mohou být NSA s dlouhým poločasem. Kontinuální podávání nesteroidních antiflogistik v plné fixní dávce dle některých údajů zpomaluje rentgenovou progresi ankylozující spondylitidy, obdobné studie pro ReA však chybějí (18).
Před zahájením léčby je nutno vyhodnotit rizika nežádoucích účinků v oblasti gastrointestinální a kardiovaskulární. V případě rizika NSA gastropatie nebo GI intolerance NSA je třeba kombinovat neselektivní NSA s inhibitorem protonové pumpy (PPI), případně podat COX-2 preferenční NSA nebo COX-2 selektivní koxiby, eventuálně i tyto při vysokém riziku kombinovat s inhibitorem protonové pumpy (19). Při zvýšeném kardiovaskulárních riziku jsou koxiby, ale také některá tradiční NSA (diclofenac) nevhodné. Kardiovaskulární toxicita spojená s užitím COX-2 inhibitorů a některých tradičních NSA je zprostředkovaná společným mechanismem zahrnujícím inhibici COX-2 dependentních prostacyklinů v krevních destičkách. Naproxen je jediné neaspirinové NSA, které postrádá funkční COX-2 selektivitu v trombocytech (20) a z metaanalýz vychází konzistentně jako nesteroidní antirevmatikum s minimálním kardiovaskulárním rizikem (21).
Glukokortikoidy podávané k entezím nebo intraartikulárně eventuálně celkově jsou vhodné pro pacienty s těžším průběhem onemocnění. Lokální aplikaci glukokortikoidů do kloubů a k entezím je možné provádět tam, kde je vyloučena infekční etiologie. Intraartikulární podání je efektivní především v časných fázích onemocnění a při aplikaci do velkých kloubů (kolenní kloub). Systémové podání glukokortikoidů je indikované v případě těžkého polyartikulárního postižení, obvyklá zahajovací dávka prednisonu je 20–40 mg/den. Lokální podání kortikoidů (v mastech, krémech, očních kapkách)lze využít také pro ovlivnění mimokloubních projevů ReA jako je keratoderma blenorhagicum, circinátní balanitida a uveitida.
Chorobu modifikující léky (DMARDs) jsou indikovány v případě nedostatečného efektu NSA a glukokortikoidů, nebo u nemocných s chronickou nebo erozivní artritidou. Sulfasalazin je účinný u onemocnění s periferní kloubními projevy, refrakterního na terapii NSA. Randomizovaná placebem kontrolovaná, dvojitě zaslepená studie z roku 1996 zkoumala efekt sulfasalazinu v dávce 2 g/den. Zařazeno bylo celkem 134 pacientů s NSA refrakterní ReA, 28 pacientů (21 %), ve studii bylo sledováno globální hodnocení aktivity onemocnění pacientem, hodnocení aktivity onemocnění lékařem, počet bolestivých a oteklých kloubů. Na léčbu sulfasalazinem pozitivně reagovalo 62 % při srovnání s 48 % léčených placebem (p = 0,09), pokles na hranici významnosti zaznamenal Spondylitis Articular Index number (p = 0,05), statisticky významně klesla sedimentace erytrocytů: -12,5 vs. -1,6 (p = 0,002). Nežádoucí účinky byly poměrně málo časté, jednalo se většinou o nespecifické gastrointestinální potíže (22). Randomizovaná dvojitě zaslepená, kontrolovaná studie srovnávala účinek sulfasalazinu v dávce 2–3 g/den (n = 79) s placebem. Aktivní léčba vedla ke snížení počtu dnů pracovní neschopnosti (p < 0,01), zvýšila procento remisí onemocnění ve 2. měsíci (p = 0,01), nebyl však prokázán statisticky významný rozdíl v rychlosti navození remise nebo trvání kompletní remise po 6 měsících. Mnoho pacientů (29 %) nedokončilo sledování, většinou z důvodů mírných nežádoucích gastrointestinálních příznaků (n = 23) (23).
Methotrexát může být použit jako alternativní DMARDs u pacientů, kteří netolerují nebo nereagují na léčbu sulfasalazinem. Podávání methotrexátu však nebylo formálně studováno u ReA a není dostatek důkazů podporujících tento postup. Klinické zkušenosti naznačují, že tato léčba může být přínosem pro léčbu periferních projevů ReA. Použití azathioprinu a cyklosporinu v léčbě ReA je popsáno v řadě kazuistik či observací, ale nebylo předmětem hodnocení relevantních klinických studií.
Anti TNFα terapie zlepšuje symptomy ReA perzistující i po vyčerpání možností konvenční terapie. Inhibitory TNFα jsou velmi účinné v léčbě jiných typů spondyloartritid, u ankylozující spondylitidy či psoriatické artritidy. Sérové hladiny TNFα jsou zvýšeny i u pacientů s ReA ve srovnání se zdravými kontrolami, ne však tak výrazně jako u jiných typů zánětlivých kloubních onemocnění (24). Na druhou stranu existují obavy z možné reaktivace perzistující infekce spouštějící ReA (25). Neexistují žádné randomizované studie hodnoticí účinnost anti-TNF terapie u ReA. Několik kazuistik a malá otevřená studie naznačují klinický přínos u k sDMARDs refrakterních ReA (26–29). Zmiňovaná otevřená studie posuzovala účinnost etanerceptu (25 mg s.c. aplikace 2x týdně) u 16 pacientů s nediferencovanou spondyloartritidou nebo ReA. Deset pacientů dokončilo šestiměsíční studii, z těchto deseti bylo devět považováno za respondéry. Synoviální biopsie byly provedeny před a po léčbě etanerceptem a byla sledována přítomnost nukleové kyseliny bakteriálních organismů pomocí polymerázové řetězové reakce (PCR). Ve třech případech byla zjištěna pozitivita PCR analýzy před zahájením léčby, po léčbě došlo k negativizaci PCR ve dvou případech (26). Léčba anti-TNFα byla bezpečná a účinná u pacientů s časným podáním v případě ReArefrakterní na NSA či DMARDs. Publikována byla také série případů 10 mužů s reaktivní artritidou s trváním onemocnění ≤ 1 rok. Byli léčeni anti-TNFαterapií, 4z nich dostávali infliximab 5 mg / kg, 1 infliximab 3 mg /kg, 4 pacienti dostali etanercept 50 mg / týden, a 1 adalimumab 40 mg každé 2 týdny. Současně byla povolena léčba NSA, glukokortikoidy, methotrexátem či sulfasalazinem. Odpověď byla definována jako zlepšení bolesti a otoku kloubu > 30 %, či zlepšení stavu > 30 % v mimokloubních projevech hodnoceno pomocí VAS (vizuální analogové škály) a jako pokles hladiny C-reaktivního proteinu pod 20 mg / l. Léčebné odezvy bylo dosaženo u 90 % pacientů, tento efekt byl pozorován již během prvních 2 týdnů léčby. Léčba byla ukončena u šesti pacientů pro remisi, u třech z nich došlo k relapsu s dobrou léčebnou odezvou na znovuzahájení léčby. U dalších třech pacientů trvala remise mezi 11 až 16 měsíci. Nebyly hlášeny žádné závažné nežádoucí příhody ani reaktivace infekce spouštějící ReA (30).
Tocilizumab v dávce 8 mg / kg aplikovaný každé 4 týdny celkem šestkrát vedl k vymizení příznaků u jedné pacientky s refrakterní ReA (31).
Antibiotická terapie. Spornou nadále zůstává otázka užitečnosti antibiotické léčby u pacientů s ReA. Léčba antibiotiky se doporučuje jednoznačně u pacientů s akutní chlamydiovou urogenitální infekcí nebo zdokumentovanou nepřeléčenou infekcí, ne však u všech nemocných s prokázanou reaktivní artritidou. V systematickém přehledu 12 randomizovaných studií, které srovnávaly efekt terapie antibiotiky vůči placebu u celkem 737 pacientů, nebyl prokázán přínos podávání antibiotik v ovlivnění počtu oteklých či bolestivých kloubů nebo v globálním hodnocení aktivity onemocnění pacientem. Dlouhodobá antibiotická léčba zvyšovala riziko především gastrointestinálních nežádoucích účinků. Je však třeba upozornit na fakt, že ke všem zařazeným studiím existují metodologické výhrady z pohledu metodiky výběru nemocných, metody zaslepení či hodnocených parametrů (32).
Oproti těmto údajům stojí však výsledky, které podání kombinace antibiotik spíše podporují. Je třeba zmínit studii kombinovaného a prolongovaného podávání antibiotik po dobu 6 měsíců u chlamydiemi indukované chronické reaktivní artritidy se 42 dospělými pacienty s chronickou postchlamydiovou ReA (zařazeni nemocní s anamnézou infekce Chlamydia trachomatis i pneumonie). Pacienti byli náhodně rozděleni do 3 skupin, byli léčeni po dobu 6 měsíců a sledováni po dobu 9 měsíců. Podávány byly kombinace doxycyklin 100 mg dvakrát denně a rifampicin 300 mg/ den, azitromycin 500 mg/ den a rifampicin 300 mg/ den anebo placebo. Primárním cílem studie bylo zlepšení o ≥ 20 % v alespoň ve 4 ze 6 parametrů měřících bolest, ztuhlost a aktivitu nemoci bez zhoršení v jakémkoli parametru. Po 6 měsících dosáhlo primárního cíle 63 % pacientů léčených kteroukoliv kombinací antibiotik oproti 20 % u placeba (p = 0,01) (33). Efekt kombinace antibiotik však nepotvrdila randomizovaná studie o 56 pacientech s časným nástupem ReA (47 postenterická ReA, 9 postchlamydiová ReA), kteří byli náhodně rozděleni do skupin užívajících kombinaci antibiotik (ofloxacin 200 mg a roxithromycin 150 mg dvakrát denně) proti placebu po dobu 3 měsíců, Chlamydie trachomatis však byla identifikovaná jako spouštěcí infekce pouze u 12,5 % ze zařazených (34). Lze říci, že výsledky uvedených studí a metaanalýz zabývajících se ATB léčbou ReA jsou spíše nejednoznačné než skutečně negativní. Užitečnost prolongovaného podávání antibiotik lze připustit u chlamydiemi indukované ReA, naproti tomu u postenterických forem ReA nejsou k dispozici žádné informace, které by prokazovaly užitečnost tohoto postupu.
Prognóza
Průběh reaktivní artritidy se značně liší pravděpodobně v závislosti na spouštěcím patogenu a genetickém pozadí hostitele. Typická doba trvání onemocnění je tři až pět měsíců. Většina pacientů se dostane buď do remise onemocnění, nebo mají onemocnění s nízkou aktivitou v období 6–12 měsíců. U 15 až 20 % pacientů může dojít k přechodu do chronické perzistující aktivní artritidy. Studie Evropské ligy proti revmatismu (EULAR) sledovala 152 pacientů s reaktivní artritidou, kteří byli zařazeni do dvou měsíců od nástupu artritidy a byli sledováni po dobu 24 týdnů. Na konci sledování téměř všichni pacienti měli velmi nízkou aktivitu onemocnění (35). Ve studiích finských autorů u nemocných s ReA indukovanou infekcí bakteriemi rodu Yersinia, Salmonella, Shigella a Chlamydia mělo projevy ReA déle než rok 4 až 19 % pacientů (36, 37). U některých pacientů s chronickou reaktivní artritidou se později vyvinou znaky charakteristické pro další choroby ze skupiny spondyloartritid, např. psoriatická artritida, ankylozující spondylitida, nebo artritidy související se zánětlivým onemocněním střev. Přítomnost antigenu HLAB27 byla spojena s horší prognózou v některých, ale ne ve všech studiích. Nálezy naznačují, že u pacientů, kteří jsou HLA-B27-pozitivní, je větší pravděpodobnost vzniku chronické spondyloartritidy s rentgenovými změnami (35, 38, 39). Pacienti s triádou artritidy, uretritidy a zánětu spojivek mohou mít horší prognózu (40, 41). Úmrtnost na ReA je vzácná, obvykle je způsobena srdečními komplikacemi nebo amyloidózou (3–5).
Závěr
ReA je důležitou nozologickou jednotkou, na kterou je třeba diagnosticky pomýšlet vždy při manifestaci artritického syndromu či entezopatiích, eventuálně definovaných extraartikulární symptomech v časovém vztahu k infekci zejména urogenitálního či zažívacího traktu. Diagnostika se opírá významně o epidemiologickou anamnézu, dále o laboratorní průkaz infekčního agens či jeho sérologické stopy a o vyloučení ostatních relevantních příčin stavu. Klinické zkušenosti ukazují, že nesteroidní protizánětlivé léky (NSAID) a kortikosteroidy jsou účinné v léčbě ReA. Chorobu modifikující léky jsou často využívány u více závažných nebo chronických případů, avšak pouze účinnost sulfasalazin (SSZ) byla náležitě studována. Inhibitory TNFα jsou mimořádně účinné u jiných typů spondyloartritid (ankylózující spondylitida, psoriatická artritida), ale existuje jen velmi málo údajů podporujících jejich použití u ReA. Přínos dlouhodobého podávání antibiotik není jasný. Prognóza ReA není tak příznivá, jak se dříve tradovalo, protože 30–50 % všech případů ReA může přejít do chronicity.
Projekt byl podpořen z SV 260373
Adresa pro korespondenci:
MUDr. M. Žurek, Ph.D.
III. interní klinika - nefrologická, revmatologická a endokrinologická
FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: martin.zurek@fnol.cz
Sources
1. Dougados M, van der Linden S, Juhlin R, Huitfeldt B, Amor B, Calin A et al. The European Spondylarthropathy Study Group preliminary criteria for the classification of spondylarthropathy. Arthritis Rheum 1991; 34 : 1218–27.
2. Rudwaleit M, van der Heijde D, Landewé R, Listing J, Akkoc N, Brandt J et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis 2009; 68 : 777–83.
3. Hannu T. Reactive arthritis. Best Pract Res Clin Rheumatol 2011; 25 : 347–57.
4. Carter JD. Treating reactive arthritis: insights for the clinician. Ther Adv Musculoskelet Dis 2010; 2 : 45–54.
5. Carter JD, Inman RD, Whittum-Hudson J, Hudson AP. Chlamydia and chronic arthritis. Ann Med 2012; 44 : 784–92.
6. Hill Gaston JS, Lillicrap MS. Arthritis associated with enteric infection. Best Pract Res Clin Rheumatol 2003; 17 : 219–39.
7. Gravano DM, Hoyer KK. Promotion and prevention of autoimmune disease by CD8+ T cells. J Autoimmun 2013; 45 : 68–79.
8. Carter JD, Gerard HC, Espinoza LR, Ricca LR, Valeriano J, Snelgrove J, et al. Chlamydiae as etiologic agents in chronic undifferentiated spondylarthritis. Arthritis Rheum 2009; 60 : 1311–6.
9. Hamdulay SS, Glynne SJ, Keat A. When is arthritis reactive? Postgrad Med J 2006; 82 : 446–53.
10. Nikkari S, Rantakokko K, Ekman P, Möttönen T, Leirisalo-Repo M, Virtala M et al. Salmonella-triggered reactive arthritis: use of polymerase chain reaction, immunocytochemical staining, and gas chromatography-mass spectrometry in the detection of bacterial components from synovial fluid. Arthritis Rheum 1999; 42 : 84–9.
11. Gérard HC, Branigan PJ, Schumacher HR Jr, Hudson AP. Synovial Chlamydia trachomatis in patients with reactive arthritis/Reiter's syndrome are viable but show aberrant gene expression. J Rheumatol 1998; 25 : 734–42.
12. Gérard HC, Schumacher HR, El-Gabalawy H, Goldbach-Mansky R, Hudson AP. Chlamydia pneumoniae present in the human synovium are viable and metabolically active. Microb Pathog 2000; 29 : 17–24.
13. Gaston JS, Cox C, Granfors K. Clinical and experimental evidence for persistent Yersinia infection in reactive arthritis. Arthritis Rheum 1999; 42 : 2239–42.
14. Kuipers JG, Zeidler H, Kohler L. How does Chlamydia cause arthritis? Rheum Dis Clin North Am 2003; 29 : 613–29.
15. Dulphy N, Peyrat MA, Tieng V, Douay C, Rabian C, Tamouza R, Laoussadi S et al. Common intra-articular T cell expansions in patients with reactive arthritis: identical beta-chain junctional sequences and cytotoxicity toward HLA-B27. J Immunol 1999; 162 : 3830–9.
16. Baillet AC, Rehaume LM, Benham H, O'Meara CP, Armitage CW, Ruscher R et al. High Chlamydia Burden Promotes Tumor Necrosis Factor-Dependent Reactive Arthritis in SKG Mice. Arthritis Rheumatol 2015; 67 : 1535–47.
17. Braun J1, Kingsley G, van der Heijde D, Sieper J. On the difficulties of establishing a consensus on the definition of and diagnostic investigations for reactive arthritis. Results and discussion of a questionnaire prepared for the 4th International Workshop on Reactive Arthritis, Berlin, Germany, July 3-6, 1999. J Rheumatol 2000; 27 : 2185–92.
18. Wanders A, Heijde D, Landewé R, Béhier JM, Calin A, Olivieri I et al. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomized clinical trial. Arthritis Rheum 2005; 52 : 1756–65.
19. Yang M, He M, Zhao M, Zou B, Liu J, Luo LM et al. Proton pump inhibitors for preventing non-steroidal anti-inflammatory drug induced gastrointestinal toxicity: a systematic review. Curr Med Res Opin 2017; 25 : 1–8.
20. Trelle S, Reichenbach S, Wandel S et al. Cardiovascular safety of non-steroidal anti-inflammatory drugs: network meta-analysis. BMJ 2011; 342: c7086.
21. Schiff M, Minic M. Comparison of the Analgesic Efficacy and Safety of Nonprescription Doses of Naproxen Sodium and Ibuprofen in the Treatment of Osteoarthritis of the Knee. The Journal of Rheumatology 2004; 31 : 1373–83.
22. Clegg DO, Reda DJ, Weisman MH, Cush JJ, Vasey FB, Schumacher HR Jr et al. Comparison of sulfasalazine and placebo in the treatment of reactive arthritis (Reiter's syndrome). A Department of Veterans Affairs Cooperative Study Arthritis Rheum 1996; 39 : 2021–7.
23. Egsmose C, Hansen TM, Andersen LS, Beier JM, Christensen L, Ejstrup L et al. Limited effect of sulphasalazine treatment in reactive arthritis. A randomised double blind placebo controlled trial. Ann Rheum Dis 1997; 56 : 32–6.
24. Rihl M, Gu J., Baeten D, Marker-Hermann E, Goodall J. C, Gaston J. S, et al. Alpha beta but not gamma delta T cell clones in synovial fluids of patients with reactive arthritis show active transcription of tumour necrosis factor alpha and interferon gamma. Ann Rheum Dis 2004; 63 : 1673–6.
25. Carter JD. Treating reactive arthritis: insights for the clinician. Ther Adv Musculoskelet Dis 2010; 2 : 45–54.
26. Flagg SD, Meador R, Hsia E, Kitumnuaypong T, Schumacher Jr, HR. Decreasedpain and synovial inflammation after etanercept therapy in patients with reactive and undifferentiated arthritis: an open-label trial. Arthritis Rheum2005; 53 : 613–617.
27. Haibel H, Brandt J, Rudawaleit M. Therapy of chronic enteral reactive arthritis with infliximab [abstract]. Ann Rheum Dis 2003; 62.
28. Oili KS, Niinisalo H, Korpilahde T and Virolainen J. Treatment of reactive arthritis with infliximab. Scand J Rheumatol 2003; 32 : 122–4.
29. Schrafranski, MD. Infliximab for reactive arthritis secondary to Chlamydia trachomatisinfection. Rheumatol Int 2009; 30 : 679–80.
30. Meyer A, Chatelus E, Wendling D, Berthelot JM, Dernis E, Houvenagel E et al. Safety and efficacy of anti-tumor necrosis factor α therapy in ten patients with recent-onset refractory reactive arthritis. Arthritis Rheum 2011; 63 : 1274–80.
31. Tanaka T, Kuwahara Y, Shima Y, Hirano T, Kawai M, Ogawa M, Arimitsu J, Hagihara K, Narazaki M, Ogata A, Kawase I, Kishimoto T. Successful treatment of reactive arthritis with a humanized anti-interleukin-6 receptor antibody, tocilizumab. Arthritis Rheum 2009; 61 : 1762–4.
32. Barber CE, Kim J, Inman RD, Esdaile JM, James MT. Antibiotics for treatment of reactive arthritis: a systematic review and metaanalysis. J Rheumatol 2013; 40 : 916 – 28.
33. Carter JD, Espinoza LR, Inman RD, Sneed KB, Ricca LR, Vasey FB, Valeriano J, Stanich JA, Oszust C, Gerard HC, Hudson AP. Combination antibiotics as a treatment for chronic Chlamydia-induced reactive arthritis: a double-blind, placebo-controlled, prospective trial. Arthritis Rheum 2010; 62 : 1298–307.
34. Kuuliala A, Julkunen H, Paimela L, Peltomaa R, Kautiainen H, Repo H, Leirisalo-Repo M. Double-blind, randomized, placebo-controlled study of three-month treatment with the combination of ofloxacin and roxithromycin in recent-onset reactive arthritis. Rheumatol Int 2013; 33 : 2723–9.
35. Kvien TK, Gaston JS, Bardin T, Butrimiene I, Dijkmans BA, Leirisalo-Repo M, Solakov P, Altwegg M, Mowinckel P, Plan PA, Vischer T, EULAR Three month treatment of reactive arthritis with azithromycin: a EULAR double blind, placebo controlled study. Ann Rheum Dis 2004; 63 : 1113–9.
36. Hannu T. Reactive arthritis. Best Pract Res Clin Rheumatol 2011; 25 : 347–57.
37. Leirisalo-Repo M, Sieper J. Reactive arthritis: epidemiology, clinical features, and treatment. In: Ankylosing spondylitis and the spondyloarthropathies, Weisman MH, van der Heijde D, Reveille JD (Eds), Mosby Elsevier, Philadelphia 2006; 53.
38. Hannu T, Inman R, Granfors K, Leirisalo-Repo M. Reactive arthritis or post-infectious arthritis? Best Pract Res Clin Rheumatol 2006; 20 : 419–33.
39. Leirisalo-Repo M, Suoranta H. Ten-year follow-up study of patients with Yersinia arthritis. Arthritis Rheum 1988; 31 : 533–7.
40. Fox R, Calin A, Gerber RC, Gibson D. The chronicity of symptoms and disability in Reiter's syndrome. An analysis of 131 consecutive patients. Ann Intern Med 1979; 91 : 190–3.
41. Hart HH, McGuigan LE, Gow PJ, Grigor RR Reiter's syndrome: chronicity of symptoms and employment. Aust N Z J Med 1986; 16 : 452–6.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2017 Issue 2
Most read in this issue- Reaktivní artritidy
- Doporučení České revmatologické společnosti pro léčbu systémové sklerodermie
- Spondyloartritidy: jejich genetická zátěž a dědičnost
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

