-
Medical journals
- Career
Asociace promotorového polymorfismu -1082 G/A v genu pro interleukin-10 s produkcí autoprotilátek u revmatoidní artritidy
Authors: P. Němec 1; M. Goldbergová-Pávková 2; J. Gatterová 3; Z. Fojtík 4; A. Vašků 2; M. Souček 1
Authors‘ workplace: Revmatologická ambulance, II. interní klinika, Fakultní nemocnice u sv. Anny v Brně a Lékařské fakulty Masarykovy univerzity, Brno, 2Ústav patologické fyziologie, Lékařské fakulty Masarykovy univerzity, Brno 1; Revmatologický ústav, Praha, 4Revmatologická ambulance, Interní a hematoonkologická klinika Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity, Brno 3
Published in: Čes. Revmatol., 16, 2008, No. 3, p. 104-109.
Category: Original Papers
Overview
Interleukin-10 (IL-10) je imunoregulační cytokin s předpokládanými protizánětlivými účinky v patogenezi revmatoidní artritidy (RA). IL-10 však může mít i prozánětlivé účinky, například schopnost aktivace B lymfocytů a stimulace produkce autoprotilátek. Cílem práce bylo analyzovat vztah mezi jednonukleotidovou záměnou na pozici -1082 G/A v promotoru genu pro IL-10 a produkcí revmatoidních faktorů (RF) u pacientů s RA. Do studie bylo zařazeno celkem 151 pacientů s RA diagnostikovanou na základě diagnostických kritérií American College of Rheumatology. Délka onemocnění byla u všech pacientů minimálně 2 roky. Pomocí polymerázové řetězové reakce (PCR) byl amplifikován promotorový úsek genu pro IL-10. Sérové hladiny RF byly detekovány ELISA metodou. Byl nalezen signifikantní rozdíl v distribuci genotypů polymorfismu -1082 G/A v genu pro IL-10 mezi souborem RA pacientů s pozitivitou a negativitou RF izotypů IgM, IgA a IgG s vyšší prevalencí genotypu GG v souboru pacientů s negativitou RF IgM (Pg = 0.006), negativitou RF IgA (Pg = 0,05) a negativitou RF IgG (Pg = 0,007). Výsledek studie naznačuje možnost existence asociace mezi promotorovým polymorfismem – 1082 G/A v genu pro IL-10 a produkcí RF u pacientů s RA, jejíchž pozitivita může predikovat závažnější průběh onemocnění.
Klíčová slova:
autoprotilátky, gen, interleukin-10, polymorfismus, revmatoidní artritida, revmatoidní faktorÚvod
Revmatoidní artritida (RA) je chronické zánětlivé onemocnění neznámé etiologie s variabilním klinickým průběhem. Genetické a některé zevní faktory mohou ovlivňovat vnímavost jedince ke vzniku onemocnění, ale i závažnost jeho průběhu (1). Geny hlavního histokompatibilního komplexu (MHC) II. třídy představují důležitý genetický faktor ovlivňující jak vnímavost ke vzniku onemocnění, tak jeho závažnost (2). Avšak příspěvek HLA-DR4 alel představuje pouze 30–50 % z předpokládaného genetického rizika RA (3, 4).
Cytokiny, které se účastní patogeneze RA a v jejichž genech jsou přítomny polymorfní genové sekvence, představují potenciální markery ovlivňující závažnost průběhu onemocnění. Interindividuální rozdíly ve vývoji RA mohou být podmíněny rozdílnou mírou produkce těchto cytokinů ovlivněnou funkčním efektem určitých polymorfismů nacházejících se ve struktuře jejich genů.
Interleukin-10 (IL-10) je významný imunoregulační cytokin s předpokládanými protizánětlivými účinky v patogenezi RA. Řada studií prokazuje jeho účast na vývoji kloubních erozí u RA. Předpokládaným mechanismem jeho působení je schopnost inhibovat produkci prozánětlivých cytokinů aktivovanými makrofágy, T lymfocyty a polymorfonukleárními leukocyty, dále inhibice produkce matrixových metaloproteináz (MMP), inhibice exprese MHC I. třídy a inhibice proliferace Th1 lymfocytů (5–10). Některé z předpokládaných účinků IL-10 v patogenezi RA však mohou být i prozánětlivé, jako například schopnost aktivace B lymfocytů a stimulace produkce autoprotilátek (11).
IL-10 je produkován zejména Th2 lymfocyty, B lymfocyty a makrofágy. Bývá detekován ve vyšších koncentracích v séru a synoviální tekutině pacientů s RA (12). Předpokládá se, že jeho produkce je pod genetickou kontrolou. Studie s jednovaječnými dvojčaty prokázala, že genetické faktory ovlivňují interindividuální rozdíly v produkci IL-10 přibližně z 75 % (9).
Gen pro IL-10 je lokalizován na dlouhém raménku prvního chromozomu v oblasti označované 1q31–q32 (13). Analýza této oblasti prokázala její značnou variabilitu s množstvím jednonukleotidových záměn (SNP) v promotorové oblasti a dvěma mikrosatelitními polymorfismy označovanými IL10.R a IL10.G, které se nacházejí 4 kb a 1,1 kb směrem k 5’ konci od iniciačního transkripčního místa genu (14–16). V promotoru genu bylo doposud identifikováno celkem osm SNP (17–19). Pozornost je věnována zejména jednonukleotidovým záměnám na pozicích -1082 G/A, -819 C/T a -592 C/A (17, 19, 20).
V naší práci jsme studovali možnou existenci vztahu mezi polymorfismem -1082 G/A v promotoru genu pro IL-10, vnímavostí ke vzniku choroby, rentgenovou progresí RA, funkčním stavem pacientů s RA a produkcí revmatoidních faktorů (RF).
Metoda
Studovaná populace
Do projektu bylo zařazeno celkem 151 pacientů s RA, kteří byli vyšetřeni v průběhu roků 2004 až 2006 v revmatologické ambulanci II. interní kliniky Fakultní nemocnice u sv. Anny v Brně. Zařazení jedince do projektu bylo podmíněno podpisem informovaného souhlasu. Studie probíhala v souladu s Helsinskou deklarací schválenou na zasedání WMA v Edinburgu. Byla schválena Etickou komisí Fakultní nemocnice u sv. Anny v Brně a Lékařské fakulty Masarykovy univerzity v Brně. Diagnóza RA byla stanovena na základě splnění revidovaných diagnostických kritérií American college of rheumatology (ACR) (21). Součástí klinického vyšetření byl odběr krve k analýze sedimentace erytrocytů (FW), C-reaktivního proteinu (CRP) a detekci RF. Sérové hladiny jednotlivých izotypů RF IgM, IgA a IgG byly detekovány metodou ELISA (Aeskulisa Rf – A,G,M; Aesku diagnostics). Vybraná demografická, klinická a laboratorní data pacientů s RA zařazených do studie ukazuje tabulka 1. Kontrolní soubor zahrnoval 205 zdravých dobrovolníků obdobné distribuce věku (věkové rozpětí 27 až 86 roků, medián 55 roků) bez klinických a laboratorních známek RA.
Table 1. Demografické, klinické a vybrané laboratorní charakteristiky souboru pacientů s RA. 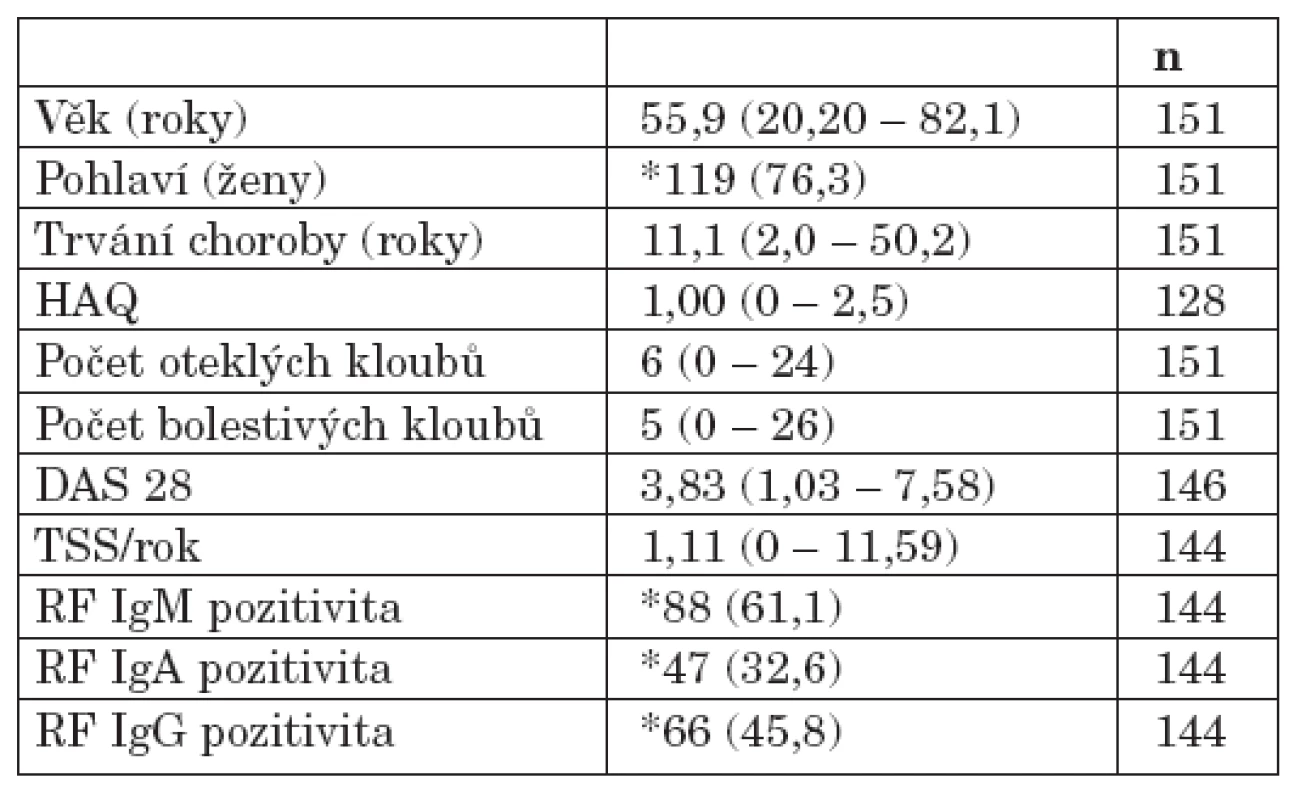
Hodnoty jsou uvedeny jako medián (rozpětí) nebo jako *absolutní počet (procento)
Hodnocení rentgenové progrese
Rentgenová progrese byla stanovena zkušeným rentgenologem z rentgenového snímku rukou pacientů s RA na základě modifikovaného skóre dle Sharpa/ van der Heijde (22). Součtem skóre erozí a skóre zúžení kloubních štěrbin bylo vypočítáno tzv. totální Sharpovo skóre (TSS) (hodnota 0–280) a dále vypočítána roční míra rentgenové progrese onemocnění (TSS/rok). Následně byl soubor pacientů s RA rozdělen na dva podsoubory podle roční míry rentgenové progrese (TSS/rok ≤ 1,00; TSS/rok > 1,00).
Hodnocení funkčního stavu
Funkční stav pacientů s RA byl hodnocen na základě dotazníku Health assessment questionnaire (HAQ). Následně byl vypočítán standardní index disability (SDI) s výslednou hodnotou od 0 do 3,0. Střední hodnota SDI byla v našem souboru 1,00. Soubor pacientů s RA byl následně rozdělen na podsoubor pacientů s SDI ≤ 1,00 a podsoubor pacientů s SDI > 1,00.
Analýza polymorfismu -1082 G/A v genu pro IL-10
Pacientům i kontrolám bylo odebráno 5 ml periferní krve do zkumavky s 300 μl 0,5M EDTA (pH = 8,0), který slouží jako antikoagulační činidlo. DNA byla izolována z periferních leukocytů technikou pomocí proteinázy K. Tato technika zahrnovala cytolýzu erytrocytů přidáním 5 ml destilované vody a následným zmrazením vzorku na -20 ŻC po dobu 24 hodin, separaci lymfocytů centrifugací, přidání 20 ml fyziologického roztoku a opakovanou centrifugaci, přidání 3 ml FASANA a 20 μl proteinázy K a důkladnou resuspenzaci lymfocytů a následnou inkubaci při 37 ŻC, dále deproteinaci chloroformem, vysrážení DNA přidáním 4 ml ledového isopropanolu, následné namotání vláken DNA na vyžíhaný skleněný háček, jejich opláchnutí 70% ethanolem a vysušení. DNA byla dále rozpuštěna ve 250 μl TE pufru a uchovávána při teplotě -20 ŻC. Amplifikace zvoleného úseku DNA probíhala metodou polymerázové řetězové reakce (PCR) v termocykleru (PTC – 200) za předem stanovených optimálních podmínek a za použití oligonukleotidových primerů: -1082 A, 5’ - ACT TCC CC T TCC CAA AGA A - 3’; -1082 G, 5’ - TTC TTT GGG A GG GGG AAG - 3’. Pro detekci polymorfismu -1082 G/A bylo použito metody analýzy délky restrikčních fragmentů (RFLP) amplifikovaného úseku DNA pomocí restrikčního enzymu BseRI. Separace fragmentů probíhala ve 2% agarózovém gelu Serva. Jako elektroforetický pufr byl použit TBE. Do gelu byl přidáván ethidium bromid do výsledné koncentrace 5 mg/ml. Jednotlivé bandy byly vizualizovaný v ultrafialovém světle. Byla detekována alela A: 359 bp a alela G: 318+41 bp.
Statistická analýza
Rozdíly v distribuci genotypů a alelických frekvencích polymorfismu -1082 G/A v genu pro IL-10 mezi pacienty a kontrolním souborem a mezi podsoubory pacientů byly kalkulovány pomocí χ2 testu a Fisher-exact testu. Shoda genotypových distribucí s Hardy-Weinbergovou rovnováhou byla testována pomocí χ2testu. Odds ratio (OR) a 95 % konfidenční interval (CI) byl využit k výpočtu rizika polymorfismu -1082 G/A ve vztahu k průkazu RF u sledovaného onemocnění. K výpočtu signifikance OR byl použit Fisher-exact test. Za signifikantní byla považována hladina významnosti 5 %. K analýze dat byl použit program Statistica v.6.0 (Statsoft Inc., Tulsa, UK).
Výsledky
V rámci obou sledovaných souborů, tedy souboru pacientů s RA a kontrolního souboru, bylo rozložení genotypů polymorfismu -1082 G/A v souladu s Hardy-Weinbergovou rovnováhou. Nebyly pozorovány signifikantní rozdíly v distribuci genotypů ani v alelických frekvencích tohoto polymorfismu mezi oběma sledovanými soubory.
Rovněž nebyl prokázán signifikantní rozdíl v distribuci genotypů a alelických frekvencích polymorfismu -1082 G/A mezi podsoubory pacientů s rozdílnou rentgenovou progresí onemocnění a rozdílným funkčním stavem.
Na druhou stranu byl nalezen signifikantní rozdíl v distribuci genotypů polymorfismu -1082 G/A mezi podsoubory pacientů s RA s pozitivitou a negativitou RF izotypů IgM, IgA a IgG.
Tabulka 2 ukazuje distribuci genotypů a alelické frekvence polymorfismu -1082 G/A genu pro IL-10 u pacientů s RA s pozitivitou a negativitou RF IgM, IgA a IgG. Byl nalezen signifikantní nárůst prevalence genotypu GG polymorfismu -1082 G/A v podsouboru pacientů s RA s negativitou RF IgM (Pg = 0,006). Ve srovnání s ostatními genotypy tohoto polymorfismu (AA; AG), byla prokázána téměř 4krát vyšší prevalence genotypu GG v podsouboru pacientů s RA s negativitou RF IgM (OR = 3,68; 95% CI 1,42 – 9,70; P = 0,0028). Rozdíl v alelických frekvencích polymorfismu -1082 G/A mezi těmito sledovanými podsoubory nebyl statisticky významný, ale byl pozorován trend k nárůstu frekvence alely G v podsouboru pacientů s RA s negativitou RF gM (Pa = 0,08).
Table 2. Distribuce genotypů a alelické frekvence polymorfismu -1082 G/A genu pro IL-10 u pacientů s RA s pozitivitou a negativitou RF IgM, IgA a IgG. 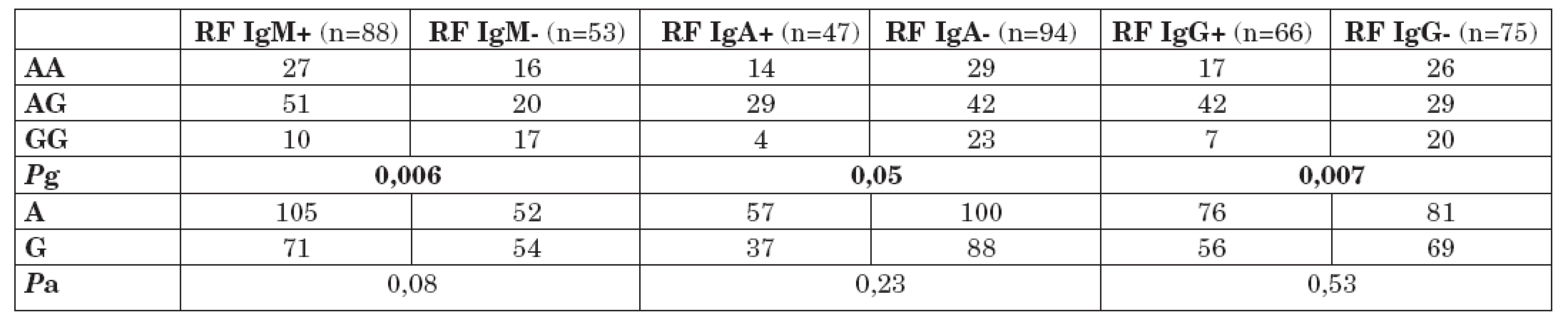
Rovněž byl nalezen signifikantní nárůst prevalence genotypu GG polymorfismu -1082 G/A v podsouboru pacientů s RA s negativitou RF IgA (Pg = 0,05). Ve srovnání s ostatními genotypy tohoto polymorfismu (AA; AG), byla nalezena více než 3krát vyšší prevalence genotypu GG v podsouboru pacientů s RA s negativitou RF IgA (OR = 3,48; 95% CI 1,04 – 12,8; P = 0,017). Rozdíl v alelických frekvencích polymorfismu -1082 G/A mezi těmito sledovanými podsoubory nebyl statisticky významný (Pa = 0,23).
Genotyp GG polymorfismu -1082 G/A v genu pro IL-10 byl rovněž statisticky významně častěji přítomen u podsoboru pacientů s RA s negativitou RF IgG (Pg = 0,007). Rovněž rozdíl v alelických frekvencích polymorfismu -1082 G/A mezi těmito sledovanými podsoubory nebyl statisticky významný (Pa = 0,53).
Diskuse
IL-10 je významný imunoregulační cytokin s předpokládanými protizánětlivými účinky v patogenezi RA. Různé práce prokazují jeho účast v procesu vývoje kloubních erozí u RA. Preklinické studie prokázaly jeho schopnost inhibovat široké spektrum prozánětlivých cytokinů jako jsou IL-1α, IL-1β, IL-6, IL-8, IL-12 a tumor nekrotizující faktor-α (TNFα) v aktivovaných makrofázích, interferon-γ (IFNγ) produkovaný T lymfocyty a TNFα, IL-1β a IL-8 produkované neutrofilními leukocyty (5 – 7, 10). Navíc je IL-10 schopen snižovat expresi MHC I. třídy a inhibovat proliferaci Th1 lymfocytů (23). Funkce IL-10 v regulaci imunitní homeostázy byly studovány v podmínkách in vivo na modelu IL-10 knock-out myší. U tohoto zvířecího modelu docházelo k nekontrolovanému zvýšení produkce IL-12 a IFN-γ, což vedlo k projevům CD4+ lymfocyty zprostředkovaného autoimunitního onemocnění (24). Experimentální práce na kulturách synoviální tkáně prokazují, že IL-10 inhibuje produkci TNFα, IL-1 a MMP a navíc stimuluje produkci tkáňového inhibitoru metaloproteináz-I (TIMP-I)(8, 25). MMP se podílí na degradaci extracelulární matrix hyalinní kloubní chrupavky. Nedostatek IL-10 může zapříčinit zvýšení exprese MMP a naopak snížení produkce TIMP-I, což může vést k degradaci kloubní chrupavky a destrukci kloubu. V souladu s těmito poznatky bylo pozorováno, že deficit IL-10 zvyšuje incidenci a závažnost onemocnění u zvířecího modelu kolagenem indukované artritidy (26–29). Naopak exogenní dodání IL-10 inhibuje kloubní destrukci, zatímco podání anti-IL10 monoklonální protilátky zhoršuje destrukci kloubů u tohoto modelu artritidy (26–28). Některé z předpokládaných účinků IL-10 v patogenezi RA však mohou být i prozánětlivé, jako například schopnost aktivace proliferace a diferenciace B lymfocytů a stimulace produkce autoprotilátek (11).
Syntéza IL-10 je geneticky kontrolována. Původně se předpokládalo, že rozdíly v produkci IL-10 jsou zapříčiněny rozdílnou produkcí TNFα, tato domněnka se však nepotvrdila (9, 30). Dřívější experimentální práce prokázala, že rozdílná úrověň lipopolysacharidy (LPS) indukované produkce IL-10 koreluje s rozdílnou produkcí IL-10 mRNA. Autoři této práce tedy předpokládají, že rozdílná produkce IL-10 je ovlivněna zejména odlišnou mírou tranksripce genu pro IL-10 (31).
Distribuce genotypů polymorfismu -1082 G/A genu pro IL-10 ve skupině pacientů s RA byla v práci Huizingy et al. (32) následující: -1082 AA 20,3 %; -1082 GA 54,3 % a -1082 GG 25,4 %. Významně se nelišila od distribuce genotypů tohoto polymorfismu v běžné holandské a britské populaci (19, 33–35). Na základě těchto výsledků autoři práce předpokládají, že polymorfismus -1082 G/A pravděpodobně není faktorem ovlivňujícím vnímavost ke vzniku RA. Podobně v case-control studii Martineze et al. (36) nebyl polymorfismus -1082 G/A asociován s vnímavostí ke vzniku RA. V této práci autoři prokázali pouze vztah mezi alelou IL-10.G12 mikrosatelitního polymorfismu IL-10.G a vnímavostí ke vzniku RA (18 % u pacientů s RA vs. 9 % u kontrolního souboru: P = 0,001; pc < 0,05) (36). Rovněž ve studii Hajeera et al. (34) nebyl nalezen vztah mezi polymorfismy -1082 G/A, -819 C/T a -592 C/A a vnímavostí ke vzniku RA. Lze tedy konstatovat, že výsledky předchozích studií neprokázaly, že by polymorfismus -1082 G/A genu pro IL-10 byl faktorem určujícím vnímavost ke vzniku RA. K obdobnému výsledku jsme dospěli i v naší práci.
V práci Morena et al. (37) nebyl prokázán rozdíl v alelických frekvencích, distribuci genotypů a haplotypů polymorfismů -1082 G/A, -819 C/T a -592 C/A v souboru pacientů s RA ve vztahu k věku vzniku onemocnění, historií náhrady velkých kloubů a ve vztahu k přítomnosti a titru RF. V již dříve citované studii Huizingy et al.(32) byla prokázána asociace mezi polymorfismem -1082 G/A a rentgenovou progresí RA (modifikované skóre dle Sharpa na rentgenových snímcích rukou a nohou) v dlouhodobé prospektivní studii sledující soubor žen s RA.Během prvních 6 roků sledování byl nárůst rentgenové progrese nižší u pacientek s genotypem -1082 AA (9 Ī 9/rok) ve srovnání s pacientkami s genotypem -1082 GG (19 Ī 16/rok) (P < 0,02). Tento rozdíl již nebyl patrný mezi 6. a 12. rokem sledování. Autoři této práce upozorňují, že rentgenová progrese onemocnění mohla být ovlivněna i přítomností jiných prognostických faktorů, avšak v této studii byla odlišná míra rentgenové progrese mezi jedinci s genotypy -1082 AA a -1082 GG nezávislá na přítomnosti rizikových faktorů jako je pozitivita RF nebo přítomnost HLA-DR4 alel. Na rozdíl od této zmíněné studie jsme v naší práci neprokázali vztah mezi promotorovým polymorfismem -1082 G/A v genu pro IL-10 a rentgenovou progresí RA.
Pro pochopení dané problematiky je nutné uvést následující. V práci Huizingy et al. (32) byla mimo jiné sledována míra produkce IL-10 v kulturách plné krve odebrané pacientům s RA. Byly analyzovány 3 SNP (-1082 A/G, -819 C/T a -592 A/C) v promotoru genu pro IL-10. Přítomnost alely -1082 G byla asociována se sníženou produkcí IL-10 (2682 Ī 137 pg/ml), naopak přítomnost alely -1082 A se zvýšenou produkcí IL-10 (3166 Ī 183 pg/ml) (P < 0,02). Navíc byla prokázána nejvyšší produkce IL-10 u jedinců, kteří byli nositelé haplotypu -1082 A/ -819 C/ -592 C (3033 Ī 252 pg/ml) a snižovala se u jedinců s haplotypy -1082 A/ -819 T/ -592 A (2931 Ī 312 pg/ml) a -1082 G/ -819 C/ -592 C (2601 Ī 138 pg/ml). Tento nález naznačuje, že polymorfismy v promotoru genu pro IL-10 (-1082 A/G, -819 C/T a -592 A/C) mohou mít funkční význam a mohou ovlivnit produkci IL-10. V této studii byla dále analyzována hladina IL-10 mRNA ve vzorcích synoviální tkáně získané od sedmi pacientů s erozivní RA a od sedmi pacientů s neerozivní chronickou artritidou. Vyrovnaná hladina IL-10 mRNA byla vyšší ve vzorcích synoviální tkáně získaných od pacientů s neerozivní chronickou artritidou než od pacientů s erozivní RA. Tento nález vedl autory k závěru, že zvýšená produkce IL-10 chrání kloub před tvorbou kostních erozí.
Tato data však nejsou zcela v souladu s výsledky dalších dvou studií, ve kterých byla pozorována zvýšená produkce IL-10 u jedinců s běžným haplotypem -1082 G/ -819 C/ -592 C a naopak snížená produkce IL-10 u méně častého haplotypu -1082 A/ -819 T/ -592 A (19, 20). Kolísání produkce IL-10 nemusí být podmíněno pouze variabilitou promotorové oblasti genu pro IL-10, ale je nutné připustit existenci i jiných regulačních mechanismů ovlivňujících jeho produkci.
Zajímavým zjištěním naší práce byl nález signifikantního rozdílu v distribuci genotypů polymorfismu -1082 G/A mezi podsoubory pacientů s RA s pozitivitou a negativitou RF izotypů IgM, IgA a IgG. Přítomnost RF je klíčovým diagnostickým nástrojem RA (38). RF jsou autoprotilátky převážně třídy IgM zaměřené proti antigenním determinantám Fc regionu IgG molekuly (39).RF jsou prokazovány u většiny pacientů s RA a jejich přítomnost bývá asociována se závažnějším průběhem onemocnění. Opakovaně byla prokázána asociace pozitivity RF IgA a IgM se závažnější prognózou onemocnění, erozivním fenotypem a přítomností revmatoidních uzlů (40, 41). IL-10 může hrát v patogenezi RA dvojí roli. Na jedné straně může být IL-10 protizánětlivým cytokinem a na druhé straně Th2-cytokinem stimulujícím proliferaci a diferenciaci B lymfocytů. Bylo rovněž prokázáno, že spontánní produkce RF IgM mononukleárními buňkami, získanými z periferní krve pacientů s RA v podmínkách in vitro, je závislá na produkci IL-10 (11). Ve studii Hajeera et al. (34) byl prokázán signifikantní nárůst frekvence alely -1082 A (OR 2,1, 95%, CI 1,1 – 4,3) a naopak signifikantní snížení frekvence alely -1082 G (OR 0,5, 95%, CI 0,2 – 1,0) u podskupiny pacientů s RA s pozitivitou RF IgA a současně negativitou RF IgG. Autoři rovněž prokázali statisticky významné zvýšení frekvence haplotypu -1082 A/ -819 C/ - 592 C u RA pacientů s pozitivitou RF IgA. Nárůst frekvence tohoto haplotypu byl významnější u pacientů, kteří navíc měli negativní RF IgG.
Podobně i v naší práci byla prokázána asociace mezi přítomností RF IgA a rovněž RF IgM a IgG, jejíchž pozitivita je považována za negativní prognostický marker vývoje onemocnění, a promotorovým polymorfismem -1082 G/A v genu pro IL-10. Homozygotní stav -1082 GG byl v naší práci asociován s negativitou RF u pacientů s RA. Z výše citovaných prací vyplývá, že G alela tohoto polymorfismu bývá převážně spojována se zvýšenou produkcí IL-10. Rovněž víme, že ustálená hladina IL-10mRNA byla vyšší v kulturách synoviální tkáně získaných od pacientů s neerozivní chronickou artritidou, než v kulturách získaných od pacientů s erozivní RA a tedy, že zvýšená exprese IL-10 pravděpodobně chrání postižený kloub před vývojem erozí (32). Výsledky získané v naší práci a rovněž výsledky práce Hajeera et al. (34) však neodpovídají předpokládanému konceptu vztahu mezi promotorovým polymorfismem -1082 G/A a produkcí IL-10 a předpokládanou rolí tohoto cytokinu v patogenezi RA. Spíše bychom tedy očekávali vztah mezi genotypem polymorfismu -1082 G/A asociovaným s vyšší produkcí cytokinu IL-10 a následný stimulační vliv tohoto cytokinu na proliferaci a diferenciaci B lymfocytů a produkci RF. Proto konstatujeme, že získané výsledky, prokazující vztah mezi genotypem kódujícím nízkou produkci IL-10 a pozitivitou RF, nejsou zcela kompatibilní s předpokládanou rolí IL-10 v ovlivnění produkce autoprotilátek. Je však nutné poznamenat, že variabilita produkce autoprotilátek nemusí být ovlivněna pouze tímto mechanismem.
Doposud publikované práce, zabývající se problematikou vztahu mezi RA a variabilitou genu pro IL-10 poskytují nejednoznačné výsledky. Je tedy žádoucí realizovat další studie s vyšším počtem pacientů, studující vazby i s jinými polymorfismy, k ověření role promotorových polymorfismů v genu pro IL-10 v predikci klinického průběhu a závažnosti vývoje RA.
Poděkování
Studie byla podpořena výzkumným projektem NR7812-3/2004, IGA Ministerstva zdravotnictví České republiky.
MUDr. Petr Němec, Ph.D.
Revmatologická ambulance, II. interní klinika,
Fakultní nemocnice u sv. Anny v Brně a Lékařské fakulty Masarykovy univerzity
Pekařská 53
656 91 Brno
e-mail: petr.nemec@fnusa.cz
Sources
1. Reveille JD. The genetic contribution to the pathogenesis of rheumatoid arthritis. Curr Opin Rheumatol 1998; 10 (3): 187–200.
2. Winchester R. The molecular basis of susceptibility to rheumatoid arthritis. Adv Immunol 1994; 56 : 389–466.
3. Singal DP, Li J, Lei K. Genetics of rheumatoid arthritis (RA): two separate regions in the major histocompatibility complex contribute to susceptibility to RA. Immunol Lett 1999; 69 (3): 301–6.
4. Rowley MJ, Stockman A, Brand CA, Tait BD, Rowley GL, Sherritt MA, et al. The effect of HLA-DRB1 disease susceptibility markers on the expression of RA. Scand J Rheumatol 1997; 26 (6): 448–55.
5. Joyce DA, Gibbons DP, Green P, Steer JH, Feldmann M, Brennan FM. Two inhibitors of pro-inflammatory cytokine release, interleukin-10 and interleukin-4, have contrasting effects on release of soluble p75 tumor necrosis factor receptor by cultured monocytes. Eur J Immunol 1994; 24 (11): 2699–705.
6. Hart PH, Ahern MJ, Smith MD, Finlayjones JJ. Regulatory effects of IL-13 on synovial fluid macrophages and blood monocytes from patients with inflammatory arthritis. Clin Exp Immunol 1995; 99 (3): 331–7.
7. Kawakami A, Eguchi K, Matsuoka N, Tsuboi M, Urayama S, Kawabe Y, et al. Inhibitory effects of interleukin-10 on synovial cells of rheumatoid arthritis. Imunology 1997; 91 (2): 252–9.
8. Brennan FM. IL-10 and arthritis. Rheumatology 1999; 38 (4): 293–7.
9. Westendorp RG, Langermans JA, Huizinga TW, Elouali AH, Verweij CL, Boomsma DI, et al. Genetic influence on cytokine production and fatal meningococcal disease. Lancet 1997; 349 (9046): 170–3.
10. Pretolani M, Goldman M. IL-10. A potential therapy for allergic inflammation? Immunol Today 1997; 18 (6): 277–80.
11. Perez L, Orte J, Brieva JA. Terminal differentiation of spontaneous rheumatoid factor-secreting B-cells from rheumatoid arthritis patients depends on endogenous interleukin-10. Arthritis Rheum 1995; 38 (12): 1771–6.
12. Cush JJ, Splawski JB, Thomas R, McFarlin JE, Schulze-Koops H, Davis LS, et al. Elevated interleukin-10 levels in patients with rheumatoid arthritis. Arthritis Rheum 1995; 38 (1): 96–104.
13. Eskdale J, Kube D, Tesch H, Gallagher G. Mapping of the human IL10 gene and further characterization of the 5’ flanking sequence. Immunogenetics 1997; 46 (2): 120–8.
14. Eskdale J, Gallagher G. A polymorphic dinucleotide repeat in the human IL-10 promoter. Immunogenetics 1995; 42 (5): 444–5.
15. Eskdale J, Kube D, Gallagher G.A second polymorphic dinucleotide repeat in the 5’ flanking region of the human IL10 gene. Immunogenetics 1996; 45 (1): 82–3.
16. Tumor necrosis factor locus polymorphisms in rheumatoid arthritis. Tissue Antigens 1997; 50 (3): 303–7.
17. Eskdale J, Keijsers V, Huizinga T, Gallagher G. Microsatellite alleles and single nucleotide polymorphisms (SNP) combine to form four major haplotype families at the human interleukin-10 (IL-10) locus. Genes Immun 1999; 1 (2): 151–5.
18. D’Alfonso S, Rampi M, Rolando V, Giordano M, Momigliano-Richiardi P. New polymorphisms in the IL-10 promoter region. Genes Immun 2000; 1 (3): 213–33.
19. Turner DM, Williams DM, Sankaran D, Lazarus M, Sinnott PJ, Hutchinson IV. An investigation of polymorphism in the interleukin-10 gene promoter. Eur J Immunogenet 1997; 24 (1): 1–8.
20. Crawley E, Kay R, Sillibourne J, Patel P, Hutchinson I, Woo P. Polymorphic haplotypes of the interleukin-10 5’ flanking region determine variable interleukin-10 transcription and are associated with particular phenotypes of juvenile rheumatoid arthritis. Arthritis Rheum 1999; 42 (6): 1101–8
21. Arnett FC, Edworthy SM, Bloch DA, McShane DJ, Fries JF, Cooper NS, et al. The American Rheumatism Association 1987 revised criteria for the classiffication of rheumatoid arthritis. Arthritis Rheum 1988; 31 (3): 315-24.
22. Sharp JT, Young DY, Bluhm GB, Brook A, Brower AC, Corbett M, et al. How many joints in the hands and wrists should be included in a score of radiologic abnormalities used to assess rheumatoid arthritis. Arthritis Rheum 1985; 28 (12): 1326–35.
23. Matsuda M, Salazar F, Petersson M, Masucci G, Hansson J, Pisa P, et al. Interleukin 10 pretreatment protects target cells from tumor - and allo-specific cytotoxic T cells and downregulates HLA class I expression. J Exp Med 1994; 180 (6): 2371–6.
24. Rennick DM, Fort MM, Davidson NJ. Studies with IL-10(–/–) mice: An overview. J Leukoc Biol 1997; 61 (4): 389–96
25. Lacraz S, Nicod LP, Chicheportiche R, Welgus HG, Dayer JM. IL-10 inhibits metalloproteinase and stimulates TIMP-1 production in human mononuclear phagocytes. J Clin Invest 1995; 96 (5): 2304–10.
26. Persson S, Mikulowska A, Narula S, Ogarra A, Holmdahl R. Interleukin-10 suppresses the development of collagen type II-induced arthritis and ameliorates sustained arthritis in rats. Scand J Immunol 1996; 44 (6): 607–14.
27. Joosten LA, Lubberts E, Durez P, Helsen MM, Jacobs MJ, Goldman M, et al. Role of interleukin-4 and interleukin-10 in murine collagen-induced arthritis: Protective effect of interleukin-4 and interleukin-10 treatment on cartilage destruction. Arthritis Rheum 1997; 40 (2): 249–60.
28. Lubberts E, Joosten LAB, Helsen MMA, Vandenberg WB. Regulatory role of interleukin 10 in joint inflammation and cartilage destruction in murine streptococcal cell wall (SCW) arthritis. More therapeutic benefit with IL-4/IL-10 combination therapy than with IL-10 treatment alone. Cytokine 1998; 10 (5): 361–9.
29. Huang SC, Jiang R, Hufnagle WO, Furst DE, Wilske KR, Milner EC. V-H usage and somatic hypermutation in peripheral blood B cells of patients with rheumatoid arthritis (RA). Clin Exp Immunol 1998; 112 (3): 516–27.
30. Wanidworanun C, Strober W. Predominant role of tumor necrosis factor-alpha in human monocyte IL-10 synthesis. J Immunol 1993; 151 (12): 6853–61.
31. Eskdale J, Gallagher G, Verweij CL, Keijsers V, Westendorp RG, Huizinga TW. Interleukin 10 secretion in relation to human IL-10 locus haplotypes. Proc Natl Acad Sci U S A 1998; 95 (16): 9465–70.
32. Huizinga TW, Keijsers V, Yanni G, Hall M, Ramage W, Lanchbury J, et al. Are differences in interleukin 10 production associated with joint damage? Rheumatology (Oxford) 2000; 39 (11): 1180–8.
33. Rood MJ, Keijsers V, van der Linden MW, Tong TQ, Borggreve SE, Verweij CL, et al. Neuropsychiatric SLE is associated with imbalance in IL-10 promoter haplotypes. Ann Rheum Dis 1999; 58 (2): 85–9.
34. Hajeer AH, Lazarus M, Turner D, Mageed RA, Vencovsky J, Sinnott P, et al. IL-10 gene promoter polymorphisms in rheumatoid arthritis.Scand J Rheumatol 1998; 27 (2): 142–5.
35. Coakley G, Mok CC, Hajeer AH, Ollier WE, Turner D, Sinnott PJ, et al. IL-10 promoter polymorphisms in RA and Felty’s syndrome. Br J Rheumatol 1998; 37 (9): 988–91.
36. Martinez A, Pascual M, Pascual-Salcedo D, Balsa A, Martin J, de la Concha EG. Genetic polymorphisms in Spanish rheumatoid arthritis patients: an association and linkage study. Genes Immun 2003; 4 (2): 117–21.
37. Moreno OM, González CI, Saaibi DL, Otero W, Badillo R, Martín J, et al. Polymorphisms of IL-10 gene promoter and rheumatoid arthritis in a Colombian population. Biomedica 2007; 27 (1): 56–65.
38. Eguchi K. Early prediction of joint destruction in rheumatoid arthritis. Clin Calcium 2007; 17 (4): 517–25.
39. Johnson PM, Faulk WP. Rheumatoid factor: its nature, specificity, and production in rheumatoid arthritis. Clin Immunol Immunopathol 1976; 6 (3): 414–30.
40. van Zeben D, Breedveld FC. Prognostic factors in rheumatoid arthritis.J Rheumatol 1996; 44 (Suppl): 31–3.
41. Agrawal S, Misra R, Aggarwal A. Autoantibodies in rheumatoid arthritis: association with severity of disease in established RA. Clin Rheumatol 2007; 26 (2): 201–4.
Labels
Dermatology & STDs Paediatric rheumatology Physiotherapist, university degree Internal medicine Cardiology Orthopaedics Rheumatology
Article was published inCzech Rheumatology

2008 Issue 3-
All articles in this issue
- Zvýšené hladiny sérového adiponectinu u pacientů s erozivní osteoartrózou
- Asociace promotorového polymorfismu -1082 G/A v genu pro interleukin-10 s produkcí autoprotilátek u revmatoidní artritidy
- Rizartróza karpometakarpálního (CMC) kloubu palce ruky
- Nové poznatky v patogenezi postchlamydiové reaktivní artritidy
- Difuzní idiopatická skeletální hyperostóza (DISH) ve stáří, výjimečné deformující postižení
- Pachydermoperiostosis
- Diagnostika komplikované myopatie. EULAR on-line kurz klinické revmatologie - ukázková kazuistika
- Krikofaryngeální achalasie u myozitidy
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Rizartróza karpometakarpálního (CMC) kloubu palce ruky
- Difuzní idiopatická skeletální hyperostóza (DISH) ve stáří, výjimečné deformující postižení
- Nové poznatky v patogenezi postchlamydiové reaktivní artritidy
- Krikofaryngeální achalasie u myozitidy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

