-
Medical journals
- Career
Krikofaryngeální achalasie u myozitidy
: J. Vencovský; H. Mann
: Revmatologický ústav, Praha
: Čes. Revmatol., 16, 2008, No. 3, p. 136-139.
: Case Report
Dysfagie je častým projevem u nemocných s idiopatickými zánětlivými myopatiemi. Nejčastější je u myozitidy s inkluzními tělísky, ale vyskytuje se i u dermatomyozitidy a polymyozitidy. Většinou je spjata s horší prognózou nemoci. Komplikací může být zejména aspirace potravy nebo malnutrice. Nejčastější příčinou je akutní zánětlivý proces či pozánětlivé fibrotické změny v oblasti krikofaryngeálního svalu, které způsobí jeho sníženou relaxační schopnost během polykacího aktu. Je popsána krátká kazuistika nemocné s dermatomyozitidou a kompletní dysfagií horního typu, která byla vyřešena krikofaryngeální myotomií.
Klíčová slova:
dermatomyozitida, dysfagie, krikofaryngeální svalÚvod
Dysfagie se vyskytuje přibližně u 12–54 % nemocných s polymyozitidou (PM) a dermatomyozitidou (DM) a je nejčastějším symptomem z oblasti gastrointestinálního traktu u těchto onemocnění. Obyčejně je dysfagie asociována s těžším průběhem a závažnější prognózou (1). Bývá častější v akutních fázích nemoci než u pozdních chronických případů. Dysfagie je velmi typická pro myozitidu s inkluzními tělísky (IBM), kde se najde až u 60 % pacientů a byla popsána raritně i jako první a jediný symptom tohoto onemocnění (2).
Poruchy polykání mohou být jen mírné a manifestovat se pouze obtížemi při polykání suché stravy, nicméně často mají nemocní závažnější neschopnost spolknout i menší sousta či úplnou zástavu polykání. Někdy je nutné zavést dlouhodobě nazogastrickou sondu či použít parenterální výživu. Komplikací dysfagie může být vdechnutí potravy a vývoj aspirační pneumonie, jejíž riziko je u PM a DM umocněno i slabostí dýchacích svalů způsobující nemožnost vykašlat aspirovanou potravu. Vývoji plicního abscesu či aspirační pneumonie napomáhá i imunosuprimovaný stav nemocných způsobený probíhající chorobou a použitou léčbou. Dlouhotrvající dysfagie může vést k těžké malnutrici.
Nejčastější příčinou dysfagie u myozitidy je postižení příčně pruhované svaloviny hypofaryngu a vstupu do jícnu stejným procesem jakým je postiženo periferní svalstvo (3). Ztrácí se normální tonus faryngálních a jícnových svalů, takže potrava nepostupuje do dalších částí trávicí trubice. Důležitý je především krikofaryngeální sval, který je umístěn na začátku horní části jícnu. Tento sval se skládá především z příčně pruhované svaloviny. Pokud je nějakým způsobem postižen, vznikají polykací obtíže a krikofaryngeální achalasie. Tyto případy byly opakovaně u nemocných s polymyozitidou a dermatomyozitidou popsány (3–7). Rozpoznání krikofaryngeální achalasie je důležité z několika důvodů, což dokumentuje následující krátký popis případu. Kazuistika slouží jako příklad podrobnějšího rozboru problému v kurzu „EULAR on-line“, který je exponován v předcházejícím článku tohoto čísla časopisu.
Popis případu
Dosud zdravá 44letá žena si všimla svalové slabosti, která se rychle zhoršovala během několika týdnů. Objevila se vyrážka v obličeji a na končetinách. Nejnápadnější byl periorbitální otok a zarudnutí kůže v této oblasti. Na základě těchto klinických příznaků, histologického nálezu zánětlivého infiltrátu ve svalové biopsii, vysokých hladin sérové kreatinkinázy byla diagnostikována dermatomyozitida. Pacientka byla léčena prednisonem 60 mg denně a zlepšení se dostavilo asi po 6 týdnech. Při pomalé detrakci glukokortikoidů relabovala svalová slabost a objevily se potíže s polykáním. Obtížně také artikulovala a měla nosový hlas. Výrazně bylo omezeno otvírání úst, přičemž maximální výška otevření byla 2 cm. Dysfagie se během několika dnů zhoršovala, takže nakonec nemocná nebyla schopná polykat ani tekutiny. Bylo nutné zavést nasogastrickou sondu. Ezofagoskopie prokázala významnou retenci slin v hypofaryngu a mírnou esofagitidu jak makroskopicky, tak v biopsii. Toto vyšetření vyloučilo malignitu jako příčinu obstrukce. Kontrastní rtg vyšetření ukázalo úplnou obstrukci v oblasti krikofaryngeálního svalu s aspirací kontrastní látky do dýchacích cest (obr. 1). Podání kontrastní látky do sondy ústící těsně pod krikofaryngeálním svalem ukázalo normální pasáž jícnem až do žaludku. Jícnová manometrie prokázala achalasii v úrovni krikofaryngeálního svalu s nemožností jeho relaxace.
1. Předozadní snímek horní části jícnu v průběhu polykacího aktu s kontrastní látkou demonstrující totální obstrukci v krikofaryngeální úrovni. 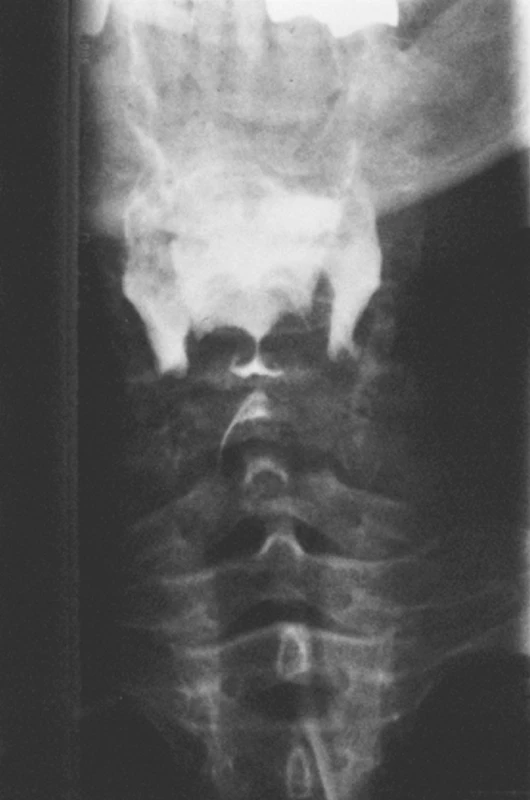
Dávka prednisonu byla zvýšena na 80 mg denně a bylo zahájeno podávání metotrexátu v dávce 20 mg i.v. jedenkrát za týden. Během tří týdnů došlo k mírnému zlepšení končetinové svalové slabosti. Hladina sérové CK se znormalizovala. Nicméně po odstranění nazogastrické sondy, neschopnost polykat přetrvávala. Byla proto indikována myotomie krikofaryngeálního svalu, kterou provedl hrudní chirurg. Druhý den po operaci byla pacientka schopná spolknout malá množství tekutiny. Biopsie odebraná z krikofaryngeálního svalu ukázala typické myozitické změny (obr. 2), ale navíc také významná ložiska intermyziální fibrózy (obr. 3). Měsíc po operaci byla pacientka schopná jíst tuhou stravu a chodit po rovině. Během dalších dvou let se jí dařilo poměrně dobře a prednison byl postupně snížen na dávku 10 mg denně. Polykání bylo téměř v normě. Po dvou letech se u nemocné vyvinul tumor prsu s mnohočetnými metastázami, který vedl k úmrtí.
2. Biopsie z krikofaryngeálního svalu ukazuje atrofii obou typů vláken a typické perifascikulární uspořádání atrofie (ATPáza, pH 10,4; 200x). 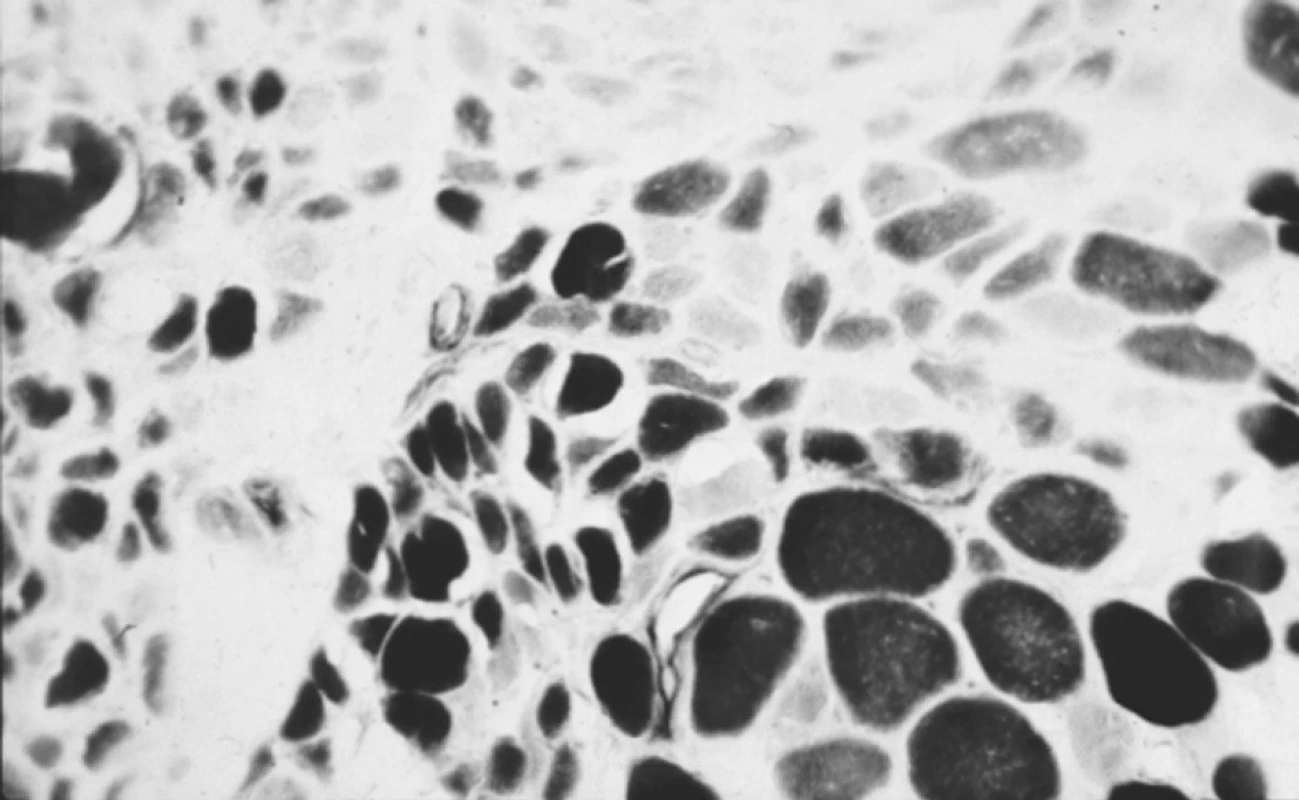
3. Intermyziální fibróza v krikofaryngeálním svalu s aktivací lysozomů ve svalových vláknech a intermyziálních elementech (kyselá fosfatáza 200x). 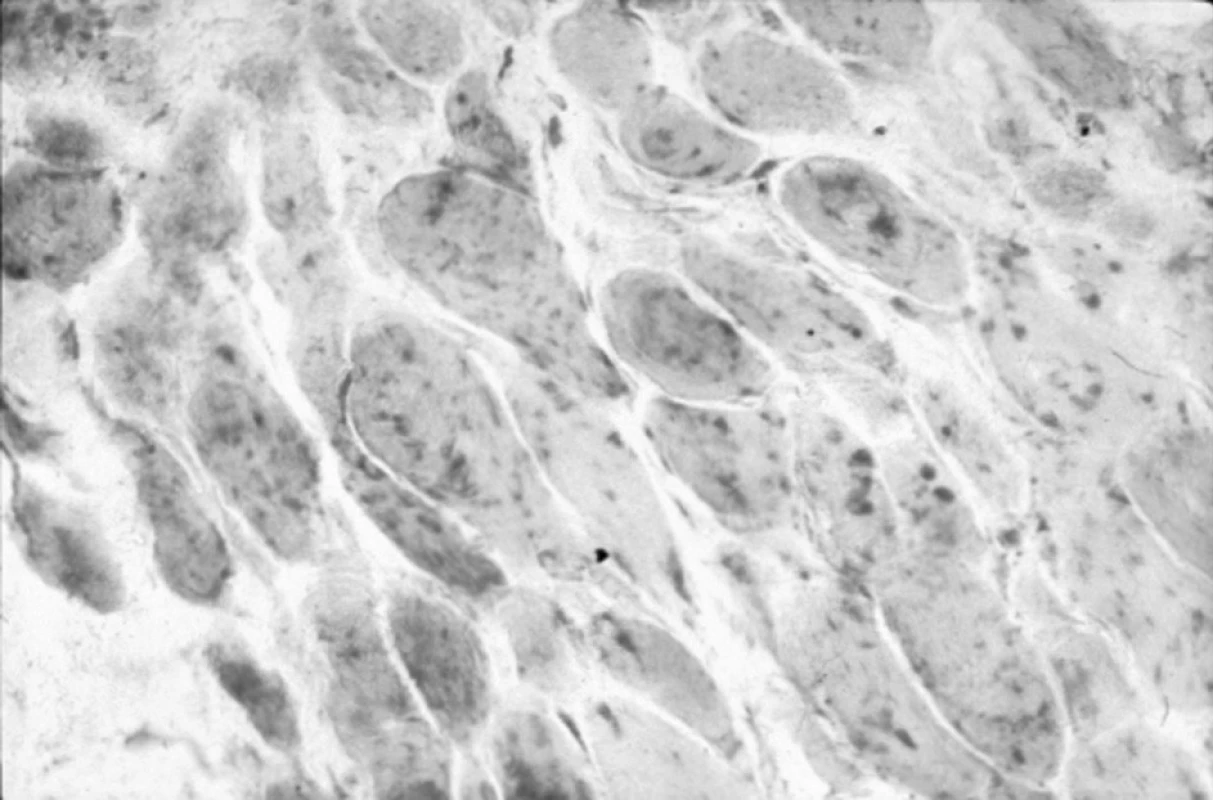
Diskuse
V případech PM, DM a IBM je dysfagie poměrně častá. Její příčinou je snížená schopnost kontrakce faryngálních svalů, porušená peristaltika a slabost jazyka. K tomu se přidává dysfunkce krikofaryngeálního svalu, která může být dominující příčinou (1, 2). Nejobvyklejší je v těchto případech horní typ dysfagie, nicméně byla popsána také dysfagie dolního jícnu (6, 8, 9).
Nejčastější příčiny orofaryngeální dysfagie jsou neuromuskulární onemocnění, která zahrnují cévní mozkové příhody, onemocnění motoneuronů, poliomyelitidu, polyneuritidu, myastenii gravis, myotonické dystrofie či jiné svalové dystrofie. Abnormality ve funkci krikofaryngeálního svalu jsou také častější ve vyšším věku (10). Situace je často řešena krikofaryngeální myotomií, která je většinou úspěšná, pokud pacient splní dvě podmínky: a) dostatečná pohyblivost a koordinace ve faryngu; b) chybění relaxace krikofaryngeálního svalu (11). Někteří pacienti se mohou také zlepšit po rigidní oezofagoskopii. Nejnověji bylo popsáno použití injekce botulotoxinu do m. cricopharyngeus u nemocných s IBM, které vedlo ke sníženému napětí ve svalu a vylepšení dysfagie (12). Tato technika nemusí být však vždy úspěšná a v některých případech pomůže až myotomie (13).
Hlavním problémem při postižení krikofaryngeálního svalu u PM/DM je jeho obstrukce. Ta vzniká z důvodu otoku, který je způsoben zánětem. Krikofaryngeální sval je sfinkter s cirkulárními vlákny, které jsou za normálních okolností v tonickém stavu. Pouze během polykání, je tento tonus uvolněn po velmi krátkou dobu. Porucha této relaxační fáze se nazývá achalasie. Zánět a otok při myozitidě mohou inhibovat relaxaci a způsobit slabost svalu, která vede k dysfagii. Tento stav může být reverzibilní, pokud je protizánětlivá terapie zavedena včas a ve svalu nevzniknou žádné další změny. Jestliže však zánětlivý proces v krikofaryngeálním svalu trvá po nějakou dobu, může se snížit elasticita a vzniknout kontraktura a fibróza. Potom nemůže dojít k relaxaci během polykání a žádná protizánětlivá terapie nemá šanci na úspěch. To vysvětluje, proč naše pacientka nereagovala zlepšením polykání, ač se síla v periferních svalech výrazně zvýšila. Konečný důkaz pro tento fakt byl podán hodnocením bioptického vzorku, ve kterém se ukázaly typické známky DM s perifascikulární atrofií a výraznou fibrózou a pouze s mírnými známkami zánětlivé infiltrace.
Detekce krikofaryngeální achalasie u myozitidy je důležitá z následujících důvodů:
- existuje nebezpečí aspirace obsahu jícnu do dýchacích cest (14),
- krikofaryngeální myotomie může vést k rychlé úlevě obtíží pacienta,
- je možné nesprávně diagnostikovat nádor jícnu, zvláště pokud máme na paměti častou koincidenci neoplazie a myozitidy (15).
Protože může dojít k aspiraci kontrastní látky do dýchacích cest, doporučuje se obvykle nepoužívat baryum k vyšetření polykacího aktu. Aspirované baryum nemůže být snadno odstraněno a může vést k nekróze a infekci v dýchacích cestách a plicích. To je obzvlášť nebezpečné u nemocných s myozitidou, protože obyčejně dostávají imunosupresivní léky, což zvyšuje jejich náchylnost k infekcím. Doporučuje se proto užít kontrastní látku, která se snadno absorbuje nebo raději použít pouze jícnovou manometrii.
Je nutné ovšem připomenout, že krikofaryngeální myotomie není zcela bez nebezpečí a že hrozí pooperační aspirace či lokální infekce, respektive perzistentní aspirace (16).
Jeden další symptom u naší pacientky zasluhuje krátký komentář. Na ztížené otvírání úst (trismus) si pacienti s polymyozitidou stěžují spontánně jen zřídka (17). Při cílených dotazech se ukazuje tento symptom poměrně častý. Trismus u naší pacientky byl výrazný. Několik případů trismu popsaných v literatuře bylo spojeno s poruchou polykání. Je pravděpodobné, že mechanismus vedoucí i krikofaryngeální dysfagii a trismu u PM/DM má podobnou příčinu. Zánět v uvedených svalech nevede pouze ke svalové slabosti, ale také k porušené elasticitě a perzistující kontrakci, která se může manifestovat obtížemi při otevírání úst a poruchami polykání.
Tato práce byla podpořena výzkumnými záměry: VZ MZČR 00000023728
Prof. MUDr. J. Vencovský, DrSc.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Sources
1. Williams RB, Grehan MJ, Hersch M, Andre J, Cook IJ. Biomechanics, diagnosis, and treatment outcome in inflammatory myopathy presenting as oropharyngeal dysphagia. Gut 2003; 52 : 471–8.
2. Oh TH, Brumfield KA, Hoskin TL, Stolp KA, Murray JA, Bassford JR. Dysphagia in inflammatory myopathy: clinical characteristics, treatment strategies, and outcome in 62 patients. Mayo Clin Proc 2007; 82 : 441–7.
3. Dietz F, Longeman JA, Sahgal V, Schmid FR. Cricopharyngeal muscle dysfunction in the differential diagnosis of dysphagia in polymyositis. Arthritis Rheum 1980; 23 : 491–5.
4. Thomas FB, LeBauer S, Greenberger NJ. Polymyositis masquerading as carcinoma of the cervical esophagus. Arch Intern Med 1972; 129 : 984–6.
4. Porubsky ES, Murray JP, Pratt LL. Cricopharyngeal achalasia in dermatomyositis. Arch Otolaryngol 1973; 98 : 428–9.
5. Kagen LJ, Hochman RB, Strong EW. Cricopharyngeal obstruction in inflammatory myopathy (polymyositis/dermatomyositis). Report of three cases and review of the literature. Arthritis Rheum 1985; 28 : 630–6.
6. De Merieux P, Verity MA, Clements PJ, et al. Esophageal abnormalities and dysphagia in polymyositis and dermatomyositis. Clinical, radiographic and pathologic features. Arthritis Rheum 1983;26 : 161–8.
7. Vencovský J, Řehák F, Pafko P, Jirásek A, Valešová M, Alušík Š, et al. Acute cricopharyngeal obstruction in dermatomyositis. J Rheumatol 1988; 15 : 1016–18.
8. Horowitz M, Mc Neil JD, Maddern GJ, Collins PJ, Shearman DJ. Abnormalities of gastric and esophageal emptying in polymyositis and dermatomyositis. Gastroenterology 1986; 90 : 434–9.
9. Jacob H, Berkowitz D, McDonald E, Bernstein LH, Beneventano T. The esophageal motility disorder of polymyositis. A prospective study. Arch Intern Med 1983; 143 : 2262–4.
10. Calcaterra TC, Kadell BM, Ward PH. Dysphagia secondary to cricopharyngeal muscle dysfunction. Arch Otolaryngol 1975; 101 : 726–9.
11. Berg HM, Persky MJ, Jacobs JB, Cohen NL. Cricopharyngeal myotomy: A review of surgical results in patients with cricopharyngeal achalasia of neurogenic origin. Laryngoscope 1985; 95 : 1337–40.
12. Liu LW, Tarnopolsky M, Armstrong D. Injection of botulinum toxin A to the upper esophageal sphincter for oropharyngeal dysphagia in two patients with inclusion body myositis. Can J Gastroenterol 2004; 18 : 397–9.
13. Bachmann G, Streppel M, Krug B, Neuen-Jacob E. Cricopharyngeal muscle hypertrophy associated with florid myositis. Dysphagia 2001; 16 : 244–8.
14. Dickley BF, Myers AR. Pulmonary disease in polymyositis/dermatomyositis. Semin Arthritis Rheum 1984; 14 : 60–76.
15. Manchul LA, Jin A, Pritchard KI, Tenenbaum J, Boyd NF, Lee P, et al. The frequency of malignant neoplasms in patients with polymyositis-dermatomyositis. Arch Intern Med 1985; 145 : 1835–39.
16. Brigand C, Ferraro P, Martin J, Duranceau A. Risk factors in patients undergoing cricopharyngeal myotomy. Br J Surg. 2007; Aug; 94(8): 978–83.
17. Singer PA, Chikarmane A, Festoff BW, Ziegler DK. Trismus. An unusual sign in polymyositis. Arch Neurol 1985; 42 : 1116–18.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2008 Issue 3-
All articles in this issue
- Increased serum levels of adiponectin in patients with erosive osteoarthritis
- Association of the -1082 G/A polymorphism in the IL-10 gene promoter with production of autoantibodies in rheumatoid arthritis
- Rhizarthrosis of carpometacarpal (CMC) joint of a thumb
- Recent findings in the pathogenesis of post-chlamydial reactive arthritis
- Diffuse idiopathic skeletal hyperostosis (DISH) in old age, exceptionally deforming disease
- Pachydermoperiostosis
- Diagnostics of a complicated myopathy. EULAR on-line course of clinical rheumatology – sample case report
- Cricopharyngeal achalasia in myositis
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Rhizarthrosis of carpometacarpal (CMC) joint of a thumb
- Diffuse idiopathic skeletal hyperostosis (DISH) in old age, exceptionally deforming disease
- Recent findings in the pathogenesis of post-chlamydial reactive arthritis
- Cricopharyngeal achalasia in myositis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

