-
Medical journals
- Career
Zvýšení sérových hladin S100–A11 a AIF-1 u pacientek s karcinomem hrdla děložního a postižením lymfatických uzlin
Authors: Maděrka M. 1; Dvořák V. 2; Hambálek J. 1; Stejskal D. 3,4; Krejčí G. 3; Švesták M. 3; Langová K. 5; Pilka R. 1
Authors‘ workplace: Porodnicko-gynekologická klinika LF UP a FN Olomouc 1; Centrum ambulantní gynekologie a primární péče, Brno 2; Oddělení laboratorní medicíny, AGEL Středomoravská nemocniční, a. s., Prostějov 3; Ústav laboratorní diagnostiky, FN Ostrava 4; Ústav lékařské biofyziky, LF UP v Olomouci 5
Published in: Ceska Gynekol 2021; 86(1): 17-21
Category: Original Article
doi: https://doi.org/10.48095/cccg202117Overview
Cíl studie: Cílem této studie bylo porovnat sérové hladiny TFF3, AIF-1, S100–A11 a DKK1 u pacientek s karcinomem hrdla děložního a u zdravých kontrol.
Metodika: Celkem bylo zařazeno na Porodnicko-gynekologické klinice ve Fakultní nemocnici v Olomouci 85 pacientek s diagnózou karcinomu děložního hrdla, které podstoupily radikální hysterektomii nebo fertilitu zachovávající operaci s pánevní lymfadenektomií. Kontrolní skupinu tvořilo 90 pacientek, které podstoupily jakoukoli hysterektomii pro nemaligní onemocnění. U všech pacientek byly předoperačně odebrány a separovány vzorky séra a všechna séra byla skladována při teplotě –80 °C až do analýzy hladin TFF3, AIF-1, S100–A11 a DKK1.
Výsledky: U 32 pacientek (40,5 %) ze 79 s karcinomem hrdla děložního, u kterých byly lymfatické uzliny histologicky vyšetřeny, byly pozitivní lymfatické uzliny. Sérové hladiny S100–A11 (p < 0,0001) a AIF-1 (p < 0,0001) byly vyšší u pacientek s karcinomem hrdla děložního než u kontrol. Kromě toho byly sérové hladiny S100–A11 (p > 0,04) a AIF-1 (p > 0,01) významně vyšší u pacientek s pozitivními lymfatickými uzlinami ve srovnání s pacientkami s negativními lymfatickými uzlinami. Hladiny TFF3 a DKK1 byly vyšší (p < 0,0001) u kontrol než u pacientek s karcinomem hrdla děložního a nelišily se ve skupinách s postižením lymfatických uzlin, nebo bez něj.
Závěr: S100–A11 a AIF-1 představují potenciální biomarkery u pacientek s karcinomem hrdla děložního. V naší studii byly současně vyšší hladiny S100–A11 a AIF-1 u pacientek s přítomností metastáz v lymfatických uzlinách.
Klíčová slova:
onkogynekologie – biomarkery – karcinom hrdla děložního – S100–A11 – TFF3 – AIF-1 – DKK1
Úvod
Karcinom hrdla děložního je celosvětově čtvrtým nejčastějším zhoubným nádorem u žen [1]. Incidence v ČR v roce 2016 byla 15,3/100 000 žen, což je 822 nových případů za rok. Incidence tohoto nádorového onemocnění je v ČR tedy přibližně o 50 % vyšší než v západních evropských zemích. Mortalita v roce 2016 byla 6,28/100 00 žen, což je v absolutních číslech 384 žen. Karcinom hrdla děložního má dva věkové vrcholy výskytu, a to v 30–35 letech a 60–65 letech a je častější u sociálně a ekonomicky slabší populace. Pánevní lymfatické uzliny jsou primárními lymfatickými uzlinami u tohoto nádorového onemocnění a jejich postižení výrazně zhoršuje šance na přežití [1–3]. Dosud neexistuje možnost spolehlivé neinvazivní predikce případného metastatického postižení lymfatických uzlin u pacientek s karcinomem hrdla děložního.
Jako tumor marker označujeme chemickou substanci, která je produkována tumorem nebo hostitelem jako odpověď na přítomnost nádoru. Nachází se v krvi, moči nebo tkáních pacientů s nádorovým onemocněním, může být ale produkována i u benigních onemocnění [4]. Biomarker bývá definován jako měřitelný indikátor určitého biologického stavu či podmínek. V souvislosti s postižením uzlin u karcinomu hrdla děložního byl studován SCC-Ag (antigen skvamocelulárního karcinomu), CA125, CEA (karcinoembryonální antigen), CA19-9 a CYFRA-21 [5–9].
Studované biomarkery
Trefoil faktor 3 (TFF3) je protein, který byl v roce 1991 objeven u krys [10]. Trifoláty jsou skupinou malých polypeptidů bohatých na cystein, jsou exprimovány ve tkáních, které obsahují buňky produkující hlen, obzvláště v gastrointestinálním traktu a v jiných epiteliálních tkáních. V roce 1989 byly pojmenovány Thimem jako „trefoil“ peptidy a dosud byly identifikovány tři: TFF1, TFF2 a TFF3 [11]. Bylo prokázáno, že sérové hladiny TFF3 jsou významně vyšší u pacientek s karcinomem endometria než u pacientek s endometriální hyperplazií a u kontrol [12].
Allograft inflammatory factor 1 (AIF-1) je protein nacházející se v cytoplazmě buněk a byl objeven roku 1995 u krys [13]. U proteinu AIF-1 již byla prokázána zvýšená exprese u karcinomu hrdla děložního. Není ovšem známo, jak se na patogenezi tohoto onemocnění podílí [14].
Proteiny rodiny S100 mají poměrně nízkou molekulovou hmotnost a do současnosti jich bylo objeveno již 25. Většina S100 proteinů váže kalcium a je lokalizována intracelulárně. Tyto proteiny mají různé funkce, jsou zastoupeny v širokém spektru biologických procesů a jejich název je odvozen od vlastnosti proteinů rozpouštět se v nasyceném roztoku síranu amonného. Proteiny S100 jsou asociovány s různými nádorovými onemocněními, ačkoli ve většině případů není funkce S100 proteinů v nádorových buňkách stále známá [15]. U námi studovaného proteinu S100–A11 již byla v literatuře publikována asociace s karcinomem prsu, slinivky břišní, žaludku, močového měchýře, prostaty a ledvin. U karcinomu hrdla děložního byla prokázána asociace s hladinou proteinu S100–A9 [16].
Dickkopf-related proteins (DKK) je rodina sekrečních proteinů, které jsou celkem čtyři, a to DKK1, DKK2, DKK3, DKK4. Tyto proteiny mají molekulovou hmotnost 24–38 kDa [17]. DKK1 je protein, který je exprimován převážně osteoblasty a stromálními buňkami kostní dřeně a je u lidí kódován genem DKK1 [18]. Byl objeven roku 1998 Glinkou u drápatky vodní (Xenopus laevis) a podílí se na embryonálním vývoji prostřednictvím inhibice signální dráhy Wnt [19,20]. Tato inhibice hraje klíčovou roli při embryonálním vývoji srdce, hlavy a horních končetin [21]. Signální dráha Wnt hraje důležitou roli také v tumorogenezi, což bylo prokázáno například u kolorektálního karcinomu [18,22].
Cílem této studie bylo porovnat sérové hladiny TFF3, AIF-1, S100 – A11 a DKK1 u pacientek s karcinomem hrdla děložního a u zdravých kontrol, dále jsme porovnávali tyto sérové hladiny u pacientek s postižením a bez postižení lymfatických uzlin.
Metodika
Tato experimentální prospektivní studie probíhala od října 2012 do června 2015 na Porodnicko-gynekologické klinice Fakultní nemocnice v Olomouci. Studie byla schválena lokální etickou komisí a všechny pacientky potvrdily svou účast ve studii podpisem informovaného souhlasu. Celkem bylo do studie zařazeno 85 pacientek s karcinomem hrdla děložního, které podstoupily radikální hysterektomii nebo fertilitu zachovávající operaci s pánevní lymfadenektomií. Histopatologicky byl diagnostikován spinocelulární karcinom u 68 (80 %), adenokarcinom u 13 (15 %), mukoepidermoidní karcinom u 2 (2 %), adenoskvamózní karcinom u 1 (1 %) a 1 (1 %) pacientka měla diagnostikován clear cell karcinom. Dle klasifikace FIGO 2009 bylo 45 (53 %) pacientek v I. stadiu, 31 (36 %) ve II. stadiu, 7 (8 %) ve III. stadiu a 2 (2 %) pacientky ve IV. stadiu onemocnění. U 32 pacientek (40,5 %) ze 79 s karcinomem hrdla děložního, u kterých byly lymfatické uzliny histologicky vyšetřeny, byly metastázy v pánevních nebo paraaortálních lymfatických uzlinách. Kontrolní skupinu tvořilo 90 pacientek, které podstoupily jakoukoli hysterektomii pro nemaligní onemocnění. Ve skupině pacientek s karcinomem hrdla děložního měla nejmladší pacientka 29 let, nejstarší 83 let, medián věku byl 45 let a průměrný věk 48,1 let. Ve skupině kontrol měla nejmladší pacientka 15 let, nejstarší 77 let, medián věku byl 41 let a průměrný věk 41,6 let.
U všech pacientek byly předoperačně odebrány vzorky séra po 12 hod lačnění. Poté byly vzorky centrifugovány (1 600 × g, 10 min, +4 °C) a následně byla provedena separace séra. Dále bylo 200 µl séra rozředěno s 100 µl fosfátového pufru (15 mmol/l, pH 6,5) a dále deproteinizováno pomocí 100 µl chlazeného etanolu (10 min, –25 °C). Po další centrifugaci (14 000 × g, 10 min) byl supernatant filtrován za použití titračních filtrů a vakuován, filtrovaný roztok byl vložen do HPLC (high-performance liquid chromatography) sloupce. Všechna séra byla skladována při teplotě –80 °C až do analýzy hladin TFF3, AIF-1, S100–A11 a DKK1.
Statistické vyhodnocení dat bylo provedeno ve spolupráci s Ústavem lékařské biofyziky Lékařské fakulty Univerzity Palackého v Olomouci. Ke statistickému zpracování dat byl použit statistický software IBM SPSS Statistics for Windows, Version 23.0. (Armonk, NY: IBM Corp).
Korelace byly testovány Mann-Whitneyovým U-testem. Vodorovná čára v krabicovém grafu znázorňuje hodnotu mediánu, dolní hrana krabice hodnotu 1. kvartilu (25. percentilu), horní hrana hodnotu 3. kvartilu (75. percentilu). Anténky ukazují maximální a minimální naměřené hodnoty. Pokud byly v souboru nalezeny odlehlé a extrémní hodnoty, jsou zakresleny kroužky a hvězdičkami (graf 1, 2).
Graph 1. Na tomto grafu je znázorněno významné zvýšení sérové hladiny S100–A11 (p > 0,040) u pacientek s pozitivními lymfatickými uzlinami (1) ve srovnání s pacientkami s negativními lymfatickými uzlinami (0).
Graph 1. This graph shows a significant increase in serum S100–A11 levels (P > 0.040) in patients with positive lymph nodes (1) compared to those with negative lymph nodes (0).
Graph 2. Na tomto grafu je znázorněno významné zvýšení sérové hladiny AIF-1 (p > 0,010) u pacientek s pozitivními lymfatickými uzlinami (1) ve srovnání s pacientkami s negativními lymfatickými uzlinami (0).
Graph 2. This graph shows a significant increase in serum AIF-1 levels (P > 0.010) in patients with positive lymph nodes (1) compared to those with negative lymph nodes (0).
Výsledky
Sérové hladiny S100–A11 (p < 0,0001) a AIF-1 (p < 0,0001) byly vyšší u pacientek s karcinomem děložního hrdla než u kontrol, což je znázorněno na grafech 1 a 2. U 32 pacientek (40,5 %) ze 79 s karcinomem hrdla děložního, u kterých byly lymfatické uzliny histologicky vyšetřeny, byly pozitivní lymfatické uzliny. Sérové hladiny S100–A11 (p > 0,04) a AIF-1 (p > 0,01) byly statisticky významně vyšší u pacientek s pozitivními lymfatickými uzlinami ve srovnání s pacientkami s negativními lymfatickými uzlinami (tab. 1). Sérové hladiny S100–A11 byly ve skupině s pozitivními lymfatickými uzlinami na úrovni (průměr ± směrodatná odchylka) 14,8 ± 13,7 ng/ml (0,9–58,1), ve skupině s negativními lymfatickými uzlinami byly 12,6 ± 17,8 ng/ml (1,4–94,4). Sérové hladiny AIF-1 byly ve skupině s pozitivními lymfatickými uzlinami na úrovni (průměr ± směrodatná odchylka) 939,6 ± 733,5 pg/ml (167,0–3 689,0), ve skupině s negativními lymfatickými uzlinami byly 778,2 ± 991,5 pg/ml (41,1–5 242,0).
Table 1. V této tabulce je prezentován medián, minimální a maximální hodnota, průměr a směrodatná odchylka sérových hladiny TFF-3, S100–A11, AIF-1 a DKK1 a věk pacientek v době odběru (jednotky SI soustavy jsou uvedeny v závorce) u pacientek s karcinomem hrdla děložního s postižením a bez postižení lymfatických uzlin.
Tab. 1. This table presents the median, minimum and maximum values, mean and standard deviations of serum TFF-3, S100–A11, AIF-1 and DKK1 levels and the age of patients with cervical cancer with and without lymph node involvement (SI units in brackets).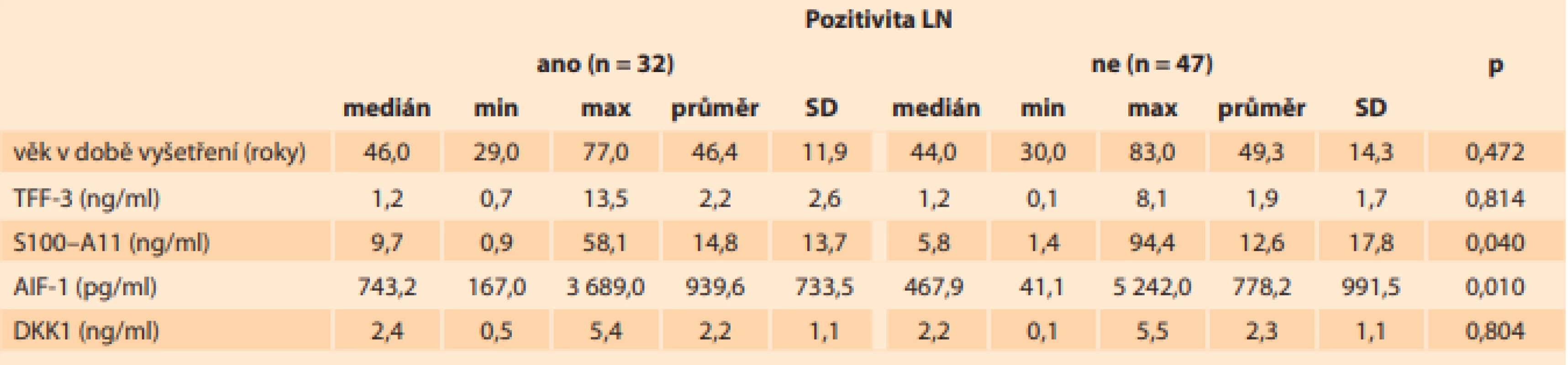
Vysvětlivky: LN – lymfatické uzliny, n – počet, SD – směrodatná odchylka, p – p-hodnota, min – minimální hodnota, max – maximální hodnota Hladiny TFF3 a DKK1 byly vyšší (p < 0,0001) u kontrol než u pacientek s karcinomem hrdla děložního a nelišily se ve skupinách s postižením lymfatických uzlin, nebo bez něj (tab. 1). Sérové hladiny TFF3 byly ve skupině s pozitivními lymfatickými uzlinami na úrovni (průměr ± směrodatná odchylka) 2,2 ± 2,6 ng/ml (0,7–13,5), ve skupině s negativními lymfatickými uzlinami byly 1,9 ± 1,7 ng/ml (0,1–8,1). Sérové hladiny DKK1 byly ve skupině s pozitivními lymfatickými uzlinami na úrovni (průměr ± směrodatná odchylka) 2,2 ± 1,1 ng/ml (0,5–5,4), ve skupině s negativními lymfatickými uzlinami byly 2,3 ± 1,1 ng/ml (0,1–5,5).
Spearmanovým korelačním koeficientem byla prokázána statisticky významná slabá negativní korelace mezi věkem pacientek a všemi sledovanými markery (S100–A11, AIF-1, TFF3 a DKK1). Z tohoto lze usuzovat, že se zvyšujícím se věkem produkce všech těchto proteinů klesá, a jsou tedy i nižší sérové hladiny. Věk pacientek ve skupině s pozitivními lymfatickými uzlinami byl na úrovni (průměr ± směrodatná odchylka) 46,4 ± 11,9 let (29,0–77,0), ve skupině s negativními lymfatickými uzlinami 49,3 ± 14,3 let (30,0–83,0) (tab. 1).
Diskuze
Karcinom hrdla děložního je v ČR čtvrtým nejčastějším gynekologickým nádorem po karcinomu prsu, endometria a ovaria [3]. Dokud se nepodaří zajistit celoplošnou primární prevenci tohoto onemocnění, bude nadále nutné zlepšovat sekundární prevenci formou screeningu, diagnostiku i follow-up již nemocných pacientek. Tak jako u jiných onkologických onemocnění jsou centrem zájmu nové potenciální biomarkery. Velmi rychle narůstá množství informací o nových proteinech TFF3, AIF-1, S100–A11, DKK1 a jejich fyziologickém i patofyziologickém významu.
Metastáza v lymfatických uzlinách je u pacientek s cervikálním karcinomem jedním z důležitých prognostických faktorů. Dalšími jsou stadium onemocnění, objem tumoru, stromální invaze, grading, histologický typ (špatná prognóza např. u neuroendokrinního karcinomu a clear cell karcinomu) a také poruchy imunity [2].
Sérový marker pro spinocelulární karcinom SCC-Ag je používán v klinické praxi. Je přítomen ve vysokých hladinách u 20–60 % pacientek s časným stadiem cervikálního karcinomu. Zvýšené hladiny SCC-Ag jsou přítomny u 64 % pacientek se spinocelulárním karcinomem a u 25 % pacientek s adenokarcinomem [23]. Sérová hladina SCC-Ag před léčbou je asociována s velikostí tumoru, stadiem onemocnění, hloubkou stromální invaze, invazí lymfovaskulárního prostoru i s postižením lymfatických uzlin. Se zvýšenými sérovými hladinami SCC-Ag bylo signifikantně asociováno postižení společných ilických a paraaortálních uzlin [5,6].
Dalšími používanými biomarkery u cervikálního karcinomu jsou antigen CA125, CA19–9 a CYFRA21–1 [7]. Zvýšené hladiny CA125 jsou asociovány s vyšším stadiem karcinomu hrdla děložního, a to u 42,6 % pacientek s adenokarcinomem a 18,9 % pacientek se spinocelulárním karcinomem [24]. Bylo zjištěno, že hladina CA125 je významně vyšší u pacientek s metastázami v pánevních a paraaortálních lymfatických uzlinách než u pacientek bez postižení lymfatických uzlin [25]. Bylo prokázáno, že vyšetřením sérové hladiny kombinace tumor markerů SCC-Ag, CEA a CA19–9 lze předpovědět pozitivní pánevní lymfatické uzliny a postižení parametrií u spinocelulárního karcinomu děložního hrdla [8]. Byla také prokázána korelace mezi sérovou hladinou CYFRA-21 a přítomností metastáz v lymfatických uzlinách u pacientek s karcinomem hrdla děložního [9].
Naše výsledky prokazují korelaci mezi zvýšením sérových hladin S100–A11 a AIF-1 a metastatickým postižením pánevních lymfatických uzlin, a mohou tedy být využity v predikci tohoto metastatického postižení.
Závěr
Proteiny S100–A11 a AIF-1 představují potenciální biomarkery u pacientek s karcinomem hrdla děložního. V naší studii jsme prokázali zvýšení sérové hladiny S100–A11 a AIF-1 u těchto pacientek v porovnání s kontrolní skupinou. Sérové hladiny S100–A11 a AIF-1 se dále u těchto pacientek významně zvyšují, pokud byly prokázány metastázy v lymfatických uzlinách.
Tumor markery hrají stále důležitější roli při detekci nádorových onemocnění. V současnosti užívané tumor markery u karcinomu hrdla děložního nejsou ideální, protože jim chybí silná specificita. Výzkum by se měl zaměřit na vývoj kombinačních panelů více biomarkerů, které by byly pro diagnostiku nejúčinnější.
Obdrženo/Submitted: 24. 11. 2020
Přijato/Accepted: 28. 12. 2020
MUDr. Martin Maděrka
Porodnicko-gynekologická klinika
LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
Sources
1. Bray F, Ferlay J, Soerjomataram I et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68 (6): 394–424. doi: 10.3322/caac.21492.
2. Cibula D, Petruželka L et al. Onkogynekologie. Praha: Grada Publishing a. s. 2009 : 616.
3. ÚZIS ČR. [online]. Dostupné na: https: //www.uzis.cz/.
4. Tchagang AB, Tewfik AH, DeRycke MS et al. Early detection of ovarian cancer using group biomarkers. Mol Cancer Ther 2008; 7 (1): 27–37. doi: 10.1158/1535-7163.MCT-07-0565.
5. Lekskul N, Charakorn C, Lertkhachonsuk AA et al. The level of squamous cell carcinoma antigen and lymph node metastasis in locally advanced cervical cancer. Asian Pac J Cancer Prev 2015; 16 (11): 4719–4722. doi: 10.7314/apjcp.2015.16.11.4719.
6. Li D, Xu XX, Yan DD et al. Clinical significance of serum squamous cell carcinoma antigen in patients with early cervical squamous cell carcinoma. Zhonghua Zhong Liu Za Zhi 2019; 41 (5): 357–362. doi: 10.3760/cma.j.issn.0253-3766.2019.05.007.
7. Laengsri V, Kerdpin U, Plabplueng C et al. Cervical cancer markers: epigenetics and microRNAs. Lab Med 2018; 49 (2): 97–111. doi: 10.1093/labmed/lmx080.
8. Ikeda S, Yoshimura K, Onda T et al. Combination of squamous cell carcinoma-antigen, carcinoembryonic antigen, and carbohydrate antigen 19-9 predicts positive pelvic lymph nodes and parametrial involvement in early stage squamous cell carcinoma of the uterine cervix. J Obstet Gynaecol Res 2012; 38 (10): 1260–1265. doi: 10.1111/j.1447-0756.2012.01862.x.
9. Gaarenstroom KN, Bonfrer JM, Kenter GG et al. Clinical value of pretreatment serum Cyfra 21-1, tissue polypeptide antigen, and squamous cell carcinoma antigen levels in patients with cervical cancer. Cancer 1995; 76 (5): 807–813. doi: 10.1002/1097-0142 (19950901) 76 : 5<807:: aid-cncr2820760515>3.0.co; 2 - m.
10. Thim L, Wöldike HF, Nielsen PF et al. Characterization of human and rat intestinal trefoil factor produced in yeast. Biochemistry 1995; 34 (14): 4757–4764. doi: 10.1021/bi00014a033.
11. Lau WH, Pandey V, Kong X et al. Trefoil factor-3 (TFF3) stimulates de novo angiogenesis in mammary carcinoma both directly and indirectly via IL-8/CXCR2. PLoS One 2015; 10 (11): e0141947. doi: 10.1371/journal.pone.0141947.
12. Neubert D, Ondrová D, Hambálek J et al. Elevated levels of TFF3 in endometrial cancer patients. Ceska Gynekol 2018; 83 (2): 109–114.
13. Meyerhardt JA, Mangu PB, Flynn PJ et al. Follow-up care, surveillance protocol, and secondary prevention measures for survivors of colorectal cancer: American Society of Clinical Oncology clinical practice guideline endorsement. J Clin Oncol 2013; 31 (35): 4465–4470. doi: 10.1200/JCO.2013.50.7442.
14. Ducreux M, Cuhna AS, Caramella C et al. ESMO Guidelines Committee. Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015; 26 (Suppl 5): v56–v68. doi: 10.1093/annonc/mdv295.
15. Molina R, Marrades RM, Augé JM et al. Assessment of a combined panel of six serum tumor markers for lung cancer. Am J Respir Crit Care Med 2016; 193 (4): 427–437. doi: 10.1164/rccm.201404-0603OC.
16. Maděrka M, Pilka R, Neubert D et al. New serum tumor markers S100, TFF3 and AIF-1 and their possible use in oncogynecology. Ceska Gynekol 2019; 84 (4): 303–308.
17. Niehrs C. Function and biological roles of the Dickkopf family of Wnt modulators. Oncogene 2006; 25 (57): 7469–7481. doi: 10.1038/sj.onc.1210054.
18. Niida A, Hiroko T, Kasai M et al. DKK1, a negative regulator of Wnt signaling, is a target of the beta-catenin/TCF pathway. Oncogene 2004; 23 (52): 8520–8526. doi: 10.1038/sj.onc.1207 892.
19. Glinka A, Wu W, Delius H et al. Dickkopf-1 is a member of a new family of secreted proteins and functions in head induction. Nature 1998; 391 (6665): 357–362. doi: 10.1038/34848.
20. Mukhopadhyay M, Shtrom S, Rodriguez-Esteban C et al. Dickkopf1 is required for embryonic head induction and limb morphogenesis in the mouse. Dev Cell 2001; 1 (3): 423–434. doi: 10.1016/s1534-5807 (01) 00041-7.
21. Schneider VA, Mercola M. Wnt antagonism initiates cardiogenesis in Xenopus laevis. Genes Dev 2001; 15 (3): 304–315. doi: 10.1101/gad.855601.
22. Polakis P. Wnt signaling and cancer. Genes Dev 2000; 14 (15): 1837–1851.
23. Kim BG. Squamous cell carcinoma antigen in cervical cancer and beyond. J Gynecol Oncol 2013; 24 (4): 291–292. doi: 10.3802/ jgo.2013.24.4.291.
24. He SM, Xing F, Sui H et al. Determination of CA-125 levels in the serum, cervical and vaginal secretions, and endometrium in Chinese women with precancerous disease or endometrial cancer. Med Sci Monit 2011; 17 (11): CR618–CR625. doi: 10.12659/msm.882046.
25. Kotowicz B, Fuksiewicz M, Kowalska M et al. The value of tumor marker and cytokine analysis for the assessment of regional lymph node status in cervical cancer patients. Int J Gynecol Cancer 2008; 18 (6): 1279–1284. doi: 10.1111/ j.1525-1438.2007.01176.x.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2021 Issue 1-
All articles in this issue
- Aspekty výběru embryí a jejich příprava pro vznik lidských embryonálních kmenových buněk určených k humánní terapii
- Zvýšení sérových hladin S100–A11 a AIF-1 u pacientek s dysplazií děložního hrdla
- Zvýšení sérových hladin S100–A11 a AIF-1 u pacientek s karcinomem hrdla děložního a postižením lymfatických uzlin
- Kombinovaná peripartálna separácia symfýzy a sakroiliakálneho kĺbu
- Myomatóza děložních rudimentů u pacientky s Mayer-Rokitansky-Küster-Hauser syndromem
- Aktuální etické aspekty léčby absolutního uterinního faktoru neplodnosti pomocí transplantace dělohy
- Poruchy příjmu potravy v ambulanci gynekologa pro děti a dospívající
- Nežádoucí účinky PARP inhibitorů
- 30. sympozium asistované reprodukce s mezinárodní účastí a 19. česko-slovenská konference reprodukční medicíny, 10.–11. listopadu 2020, Brno
- Editorial
- Osobní vzpomínka na MUDr. Karla Nouzu, DrSc.
- Kouření u žen s chronickým vaginálním diskomfortem není spojeno se sníženým výskytem Lactobacillus spp. ale podporuje nadměrný růst bakterií Mobiluncus a Gardnerella spp. – sekundární analýza dat z klinické studie zahrnující mikrobiální analýzu
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nežádoucí účinky PARP inhibitorů
- Kombinovaná peripartálna separácia symfýzy a sakroiliakálneho kĺbu
- Aspekty výběru embryí a jejich příprava pro vznik lidských embryonálních kmenových buněk určených k humánní terapii
- Poruchy příjmu potravy v ambulanci gynekologa pro děti a dospívající
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

