-
Medical journals
- Career
Transabdominální punkce folikulů v IVF cyklu u pacientky po transpozici ovarií
Authors: Simona Jirsová; D. Bednářová; Z. Žižka; Olga Teplá
Authors‘ workplace: Gynekologicko porodnická klinika l. LF UK a VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc.
Published in: Ceska Gynekol 2020; 85(1): 11-14
Category: Case Report
Overview
Cíl studie: Popis postupu odebírání folikulární tekutiny u pacientky po transpozici ovarií.
Typ studie: Kazuistika.
Název a sídlo pracoviště: Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha.
Vlastní pozorování: Popisujeme případ IVF léčby u pacientky, která podstoupila léčbu po transpozici ovarií, a obtížnost odběru v souvislosti s transabdominálním přístupem.
Závěr: Punkce folikulární tekutiny transabdominálně je možná, ale je technicky náročná s nižším ziskem oocytů. Doporučujeme získání oocytů IVF metodou před chirurgickým řešením.
Klíčová slova:
transpozice ovarií – IVF – punkce oocytů – onkofertilita
ÚVOD
V současnosti se udává, že kolem 11 % zhoubných nádorů, které jsou celosvětově hlášeny, je diagnostikováno u dětí a populace ve fertilním věku. Tito pacienti pak následně ve velkém procentu podstupují léčbu radioterapií nebo chemoterapií, která může nenávratně ovlivnit jejich fertilní možnosti v pozdějším období [8].
Pacienti jsou v krátké době vystaveni sdělení nepříjemné diagnózy a informováni i o dalších následcích léčby. Zároveň se musí rychle rozhodnout, zda ještě absolvují kroky, které by mohly vést k zachování pozdější fertility.
O možnostech ztráty, ale i zachování fertility by měl pacienta informovat jeho ošetřující onkolog a následně rychle předat pacienta do specializovaného centra asistované reprodukce. To vyžaduje rychlou mezioborovou spolupráci a také informovanost onkologů o možnostech léčby tak, abychom mohli všechny procesy uskutečnit v co nejefektivnějším pořadí.
MOŽNOSTI ZACHOVÁNÍ FERTILITY U ŽEN
Aplikace analog gonadoliberinu
Depotní preparáty vyvolají zablokování výdeje gonadoliberinů z hypofýzy a následně snižují rekrutaci primordiálních folikulů v ovariích a snižují riziko jejich poškození [3]. Účinek nastupuje přibližně za sedm až deset dnů po aplikaci první injekce depotních preparátů.
Transpozice ovarií
Laparotomický nebo laparoskopický výkon prováděný před aplikací radioterapie, kdy jsou ovaria umístěna nad oblast malé pánve před následnou radioterapií.
Kryoprezervace ovariální tkáně
Laparoskopicky nebo laparotomicky se odebere ovariální tkáň a zamrazí se pro možnost pozdější transplantace. Po transplantaci je možné obnovit funkci ovarií [6] nebo lze získat oocyty stimulací ovariální tkáně pro IVF. Do budoucna je zvažována i možnost in vitro maturace oocytů ze získané ovariální tkáně. Časová náročnost záleží na operačních možnostech pracoviště. Obvykle se jedná o oddálení léčby o několik dnů.
Stimulace ovarií a zamražení oocytů nebo embryí
U pacientky se provede stimulace ovarií s punkcí folikulární tekutiny a získáním oocytů jako při metodě IVF (in vitro fertilizace). Stimulaci je možné začít v jakékoli fázi menstruačního cyklu ženy [5]. Na získání oocytů nebo embryí je potřeba přibližně 13–15 dnů. Po získání oocytů může pacientka začít s onkologickou léčbou. Následně záleží na partnerském vztahu pacientky. U mladých žen, které nemají stálého partnera, se přistupuje k mražení oocytů. V případě, že žena vstupuje do léčby s partnerem, dojde k oplození oocytů a následnému zamražení embryí jako v IVF cyklu. Embrya jsou pak uchovávána po dobu léčby pacientky a se souhlasem ošetřujícího onkologa v souladu se zdravotním stavem posléze transferována do dělohy [2].
Surogátní mateřství
V případě ztráty dělohy u onkogynekologické pacientky musí být oocyty po oplození nebo embrya po rozmražení transferována do dělohy náhradní matky.
VLASTNÍ POZOROVÁNÍ
Anamnéza
Pacientka ve věku 34 let se dostavila do naší ambulance CAR (Centrum asistované reprodukce) dne 19. 9. 2018 pro diagnózu spinocelulárního karcinomu děložního hrdla G3 T2b pN1 M0, který byl u ní diagnostikován v červenci 2018 na základě histologického výsledku konizace provedené 4. 7. 2018 na Gynekologicko-porodnické klinice Všeobecné fakultní nemocnice (GPK VFN) v Praze. Poté byla provedena laparoskopická exstirpace lymfatických uzlin z pánve, nízká paraaortální lymfadenektomie, bilaterální salpingektomie a transpozice ovarií (30. 8. 2018) s histologickým vyšetřením 14 lymfatických uzlin. V jedné uzlině byla nalezena metastáza dlaždicobuněčného karcinomu.
Na doporučení onkogynekologického konzilia ze dne 12. 9. 2018 žádá žena o stimulaci a zamražení embryí. Následně je plánována primární chemoterapie na onkologickém pracovišti v místě bydliště na 12. 10. 2018.
V rodinné anamnéze pacientky se vyskytl u matky karcinom prsu ve 48 letech, u maternální babičky karcinom prsu a ovaria v 63 letech. Jiné choroby nebyly dokumentovány. V osobní anamnéze nebyly nalezeny patologie, pacientka byla dosud bez interních nemocí a operací. V gynekologické anamnéze byla uváděna menarche ve 14 letech, pravidelný menstruační cyklus po 28 dnech, gestace dosud žádná neproběhla, hormonální antikoncepci užívala od 16 do 19 let. Žádné gynekologické onemocnění kromě současného pacientka neudávala, na preventivní prohlídky docházela v rozmezí 1–1,5 roku.
Při fyzikálním vyšetření při vstupním pohovoru byl zjištěn celkový dobrý stav, vaginálně byl shledán normální gynekologický nález.
Ultrazvukové vyšetření abdominálně: ledviny bilaterálně bez dilatace kalichopánvičkového systému, obě ovaria solidní struktury, uloženy jsou v parakolických prostorech bilaterálně v úrovni pupku, blíže ke kyčelním kostem, pravé ovarium velikosti 35×21×30 mm (v hloubce 27 mm od kůže), levé ovarium velikosti 41×18×29 mm (v hloubce 26 mm).
PROVEDENÍ IVF CYKLU
Protože pacientka měla stálý partnerský vztah a plánovali společnou graviditu, byl proveden pohovor společně s partnerem a plánována kryokonzervace embryí.
Páru společně byl vysvětlen nižší zisk při punkci folikulů abdominální cestou. Nabídnut IVF cyklus s cílem kryoprezervace embryí nebo oocytů v libovolném poměru. Pár se rozhoduje pro kryokonzervaci embryí. Byly jim vydány informace, podrobně vysvětlen postup. U muže byl vyšetřen spermiogram s nálezem normospermie a provedeno bylo povinné vyšetření na sexuálně přenosné choroby u obou partnerů. U ženy byly ordinovány hormonální odběry (AMH – anti-mülleriánský hormon, PRL – prolaktin, TSH – tyreostimulační hormon, ATPO – protilátky proti štítné žláze). Hladina AMH byla 2,3, ostatní hodnoty byly také v normě.
Pacientka byla stimulována v krátkém protokolu dávkou 275 IU rekombinantního FSH od druhého dne menstruačního cyklu, od sedmého dne byl aplikován antagonista gonadoliberinu (GnRH). Na ultrazvukovém vyšetření byly devátý den cyklu popisovány vpravo na ovariu tři folikuly velikosti 13–14 mm, vlevo reakce větší, s přítomností šesti folikulů 13–14 mm. Následně byla po aplikaci hCG provedena punkce folikulární tekutiny transabdominální cestou. Punktováno bylo sedm folikulů, získány tři oocyty (obr. 1). Protože došlo k odkladu začátku chemoterapie, byla zvolena po punkci a oplození stimulace v duálním protokolu a pátý den po první punkci byla zahájena stimulace 250 IU rekombinantního FSH v antagonistickém protokolu. Opakovali jsme punkci folikulů transabdominálně a punktovali sedm folikulů, získali jsme dalších šest oocytů (obr. 2, obr. 3). Po oplození bylo zamraženo z první punkce jedno třídenní embryo, ze druhé punkce dvě embrya, jedno třídenní a jedno pětidenní. Vzhledem k nižšímu zisku bylo oplozeno metodou ICSI.
Image 1. Ultrazvukové zobrazeni stimulovaného ovaria abdominálni sondou 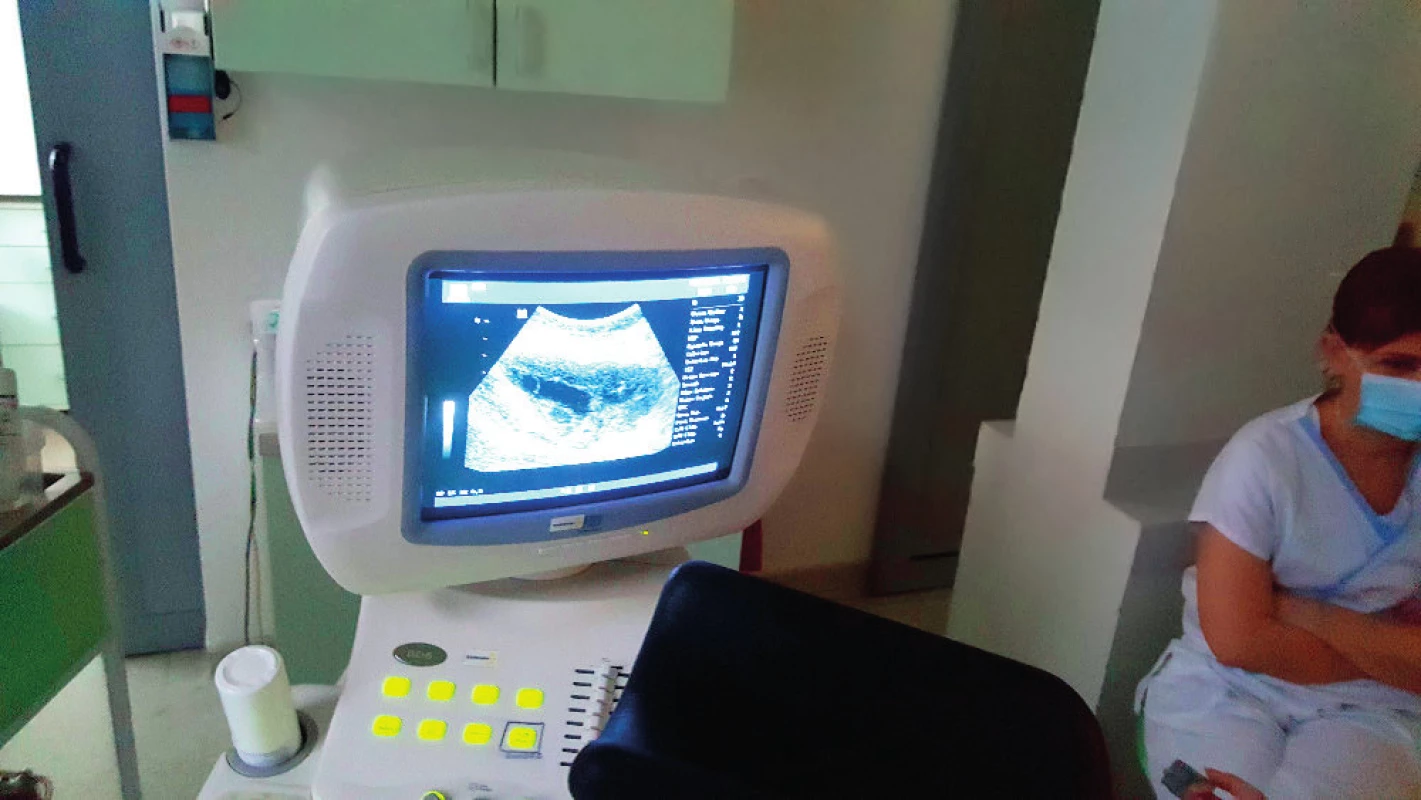
Image 2. Technika punkce folikulárni tekutiny transabdominální cestou 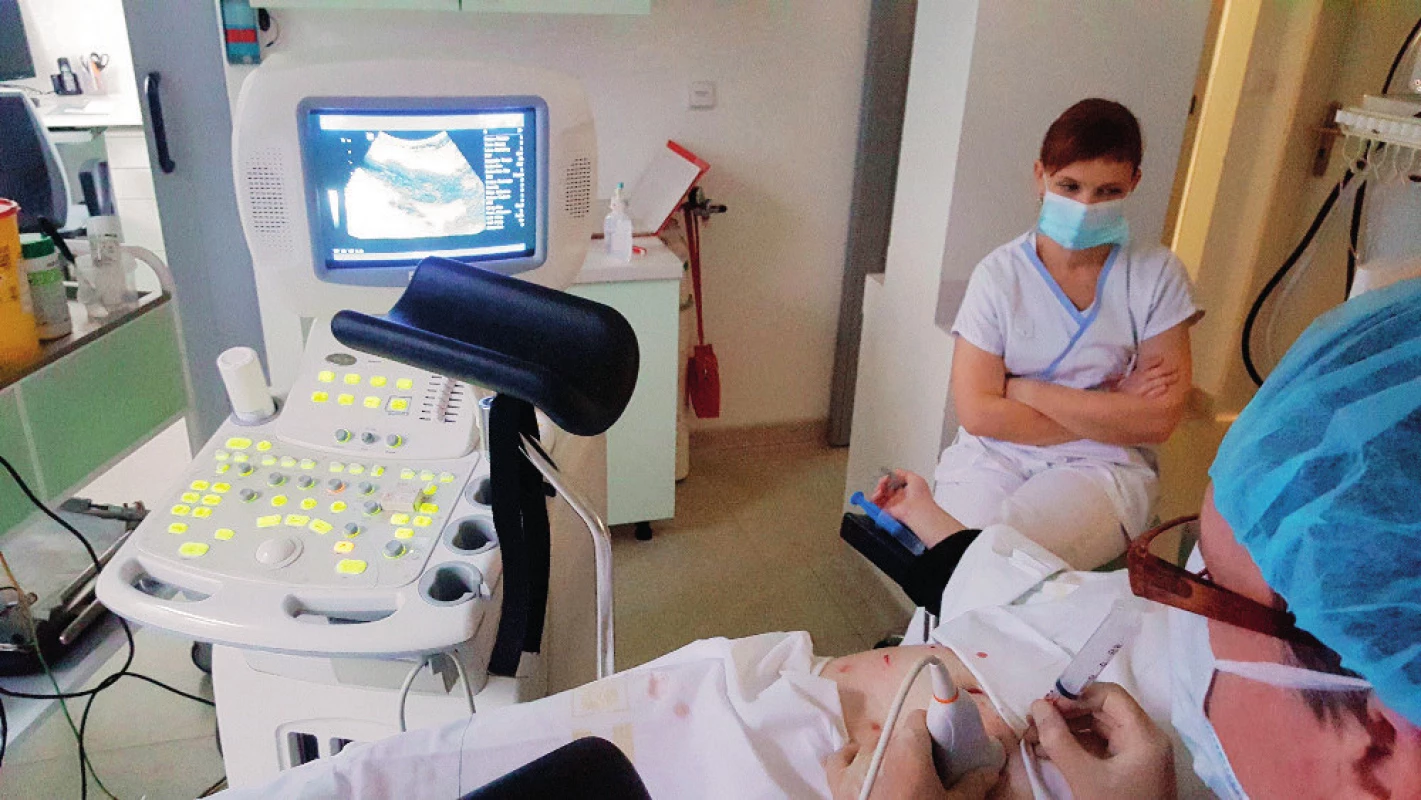
Image 3. Technika punkce folikulárni tekutiny transabdominální cestou 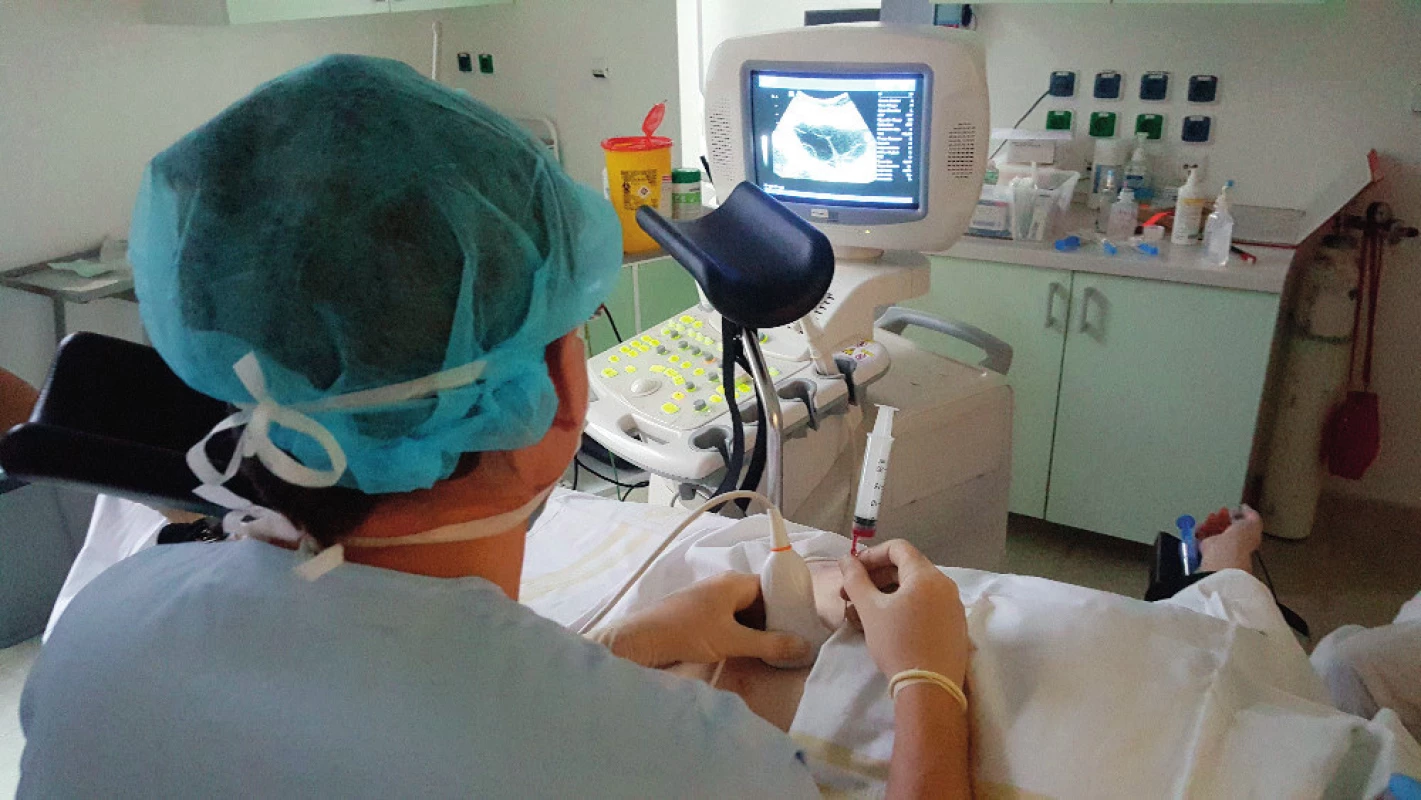
DISKUSE
Punkce transabdominální cestou je technicky náročnější než vaginální zisk folikulární tekutiny a vyžaduje bezesporu možnost kvalitního UZ zobrazení. V případě obézních pacientek by se komplikovanost výkonu ještě zhoršila. Zisk oocytů u naší pacientky byl pro daný věk a hodnoty AMH spíše nižší, což si vysvětlujeme přítomností základního onemocnění s možností ovlivnění vývoje oocytů i obtížnou technikou punkce.
V dostupné literatuře jsme nenašli výsledky gravidit po punkcích na transponovaných ovariích. Jsou uváděny spíše kazuistiky a popisováno použití takto získaných embryí k donošení surogátními matkami u pacientek po hysterektomii [1, 4, 9]. V případě naprosté remise a se souhlasem onkologa je možný transfer i u léčené pacientky se zachovanou dělohou. Jsou dokonce popisovány případy, kdy bylo dosaženo spontánního těhotenství u pacientky s transpozicí ovarií a zachovanou dělohou dokonce i po pánevní radiaci [7]. Morice et al. popisují v souboru 37 pacientek 18 gravidit, kdy 75 % jich vzniklo spontánně a jen dvě gravidity byly dosaženy metodou IVF. Transponovaná ovaria byla ale před punkcí navrácena do předchozí anatomické lokalizace. Je tedy možnost po ukončení léčby ovaria transponovat zpět, ale s takovým případem jsme se v praxi zatím nesetkali. Bylo by to možné při zachování funkčnosti ovaria po radioterapii.
Je efektivnější upřednostnit klasickou punkci folikulů před provedením transpozice ovarií. Proto je nutné informovat širší lékařskou veřejnost o možnostech zachování fertility při onkologické léčbě. Provedení stimulace a punkce folikulární tekutiny před transpozicí by podle nás mohlo přinášet lepší zisk oocytů a technicky zcela lepší podmínky k odběru. Na stimulaci a získání oocytů je potřeba doba zhruba dvou týdnů a stimulaci ovarií je možné začít v jakékoli fázi menstruačního cyklu. O těchto postupech je nutno poučit ošetřující onkology a seznámit s nimi lépe lékařskou veřejnost.
ZÁVĚR
Provedli jsme úspěšný odběr folikulární tekutiny po stimulaci transponovaných ovarií pacientky před onkologickou léčbou. Po tomto odběru jsme získali embrya vhodná ke kryokonzervaci a následnému použití u mladé pacientky po ukončení onkologické léčby. Transabdominální odběr folikulární tekutiny je možný, nicméně technicky obtížný. Proto je při onkologické léčbě u fertilních pacientek nutná mezioborová spolupráce a souhra onkologa a lékaře v reprodukčním centru.
Podporováno projektem UNCE 204065.
MUDr. Simona Jirsová, Ph.D.
Gynekologicko porodnická klinika
l. LF UK a VFN
Apolinářská 18
128 08 Praha 2
e-mail: simona.jirsova@email.cz
Sources
1. Agorastos, T., Zafrakas, M., Mastrominas, M. Long-term follow-up after cervical cancer treatment and subsequent successful surrogate pregnancy. Reprod BioMedicine Online, 2009, 19, p. 250–251.
2. Demeestere, I., Simon, F., Dedeken, I., et al. Live birth after autograft of ovarian tissue cryopreserved during childhood. Hum Reprod, 2015, 30, p. 2007–2009.
3. Fruhaufová, K., Hulvert, J. Zachování fertility u onkologicky nemocných v praxi. Praha: Grada, 2018.
4. Giacalone, PL., Laffargue, F., Bénos, P., et al. Successful in vitro fertilization - surrogate pregnancy in a patient with ovarian transposition who had undergone chemotherapy and pelvic irradiation. Fertil Steril, 76, p. 388–389.
5. Kuang, Y., Hong, Q., Chen, Q., et al. Luteal-phase ovarian stimulation is feasible for producting competent oocytes in women indergoing in vitro fertilization/intracytoplasmic sperm injection treatment, with optimal pregnancy outcomes in frozen-thawed embryotransfer cycles. Fertil Steril, 2017, 101, p. 105–111.
6. Mardešič, T., Jelínková, L., Melicharová, L. Úspěšná transplantace ovariální tkáně u pacientky s ovariálním selháním po onkologické léčbě. Čes Gynek, 2017, 82, s. 38–41.
7. Morice, P., Thiam-Ba, R., Castaigne, D., et al. Fertility results after ovarian transposition for pelvic malignancies treated by external irradiation or brachytherapy. Hum Reprod, 1998, 13, p. 660–663.
8. Řezáčová, J., et al. Reprodukční medicína. Praha: Mladá fronta, 2018.
9. Steigrad, S., Hacker, NF., Kolb, B. In vitro fertilization surrogate pregnancy in a patient who underwent radical hysterectomy followed by ovarian transposition, lower abdominal wall radiotherapy and chemotherapy. Fertil Steril, 2005, 83, p. 573–574.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2020 Issue 1-
All articles in this issue
- Trendy v asistované reprodukci v datech Národního registru asistované reprodukce České republiky v letech 2007–2017
- Transabdominální punkce folikulů v IVF cyklu u pacientky po transpozici ovarií
- Bilaterální tubární gravidita
- Trombotické mikroangiopatie a těhotenství
- Závažná trombotická mikroangiopatie provázená rupturou jater a multiorgánovým selháním ve 26. týdnu těhotenství
- Echinokokóza s obrazem peritoneální karcinomatózy
- Lactobacillus crispatus dominantní vaginální mikrobiota v těhotenství
- Prenatální, perinatální a neonatální faktory a jejich vliv na školní úspěšnost u dětí mladšího školního věku
- Neinvazivní prenatální testy: jejich přínos a limity
- Je možná prevence ovariálního karcinomu?
- Sledovanie spokojnosti hospitalizovaných pacientiek na II. GPK LFUK pomocou štandardizovaného dotazníka, analýza možností na zlepšenie
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Trombotické mikroangiopatie a těhotenství
- Lactobacillus crispatus dominantní vaginální mikrobiota v těhotenství
- Neinvazivní prenatální testy: jejich přínos a limity
- Je možná prevence ovariálního karcinomu?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

