-
Medical journals
- Career
Prebioptické a bioptické metody při screeningu a diagnostice karcinomu děložního hrdla
Authors: V. Dvořák 1; R. Pilka 2
Authors‘ workplace: Centrum ambulantní gynekologie a primární péče, Brno 1; Gynekologicko-porodnická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 2
Published in: Ceska Gynekol 2014; 79(2): 88-97
Overview
Cíl:
Popsat dostupné prebioptické a bioptické metody využívané při screeningu a diagnostice karcinomu děložního hrdla.Typ studie:
Přehledový článek.Název a sídlo pracoviště:
Centrum ambulantní gynekologie a primární péče, Brno; Gynekologicko-porodnická klinika FN a LF UP Olomouc.Předmět a metoda studie:
V přehledovém článku je podán nástin prebioptických vyšetřovacích metod a na ně navazující diagnostiky, mající za cíl detekci, verifikaci a léčbu lézí děložního hrdla. Popisuje a srovnává jednotlivé metody, včetně jejich vzájemné korelace.Závěr:
V diagnostice karcinomu děložního hrdla má nezastupitelnou úlohu onkologická cytologie, kolposkopie a HPV testace. Jejich vhodnou kombinací jsme schopni dosáhnout vysoké senzitivity v detekci závažných lézí děložního hrdla.Klíčová slova:
karcinom děložního hrdla, kolposkopie, onkologická cytologie, HPV testace, CIN, konizaceÚVOD
Karcinom děložního hrdla je po karcinomu prsu a děložního těla třetí nejčastější malignitou gynekologických orgánů v České republice. V jeho incidenci jsou v posledních letech náznaky sestupné tendence, ale po řadu dekád se pohybovala okolo 20 případů na 100 000 žen, s mortalitou 7 úmrtí na 100 000 žen za rok, což je 1,5–2krát více než v západních zemích [21]. Podíl zde má dosavadní neúplná účast žen v organizovaném screeningovém programu na včasný záchyt tohoto onemocnění. V etio-patogenezi nádorů děložního hrdla hraje hlavní úlohu infekce lidským papilomavirem (HPV). Z klinického hlediska se HPV dělí na základě onkogenního potenciálu na high risk [16, 18, 26, 31, 33, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82] a low risk genotypy [6, 11, 40, 42, 43, 44, 54, 61, 72, 81]. Mezi další predisponující faktory patří časné koiarché, více sexuálních partnerů, nízký socioekonomický status, multiparita, nepřímo dlouhodobé užívání hormonální antikoncepce, poruchy buněčné i humorální imunity, nutriční stav, kouření cigaret, genitální infekce [19]. Z histologického hlediska se karcinom hrdla děložního dělí na spinocelulární karcinom, který se vyskytuje v 80 až 90 %, dále pak adenokarcinom (10–15 %), který se vyskytuje spíše u mladších žen a je u něho slabší vazba na socioekonomické a sexuální faktory, lokalizován bývá častěji v kanálu děložního hrdla. Spíše výjimečně se vyskytují nonepiteliální nádory – sarkomy, lymfomy a melanomy [20]. V diagnostice karcinomu děložního hrdla má nezastupitelnou úlohu onkologická cytologie, kolposkopie a HPV testace. K realizaci invazivního nádoru je nezbytně nutné dlouhodobé působení predisponujících faktorů, jež snižují kompetenci individuální imunitní obrany organismu.
PREBIOPTICKÉ METODY
1. Onkologická cytologie
Onkologická cytologie je metodou vysoce specifickou (97 %), avšak málo senzitivní (60 % při jednorázovém odběru). Slouží k časné detekci a následně léčbě lézí předcházejících karcinom děložního hrdla [5]. Jako odběrové nástroje se používají cervikální broom nebo častěji kombinace špátle a kartáčku. Odběr by měl postihnout celou transformační zónu, nátěr nanášíme na podložní sklo a neprodleně fixujeme. V současné době se pro klasifikaci onkologické cytologie v České republice používá klasifikace přijatá v Bethesdě v roce 2001 [14]. Hodnotí se kvalita stěru, interpretace cytologického nálezu, součástí je závěr cytologa a doporučení (tab. 1, 2, 3). Doporučení cytologa nejsou závazná, k expertnímu kolposkopickému vyšetření je pacientku možné odeslat při jakémkoli cytologickém nálezu. Doporučení cytologa však nelze ignorovat bez dokumentovaného odůvodnění. Cytologie v tekutém médiu (LBC – liquid based cytology) se odebírá plastovým nástrojem, jehož kon-cová část se ponoří do nádobky s tekutým médiem, v laboratoři se pak materiál odstředí a v tenké vrstvě se nanese na podložní sklo. Preparát neobsahuje příměsi krve a zánětlivé buňky, rozvrstvení je stejnoměrné, díky čemuž je méně preparátů nehodnotitelných. Větší senzitivita vůči konvenčním stěrům však nebyla pro detekci HG lézí prokázána, jsou zde i vyšší náklady na vyšetření [4].
Table 1. Hodnocení onkologické cytologie 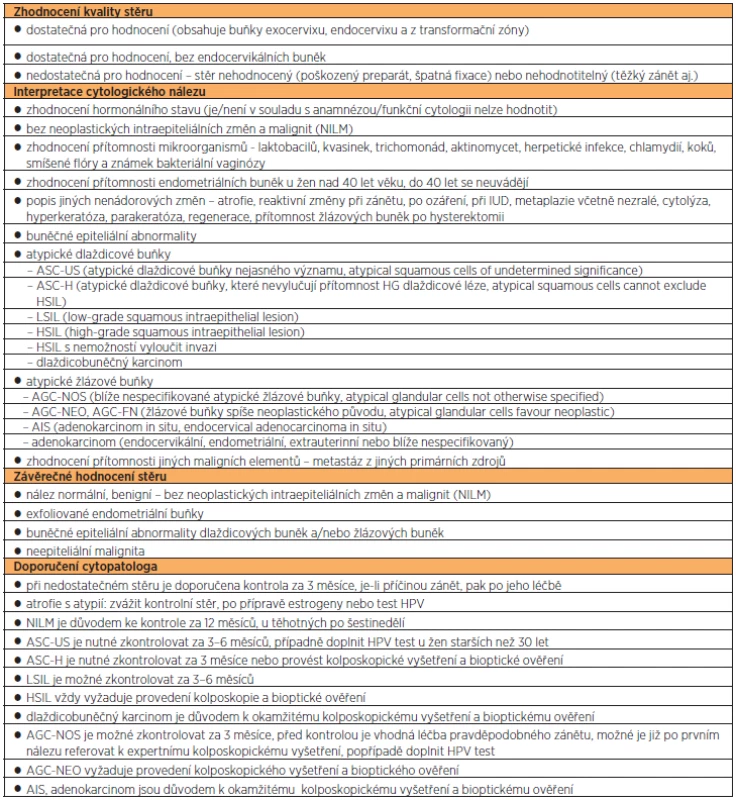
Table 2. Frekvence jednotlivých cytologických stěrů 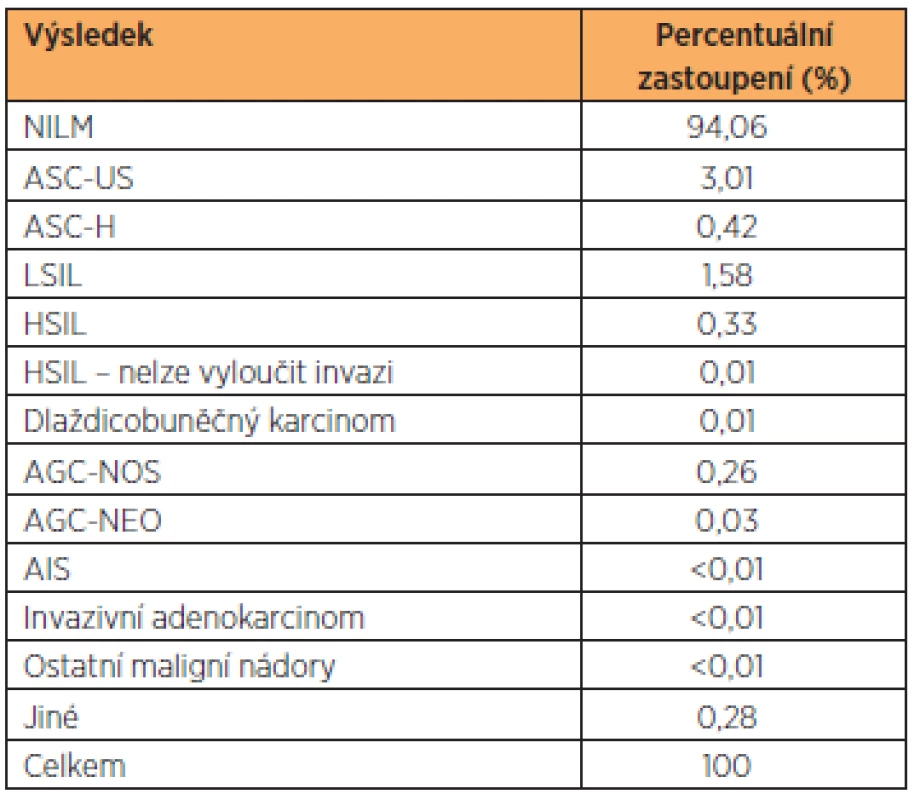
Table 3. Korelace systému Bethesda a histologického nálezu 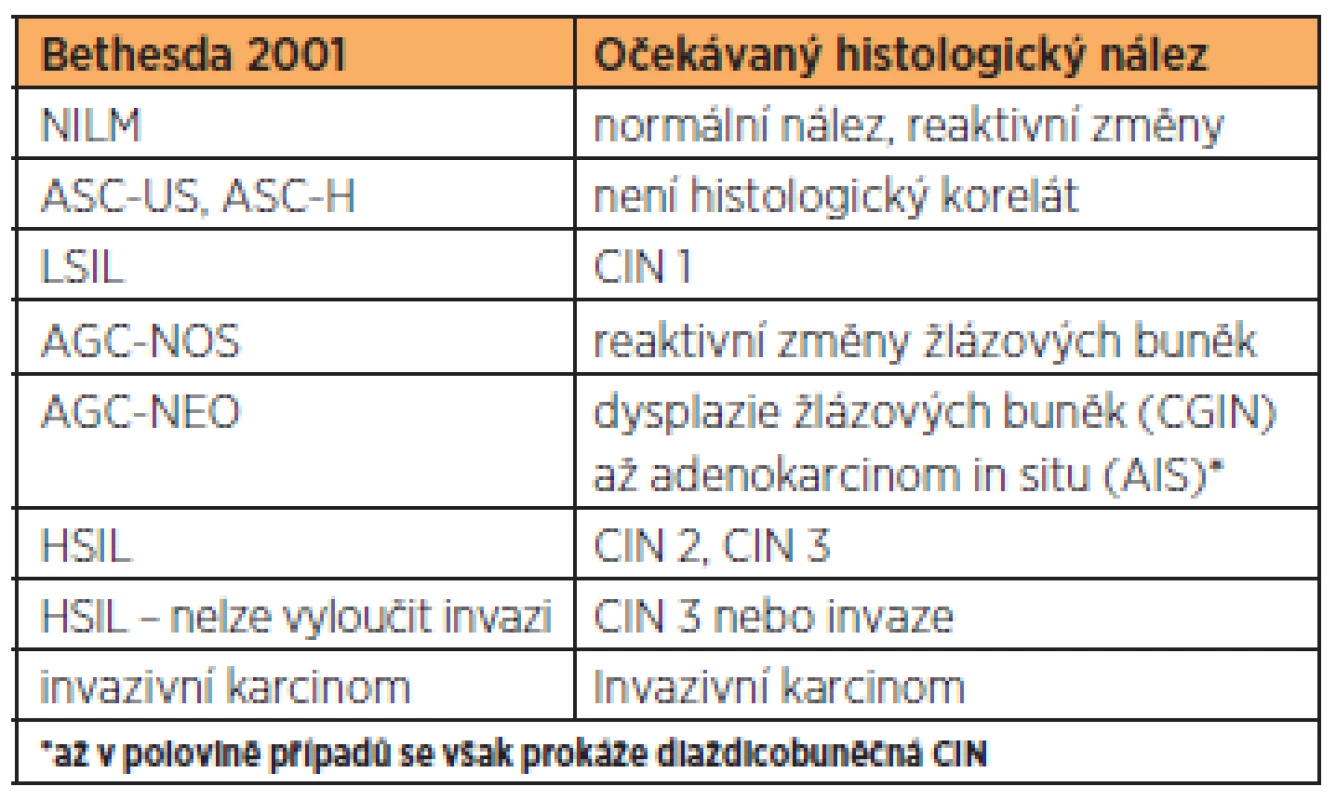
2. HPV testy
Vzhledem k vysoké prevalenci infekce u žen mladších než 30 let věku má význam test provádět až po 30. roce života pacientky. Pozitivita HR (high risk) HPV totiž představuje významný rizikový faktor pro rozvoj karcinomu děložního hrdla. U žen po 35. roce života je senzitivita HPV testu pro HG léze 95 %, specificita 93 % [7].
V současnosti se k průkazu přítomnosti virové DNA využívá dvou metod. Jednak metody založené na přímé hybridizaci, jednak metody založené na polymerázové řetězové reakci. Test vykazuje vysokou negativní prediktivní hodnotu (97–99 %). Senzitivita a specificita u HG lézí (high grade le-sion) je také vysoká. V klinické praxi lze test s úspěchem využít jako třídicí kritérium u hraničních cytologických nálezů a u nálezů ASC-US, ASC-H a AGC-NOS. Na základě pozitivity či negativity pak volíme více či méně radikální postup. Přínosná je testace i u žen, které podstoupily chirurgické ošetření čípku pro prekancerózu, kdy se vyšetření provádí za 6 až 12 měsíců po výkonu [1].
Testy druhé generace jsou založeny na amplifikaci transkriptů, umožňují detekci mRNA virů HPV z kohorty vysokého rizika přímo v genomu cervikálních epiteliálních buněk.Testy mají stejnou senzitivitu jako detekce virové DNA, ale významně vyšší specificitu [9]. Prokazují transformaci epiteliálních buněk, řízenou virem.
3. Kolposkopie
Kolposkopie je zobrazovací vyšetřovací metoda cervixu a anogenitální krajiny využívající bin-okulární aspekci s osvitem a zvětšením objektu. Je součástí komplexního gynekologického vyšetření a preventivní prohlídky gynekologa v ČR. Úkolem kolposkopie je zhodnocení přítomnosti léze, odhad stupně její závažnosti, posouzení jejího rozsahu, případně identifikace suspektních míst k cílenému bioptickému odběru [16]. Cílem kolposkopie a úvahy s ní spojené je stratifikace rizika. Management ošetření lézí má eradikovat nebo alespoň snížit riziko maligního zvratu. Dělí se podle erudice vyšetřujícího na základní a expertní, podle využití chemických roztoků na nativní a rozšířenou. Během rozšířené kolposkopie se na čípek aplikuje 3–5% roztok kyseliny octové. Ta působí edém epitelu, hlavně cylindrického a abnormálního. Dochází k reverzibilní koagulaci epiteliálních a stromálních cytokeratinů, což se projeví zbělením. V normálním epitelu s rozptýlenými jádry dochází v intermediální vrstvě jen k malé precipitaci. Mírné zbělení provází i fyziologickou dlaždicovou metaplazii. V okrscích cervikální intraepiteliální neoplazie (CIN) se vysráží nukleoprotein neoplastických buněk a překrývá podložní stroma, odražené světlo je bílé. Při LG lézi (low grade lesion) musí kyselina octová proniknout do dolní poloviny epitelu a zbělení je opožděné. HG léze naproti tomu skýtá konstantní odezvu markantního zbělání. Odeznívá pomalu, jak je kyselina pufrována a nukleoprotein se již nesráží [8]. Dalším chemickým roztokem používaným při kolposkopii je Lugolův roztok (Schillerův test). Jod v něm obsažený barví glykogen přítomný v dlaždicových buňkách dohněda. Cylindrické buňky glykogen neobsahují, proto se nebarví. Atypické a reaktivní léze se barví dožluta (hořčicová). Jestliže chceme lépe zviditelnit cévní vzorce, použijeme zelený filtr.
Současná kolposkopická terminologie využívá klasifikaci schválenou v Rio de Janeiro r. 2011, která nahradila klasifikaci z Barcelony 2002 [17] (tab. 4).
Table 4. Názvosloví kolposkopie IFCPC 2011 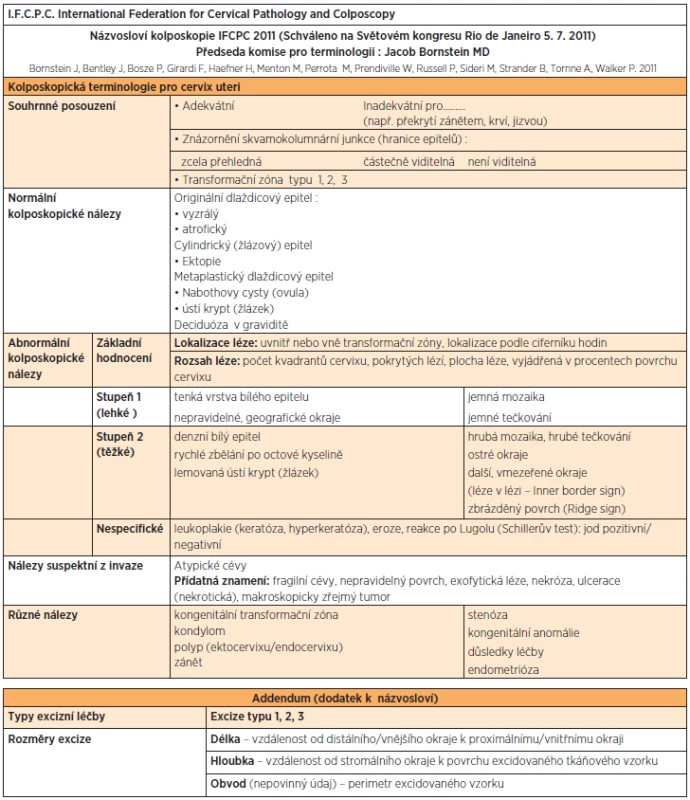
NORMÁLNÍ KOLPOSKOPICKÉ NÁLEZY
A. Originální dlaždicový epitel
Originální dlaždicový epitel (OE) je hladký růžový epitel přítomný na děložním čípku a v pochvě. Bílé světlo se kombinuje s příměsí červené z hlouběji umístěných krevních kapilár ve výslednou růžovou barvu. Pod epitelem mohou být přítomny cévy, a to vlásenkové a síťové kapiláry. Po aplikaci roztoku kyseliny octové OE nezbělá, po aplikaci Lugolova roztoku zhnědne.
B. Cylindrický epitel
Cylindrický epitel je jednořadý epitel, který produkuje hlen. Nachází se mezi endometriem a originálním dlaždicovým epitelem, případně epitelem metaplastickým. Má červenou barvu a po aplikaci roztoku kyseliny octové hrozníčkovitou strukturu. Může se vyskytovat v endocervixu, na exocervixu, někdy i v pochvě. Jestliže pokrývá exocervix, je označován jako ektopie, cylindrický epitel vznikající lacerací po porodu se nazývá ektropium, při lokalizaci v pochvě pak vaginální adenóza.
C. Transformační zóna
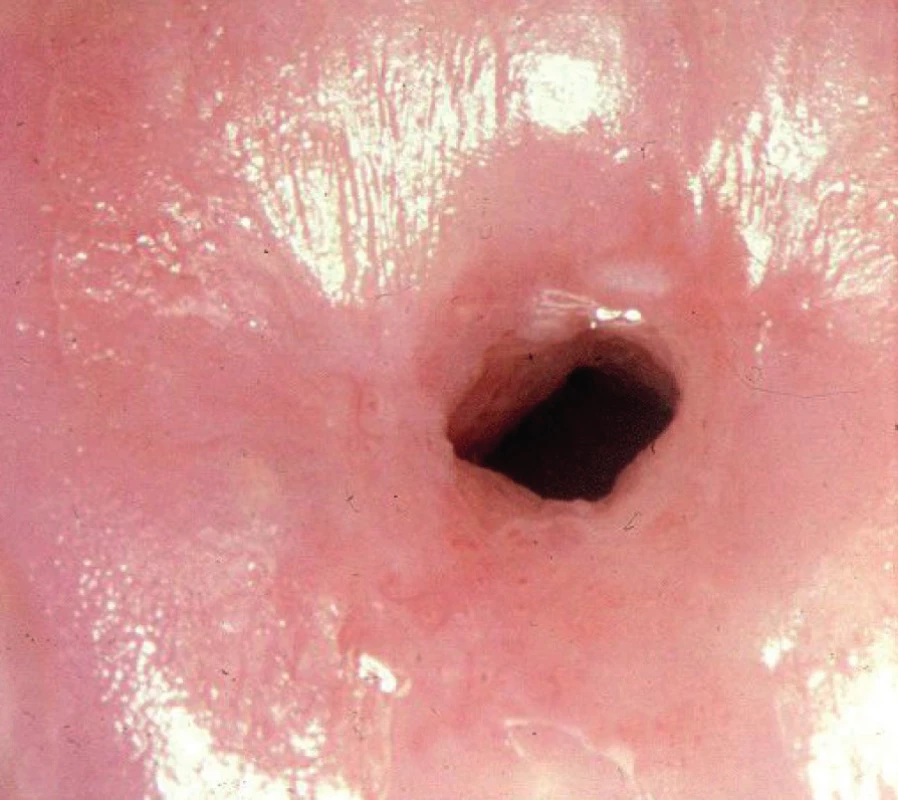
Transformační zóna (TZ) je oblast mezi originálním dlaždicovým epitelem a cylindrickým epitelem s různými stupni vyzrávání metaplazie. Po aplikaci roztoku kyseliny octové se barví lehce doběla, po aplikaci Lugolova roztoku lehce dohněda. Mohou zde být přítomna otevřená ústí žlázových krypt, ovula Nabothi (což jsou obliterované žlázové krypty naplněné vazkým sekretem) nebo okrsky cylindrického epitelu (obr. 1, 2).
Image 1. Transformační zóna 1, normální nález 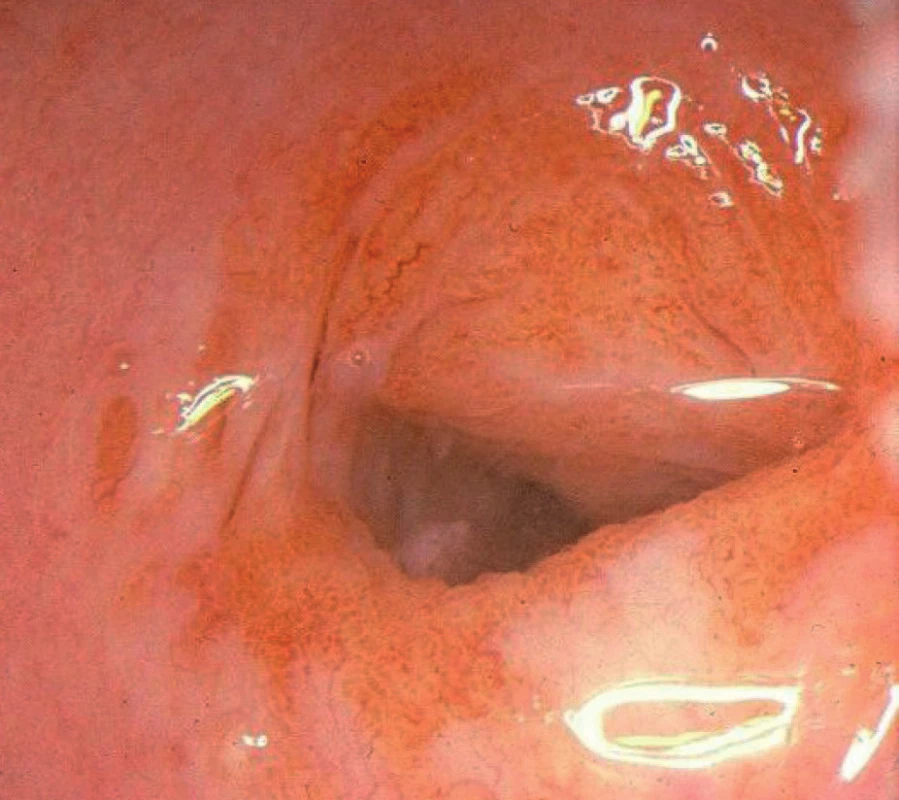
Rozlišujeme tři typy TZ. U typu 1 je TZ umístěna na exocervixu a viditelná v celém rozsahu, TZ typu 2 má endocervikální komponentu, ale ta je také plně viditelná. U typu 3 je TZ s endocervikální komponentou, kterou v celém rozsahu vizualizovat nelze.
Linie, kde se setkává vícevrstevnatý nerohovějící dlaždicový epitel a epitel cylindrický, se nazývá skvamokolumnární junkce (SCJ). Její umístění se v průběhu života ženy mění v závislosti na hormonální aktivitě.
Postnatální přeměna jednoho buněčného epitelu v epitel jiný se nazývá metaplazie. Dochází k ní na základě vystavení ektopicky umístěného cylindrického epitelu vnějším agresivním vlivům. Ten je pak nahrazován odolnějším epitelem dlaždicovým. Zdrojem této přeměny jsou rezervní buňky ze subcelulární vrstvy endocervikálních buněk.
ABNORMÁLNÍ KOLPOSKOPICKÉ NÁLEZY
A. Bílý epitel
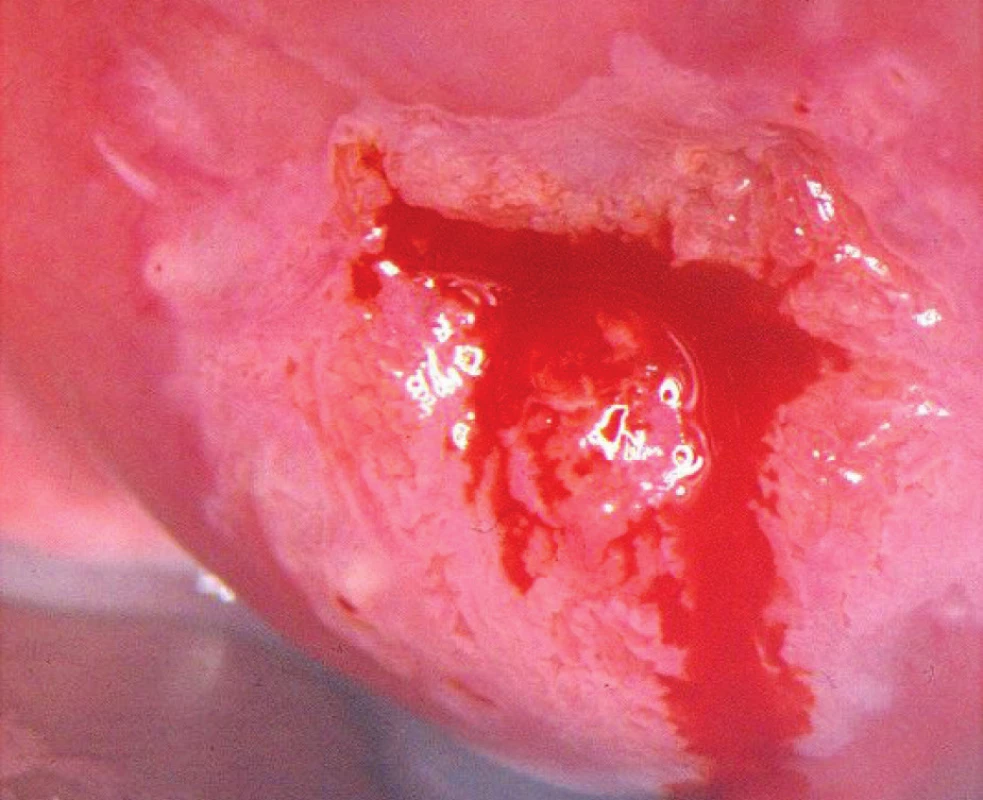
Po aplikaci roztoku kyseliny octové se barví bíle vzhledem k vysoké hustotě buněčných jader. Obecně platí, že čím je léze závažnější, tím sytější je zabarvení, rychleji vzniká a déle přetrvává, často mívá matný povrch. U low-grade lézí totiž musí kyselina octová proniknout do distální třetiny epitelu, což způsobí pomalejší nástup zbělání. Mezi acetopozitivní epitelové změny patří CIN, projevy HPV infekce, nezralá dlaždicová metaplazie, hojení a regenerace epitelu, kongenitální TZ, zánět, adenokarcinom in situ, invazivní adenokarcinom, invazivní dlaždicobuněčný karcinom (obr. 3, 4).
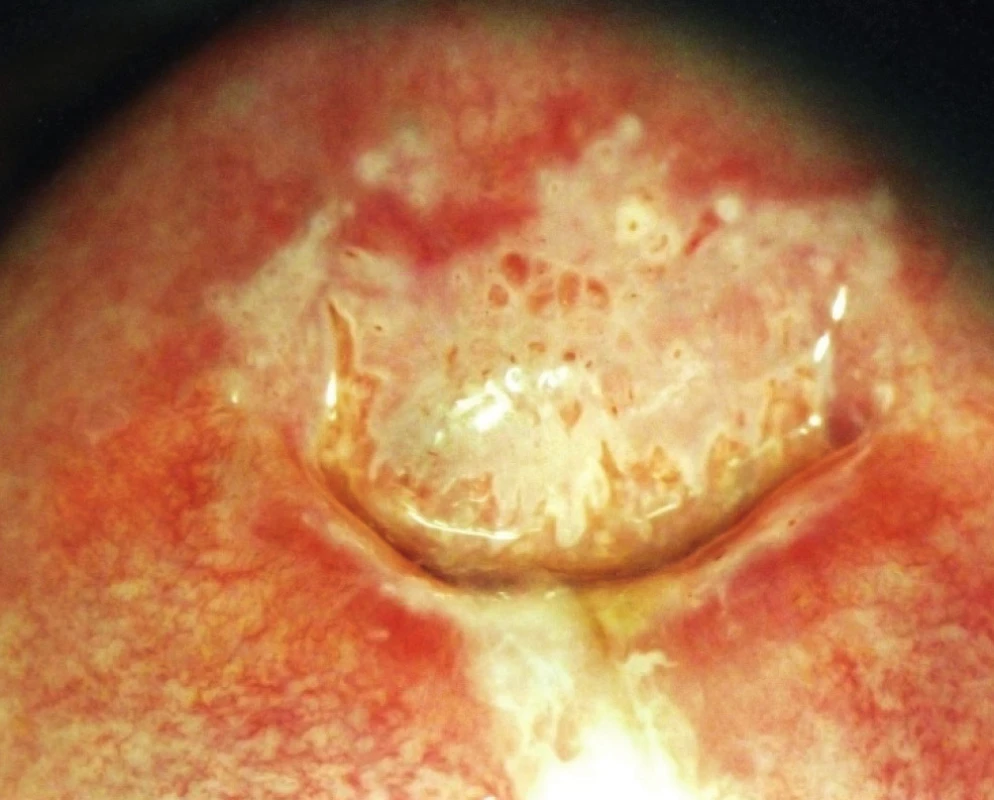
B. Tečkování
Tečkováním označujeme v kolposkopickém obraze změnu, kdy se kapiláry zobrazují jako tečky. Low-grade léze mají tečkování jemnější, high-grade léze hrubší s většími interkapilárními vzdálenostmi (obr. 5).
Image 5. Hrubé tečkování, hrubá mozaika, CIN 3 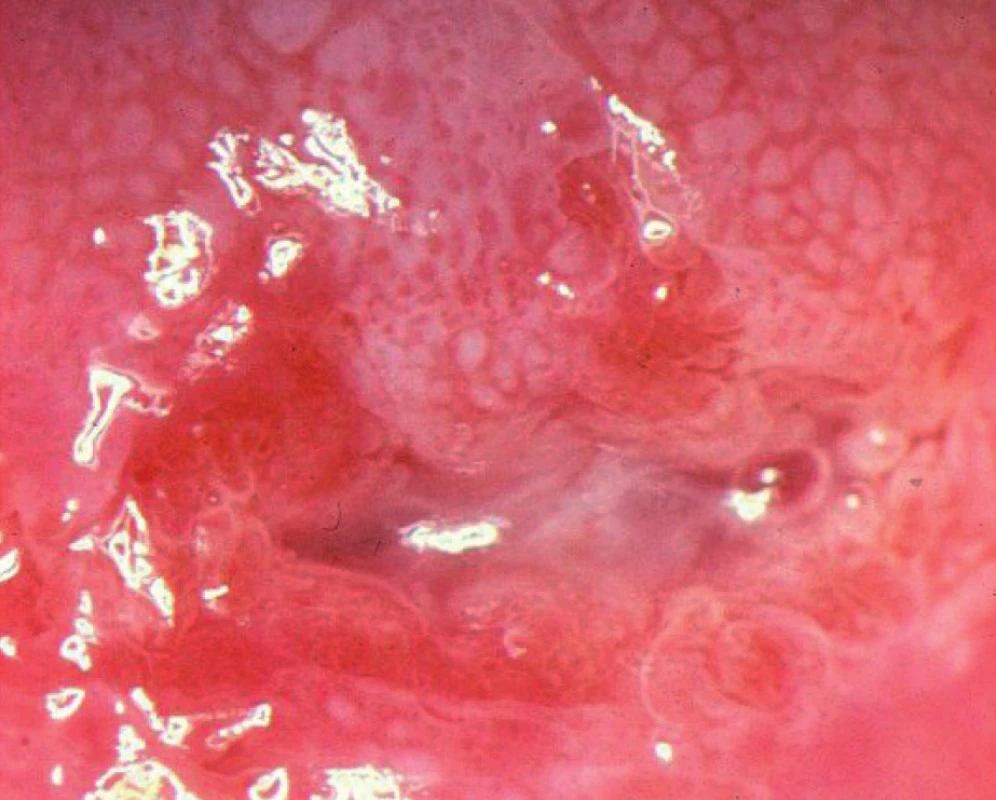
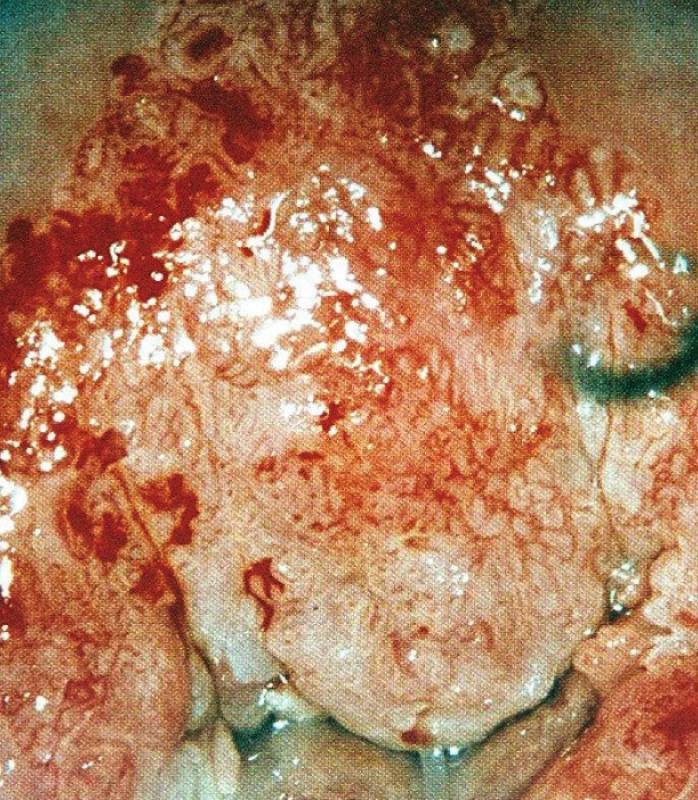
C. Mozaika
Jako mozaiku v kolposkopii označujeme novotvorbu cév, která vykazuje pravoúhlé vzorování podobné mozaice. Low-grade léze mají políčkování jemnější, high-grade léze mají políčka hrubší, větší a nepravidelnější (obr. 5, 6). Mozaika odpovídá průběhu spojovacích kapilár probíhajících paralelně s povrchem.
Image 6. Hrubá mozaika, hrubé tečkování, CIN 3 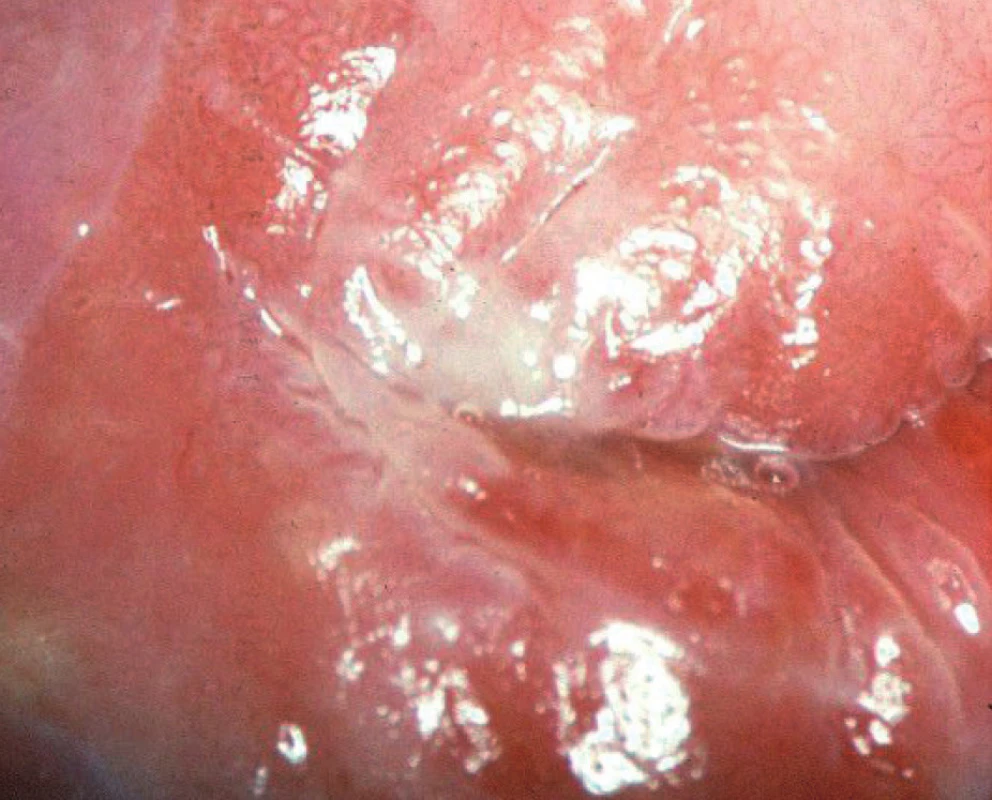
D. Jodnegativní zóna
Jodnegativní zóna představuje okrsek epitelu, který se po aplikaci Lugolova roztoku nebarví. Může jít o nezralou metaplazii, atrofii, erozi, zánět, keratózu, úplná jodnegativita s hořčicově žlutavým zbarvením je suspektní z high-grade léze.
E. Atypické cévy
Atypické cévy jsou nepravidelné, se změnami v průběhu, změnami kalibru, přirovnávají se ke špagetám, vývrtkám, kořenům zázvoru, širokým vlásenkám atd. (obr. 7). Jde o novotvořené cévy vznikající jako důsledek zvýšených metabolických nároků proliferující nádorové tkáně [15].
Image 7. Atypické cévy, invazivní karcinom 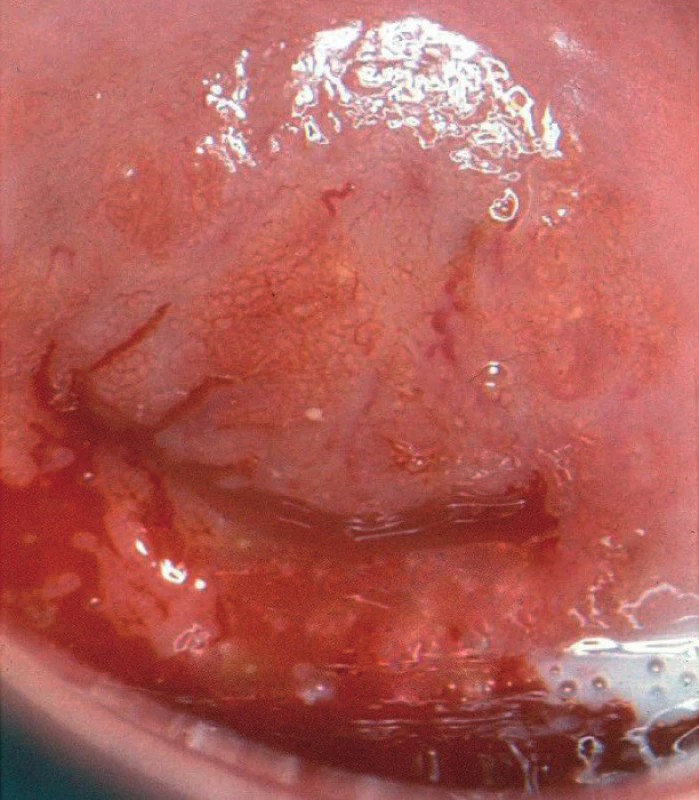
F. Rozlišení low-grade a high-grade lézí dlaždicového epitelu (tab. 5)
Table 5. Rozlišení low-grade a high-grade lézí dlaždicového epitelu 
Většina low-grade lézí je spíše projevem HPV infekce než prekancerózou. Zahrnují CIN 1 část heterogenní množiny změn CIN 2, kondylomata. Povrch bývá plochý, okraje nerovné, mapovité, zpeřené nebo vločkovité. Po aplikaci roztoku kyseliny octové se barví doběla či růžovoběla, někdy se odstín popisuje jako lesklý či sněhově bílý. Nastupuje pomalu a rychle mizí. Po aplikaci Lugolova roztoku se barví nespecificky, přes žlutou k hnědé. Cévní vzorce jsou jemné a pravidelné, vyskytuje se jemné tečování a jemná mozaika [18].
High-grade léze zahrnují CIN 2 a CIN 3. Tyto léze často progredují v invazivní karcinom,u CIN 3 v rozmezí 12–70 % [11]. Povrch léze může být plochý, vyvýšený či s reliéfem, okraje jsou ostré, může docházet k odlupování epitelu od stromatu (peeling). Po aplikaci roztoku kyseliny octové se barví šedavě bíle, barva je přirovnávána k ústřicově bílé. Barevná změna nastupuje rychle a dlouho přetrvává. Cévní vzorce jsou hrubé a nepravidelné s velkými interkapilárními vzdálenostmi. Patří sem hrubé tečkování, hrubá mozaika, políčka mozaiky s centrální tečkou, atypické cévy.
KOLPOSKOPICKÉ JEVY NAZNAČUJÍCÍ INVAZIVNÍ KARCINOM
Mezi kolposkopické znaky invazivního karcinomu patří nepravidelný povrch, eroze, ulcerace, sytý bílý epitel, nepravidelné hrubé tečkování a mozaika, atypické cévy, nekróza, keratóza, fragilita tkáně, drolivost, olupování či kontaktní krvácení. Typický je exofytický nebo endofytický růst (obr. 8).
NEDOSTATEČNÁ KOLPOSKOPIE
Při nedostatečné kolposkopii nejsme schopni plně nebo dokonce vůbec vizualizovat děložní hrdlo případně celou transformační zónu. Při nedostatečné kolposkopii nelze zcela vyloučit přítomnost invazivního karcinomu.
RŮZNÉ KOLPOSKOPICKÉ JEVY
Mezi různé kolposkopické nálezy řadíme kondylomata, keratózu, eroze, zánět, atrofii, deciduózu, polypy a endometriózu.
BIOPTICKÉ METODY
1. Biopsie děložního hrdla
Nejčastěji se používá punch biopsie z děložního hrdla. Vzorek se odebírá pomocí bioptických kleští, ideálně pod kolposkopickou kontrolou. Odběr se provádí z nejvíce suspektního místa, většinou nevyžaduje anestezii a je možné jej provádět ambulantně. Riziko selhání pro diagnózu karcinomu se uvádí 2 % [6, 13].
2. Konizace a excize
Před každým excizním výkonem by měl být posouzen typ transformační zóny a na základě toho pak zvolena vhodná excizní metoda. Minimální hloubka preparátu by měla být 6 mm, laterálně by měl řez přesahovat alespoň 2 mm od okraje léze. Excize by měla odstranit celou transformační zónu, preparát by měl být získán v jednom kuse a měl by být orientován a vypnut na podložku řeznou plochou. Po provedení výkonu následuje výběrově (selektivně) cervikální kyretáž nebo cytobrush. Endocervikální kyretáž v kombinaci s kolposkopicky cílenou biopsií umožňuje histologické zhodnocení jak ektocervixu, tak endocervixu, bez nutnosti odstranění velkého množství cervikální tkáně. Abraze musí být systematická a měla by postihnout celou plochu v ose cervikálního kanálu. Poté se ranná plocha ošetří pomocí koagulace, případně aplikací lokálních hemostyptik. Existuje několik technik excizních výkonů v závislosti na typu transformační zóny [12].
- Konizace kličkou je vhodná u TZ 1, někdy i u TZ 2. Dochází k miskovitému vytnutí léze, řez se provádí kaudo-kraniálně nebo latero-laterálně.
- Při konizaci cowboy hat se na předchozí výkon navazuje výkonem identickým, jen s menší kličkou. Provádí se u lézí s endocervikální komponentou.
- U všech typů transformační zóny můžeme použít konizaci praporkem. Začíná se přiložením praporku u čísla 12 a pozvolným otáčením je vytnuta celá transformační zóna.
- U všech typů TZ můžeme použít i konizační jehlu (NETZ) případně metodu „rovného drátku“ (SWETZ). Využívá se spíše pro hlubší excize, pro rozsáhlejší výkony a pro asymetrické léze. Začíná se mělkým obkroužením léze, konus se následně postupně preparuje.
- U konizace skalpelem (cold knife) je vhodné užít vazokonstrikčních preparátů. Při správném provedení a užití koagulace bez sutury není zhoršeno hojení a ani nebyl prokázán vyšší výskyt negativních dopadů na případnou graviditu ve srovnání s ostatními metodami. Vzhledem k absenci termického poškození je to metoda vhodná při opakovaných výkonech. Dnes se však využívá jen vzácně, a to prakticky jen u glandulárních lézí.
- Konizace laserem kombinuje výhody excizních a destrukčních výkonů. Výkon vyžaduje kolposkopickou kontrolu, postup je obdobný jako při konizaci jehlou. V posledních desetiletích byl téměř vytlačen elektroexcizními metodami, jako je LLETZ, SWETZ a NETZ.
- U adenolézí a u endocervikálně uložených dlaždicobuněčných lézí provádíme cylindrickou disekci stejným způsobem jako u konizace jehlou, baze se může odstřihnout nůžkami.
Histologická klasifikace dělí prekancerózy na dlaždicobuněčné a žlázové. Prekancerózou dlaždicobuněčného karcinomu je cervikální intraepite-liální neoplazie (CIN). Je definována jako přítomnost dysplazie, tzn. porucha vyzrávání a cytologické abnormality buněk. Podle rozsahu dysplastických změn se dělí do tří stupňů. U CIN 1 (mírný stupen dysplazie) jsou změny přítomny v dolní třetině epitelu, u CIN 2 (dysplazie střední) v dolních dvou třetinách epitelu a u CIN 3 (těžká dysplazie) přesahují dvě třetiny epitelu. CIN 1 se řadí k low-grade lézím (LSIL), zbylé kategorie pak k high-grade lézím (HSIL). Riziko vývoje jednotlivých kategorií CIN v invazivní karcinom ukazuje tabulka 6 [11]. Prekurzorem invazivního adenokarcinomu je glandulární intraepiteliální neoplazie (CGIN) a adenokarcinom in situ (AIS). Buňky vykazují jaderné atypie, úbytek hlenu a zvýšený počet mitóz. Pro odlišení morfologických lézí s onkogenním potenciálem tenkého dlaždicového epitelu, jaký bývá fyziologicky u nezralé dlaždicobuněčné metaplazie a při atrofii, a zejména pak u morfologických změn, jež se jeví jako CIN 2 (VAIN 2, VIN 2 atd.), je indikováno v tomto doporučení užití biomarkeru p16 INK4a, indikátoru léze asociované s infekcí HPV. Pro zpřesnění proliferačního potenciálu lézí se doporučuje imunohistochemické stanovení biomarkerem ki-67. Jeho exprese narůstá se závažností dysplastických změn [3]. Protilátky proti endote-liálním proteinům, jako např. faktor VIII – antigen, se vážou z endotelu krevních i lymfatických cév, a představují tak užitečný nástroj pro detekci lymfavaskulární invaze u cervikálního karcinomu. Pro selektivnější vyhodnocení krevních cév je doporučován CD31. Pro detekci lymfoaskulární invaze je možné provést imunohistochemické vyšetření nově popsaných lymfendoteliálních proteinů (např. podoplanin) [2, 10].
Table 6. Riziko vývoje kategorií CIN v invazivní karcinom 
Table 7. Korelace kolposkopického, cytologického a histopatologického nálezu 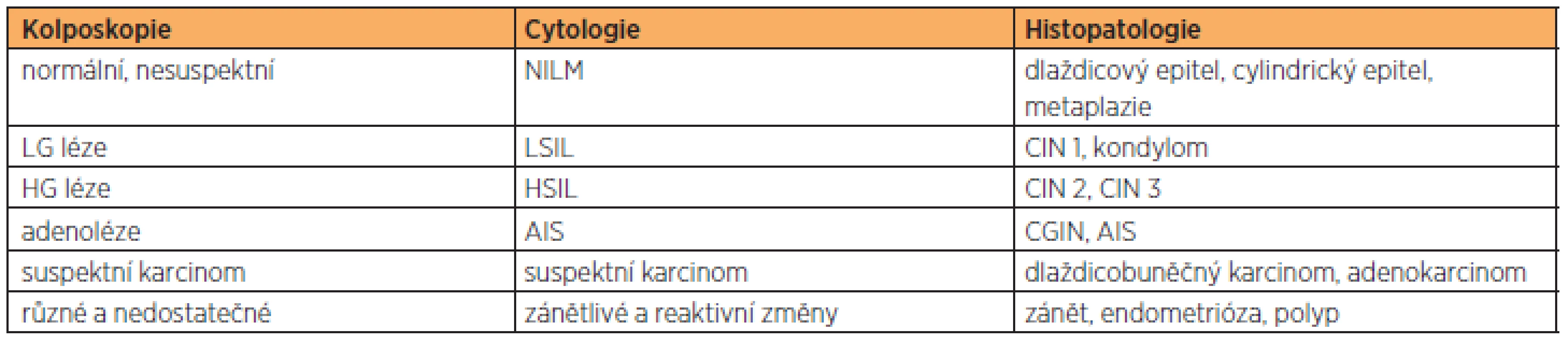
ZÁVĚR
V přehledu byl podán nástin prebioptických vyšetřovacích metod a na ně navazující diagnostiky, směřujících k detekci, verifikaci a pak eradikaci předstupňů s onkogenním potenciálem tak, jak je zamýšlí národní program prevence karcinomu děložního cervixu. Základem screeningu, vyhledávání bezpříznačných ohrožení, je pokrytí populace dospělých žen. Základní podmínkou pro další postup je kompetence odborných specialistů. Jde zejména o minimalizaci výkonů nadměrných a zbytečných (overtreatment) včetně jejich důsledků a také o správné provedení výkonů nezbytných pro ověření a léčbu cervikálních lézí.
V odbornostech, jež tu sdílejí odpovědnost, došlo ke zřetelnému sblížení terminologií, jejich zjemnění a zjednodušení k prospěchu pacientek i dalšího výzkumu, a to na základě lepšího poznání etiologie i patogeneze lézí. Užívání těchto pojmů ve vzájemné komunikaci laboratoří, klinicky působících specialistů i morfologů je pro udržení kvalit screeningového programu závazné.
MUDr. Vladimír Dvořák
Centrum ambulantní gynekologie a primární péče
Orlí 10, 602 00 Brno
e-mail: ssgcr@ti.czz
Sources
1. Berkhof, J., Bogaards, JA. Vaccination against human papillomavirus types 16 and 18: the impact on cervical cancer. Future Oncol, 2010, 6(12), p. 1817–1821.
2. Birner, P., Obermair, A., Schindl, M., et al. Selective immunohistochemical staining of blood and lymphatic vessels reveals independent prognostic influence of blood and lymphatic vessel invasion in early-stage cervical cancer. Clin Cancer Res, 2001, 7(1), p. 93–97.
3. Bulten, J., van der Laak, JA., Gemmink, JH., et al. MIB1, a promising marker for the classification of cervical intraepithelial neoplasia. J Pathol, 1996, 178(3), p. 268–273.
4. Celik, C., Gezginc, K., Toy, H., et al. A comparison of liquid-based cytology with conventional cytology. Int J Gynaecol Obstet, 2008, 100(2), p. 163–166.
5. Costa, MJ., Grimes, C., Tackett, E., et al. Cervicovaginal cytology in an indigent population. Comparison of results for 1964, 1981 and 1989. Acta Cytol, 1991, 35(1), p. 51–56.
6. Costa, S., Nuzzo, MD., Rubino, A., et al. Independent determinants of inaccuracy of colposcopically directed punch biopsy of the cervix. Gynecol Oncol, 2003, 90(1), p. 57–63.
7. Cuzick, J., Clavel, C., Petry, KU., et al. Overview of the European and North American studies on HPV testing in primary cervical cancer screening. Int J Cancer, 2006, 119(5), p. 1095–1101.
8. Herbeck, G., Ondruš, J., Dvořák, V., Mortakis, A. Atlas kolposkopie. Praha: Maxdorf, 2011.
9. Monsonego, J., Hudgens, MG., Zerat, L., et al. Evaluation of oncogenic human papillomavirus RNA and DNA tests with liquid-based cytology in primary cervical cancer screening: the FASE study. Int J Cancer, 2011, 129(3), p. 691–701.
10. Obermair, A., Wanner, C., Bilgi, S., et al. The influence of vascular space involvement on the prognosis of patients with stage IB cervical carcinoma: correlation of results from hematoxylin and eosin staining with results from immunostaining for factor VIII-related antigen. Cancer, 1998, 82(4), p. 689–696.
11. Ostor, AG. Natural history of cervical intraepithelial neoplasia: a critical review. Int J Gynecol Pathol, 1993, 12(2), p. 186–192.
12. Rob, L. Onkologická prevence v gynekologii. Mod Gynekol Porod, 2003, p. 612–694.
13. Rokyta, Z. Diagnostic reliability of prebioptic methods in the prediction of a histological basis of cervical lesions and its correlation with accuracy of colposcopically directed biopsy in patients with cervical neoplasia. Eur J Gynaecol Oncol, 2000, 21(5), p. 484–486.
14. Solomon, D., Davey, D., Kurman, R., et al. The 2001 Bethesda System: terminology for reporting results of cervical cytology. JAMA, 2002, 287(16), p. 2114–2119.
15. Stafl, A., Mattingly, RF. Angiogenesis of cervical neoplasia. Am J Obstet Gynecol, 1975, 121(6), p. 845–852.
16. Turyna, R., Sláma, J. Kolposkopie děložního hrdla. Praha: Galén, 2010.
17. Walker, P., Dexeus, S., De Palo, G., et al. International terminology of colposcopy: an updated report from the International Federation for Cervical Pathology and Colposcopy. Obstet Gynecol, 2003, 101(1), p. 175–177.
18. Waxman, AG. Low-grade squamous intraepithelial lesion. Apgar, BS., Brotzman, GL., Spitzer, M., eds. Colposcopy: principles and practice: An integrated textbook and atlas. Philadelphia: Saunders, 2002, p. 255–265.
19. WHO. Human papillomavirus infection and cervical cancer. In: www.who.int/vaccine_research/diseases/hpv/en/; 2004.
20. WHO. Pathology and genetics of tumours of the breast and female genital organs. Lyon 2005.
21. www.svod.cz.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2014 Issue 2-
All articles in this issue
- Prebioptické a bioptické metody při screeningu a diagnostice karcinomu děložního hrdla
- Ovariální epiteliální malignity v adolescentním věku
- Úloha mastných kyselin v membráně spermií
- Poloha plodu koncom panvovým - analýza výsledkov jedného perinatologického centra
- Vliv psychické odolnosti ženy na úspěšnost prvního IVF/ICSI
- Syndrom intrauterinního úmrtí plodu: analýza souboru za období 2008–2012 v Ústavu pro péči o matku dítě
- Kyselina listová a prevence rozštěpových vad centrálního nervového systému
- Využití syntetických síťových implantátů v operační léčbě sestupu pánevních orgánů
- Nové pohľady na funkčnú morfológiu klitorisu
- Směrnice ke správné laboratorní praxi při asistované reprodukci – čistota prostředí
- Vysoce účinná antiretrovirová terapie během těhotenství: vliv na těhotenství na krysím modelu
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prebioptické a bioptické metody při screeningu a diagnostice karcinomu děložního hrdla
- Syndrom intrauterinního úmrtí plodu: analýza souboru za období 2008–2012 v Ústavu pro péči o matku dítě
- Nové pohľady na funkčnú morfológiu klitorisu
- Poloha plodu koncom panvovým - analýza výsledkov jedného perinatologického centra
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career