-
Medical journals
- Career
Úloha mastných kyselin v membráně spermií
Authors: X. Štramová 1; Radek Hampl 2; J. Štěpán 2; R. Kanďár 1
Authors‘ workplace: Fakulta chemicko-technologická, Katedra biologických a biochemických věd, Univerzita Pardubice
Published in: Ceska Gynekol 2014; 79(2): 103-106
Overview
Reaktivní sloučeniny kyslíku jsou ve vhodné koncentraci důležité pro fyziologickou funkci spermií. Pokud je ale jejich množství v buňce vysoké nebo hladina antioxidantů nedostatečná, může dojít k oxidativnímu poškození buněk. Volné radikály napadají především polynenasycené mastné kyseliny ve fosfolipidové membráně spermií. Důsledkem peroxidace lipidů může být zhoršená kvalita spermií, tedy problémy s plodností.
Přehledový článek popisuje složení membrány spermatických buněk, význam mastných kyselin a možnosti prevence oxidativního poškození buněk.Klíčová slova:
membrána spermií, mastné kyseliny, mužská neplodnost, lipoperoxidace, antioxidantySLOŽENÍ MEMBRÁNY SPERMIÍ
Plazmatická membrána spermií hraje primární roli při přichycení spermie na oocyt během fertilizace. V době klesající mužské plodnosti je biochemické složení membrány intenzivně studováno. Zásadní význam pro její funkci mají především lipidy [14, 26].
Membrány spermií jsou složeny především z fosfolipidů, glykolipidů a sterolů. Fosfolipidová frakce je hlavní strukturální součástí membrán spermií. Řadíme sem fosfatidylethanolamin, fosfatidylcholin, cholinplasmalogen, ethanolaminplasmalogen, sfingomyelin, fosfatidylserin, kardiolipin, fosfatidylinositol, lysofosfatidylcholin, lysofosfatidylethanolamin a fosfatidylglycerol [9, 17, 25, 27]. Membrána lidské spermie obsahuje neobvykle vysokou hladinu lipidů s etericky vázanou mastnou kyselinou na prvním uhlíku glycerolu (plasmalogeny) a velké množství nenasycených mastných kyselin (např. dokosahexaenovou kyselinu, DHA, C22 : 6). Také sfingomyeliny jsou v membráně spermie hojně zastoupeny. Glykolipidy nepatří mezi majoritní složky membrány, avšak spermatická membrána obsahuje pro ni typický a unikátní sulfogalaktosylglycerolipid (seminolipid). Poměr cholesterol/fosfolipidy je kolem 1; velké množství cholesterolu hraje důležitou úlohu v procesu dozrávání spermií (tzv. kapacitace) [17]. Kapacitace je důležitá pro úspěšné oplodnění oocytu. Po ukončení kapacitace se struktura a fluidita plazmatické membrány spermií mění, především dochází k uvolnění cholesterolu [4].
PLASMALOGEN
Plasmalogen je speciální druh fosfolipidů se schopností okamžitě reagovat na určité podněty (nachází se např. v buňkách nervového systému a ve spermiích). Tzv. ether-linked lipidy jsou glycerofosfolipidy, které obsahují jednu alkenyletherickou skupinu na pozici sn-1 glycerolu. Cholinplasmalogen a ethanolaminplasmalogen mají specifickou molekulovou konformaci (obr. 1). Jsou zodpovědné za „hustěji sbalenou“ strukturu membrány a podílejí se na fúzi membrán při oplodnění. Cholinplasmalogen se může uplatnit při formaci nepropustných částí membrány, čímž napomáhá zvýšení stability membrány [14, 17].
Image 1. Základní struktura plasmalogenu 
VÝZNAM MASTNÝCH KYSELIN V BIOLOGICKÝCH MEMBRÁNÁCH
Mastné kyseliny, součásti fosfolipidů v biologických membránách, mají vliv na fluiditu, flexibilitu, integritu, propustnost a odolnost membrány vůči fyzikálním a chemickým vlivům [26]. Na druhou stranu, lipidy jsou hlavním substrátem lipoperoxidace, která může být důsledkem některých funkčních poruch spermií [11].
Mastné kyseliny dělíme na nasycené (SFA, saturated fatty acid) a nenasycené (MFA, monounsaturated fatty acid), popř. polynenasycené mastné kyseliny (PUFA, polyunsaturated fatty acid). Nenasycené mastné kyseliny můžeme rozdělit také podle umístění poslední dvojné vazby na omega 3 a 6 mastné kyseliny (označované také n-3, n-6). Membrány spermií obsahují jak nasycené mastné kyseliny (myristová C14 : 0, palmitová C16 : 0, stearová C18 : 0), tak nenasycené mastné kyseliny (olejová C18 : 1, linolová C18 : 2, linolenová C18 : 3). Nejdůležitější úlohu však hrají PUFA (kyselina arachidonová C20 : 4, eikosapentaenová – EPA C20 : 5, dokosahexaenová C22 : 6) [2, 11, 25–27]. Speciální skupinu mastných kyselin, které živočichové nejsou schopni syntetizovat, nazýváme esenciální (nezbytné) mastné kyseliny (EFA). Výchozími EFA jsou kyselina linolová a kyselina linolenová [30].
Struktura membrány spermií má zásadní úlohu pro úspěšné oplodnění, lipidy jsou důležité pro životaschopnost, zralost a funkci spermií. Vysoká koncentrace nenasycených mastných kyselin ovlivňuje vlastnosti membrány, včetně její fluidity a flexibility [2, 14]. PUFA jsou také prekurzory prostaglandinů a leukotrienů, které jsou důležité pro pohyblivost spermií a v procesu zánětlivých reakcí [14]. Fluidita membrány spermií a její fosfolipidové složení se v epididymis může během vývoje měnit [27].
Safarinejad a kol. popisují významné pozitivní korelace mezi hladinou n-3 FA (linolenová kyselina, eikosapentaenová kyselina, dokosahexaenová kyselina) a parametry spermiogramu (koncentrace spermií, procento pohyblivých spermií, procento normální morfologie). Naopak byly nalezeny negativní korelace mezi hladinou n-6 FA (linolová kyselina, arachidonová kyselina) a parametry spermiogramu (celkový počet spermií v ejakulátu, pohyblivost spermií, morfologie). U neplodných mužů byla zjištěna koncentrace n-3 FA nižší a n-6 FA vyšší než u plodných mužů [19].
DOKOSAHEXAENOVÁ KYSELINA
Dokosahexaenová kyselina (DHA) (obr. 2) je hlavní n-3 polynenasycenou mastnou kyselinou lidských spermií [7]. DHA má hlavní význam v regulaci fluidity spermatické membrány a její obsah se zvyšuje při migraci spermie ze semenných kanálků do cauda epididymis [18, 27]. Ve vysokých koncentracích se nachází u nezralých zárodečných buněk. Může tedy hrát i důležitou úlohu v regulaci spermatogeneze [18]. Díky vysokému počtu dvojných vazeb je DHA také hlavním substrátem pro peroxidaci, téměř z 90 %. Oxidace DHA vázané ve fosfolipidové vrstvě je hlavním faktorem, který ovlivňuje životnost spermií in vitro a může vést ke ztrátě akrozomu a oxidaci DNA [18].
Image 2. Kyselina dokosahexaenová 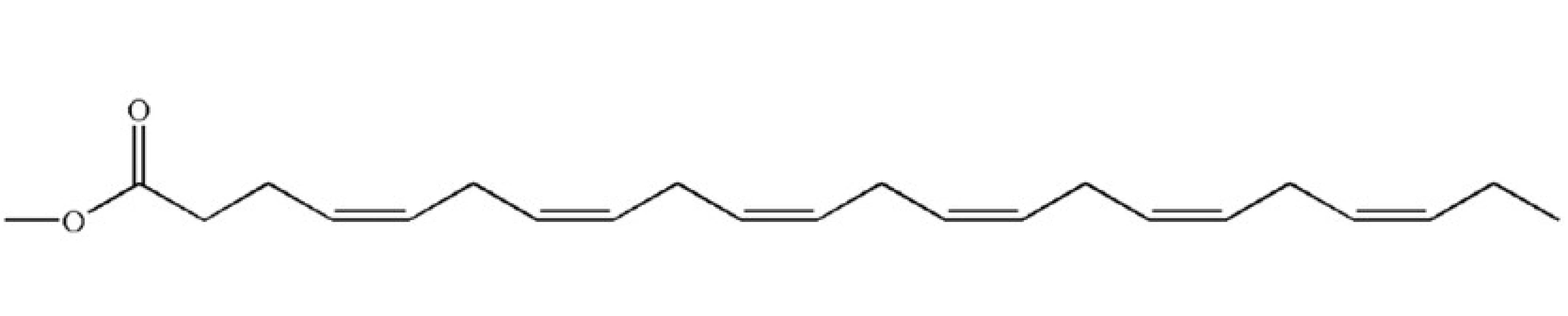
Některé studie uvádějí, že hladina DHA v ejakulátu a spermiích koreluje s jejich pohyblivostí [6, 11]. Hladina DHA v ejakulátu, spermiích i seminální plazmě byla nižší u mužů s nižší pohyblivostí spermií v porovnání se skupinou normozoospermiků. Stále není úplně jasné, jak se DHA může podílet na regulaci pohyblivosti lidských spermií: může mít význam v regulaci volných mastných kyselin, nebo může být metabolizována na jiné sloučeniny. Nejvíce se zřejmě uplatňují biofyzikální vlastnosti DHA. Podílí se na fluiditě a flexibilitě membrány, která je potřebná pro pohyb bičíku. Doplňky stravy obsahující DHA nezlepšují pohyblivost spermií [6].
PEROXIDACE LIPIDŮ
Peroxidace lipidů (LPO, lipoperoxidace) je definována jako oxidativní poškození PUFA, především těch, které obsahují více než dvě dvojné vazby. Spermie, stejně jako jiné buňky, jsou jedinečné svou strukturou, funkcí a náchylností k poškození lipoperoxidací. Spermie nejsou schopny napravit poškození způsobené nadměrnou produkcí reaktivních sloučenin kyslíku (ROS). Postrádají antioxidační enzymy v cytoplazmě, které jsou potřebné pro obnovu membrány [15]. Zvýšené hladiny ROS byly zaznamenány u 40 % neplodných mužů [21].
Pokud množství ROS překročí kapacitu obranného antioxidačního systému, dochází k tzv. oxidačnímu stresu. V určité koncentraci jsou ale ROS důležité k průběhu fyziologických procesů – kapacitace, hyperaktivace a fúze spermie-oocyt [1, 13, 28, 29]. Hlavními zdroji ROS jsou leukocyty (neutrofily, makrofágy) a nezralé spermatické buňky. Oxidační stres v buňkách, tedy i produkce ROS, může být také zvyšován životním stylem. Škodliviny z životního prostředí, kouření, infekce atd. mohou ovlivňovat kvalitu spermií [1, 22, 28].
PUFA ve fosfolipidové dvojvrstvě biologické membrány stojí za fluiditou membrány. Lipoperoxidací se fluidita membrány snižuje, inaktivují se membránové iontové kanály udržující iontovou homeostázu, mění se vlastnosti membrány, a tak se snižuje její odolnost vůči okolnímu prostředí [8, 20]. Zvýšená propustnost membrány vede ke ztrátě pohyblivosti spermie a schopnosti oplodnění. Oxidační poškození membrány a DNA spermií je hlavním patologickým mechanismem, který je příčinou neplodnosti [3, 23, 25]. Lipoperoxidace je také příčinou patogeneze mnoha onemocnění (diabetes, Parkinsonova choroba, Alzheimerova choroba, chronické zánětlivé procesy, fibróza, rakovina, ateroskleróza a mnoho dalších) [8].
PREVENCE OXIDAČNÍHO STRESU
Mužská reprodukční soustava disponuje přirozeným obranným mechanismem chránícím fosfolipidovou membránu proti oxidačnímu stresu. Jsou to antioxidační enzymy: superoxiddismutáza (SOD), glutathionperoxidáza, glutathionreduktáza a antioxidanty: kyselina askorbová (vitamin C), alfa-tokoferol (vitamin E), glutathion, aminokyseliny (taurin, hypotaurin), albumin, karnitin, karotenoidy, flavonoidy atd. [12, 25, 28]. Pokud se ale rovnováha mezi produkcí volných radikálů a kapacitou antioxidantů poruší, míra poškození buněk oxidačním stresem se zvyšuje.
Důležitým faktorem prevence oxidačního stresu je změna životního stylu. Kouření ze 48 % zvyšuje koncentraci leukocytů a ze 107 % hladinu ROS v seminální plazmě. U kuřáků byly také naměřeny nižší hladiny přirozených antioxidantů – vitaminu E, C a zvýšená hladina 8-hydroxy-2-deoxyguanosinu (8-OHdG, markeru oxidačního poškození DNA) [1, 28]. Kouření ovlivňuje morfologii, koncentraci i pohyblivost spermií v ejakulátu [16]. Také nadměrné požívání alkoholu způsobuje zvýšení oxidačního stresu. Ethanol stimuluje produkci ROS u alkoholiků [28]. Důsledkem je snížená pohyblivost a životnost spermií [16]. Deficit antioxidantů způsobený dietami a nevyváženou potravou, extrémní pohybové aktivity, psychický stres, nevhodné pracovní a životní prostředí, bakteriální a virové infekce pohlavního ústrojí a chronické záněty mohou být příčinou zvýšené produkce ROS či snížené funkce antioxidační kapacity, což vede k oxidačním procesům v buňce a způsobuje dysfunkci spermií [28].
Současný životní styl u většiny pacientů způsobuje zvýšenou produkci ROS a je také snížen příjem přirozených antioxidantů (např. v ovoci a zelenině). Proběhlo mnoho studií o vlivu doplňků stravy na kvalitu ejakulátu. K redukci hladiny ROS a zlepšení pohyblivosti a počtu spermií se využívají jak samostatné antioxidanty, tak jejich kombinace [10, 24]. Jako další doplňky stravy se mohou využít esenciální mastné kyseliny, např. v rybím tuku, lněném semínku či rostlinné extrakty. Podle WHO patří mezi nejobvyklejší doplňky karnitin, zinek, kyselina listová, tokoferol a astaxantin (lipofilní karotenoid produkovaný řasou Haematococcus pluvialis) [5].
Mgr. Xenie Štramová
Univerzita Pardubice
Fakulta chemicko-technologická
Katedra biologických a biochemických věd
Studentská 573
532 10 Pardubice
Korespondující autor
doc. Mgr. Kanďár Roman, Ph.D.
roman.kandar@upce.cz
Sources
1. Agarwal, A., Prabakaran, SA., Said, TM. Prevention of oxidative stress injury to sperm. J Androl, 2005, 26, p. 654–660.
2. Aksoy, Y., Aksoy, H., Alttinkaynak, K., et al. Sperm fatty acid composition in subfertile men. Prostaglandins Leukot Essent Fatty Acids, 2006, 75, p. 75–79.
3. Bansal, AK., Bilaspuri, GS. Impacts of oxidative stress and antioxidants on semen functions. Vet Med Int, 2011, p. 1–7.
4. Buffone, MG., Doncel, GF., Clalamera, JC., Verstraeten, SV.Capacitation-associated changes in membrane fluidity in asthenozoospermic human spermatozoa. Int J Androl, 2008, 32, p. 360–375.
5. Comhaire, FH., Mahmoud, A. The role of food supplements in the treatment of the infertile man. Reprod BioMed Online, 2003, 7, p. 385–391.
6. Conquer, JA., Martin, JB., Tummon, I., et al. Effect of DHA supplementation on DHA status and sperm motility in asthenozoospermic males. Lipids, 2000, 35, p. 149–154.
7. Conquer, JA., Martin, JB., Tummon, I., et al. Fatty acids analysis of blood serum, seminal plasma, and spermatozoa of mormozoospermic vs. asthenozoospermic males. Lipids, 1999, 34, p. 793–799.
8. Devasagayam, TPA., Boloor, KK., Ramasarma, T. Methods for estimating lipid peroxidation: An analysis of merits and demerits. Indian J Biochem Biophys, 2003, 40, p. 300–308.
9. Gulaya, NM, Margitich, VM., Govseeva, NM., Klimashev-sky, VM. Phospholipid composition of human sperm and seminal plasma in relation to sperm fertility. Arch Androl, 2001, 46, p. 169–175.
10. Henkel, RR. Leukocytes and oxidative stress: dilemma for sperm function and male infertility. Asian J Androl, 2011, 13, p. 43–52.
11. Khosrowbeygi, A., Zarghami, N., Farzadi, L. Fatty acid composition in normozoospermic, asthenozoospermic, asthenoteratozoospermic and oligoasthenoteratozoospermic ejaculates. Iran J Reprod Med, 2008, 6, p. 39–43.
12. Khosrowbeygi, A., Zarghami, N. Levels of oxidative stress biomarkers in seminal plasma and their relationship with seminal parameters. BMC Clin Pathol, 2007, 7, p. 1–6.
13. Kothari, S., Thompson, A., Agarwal, A., du Plessis, SS. Free radicals: their beneficial and detrimental effects on sperm function. Indian J Exper Biol, 2010, 48, p. 425–435.
14. Lenzi, A., Picardo, M., Gandini, L., Dondero, F. Lipids of the sperm plasma membrane: From polyunsaturated fatty acids considered as markers of sperm function to possible scavenger therapy. Hum Reprod Update, 1996, 2, p. 246–256.
15. Maneesh, M., Jayalekshmi, H. Role of reactive oxygen species and antioxidants on pathology of male reproduction. Indian J Clin Biochem, 2006, 21, p. 80–89.
16. Marinelli, D., Gaspari, L., Pedotti, P., Taioli, E. Mini-review of studies on the effect of smoking and drinking habits on semen parameters. Int J Hyg Health, 2004, 207, p. 185–192.
17. Martínez, P., Morros, A. Membrane lipid dynamics during human sperm capacitation. Front Biosci, 1996, 1, p. 103–117.
18. Ollero, M., Powers, RD., Alvarez, JG. Variation of docosahexaenoic acid content in subsets of human spermatozoa at different stages of maturation: implications for sperm lipoperoxidative damage. Mol Reprod Dev, 2000, 55, p. 326–334.
19. Safarinejad, MR., Hosseini, SY., Dadkhah, F., Asgari, AM. Relationship of omega-3 and omega-6 fatty acids with semen characteristics, and anti-oxidant status seminal plasma: A comparison between fertile and infertile men. Clin Nutr, 2010, 29, p. 100–105.
20. Sanocka, D., Kurpisz, M. Reactive oxygen species and sperm cells. Reprod Biol Endocrinol, 2004, 2, p. 1–7.
21. Shiva, M., Gautam AK., Verma, Y., et al. Association between sperm quality, oxidative stress, and seminal antioxidant activity. Clin Biochem, 2011, 44, p. 319–324.
22. Sikka, SC., Rajasekaran, M., Hellstrom, WJG. Role of oxidative stress and antioxidants in male infertility. J Androl, 1995, 16, p. 464–468.
23. Storey, BT. Biochemistry of the induction and prevention of lipoperoxidative damage in human spermatozoa. Mol Hum Reprod, 1997, 3, p. 203–213.
24. Suleiman, SA., Ali, ME., Zaki, ZMS., et al. Lipid peroxidation and human sperm motility. Protective role of vitamin E. J Androl, 1996, 17, p. 530–537.
25. Tavilani, H. Relationship between seminal antioxidant enzymes and the phospholipid and fatty acid composition of spermatozoa. Reprod Biomed Online, 2008, 16, p. 649–656.
26. Tavilani, H., Doosti, M., Abdi, K., et al. Decreased polyunsaturated and increased saturated fatty acid concentration in spermatozoa from asthenozoospermic males as compared with normozoospermic males. Andrologia, 2006, 38, p. 173–178.
27. Tavilani, H., Doosti, M., Nourmohammadi, I., et al. Lipid composition of spermatozoa in normozoospermic and asthenozoospermic males. Prostaglandins Leukot Essent Fatty Acids, 2007, 77, p. 45–50.
28. Tremellen, K. Oxidative stress and male infertility – a clinical perspective. Hum Reprod Update, 2008, 14, p. 248–258.
29. Zalata, AA., Christophe, AB., Depuydt, CE., et al. The fatty acid composition of phospholipids of spermatozoa from infertile patients. Mol Hum Reprod, 1998, 4, p. 111–118.
30. Žák, A., Tvrzická, E., Zeman, M., Vecka, M. Patofyziologie a klinický význam vícenenasycených mastných kyselin řady n-3. Čas Lék čes, 2005, 144, s. 6–18.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2014 Issue 2-
All articles in this issue
- Prebioptické a bioptické metody při screeningu a diagnostice karcinomu děložního hrdla
- Ovariální epiteliální malignity v adolescentním věku
- Úloha mastných kyselin v membráně spermií
- Poloha plodu koncom panvovým - analýza výsledkov jedného perinatologického centra
- Vliv psychické odolnosti ženy na úspěšnost prvního IVF/ICSI
- Syndrom intrauterinního úmrtí plodu: analýza souboru za období 2008–2012 v Ústavu pro péči o matku dítě
- Kyselina listová a prevence rozštěpových vad centrálního nervového systému
- Využití syntetických síťových implantátů v operační léčbě sestupu pánevních orgánů
- Nové pohľady na funkčnú morfológiu klitorisu
- Směrnice ke správné laboratorní praxi při asistované reprodukci – čistota prostředí
- Vysoce účinná antiretrovirová terapie během těhotenství: vliv na těhotenství na krysím modelu
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prebioptické a bioptické metody při screeningu a diagnostice karcinomu děložního hrdla
- Syndrom intrauterinního úmrtí plodu: analýza souboru za období 2008–2012 v Ústavu pro péči o matku dítě
- Nové pohľady na funkčnú morfológiu klitorisu
- Poloha plodu koncom panvovým - analýza výsledkov jedného perinatologického centra
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

