-
Medical journals
- Career
Vliv nadváhy na úspěšnost technik asistované reprodukce u neplodných žen
Authors: M. Čedíková 1,2; V. Babuška 3; P. Lhotská 1; P. Lošan 1; N. H. Zech 4; M. Králíčková 1,2,5; Z. Novotný 5
Authors‘ workplace: Ústav histologie a embryologie LF UK, Plzeň, přednostka doc. MUDr. M. Králíčková, Ph. D. 1; Biomedicínské centrum LF UK, Plzeň, vědecký ředitel doc. MUDr. M. Štengl, Ph. D. 2; Ústav lékařské chemie a biochemie, LF UK, Plzeň, přednosta prof. MUDr. J. Racek, DrSc. 3; Institut reprodukční medicíny a endokrinologie, IVF centrum Prof. Zecha, Plzeň, přednosta Univ. Doz. Dr. med. Nicolas H. Zech 4; Gynekologicko-porodnická klinika LF UK a FN, Plzeň, přednosta doc. MUDr. Z. Novotný, CSc. 5
Published in: Ceska Gynekol 2014; 79(1): 16-21
Overview
Cíl studie:
Obezita i nadváha negativně ovlivňují schopnost ženy přirozeně otěhotnět, podílí se na zvýšeném výskytu porodnických komplikací v průběhu těhotenství a negativně ovlivňují i výsledek technik asistované reprodukce (ART). Cílem naší práce bylo porovnat výsledky léčby neplodnosti u skupiny neplodných žen podstupujících ART v závislosti na hodnotách jejich BMI a změny hladin vybraných hormonů a markerů oxidačního stresu ve folikulární tekutině.Typ studie:
Retrospektivní komparativní studie.Název a sídlo pracoviště:
LF UK, Plzeň; Institut reprodukční medicíny a endokrinologie, IVF Centrum Prof. Zecha, Plzeň.Metodika:
Studovaný soubor tvořilo 44 žen (průměrný věk 31,9 let, SD = 4,35) léčených pro neplodnostv Institutu reprodukční medicíny a endokrinologie – IVF Centrum Prof. Zecha. Ženy byly rozděleny do dvou skupin podle hodnoty BMI (37 žen mělo normální BMI, 7 žen mělo nadváhu). Hladiny prolaktinu, volného T3 a T4 hormonu, homocysteinu, malondialdehydu, glutathionperoxidázy (GPx), celkové antioxidační kapacity a celkové bílkoviny byly analyzovány ve folikulární tekutině u obou sledovaných skupin. U každé ženy byly použity vzorky folikulární tekutiny bez příměsi krvea ze všech foliklů dohromady, tedy ze společného poolu.Výsledky:
Pozorována byla jen signifikantně nižší hladina GPx u skupiny žen s nadváhou (p = 0,0044). V úspěšnosti pregnancy rate se ženy s normálním BMI a ženy trpící nadváhou od sebe významně nelišily(p = 0,4430).Závěr:
Naše studie nepotvrdila negativní efekt nadváhy na výsledky léčby neplodnosti, konkrétně pregnancy rate u skupiny neplodných žen podstupujících léčbu pomocí technik asistované reprodukce.Klíčová slova:
folikulární tekutina – obezita – nadváha – neplodnostÚVOD
V současnosti trpí obezitou či nadváhou více než 1,4 miliardy lidí ve věku vyšším než 20 let. Jde o celosvětovou epidemii. Nadváhu a obezitu definujeme jako nadměrné nebo abnormální ukládání tuku, které může negativně ovlivňovat zdraví. Body mass index (BMI) je jednoduchý index, který se běžně užívá ke klasifikaci nadváhy a obezity u dospělých. K výpočtu slouží vzorec, kde čitatelem je tělesná hmotnost v kilogramech [kg] a jmenovatelem druhá mocnina výšky v metrech [m]. Výsledkem je hodnota v jednotkáchkg/m2. V klinické praxi je doplňován dalšími testy, např. měřením obvodu pasu, bioimpedancí či vyšetřením pomocí kaliperačních kleští. Podle Světové zdravotnické organizace (WHO) je BMI kategorizován na podváhu (BMI < 18,49 kg/m2), normální váhu (BMI 18,5–24,9 kg/m2), nadváhu (BMI ≥ 25 kg/m2) a obezitu (mírná obezita BMI ≥ 30 kg/m2, střední obezita BMI ≥ 35 kg/m2 a morbidní obezita BMI ≥ 40 kg/m2) [45]. Obezita i nadváha negativně ovlivňují vznik kardiovaskulárních onemocnění, nádorových onemocnění, diabetu, ale velkou měrou se podílí i na porodnických komplikacích těhotenství [32]. Obézní ženy mají častější komplikace v průběhu těhotenství, zvláště pak ve třetím trimestru. Patří k nim hypertenze [38], preeklampsie [12, 28], gestační diabetes [10, 37], kongenitální abnormality [18, 40, 43], vyšší fetální a novorozenecká úmrtnost [21, 32], makrosomie [11, 38], ale také častější výskyt infekce močových cest, tromboembolických komplikací [10] či komplikací při anestezii a chirurgickém výkonu [19, 31]. Dále se obezita může podílet na selhání technik asistované reprodukce [20, 36], s čímž souvisí i celkové negativní ovlivnění psychiky ženy.
V některých studiích se však negativní efekt vyššího BMI na výsledky léčby neplodnosti metodami ART (techniky asistované reprodukce) neprokázal [5, 9, 23, 25, 42, 44].
Cílem této práce bylo porovnat výsledky léčby neplodnosti, konkrétně pregnancy rate u skupiny neplodných žen podstupujících ART v závislosti na hodnotách jejich BMI a změny hladin vybraných hormonů a markerů oxidačního stresu. Ze skupiny hormonů se sledoval prolaktin, hormony štítné žlázy (volný T3 a volný T4), a jako markery oxidačního stresu byly zvoleny homocystein (Hcy), malonyldialdehyd (MDA), glutathionperoxidáza (GPx), celková antioxidační kapacita (AOK) a celková bílkovina (CB). Všechny tyto parametry byly sledovány ve folikulární tekutině (FT), jejíž biochemické složení hraje zásadní roli pro kvalitu oocytu, zvláště pro jeho schopnost fertilizace a následný vývoj embrya (popis současného stavu těchto markerů ve FT jsme podali v předchozích publikacích [4, 8]).
SOUBOR A METODIKA
Studovaný soubor tvořilo 44 žen (průměrný věk 31,9 let, SD = 4,35) léčených pro neplodnost v Institutu reprodukční medicíny a endokrinologie – IVF Centrum Prof. Zecha, Plzeň. Příčiny neplodnosti byly následující: u 13,64 % žen ovariální faktor, ve 22,73 % tubární faktor, endometrióza se vyskytovala u 11,37 % žen, andrologický faktor u 27,27 % žen a u 25 % žen nebyla popsána příčina neplodnosti, šlo o tzv. idiopatickou infertilitu. Všechny sledované ženy měly normální hladiny prolaktinu i hormonů štítné žlázy v krvi. Neplodné ženy byly rozděleny do dvou skupin podle hodnoty BMI (37 žen mělo normální BMI, u 7 žen byla přítomna nadváha). Po detailním seznámení s problematikou studie, vyplnění dotazníku a po podpisu informovaného souhlasu byla ženám odebírána FT v době odběru oocytů v rámci jejich léčby neplodnosti metodami asistované reprodukce. Vyšetřovány byly tzv. pooly FT, tedy směs ze všech folikulů, u nichž nedošlo ke kontaminaci krví v průběhu odběru oocytů. Ve FT byly stanoveny hladiny prolaktinu, volného T3 (fT3), volného T4 (fT4), homocysteinu, malonyldialdehydu, glutathionperoxidázy, celkové antioxidační kapacity a celkové bílkoviny. Tyto parametry byly korelovány s hodnotou BMI žen. Sledována byla i úspěšnost fertilizace u neplodných žen v závislosti na BMI.
Metoda stanovení hormonů prolaktinu a volného T3 a T4 byla založena na sendvičovém principu elektrochemiluminiscenční imunoanalýzy (ECLIA) s využitím kitů Prolactine II, FT3 a FT4 (ROCHE Diagnostics, ČR) na přístroji Cobas e411. Hladina Hcy byla stanovena enzymaticky kitem Liquid Stable (LS) 2-Part Homocysteine Reagent (Axis-Shield Diagnostics Ltd., UK) na přístroji Olympus AU400. Na stejném přístroji byla měřena i hodnota GPx (kit RANSEL, Randox Laboratories Ltd., UK) a AOK (kit TAS, Randox Laboratories Ltd., UK). Hladina MDA byla stanovena po reakci s kyselinou thiobarbiturovou (TBA) v kyselém prostředí za vzniku barevného produktu, který byl po extrakci n-butanolem měřen při 532 nm za použití ELISA-readeru. Celková bílkovina (CB) a peptidy poskytují s biuretovým činidlem fialový komplex vhodný k fotometrickému stanovení. Absorbance byla stanovena při 546 nm na analyzátoru Olympus AU 2700 soupravou TP 300 (Lachema, CZ).
Tato studie byla schválena etickou komisí LF UK v Plzni a všechny pacientky podepsaly informovaný souhlas.
Statistické hodnocení
Výsledky se statisticky hodnotily pomocí neparametrického Mannova-Whitneyho U testu a Fischerova přesného testu. Hodnoty p < 0,05 byly považovány za statisticky signifikantní.
VÝSLEDKY
Porovnávány byly hladiny prolaktinu, volného T3 a volného T4, homocysteinu, malonyldialdehydu, glutathionperoxidázy, celkové antioxidační kapacity a celkové bílkoviny v závislosti na hodnotě BMI. Jak je zřejmé z tabulky 1, hladiny sledovaných parametrů se mezi sebou výrazně nelišily. Pozorována byla jen signifikantně nižší hladina GPx u skupiny žen s nadváhou (p = 0,0044) (obr. 1). V úspěšnosti pregnancy rate se ženy s normálním BMI a ženy trpící nadváhou od sebe významně nelišily (p = 0,4430).
Table 1. Hladiny prolaktinu, volného T3, volného T4, HCy, MDA, GPx, AOK a CB ve folikulární tekutině neplodných žen s normálním BMI a nadváhou (BMI ≥ 25 kg/m<sup>2</sup>) (hodnoty jsou uvedeny jako průměr a směrodatná odchylka) 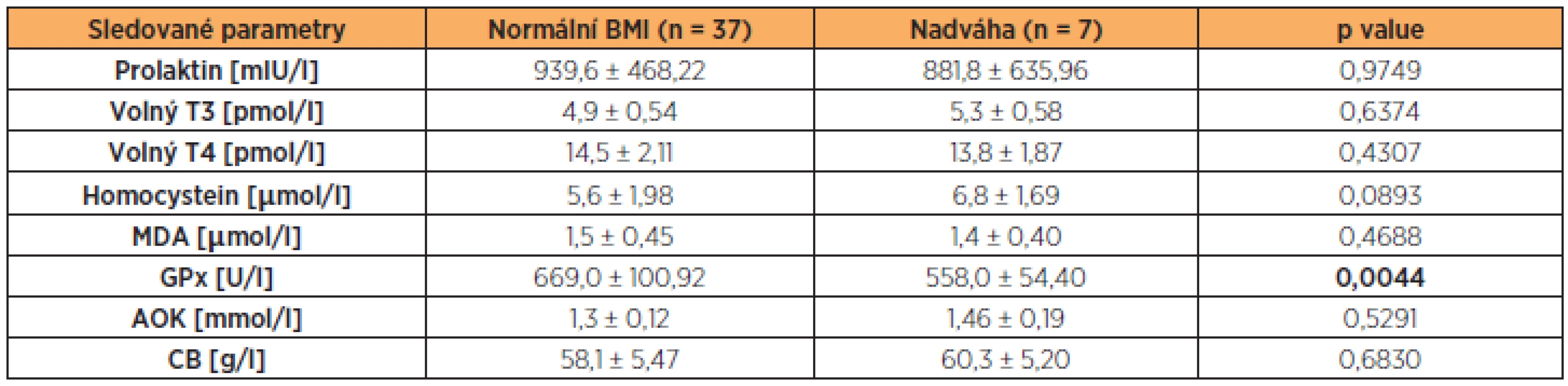
Image 1. Srovnání hladin GPx u skupiny s normálním BMI a nadváhou 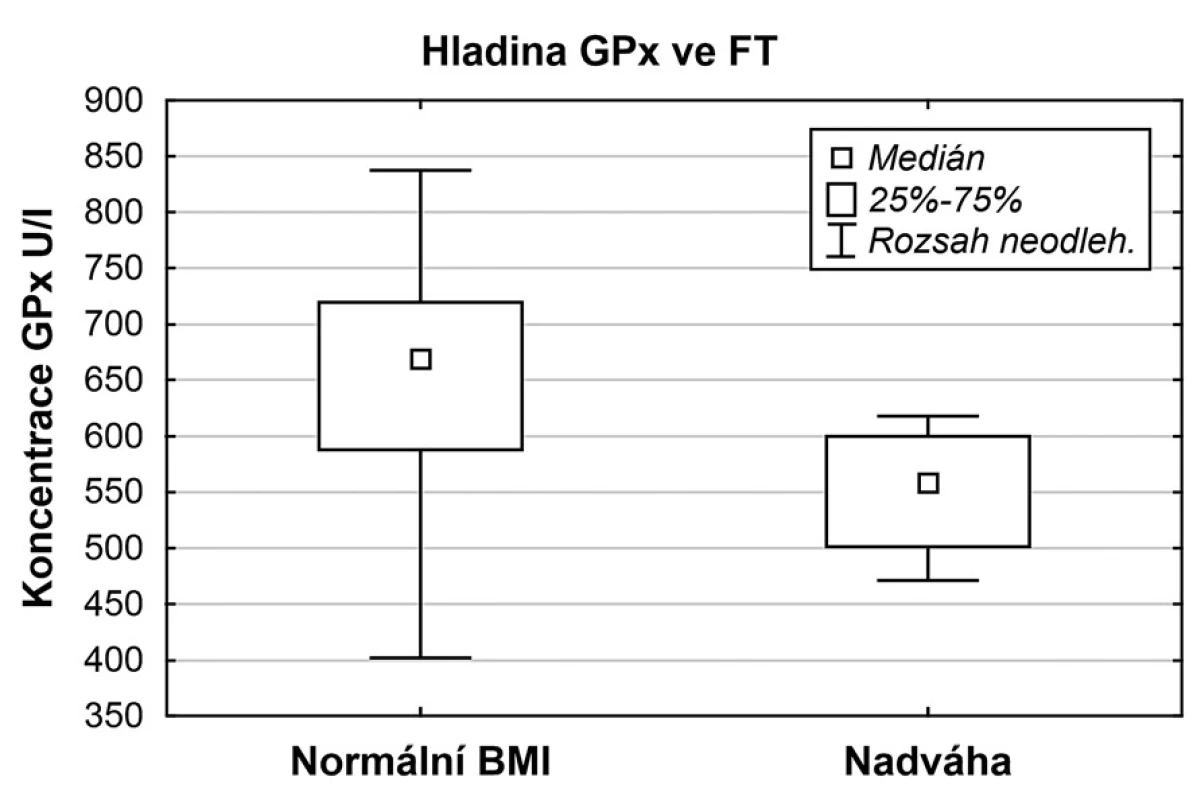
Hladiny sledovaných markerů a úspěšnost otěhotnění však mohla být ovlivněna skupinou žen, u kterých byl příčinou neplodnosti andrologický faktor. V naší skupině bylo těchto žen 27,27 %(n = 12). Po vyřazení těchto žen a opětovné analýze výsledků se zjistilo, že u žen trpících nadváhou můžeme pozorovat signifikantně vyšší hodnotu volného T3 (p = 0,0134) a nižší hladinu GPx(p = 0,0466) ve FT. Tyto výsledky dokumentuje tabulka 2 a obrázky 2 a 3. V úspěšnosti pregnancy rate se však ani tyto dvě skupiny významně nelišily (p = 0,6290).
Table 2. Hladiny prolaktinu, volného T3, volného T4, HCy, MDA, GPx, AOK a CB ve folikulární tekutině neplodných žen s normálním BMI a nadváhou (BMI ≥ 25 kg/m<sup>2</sup>) po vyřazení žen s andrologickou příčinou neplodnosti (hodnoty jsou uvedeny jako průměr a směrodatná odchylka) 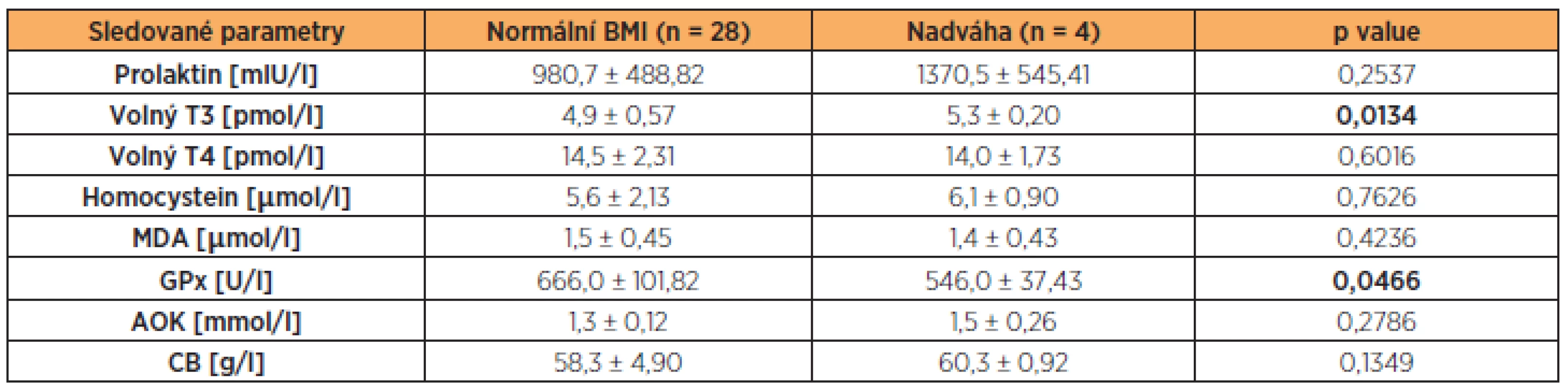
Image 2. Srovnání hladin volného T3 u skupiny žen s normálním BMI a nadváhou po vyřazení pacientek s andrologickou příčinou neplodnosti 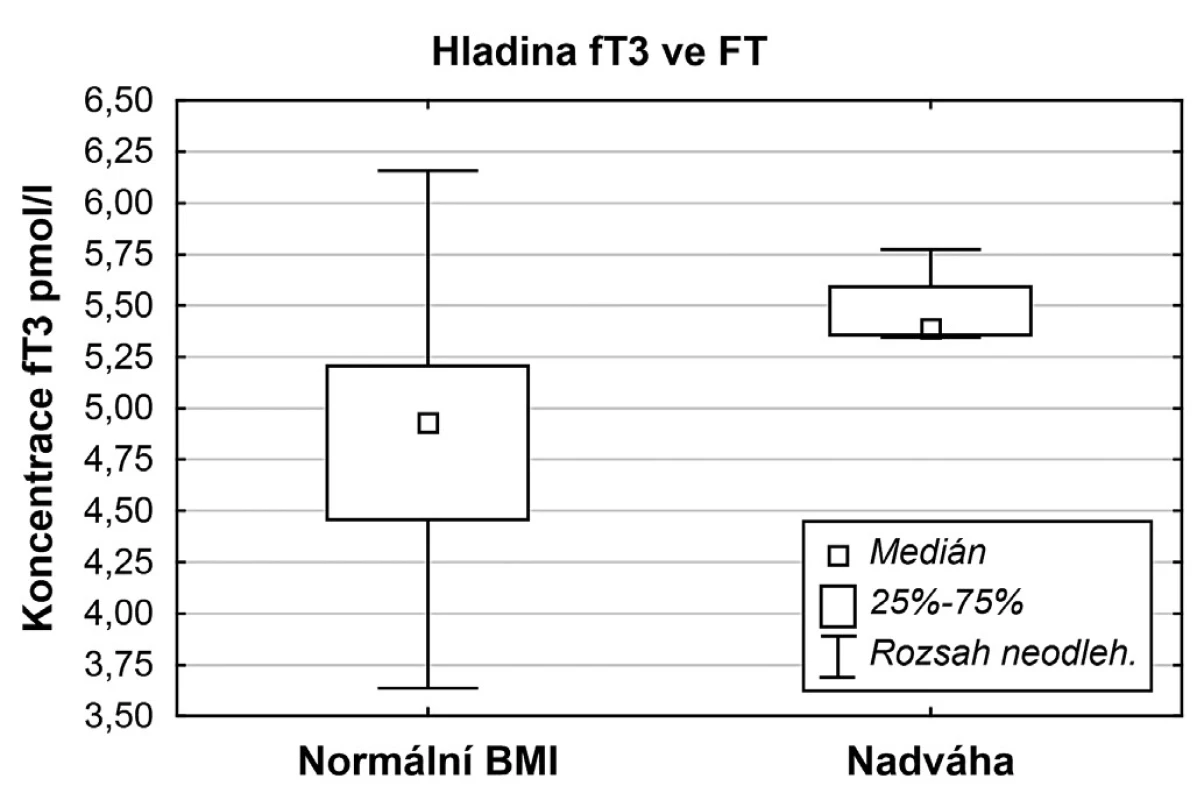
Image 3. Srovnání hladin GPx u skupiny žen s normálním BMI a nadváhou po vyřazení pacientek s andrologickou příčinou neplodnosti 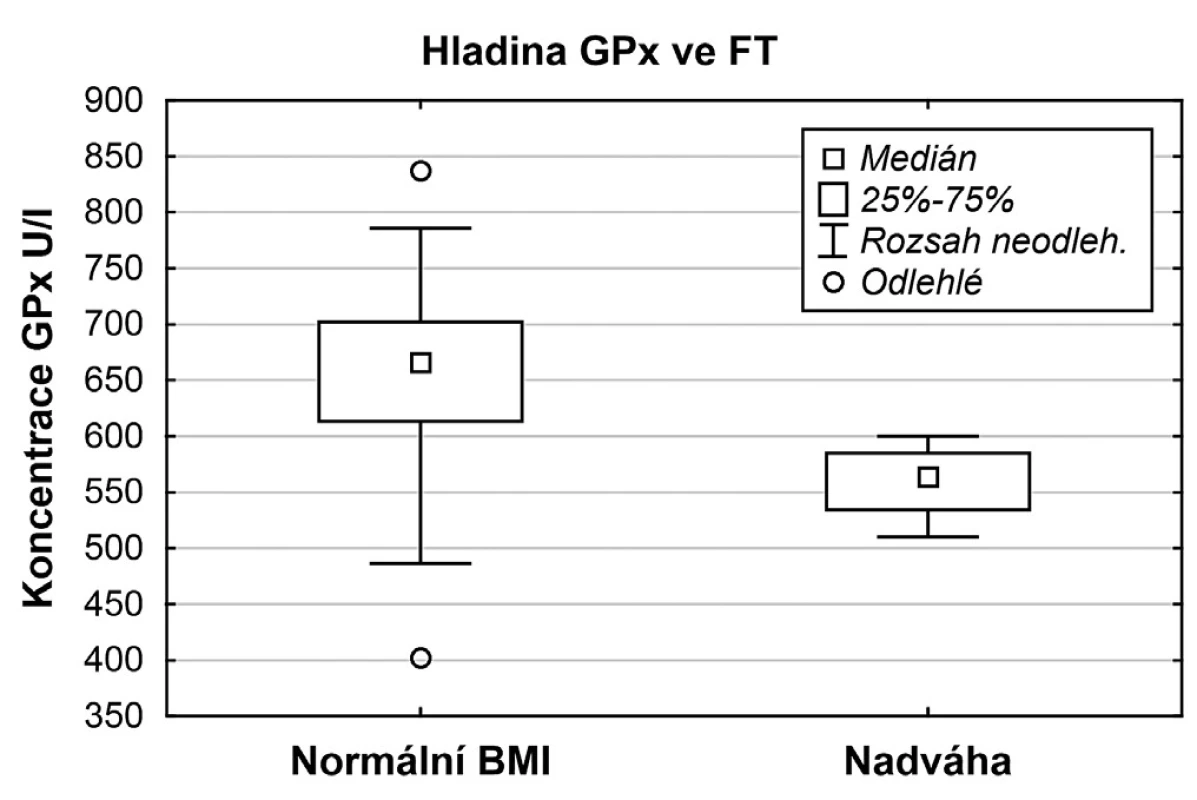
DISKUSE
Obezita s nadváhou se šíří světem jako epidemie. Obezita, tedy BMI ≥ 30 kg/m2,ovlivňuje fyziologické funkce mnoha tkání a orgánů. V důsledku toho mají obézní ženy problémy s přirozeným otěhotněním a obrací se na centra specializující se na léčbu neplodnosti. Tento jev je zvýšeně sledován v průběhu posledních dvaceti let, a to zvláště ve vyspělých zemích.
O mechanismu, jakým přítomnost obezity negativně ovlivňuje reprodukční schopnosti ženy, není zatím příliš známo. Předpokládá se souvislost s poruchou metabolismu steroidů, sekrecí a působením inzulinu či adipokinů. Tyto změny mohou ovlivňovat růst folikulů, vývoj embrya i jeho implantaci, a to jak za přirozených podmínek, tak po ART [5, 7, 26]. Důležitým faktorem je také výskyt obezity již v adolescentním věku ženy. Právě změny ve váze a tělesné konstituci v tomto kritickém životním období mohou ovlivnit endokrinní regulaci puberty, a tím i správný vývoj reprodukčního systému [13, 30].
Většina prací zabývajících se obezitou a neplodností zdůrazňuje negativní efekt vyššího BMI na implantaci a kvalitu embrya, na úspěšnost fertilizace, incidenci potratů, průběh těhotenství a pregnancy rate [5, 14, 22, 27, 36, 39, 41].
Výsledky naší studie podporují hypotézu, že negativní efekt vyššího BMI začíná až u BMI nad 30 kg/m2 [5, 9, 23, 25, 27, 29, 42, 44].
V naší skupině jsme zaznamenali nižší hladiny GPx u žen s vyšším BMI. Nižší hladiny cytoprotektivních enzymů jsou pozorovány nejen u žen s vyššími hodnotami BMI [1, 2, 24] a u pacientek s diabetes mellitus [17], ale například i v seminální plazmě některých neplodných mužů, kde nižší hladina tohoto protektivního enzymu způsobuje vyšší peroxidaci lipidů, a tím ztrátu motility spermií [3, 16]. K úpravě snížené hladiny GPx u žen s nadváhou dochází po dosažení normálních hodnot BMI [6].
Zvýšenou hladinu volného T3 hormonu nacházíme častěji u žen trpících nadváhou a obezitou [33]. Stejné výsledky ukazuje i naše práce, kde hladina volného T3 hormonu byla signifikantně vyšší u žen s BMI nad 25 kg/m2. Oproti ostatním pracím, kde byl volný T3 stanovován ze séra, jsme však tuto rozdílnou hladinu prokázali ve FT. Mechanismus vzrůstu hladiny hormonu není prozatím znám, ví se však, že jeho hladina se normalizuje při snížení váhy a nejspíše souvisí s metabolismem leptinu [33–35].
ZÁVĚR
Naše studie prokázala vyšší hladinu volného T3 hormonu a nižší hladinu cytoprotektivního enzymu GPx ve FT u žen s vyšším BMI oproti ženám s nižším BMI. Nepotvrdil se však negativní efekt nadváhy na pregnancy rate neplodných žen. Limitací závěrů z naší studie je relativně malý počet pacientek ve skupině s nadváhou.
Předložené výsledky jsou založeny na analýzách poolů FT, hodláme je ale dále zpřesnit sledováním hladin hormonů a markerů oxidačního stresu v monofolikulárních vzorcích.
Tato studie je podporována projektem OP VaVpI PO 2 Biomedicínské centrum ED2.1.00/03.0076, programem rozvoje vědních oblastí na Karlově univerzitě (projekt P36), grantem GA UK 696212, projektem specifického vysokoškolského výzkumu SVV 266 802 a projektem IGA MZ NT 14330-3/2013.
MUDr. Miroslava Čedíková
Ústav histologie a embryologie
LF UK
Karlovarská 48
301 00 Plzeň
e-mail: miroslava.cedikova@lfp.cuni.cz
Sources
1. Agarwal, A., Gupta, S., Sharma, R. Oxidative stress and its implications in female infertility – a clinician’s perspective. Reprod Biomed Online, 2005, 11, 5, p. 641–650.
2. Alpay, Z., Saed, GM., Diamond, MP. Female infertility and free radicals: potential role in adhesions and endometriosis. J Soc Gynecol Investig, 2006, 13, 6, p. 390–398.
3. Alvarez, JG., Storey, BT. Role of glutathione peroxidase in protecting mammalian spermatozoa from loss of motility caused by spontaneous lipid peroxidation. Gamete Res, 1989, 23, 1, p. 77–90.
4. Babuška, V., Cedíková, M., Rajdl, D., et al. Comparison of selective oxidative stress parameters in the follicular fluid of infertile women and healthy fertile oocyte donors. Ces Gynek, 2012, 77, 6, p. 543–548.
5. Bellver, J., Ayllón, Y., Ferrando, M., et al. Female obesity impairs in vitro fertilization outcome without affecting embryo quality. Fertil Steril, 2010, 93, 2, p. 447–454.
6. Bougoulia, M., Triantos, A., Koliakos, G. Plasma interleukin-6 levels, glutathione peroxidase and isoprostane in obese women before and after weight loss. Association with cardiovascular risk factors. Horm Athens Greece, 2006, 5, 3, p. 192–199.
7. Budak, E., Fernández Sánchez, M., Bellver, J., et al. Interactions of the hormones leptin, ghrelin, adiponectin, resistin, and PYY3-36 with the reproductive system. Fertil Steril, 2006, 85, 6, p. 1563–1581.
8. Cedíková, M., Babuška, V., Rajdl, D., et al. Comparison of prolactin, free T3 and free T4 levels in the follicular fluid of infertile women and healthy fertile oocyte donors. Ces Gynek, 2012, 77, 5, p. 471–476.
9. Dechaud, H., Anahory, T., Reyftmann, L., et al. Obesity does not adversely affect results in patients who are undergoing in vitro fertilization and embryo transfer. Eur J Obstet Gynecol Reprod Biol, 2006, 127, 1, p. 88–93.
10. Edwards, LE., Hellerstedt, WL., Alton, IR., et al. Pregnancy complications and birth outcomes in obese and normal-weight women: effects of gestational weight change. Obstet Gynecol, 1996, 87, 3, p. 389–394.
11. Ehrenberg, HM., Mercer, BM., Catalano, PM. The influence of obesity and diabetes on the prevalence of macrosomia. Am J Obstet Gynecol, 2004, 191, 3,p. 964–968.
12. Eskenazi, B., Fenster, L., Sidney, S. A multivariate analysis of risk factors for preeclampsia. J Am Med Assoc, 1991, 266, 2, p. 237–241.
13. Farooqi, IS., Jebb, SA., Langmack, G., et al. Effects of recombinant leptin therapy in a child with congenital leptin deficiency.N Engl J Med, 1999, 341, 12, p. 879–884.
14. Ferlitsch, K., Sator, MO., Gruber, DM., et al. Body mass index, follicle-stimulating hormone and their predictive value in in vitro fertilization. J Assist Reprod Genet, 2004, 21, 12, p. 431–436.
15. Garrouste-Orgeas, M., Troché, G., Azoulay, E., et al. Body mass index. Intensive Care Med, 2004, 30, 3, p. 437–443.
16. Giannattasio, A., De Rosa, M., Smeraglia, R., et al. Glutathione peroxidase (GPX) activity in seminal plasma of healthy and infertile males. J Endocrinol Invest, 2002, 25, 11, p. 983–986.
17. Goyal, R., Singhai, M., Faizy, AF. Glutathione peroxidase activity in obese and nonobese diabetic patients and role of hyperglycemia in oxidative stress. J -Life Heal, 2011, 2, 2, p. 72–76.
18. Honein, MA., Moore, CA., Watkins, ML. Subfertility and prepregnancy overweight/obesity: possible interaction between these risk factors in the etiology of congenital renal anomalies. Birt Defects Res A Clin Mol Teratol, 2003, 67, 8, p. 572–577.
19. Hood, DD., Dewan, DM. Anesthetic and obstetric outcome in morbidly obese parturients. Anesthesiology, 1993, 79, 6, p. 1210–1218.
20. Koning, AMH., Mutsaerts, MA., Kuchenbecher, WKH., et al. Complications and outcome of assisted reproduction technologies in overweight and obese women. Hum Reprod, 2012, 27, 2, p. 457–467.
21. Kristensen, J., Vestergaard, M., Wisborg, K., et al. Pre-pregnancy weight and the risk of stillbirth and neonatal death. Int J Obstet Gynaecol, 2005, 112, 4, p. 403–408.
22. Kuchenbecker, WKH., Ruifrok, AE., Bolster, JHT., et al. Subfertility in overweight women. Ned Tijdschr Geneeskd, 2006, 150, 45, p. 2479–2483.
23. Lashen, H., Ledger, W., Bernal, AL., Barlow, D. Extremes of body mass do not adversely affect the outcome of superovulation and in-vitro fertilization. Hum Reprod, 1999, 14, 3, p. 712–715.
24. Lee, YS., Kim, AY., Choi, JW., et al. Dysregulation of adipose glutathione peroxidase 3 in obesity contributes to local and systemic oxidative stress. Mol Endocrinol Baltim Md, 2008, 22, 9, p. 2176–2189.
25. Matalliotakis, I., Cakmak, H., Sakkas, D., et al. Impact of body mass index on IVF and ICSI outcome: a retrospective study. Reprod Biomed Online, 2008, 16, 6, p. 778–783.
26. Mitchell, M., Armstrong, DT., Robker, RL., Norman, RJ. Adipokines: implications for female fertility and obesity. Reprod Camb Engl, 2005, 130, 5, p. 583–597.
27. Moragianni, VA., Jones, S-ML., Ryley, DA. The effect of body mass index on the outcomes of first assisted reproductive technology cycles. Fertil Steril, 2012, 98, 1, p. 102–108.
28. O’Brien, TE., Ray, JG., Chan, W-S. Maternal body mass index and the risk of preeclampsia: a systematic overview. Epidemiol Camb Mass, 2003, 14, 3, p. 368–374.
29. Pasquali, R., Patton, L., Gambineri, A. Obesity and infertility. Curr Opin Endocrinol Diabetes Obes, 2007, 14, 6, p. 482–487.
30. Pelusi, C., Pasquali, R. Polycystic ovary syndrome in adolescents: pathophysiology and treatment implications. Treat Endocrinol, 2003, 2, 4, p. 215–230.
31. Perlow, JH., Morgan, MA. Massive maternal obesity and perioperative cesarean morbidity. Am J Obstet Gynecol, 1994, 170, 2, p. 560–565.
32. Ramachenderan, J., Bradford, J., McLean, M. Maternal obesity and pregnancy complications: a review. Aust N Z J Obstet Gynaecol, 2008, 48, 3, p. 228–235.
33. Reinehr, T. Obesity and thyroid function. Mol Cell Endocrinol, 2010, 316, 2, p. 165–171.
34. Reinehr, T., Andler, W. Thyroid hormones before and after weight loss in obesity. Arch Dis Child, 2002, 87, 4, p. 320–323.
35. Reinehr, T., Isa, A., de Sousa, G., et al. Thyroid hormones and their relation to weight status. Horm Res, 2008, 70, 1, p. 51–57.
36. Rittenberg, V., Sobaleva, S., Ahmad, A., et al. Influence of BMI on risk of miscarriage after single blastocyst transfer. Hum Reprod, 2011, 26, 10, p. 2642–2650.
37. Roberts, JM., Lain, KY. Recent Insights into the pathogenesis of pre-eclampsia. Placenta, 2002, 23, 5, p. 359–372.
38. Sebire, NJ., Jolly, M., Harris, JP., et al. Maternal obesity and pregnancy outcome: a study of 287,213 pregnancies in London. Int J Obes Relat Metab Disord, 2001, 25, 8, p. 1175–1182.
39. Shah, DK., Missmer, SA., Berry, KF., et al. Effect of obesity on oocyte and embryo quality in women undergoing in vitro fertilization. Obstet Gynecol, 2011, 118, 1, p. 63–70.
40. Shaw, GM., Velie, EM., Schaffer, D. Risk of neural tube defect-affected pregnancies among obese women. J Am Med Assoc, 1996, 275, 14, p. 1093–1096.
41. Van der Steeg, JW., Steures, P., Eijkemans, MJC., et al. Obesity affects spontaneous pregnancy chances in subfertile, ovulatory women. Hum Reprod, 2008, 23, 2, p. 324–328.
42. Styne-Gross, A., Elkind-Hirsch, K., Scott, RT. Jr. Obesity does not impact implantation rates or pregnancy outcome in women attempting conception through oocyte donation. Fertil Steril, 2005, 83, 6, p. 1629–1634.
43. Watkins, ML., Rasmussen, SA., Honein, MA., et al. Maternal obesity and risk for birth defects. Pediatrics, 2003, 111, 5, p. 1152–1158.
44. Winter, E., Wang, J., Davies, MJ., Norman, R. Early pregnancy loss following assisted reproductive technology treatment. Hum Reprod, 2002, 17, 12, p. 3220–3223.
45. WHO. Obesity and overweight. In: WHO. http://www.who.int/mediacentre/factsheets/fs311/en/index.html. Accessed 1 Jul 2013.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology
2014 Issue 1-
All articles in this issue
- Detekce nádorových kmenových buněk karcinomu ovaria
- Stav vývoje kontracepčního vakcinogenu
- Vliv nadváhy na úspěšnost technik asistované reprodukce u neplodných žen
- Funkce mitochondrií ve spermii u mužů s normozoospermií a astenozoospermií
- Stav orálního zdraví u žen s fyziologickým a rizikovým těhotenstvím
- Závažné pooperační krvácení po operaci prolapsu pochvy po hysterektomii s užitím systému Total Prolift – kazuistika
- Syndrom úplné androgenní insenzitivity – kazuistika
- Výsledky perinatální péče o těhotné s diabetem v západních Čechách
- Vyšetření bodových mutací v genu pro interleukin-11 v populaci neplodných žen a plodných kontrol
- Národní registr komplikací gynekologické laparoskopie ČR –první zkušenosti s elektronickým sběrem dat a vize do budoucna
- Nenádorové epiteliální změny vulvy – lichen sclerosus
- Ritgenův manévr a jeho modifikace
- Porovnání technik hysterektomie v souboru jedinců operovaných z indikace transsexualismu femaleto male
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nenádorové epiteliální změny vulvy – lichen sclerosus
- Syndrom úplné androgenní insenzitivity – kazuistika
- Závažné pooperační krvácení po operaci prolapsu pochvy po hysterektomii s užitím systému Total Prolift – kazuistika
- Porovnání technik hysterektomie v souboru jedinců operovaných z indikace transsexualismu femaleto male
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

