-
Medical journals
- Career
Vyšetření bodových mutací v genu pro interleukin-11 v populaci neplodných žen a plodných kontrol
Authors: P. Lhotská 1,2; P. Martínek 1; M. Čedíková 1,2; P. Lošan 1; M. Králíčková 1,2,3; V. Kališ 3; Z. Novotný 3
Authors‘ workplace: Ústav histologie a embryologie LF UK, Plzeň, přednostka doc. MUDr. M. Králíčková, Ph. D. 1; Biomedicínské centrum LF UK, Plzeň, vědecký ředitel doc. MUDr. M. Štengl, Ph. D. 2; Gynekologicko-porodnická klinika LF UK a FN, Plzeň, přednosta doc. MUDr. Z. Novotný, CSc. 3
Published in: Ceska Gynekol 2014; 79(1): 48-52
Overview
Cíl studie:
Interleukin-11 (IL-11) je jedním z klíčových cytokinů hrajících úlohu při decidualizaci a embryo-maternálním molekulárním dialogu, který probíhá během implantace embrya. Naším cílem bylo zjistit prevalenci variant v genu pro IL-11 v populaci neplodných žen a v populaci plodných kontrol.Typ studie:
Kohortová studie.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika LF UK a FN v Plzni.Metodika a soubor:
Vyšetřili jsme 354 infertilních a 195 kontrolních zdravých plodných žen. K analýze jsme použili elektroforézu probíhající v teplotním gradientu a přímou sekvenaci. Statistické zhodnocení rozdílu mezi skupinou neplodných pacientek a skupinou fertilních kontrol bylo provedeno pomocí Fisherova exaktního testu pro čtyřpolní tabulky.Výsledky:
Ve skupině neplodných žen byla u 13 z nich zjištěna varianta G3651A, přičemž tato varianta má za následek záměnu argininu za histidin na pozici 113 (R113H). V kontrolní skupině tato bodová mutace zjištěna nebyla, což znamená, že frekvence této mutace v genu pro IL-11 je u neplodných žen signifikantně vyšší ve srovnání s plodnými ženami(p = 0,01 Fisherova exaktního testu pro čtyřpolní tabulky).Závěr:
Výsledky prokazují přítomnost bodových mutací v genu pro IL-11 v populaci neplodných pacientek. Výskyt variant nemusí být sám o sobě mechanismem snižujícím plodnost, ale může přispívat k narušení cytokinové rovnováhy, která je k decidualizaci a následné implantaci embrya nutná. Ačkoli se mutace v genu pro IL-11 vyskytují vzácně, jejich vliv na molekulární pochody během implantace a časné embryogeneze by měl být objasněn.Klíčová slova:
interleukin-11 – varianta – decidualizace – implantace embrya – neplodnost – asistovaná reprodukce – in vitro fertilizace – elektroforéza v teplotním gradientu – sekvenování DNAÚVOD
Jednou z příčin neplodnosti a také stále neuspokojivých výsledků její léčby [11] může být snížená schopnost embrya implantovat se do děložní sliznice. Implantaci embrya musí předcházet decidualizace děložní sliznice, která je kontrolována hierarchizovanou souhrou řady humorálních faktorů včetně mnoha cytokinů. Souvislost vyvážené a delikátně regulované cytokinové souhry se schopností spontánního otěhotnění byla opakovaně prokázána [7]. Interleukin-11 (IL-11) je pokládán za klíčový cytokin celé vyvážené cytokinové souhry regulující decidualizaci [5].
Interleukin-11 je členem rodiny interleukinu-6 spolu s leukemickým inhibičním faktorem (LIF), ciliárním neurotrofickým faktorem (CNTF), kardiotrofinem (CT-1) a onkostatinem-M (OSM) a společně s nimi sdílí afinitu k receptorovému řetězci gp130. Hotový protein je monomer složený ze 179 aminokyselin o molekulové váze 150 kDa. Sám se váže na vysokoafinní receptor IL-11Rα a po spojení s gp130 dochází k homodimerizaci IL-11 a přenosu signálu. IL-11 reguluje hematopoezu, indukuje proliferaci B buněk, stimuluje vývoj osteoblastů, buněk gastrointestinálního a nervového systému [6]. V roce 1997 byl schválen rekombinantní IL-11 (pod názvem Oprelvekin) jako lék pro prevenci závažné trombocytopenie u pacientů po chemoterapii.
Studie na myším modelu ukazují, že defekty v genu pro IL-11Rα nevedou k žádným abnormalitám v hemopoetickém procesu, ale samice s tímto defektem jsou sterilní [10]. Jako příčina neplodnosti u těchto myší byla potvrzena nedostatečná decidualizace endometria a jeho postupná degradace. U člověka byla pomocí imunohistochemického barvení prokázána produkce IL-11 v endometriu během celého menstruačního cyklu a v epiteliál-ních buňkách glandulárních byla pozorována silnější intenzita produkce IL-11 než u stromálních buněk endometria [4]. Bylo prokázáno, že produkce IL-11 epiteliálními buňkami endometria je silně snížená u žen s opakovanými potraty v anamnéze ve srovnání se zdravou skupinou [9] a také u žen s idiopatickou neplodností je přítomnost IL-11 v glandulárním epitelu signifikantně nižší [5].
Gen IL-11 se nachází na chromozomu 19 v oblasti q13.3–q13.4, je kódován pěti exony a čtyřmi introny. Dosud nebyla v literatuře popsána žádná mutace genu v souvislosti s neplodností. Je popsáno celkem 27 variant genu, z toho tři se nacházejí v exonech. Jako referenční sekvence byl v naší studii použit záznam genové banky číslo AY207429 z webových stránek http://www.ncbi.nlm.nih.gov odpovídající referenční sekvenci číslo NM_000641, ze které byly získány varianty genu [1]. V minulosti nalezené varianty genu IL-11 jsou uvedeny v seznamu známých variant na stránkách NCBI (http://www.ncbi.nlm.nih.gov). Tyto varian-ty byly zjištěny například firmou Seattle SNPs (CA, USA), která je částí National Heart Lung and Blood Institute‘s (NHLBI) a výzkum proběhl v rámci Programs for Genomic Applications (PGA). Jejich studie čítala 60 vzorků evropského původu, 60 vzorků afrického původu a 90 vzorků asijského původu.
Cílem naší práce bylo stanovit výskyt mutací v genu pro IL-11 v populaci neplodných žen a porovnat jej s kontrolní populací zdravých plodných žen.
METODIKA A SOUBOR ŽEN
Soubor žen
DNA jsme vyšetřili u 354 infertilních pacientek, z toho 252 bylo primárně a 102 sekundárně neplodných. Skupinu neplodných žen jsme rozdělili podle příčin sterility na ovariální faktor(n = 45), tubární faktor (n = 34), endometriózu(n = 30), andrologický faktor (n = 93), idiopatickou infertilitu (n = 99) a kombinaci faktorů (n = 44). Pacientky s endometriózou nebyly členěny podle stadia choroby. Pacientky klasifikované v naší studii jako idiopaticky neplodné měly ovulační cykly, laparoskopicky prokázanou průchodnost obou vejcovodů a absenci pelvických adhezí či endometriózy a měly též normální hysteroskopický či hysterosalpingografický nález. Jejich partneři měli normální spermiogramy a nebyly prokázány antispermatické protilátky.
Kontrolní populace pro vyšetřování DNA se skládala z 195 zdravých fertilních žen, které měly v anamnéze alespoň jedno spontánní otěhotnění následované porodem zdravého novorozence.
Studie byla schválena etickou komisí LF UK v Plzni a všechny pacientky podepsaly informovaný souhlas.
DNA extrakce
DNA byla izolována z leukocytů periferní krve za pomoci DNeasy Tissue Kit (QIAgen, Hilden, Germany) podle firemního protokolu. Vzorky byly skladovány při teplotě -20 °C.
Polymerázová řetězová reakce a vyšetřování mutací v genu pro IL-11
Pro analýzy DNA jsme používali gelovou elektroforézu probíhající v teplotním gradientu (TGGE) a přímé sekvenování. Analyzovány byly kódující oblasti a exon-intronové spoje genu. Za účelem vytvoření termostabilních domén byly primery modifikovány pomocí Poland java script přidáním GC svorek (www.biophys.uni-duesseldorf.de/POLAND/poland.html), ty vytvářejí u PCR produktu termostabilní domény, které umožňují analýzu variant pomocí TGGE. Polymerázová řetězová reakce (PCR) byla sestavena takto: 12.5 µl HotStart Taq PCR Master Mix (QIAgen), 10 pmol příslušných primerů, 100 ng DNA a destilovaná voda do celkového objemu 25 µl. Amplifikační program se skládal z denaturace při 95 °C po dobu 15 minut a pak 35 cyklů skládajících se z denaturace při 95 °C po dobu 30 sekund, annealingu při 60 °C po dobu 30 sekund a extenze při 72 °C po dobu 1 minuty. PCR byla zakončena finální extenzí při 72 °C po dobu 7 minut. Délka a kvalita PCR produktů byla kontrolována na standardním agarózovém gelu.
Vyhledávání mutací bylo prováděno analýzou heteroduplexů na TGGE (Biometra, Goettingen, Germany) za použití akrylamidových gelů (8% akrylamid (AA:bis-AA [37,5 : 1]), 6M urea, 1× MOPS, 2% glycerol)). Směs heteroduplexů byla provedena denaturací v termocykleru GeneAmp 9700 (PE/AB Foster City, CA, USA) při 95 °C po dobu 5 minut s následnou postupnou renaturací (1 °C za sekundu) na výslednou teplotu 55 °C, která byla udržována po dobu 15 minut. Poté byly vzorky zchlazeny na 4 °C.
TGGE analýzy se prováděly ve dvou krocích – nejprve byly podmínky elektroforézy optimalizovány pro každý PCR fragment zvlášť, pak byly vzorky pacientek analyzovány na paralelních gelech. DNA byla detekována metodou barvení stříbrem, kterou jsme popsali již v našich předešlých publikacích [2, 8].
Všechny vzorky pozitivní v TGGE jsme sekvenovali. Pro přípravu sekvenačních reakcí byl použit Big Dye Terminator Sequencing kit verze 1.1 či verze 3.1 (PE/AB, Foster City, CA, USA). Na jednu sekvenační reakci bylo použito přibližně 100 ng templátové DNA, 3,2 pmol sekvenačního primeru, 2 µl Big Dye Terminator Sequencing kit v1.1 (v3.1), 2 µl 5x Sequencing buffer, vše bylo doplněno sterilní deionizovanovou vodou do objemu 10 µl. Reakce probíhala v termocykleru GeneAmp 9700 (PE/AB Foster City, CA, USA) v následujících krocích: denaturace 96 °C/1 minuta, 25 cyklů (96 °C/15 sekund, teplota annealingu viz tabulka 2/5 sekund, 60 °C/4 minuty) a na sekvenátoru ABI Prism 310 (PE/Applied Biosystems, Foster City, USA) při 11.3 kV po dobu 20 minut. Pro přečištění PCR produktů po amplifikaci byl použit kit Agencourt AmPure a pro přečištění sekvenační reakce kit Agencourt CleanSeq (Agencourt Bioscience Corporation, Beverly, MA,USA) podle návodu výrobce.
Statistické hodnocení
Výsledky byly statisticky hodnoceny pomocí Fisherova exaktního testu pro čtyřpolní tabulky. Hodnoty p < 0,05 se považovaly za statisticky signifikantní.
Image 1. Ideogram genu pro IL-11 s vyznačením variant v exonech 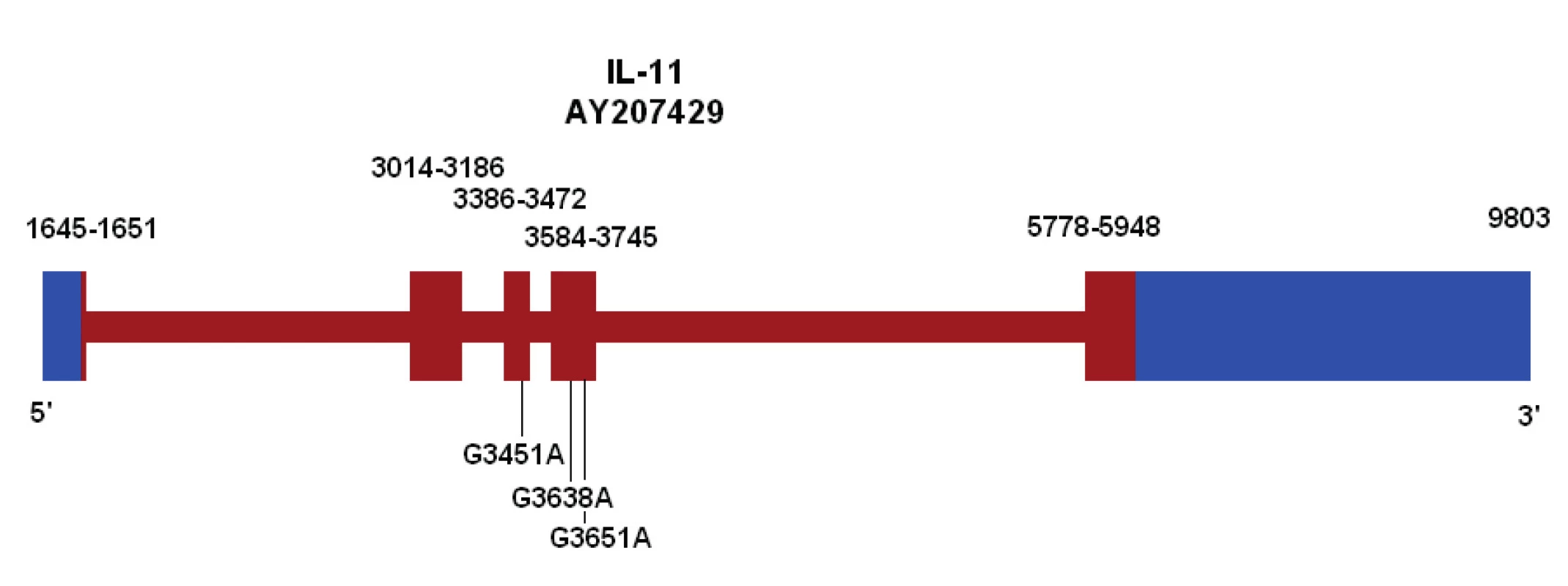
VÝSLEDKY
V námi vyšetřované populaci byly detekovány dvě různé varianty – varianta G3451A, která nevede k záměně aminokyselin v proteinovém řetězci a varianta G3651A, která má za následek záměnu argininu za histidin na pozici 113 (R113H).
U varianty G3451A byla zjištěna vyšší frekvence (0,74), než je celková frekvence této varianty podle Seattle SNPs (0,3) [1]. To je zřejmě dáno tím, že všechny vzorky v námi vyšetřované skupině byly evropského původu, a nikoli smíšené jako u studie Seattle SNPs. Jejich frekvence pro evropskou populaci byla 0,58, kdežto například pro africkou 0,0 [1]. Tato varianta nezpůsobuje aminokyselinovou záměnu, lze ji považovat za „silent mutaci“ nebo polymorfismus. Navíc její výskyt se statisticky významně neliší ve skupině neplodných žen a plodných kontrol.
Druhá námi detekovaná varianta, varianta G3651A, byla v populaci, kterou jsme vyšetřovali, nalezena u 13 případů neplodných žen. Tato va-rianta má za následek záměnu argininu za histidin na pozici 113 (R113H), takže její vliv na například prostorové uspořádání molekuly je možný. V kontrolní skupině tato bodová mutace zjištěna nebyla, což znamená, že frekvence této mutace v genu pro IL-11 je u neplodných žen signifikantně vyšší ve srovnání s plodnými ženami (p = 0,01 Fisherova exaktního testu pro čtyřpolní tabulky).
DISKUSE
Naše pilotní výsledky prokazují, že frekvence varianty G3651A v genu pro IL-11 je u neplodných žen signifikantně vyšší ve srovnání s plodnými ženami. Protože tato varianta vede k záměně aminokyselin v proteinovém řetězci, existuje možnost, že by její výskyt mohl souviset např. se změnou prostorového uspořádání molekuly IL-11, a tím i se změnou její afinity k receptoru apod.
Jeden cytokin sám o sobě pravděpodobně nemůže významnou měrou ovlivnit proces decidualizace, ale existuje možnost, že abnormalita jednoho činitele naruší celkovou harmonii cytokinového prostředí, která je obecně uznávanou podmínkou úspěšnosti periimplantačních dějů [3]. K jednoznačným závěrům je však třeba mít populaci rozsáhlejší a studii doplnit analýzami následných dějů.
Ačkoli se varianty v genu pro IL-11 vyskytují vzácně [1], mohou mít vliv na molekulární pochody během decidualizace, a tím pádem i implantace a časné embryogeneze. Porozumění působení IL-11 může sloužit k pochopení molekulárních procesů peri-implantačních dějů, a tím i k vytvoření nových léčebných postupů, jež podpoří schopnost implantace a viabilitu embrya, a zvýší tím úspěšnost léčby neplodnosti.
ZÁVĚR
Ačkoli je zřejmé, že mutace v genu pro IL-11 nejsou časté a samy o sobě klinicky významné, představují dílek v poznání zatím nepochopených peri-implantačních dějů. Souvislost vyvážené a delikátně regulované cytokinové souhry s možností spontánního otěhotnění byla opakovaně prokázána. Pochopení imunogenetického pozadí implantace embrya má tedy potenciál přispět k objasnění příčin některých zatím nevysvětlitelných případů neplodnosti a otvírá nové možnosti léčby.
Tato studie je podporována projektem OP VaVpI PO 2 Biomedicínské centrum ED2.1.00/03.0076 a programem rozvoje vědních oblastí na Karlově Univerzitě (projekt P36).
Mgr. Pavla Lhotská
Ústav histologie a embryologie LF UK
Karlovarská 48
306 05 Plzeň
e-mail: lhotskap@pilsfree.cz
Sources
1. Balakrishnan, L., Soman, S., Patil, YB., et al. IL-11/IL11RA receptor mediated signaling: a web accessible knowledgebase. Cell Commun Adhes, 2013, 20, 3–4, p. 81–86.
2. Beranová, M., Oliveira, LM., Bedecarrats, GY., et al. Prevalence, phenotypic spectrum, and modes of inheritance of gonadotropin-releasing hormone receptor mutations in idiopathic hypogonadotropic hypogonadism. J Clin Endocrinol Metab, 2001, 86, 4, p. 1580–1588.
3. Carp, H. Cytokines in recurrent miscarriage. Lupus., 2004, 13, 9, p. 630–634.
4. Cork, BA., Li, TC., Warren, MA., Laird, MS. Interleukin-11 in human endometrium: expression throughout the menstrual cycle and the effects of cytokines on endometrial IL-11 production in vitro. J Reprod Imunol, 2001, 50, p. 3–17.
5. Dimitriadis, E., Sharkey, AM., Tan, YL., et al. Immuno-localisation of phosphorylated STAT3, interleukin-11 and leukaemia inhibitory factor in endometrium of women with unexplained infertility during the implantation window. Reprod Biol Endocrinol, 2007, 29, 5, p. 44.
6. Du, XX., Wiliams, DA. Interleukin-11: a multifunctional growth factor derived from the haemopoietic microenvironment. Blood, 1994, 83, 8, p. 2023–2030.
7. Granot, I., Gnainsky, Y., Dekel, N. Endometrial inflammation and effect on implantation improvement and pregnancy outcome. Reproduction, 2012, 144, 6, p. 661–668.
8. Králíčková, M., Šíma, R., Vaněček, T., et al. Leukemia inhibitory factor gene mutations in the population of infertile women are not restricted to nulligravid patients. Eur J Obstet Gynecol Reprod Biol, 2006, 127, 2, p. 231–235.
9. Linjawi, S., Li, TC., Tuckerman, EM., et al. Expression of interleukin-11 receptor alpha and interleukin-11 protein in the endometrium of normal fertile women and women with recurrent miscarriage. J Reprod Immunol, 2004, 64, 1–2, p. 145–155.
10. Robb, L., Li, R., Hartley, L., et al. Infertility in female mice lacking the receptor for interleukin 11 is due to defective uterine response to implantation. Nat Med, 1998, 4, 3, p. 303–308.
11. Sullivan, EA., Zegers-Hochschild, F., Mansour, R., et al. International Committee for Monitoring Assisted Reproductive Technologies (ICMART) world report: assisted reproductive technology 2004. Hum Reprod, 2013, 28, 5, p. 1375–1390.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology
2014 Issue 1-
All articles in this issue
- Detekce nádorových kmenových buněk karcinomu ovaria
- Stav vývoje kontracepčního vakcinogenu
- Vliv nadváhy na úspěšnost technik asistované reprodukce u neplodných žen
- Funkce mitochondrií ve spermii u mužů s normozoospermií a astenozoospermií
- Stav orálního zdraví u žen s fyziologickým a rizikovým těhotenstvím
- Závažné pooperační krvácení po operaci prolapsu pochvy po hysterektomii s užitím systému Total Prolift – kazuistika
- Syndrom úplné androgenní insenzitivity – kazuistika
- Výsledky perinatální péče o těhotné s diabetem v západních Čechách
- Vyšetření bodových mutací v genu pro interleukin-11 v populaci neplodných žen a plodných kontrol
- Národní registr komplikací gynekologické laparoskopie ČR –první zkušenosti s elektronickým sběrem dat a vize do budoucna
- Nenádorové epiteliální změny vulvy – lichen sclerosus
- Ritgenův manévr a jeho modifikace
- Porovnání technik hysterektomie v souboru jedinců operovaných z indikace transsexualismu femaleto male
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nenádorové epiteliální změny vulvy – lichen sclerosus
- Syndrom úplné androgenní insenzitivity – kazuistika
- Závažné pooperační krvácení po operaci prolapsu pochvy po hysterektomii s užitím systému Total Prolift – kazuistika
- Porovnání technik hysterektomie v souboru jedinců operovaných z indikace transsexualismu femaleto male
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

