-
Medical journals
- Career
Postavení cílené léčby v managementu ovariálního karcinomu
Authors: M. Majirský 1; M. Kubecová 1; E. Kindlová 1; K. Tikovský 2
Authors‘ workplace: Radioterapeutická a onkologická klinika 3. LF UK a FN KV, Praha, přednostka doc. MUDr. M. Kubecová, Ph. D. 1; Gynekologicko-porodnická klinika 3. LF UK a FN KV, Praha, přednosta doc. MUDr. E. Kučera, CSc. 2
Published in: Ceska Gynekol 2013; 78(4): 347-350
Overview
Cíl studie:
Podat aktuální přehled problematiky využití cílené léčby u ovariálního karcinomu.Typ studie:
Literární přehled.Název a sídlo pracoviště:
Radioterapeutická a onkologická klinika 3. LF UK a FN KV, Praha.Metodika:
Po zpracování současné literatury – publikovaných studií a statistických údajů z České republiky předkládáme aktuální pohled na danou problematiku.Výsledky:
Karcinomy ovarií jsou v České republice mezi gynekologickými zhoubnými nádory onemocněním s nejvyšší mortalitou. U většiny pacientek je nádor diagnostikován v pokročilém stadiu. Primární léčba je založena na kombinaci radikální resekce a adjuvantní chemoterapie. Více než u dvou třetin případů dochází dříve nebo později k recidivě nádoru, velice často bez možnosti vyléčení. Neuspokojivé výsledky standardní léčby jsou důvodem hledání účinnějších postupů.Závěr:
Předmětem výzkumu posledních let je cílená léčba. Byl prokázán příznivý vliv bevacizumabu, jenž inhibicí nádorové angiogeneze vede k prodloužení intervalu do progrese nádoru.Klíčová slova:
ovariální karcinom – cílená léčba – bevacizumab – QALYÚVOD
Zhoubné novotvary vaječníků tvoří heterogenní skupinu nádorů. Karcinom ovaria patří mezi epiteliální nádory vaječníku a tvoří 90 % všech zhoubných nádorů ovaria. Mezi neepiteliální nádory ovaria řadíme tumory z germinálních buněk (3 %) a nádory ze zárodečných pruhů a stromatu ovaria (7 %) [2]. V České republice bylo v roce 2010 nově diagnostikováno celkem 1107 případů karcinomu ovaria, což odpovídá incidenci 20,8 onemocnění na 100 000 žen. Mortalita činila 12,2 na 100 000 žen, tj. 675 případů. Jde o druhou nejčastější gynekologickou malignitu, v rámci této skupiny však zaujímá dlouhodobě první místo v mortalitě [13].
Postupné zvětšování nádoru rostoucího v břišní dutině je ve většině případů dlouhou dobu bez jakýchkoli příznaků, proto je až u dvou třetin pacientek nemoc diagnostikována v pozdním stadiu. I po absolvování radikální resekce a následné adjuvantní chemoterapie dochází u 40 % případů ke vzniku recidiv již v prvních dvou letech, celkem relabuje až 70 % nádorů. PFS (progression free survival) je v rozpětí 16–22 měsíců, medián celkového přežití mezi 2 až 4 roky a pětileté přežití nedosahuje 30 %.
Familiární výskyt nemoci je v 5–10 % případů. Nejznámější je souvislost s mutací genu BRCA 1 a BRCA 2. Celoživotní riziko vzniku karcinomu vaječníků se pohybuje pro nosičky mutací mezi 26–54 % pro BRCA 1 a 10–23 % pro BRCA 2 a je přibližně 10–20krát vyšší než v běžné populaci. Průměrný věk vzniku dědičných forem karcinomu prsu i vaječníků je snížen proti sporadickým formám přibližně o 10 let.
K rizikovým faktorům vzniku karcinomu ovaria patří vedle obezity a kontaktu s talkem nebo azbestem i vysoký počet ovulací (nízký věk v době první menstruace, nuliparita, pozdní menopauza). Možnou příčinou je opakované poškození a hojení povrchového epitelu při každé ovulaci, což je spojeno s proliferací jeho buněk zvýšenou expresí vaskulárního endoteliálního růstového faktoru (VEGR) [6]. Multiparita, kojení a užívání hormonální antikoncepce, profylaktické odstranění vaječníků, bilaterální podvázání vejcovodů nebo hysterektomie riziko vniku karcinomu ovaria významně snižuje [4].
V současné době neexistuje metoda pro screening karcinomu ovaria, která by měla dostatečnou senzitivitu, specificitu a pozitivní prediktivní hodnotu. Význam preventivních opatření se uznává pouze selektivně u skupiny žen s vysokým rizikem onemocnění, což jsou nositelky genetické mutace.
TERAPIE
Obecně považujeme ovariální karcinomy za chemosenzitivní, jednotlivé histologické typy se však výrazně liší nejen biologickým chováním, ale právě i v citlivosti na cytostatika, a tím i v prognóze (tab. 1), což částečně vysvětluje neuspokojivé výsledky konvenční adjuvantní léčby.
Table 1. Karcinom ovaria: klinické a molekulární rysy pěti nejčastějších typů (podle 10) 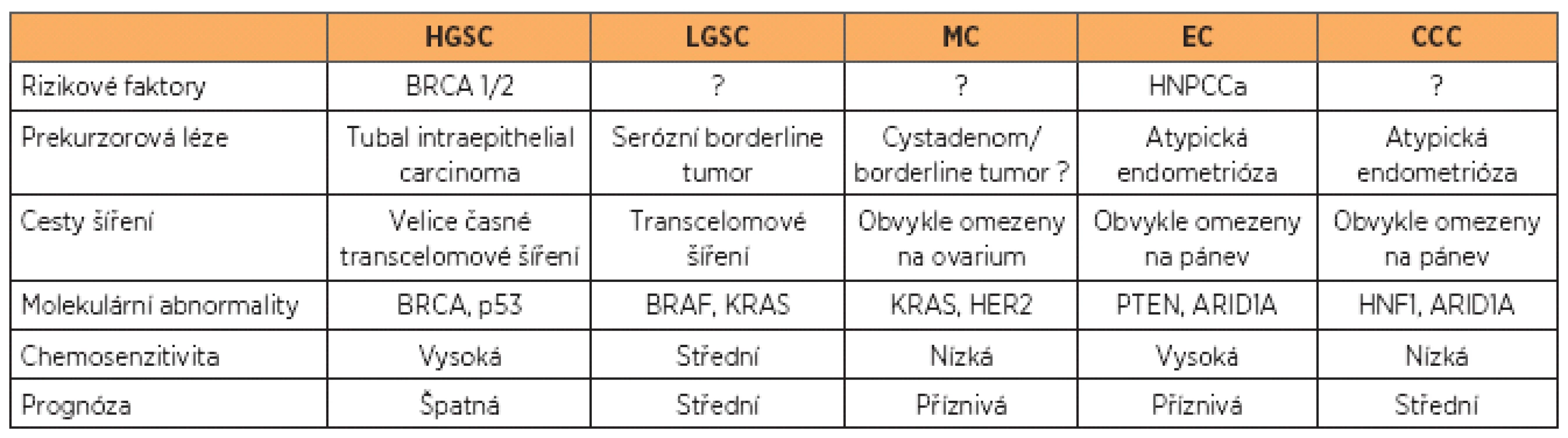
Snaha o zlepšení celkového přežívání (OS – overal survival) vedla k různým léčebným strategiím, mimo jiné k přidání třetího cytostatika k zavedeným režimům. Výstupem nejrozsáhlejší klinické studie Gynecological Cancer Intergroup (GCIG) III. fáze s 4312 zařazenými pacientkami (trial GOG 0182-ICON 5) bylo zjištění absolutně žádné statisticky signifikantní superiority nebo klinického benefitu použití trojkombinace ve srovnání s kontrolním ramenem. Proto kombinace karboplatina-paklitaxel zůstává léčbou volby. Léčbu recidiv znesnadňuje rozvoj chemorezistence i u původně chemosenzitivních nádorů, odpověď na léčbu nemá dlouhého trvání, po 5–9 měsících nádor progreduje. V takových případech je v popředí zájmu nezhoršovat kvalitu života pacientek.
Odpověď na otázku, zda zahájit léčbu relapsu ihned při asymptomatické elevaci CA 125, nebo léčbu odložit až do výskytu obtíží, přinesla studie OV 05/EORTC 55955 – dřívější zahájení léčby nezlepšilo celkové přežívání pacientek, naopak přineslo dřívější nástup toxicity a zhoršení kvality života [12].
Paliativní efekt hormonální léčby (Tamoxifen, Letrozol) u pacientek s recidivou nemoci po vyčerpání chemoterapie nebo při její kontraindikaci lze očekávat u karcinomů vaječníků s pozitivitou estrogenových a/nebo progesteronových receptorů, nejčastěji tedy serózního adenokarcinomu. Uplatnění radioterapie je okrajové, zatíženo rizikem toxicity a komplikací.
Ozáření menšího objemu může být efektivní v případech chemorezistentních recidiv, nebo po vyčerpání ostatních léčebných metod.
Novou éru v medicíně i onkologii představuje zavádění látek se selektivním účinkem na některé skupiny nádorových buněk s výrazně užším spektrem toxicity na buňky tělu vlastní. Označení těchto farmak pojmem biologická léčba je poměrně zavádějící a nepřesné, neboť nejde o látky běžně se vyskytující v přírodě, ale o syntetické molekuly. I když je toto pojmenování hojně rozšířené jak u odborné veřejnosti, tak i mezi laiky, přesnější termín je cílená léčba. Zatímco konvenční chemoterapií lze ovlivnit především proliferaci, replikaci a apoptózu nádorových buněk, cílenou léčbou můžeme selektivně zasáhnout do procesů, jako je angiogeneze, invazivita, metastazování a diferenciace [7].
Od roku 2005 byl zkoumán erlotinib (Tarceva), perorální tyrozin kinázový inhibitor, který blokuje intracelulární doménu receptoru pro epidermální růstový faktor (EGFR). U pacientek s epiteliálním karcinomem ovaria byl podáván jako udržovací léčba po ukončení adjuvantní chemoterapie. Pokud ve studii fáze II bylo zaznamenáno 44 % pacientek se stabilizací nemoci, ve studii fáze III se neprokázalo prodloužení intervalu do progrese (PFS) ani prodloužení celkového přežití. Nebyla identifikována ani podskupina pacientek, jež by mohly z erlotinibu profitovat [8, 14]. Design této studie (OV07) – randomizace ve smyslu: pacientka dostane cílený lék, nebo jej nedostane, je bez znalosti nádorového profilu z pohledu molekulární biologie (bez identifikace prediktivního faktoru) popřením filozofie cílené léčby a naivním očekáváním, že nahodilé podání léku bude mít klinický benefit.
Další látkou podrobenou experimentu se stal bevacizumab (Avastin), rekombinantní humanizovaná monoklonální protilátka proti růstovému faktoru cévního endotelu (VEGF). V současné době není k dispozici žádný klinický ani biochemický marker, podle kterého by bylo možno vybírat nemocné k léčbě. Úsilí o zhodnocení efektu bevacizumabu v karcinomu ovaria i přesto obsahuje racionální základ. Nádor do velikosti 2 mm je vyživován z okolí difuzí. V centrální porci tumoru dochází k hypoxii a nádor na to reaguje mimo jiné zvýšenou tvorbou VEGF (vaskulární endoteliální růstový faktor), jenž nastartuje neoangiogenezi – novotvorbu cévních struktur (z cév v postiženém orgánu) rostoucích směrem k nádorovému ložisku (obr. 1).
Image 1. Proces angiogeneze (TAF – tumor angiogenesis factor, dnes VEGF); podle [5] ![Proces angiogeneze (TAF – tumor angiogenesis factor, dnes VEGF); podle [5]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c49579dd1c50a507b5e58ca4949e925b.jpg)
Novotvořené cévy jsou nezralé, křivolaké a propustné, způsobují zvýšení intersticiálního tlaku v nádorové tkáni, a tím usnadňují pronikání nádorových buněk (tlakový gradient přes nedokonalou cévní stěnu) do cirkulace, a tím umožňují metastazování, přičemž zhoršují účinnost chemoterapie (pronikání cytostatik proti tlakovému gradientu) [1]. VEGF může přispívat k přeměně normálního epitelu vaječníku v nádor produkující ascites a zvyšováním propustnosti peritoneálních cév vede ke vzniku ascitu také [11]. U karcinomu vaječníků je prokázána jak vysoká vaskularizace, tak i výrazná exprese VEGF. Bevacizumab se váže na VEGF, a brání tak jeho vazbě na receptor endotelových buněk, což vede k regresi nádorových cév a jejich normalizaci (snížení úniku plazmatických proteinů mimo lumen cév) – časný účinek, při dlouhodobém podávání vede k inhibici novotvorby cév – pozdní účinek.
VÝSLEDKY STUDIÍ
Bevacizumab byl v primární léčbě testován v randomizovaných studiích ICON7 (otevřená) a GOG 218 (dvojitě zaslepená). V GOG 218 bylo zařazeno 1873 pacientek s epitelovým nádorem vaječníku, peritonea nebo vejcovodů stadia III a IV, které randomizace rozdělila do tří ramen: I. chemoterapie 6 cyklů: karboplatina s paklitaxelem, II. chemoterapie jako kontrolní skupina + bevacizumab od 2. cyklu chemoterapie do jejího ukončení, III. chemoterapie jako kontrolní skupina + bevacizumab od 2. cyklu chemoterapie na 15 měsíců. Studie prokázala prodloužení střední doby do progrese v rameni III ve srovnání se standardní léčbou o 6 měsíců, poměr rizik 0,65. Ukázalo se také, že krátkodobé podávání bevacizumabu pouze po dobu chemoterapie dobu do progrese neprodlužuje [3].
Ve studii ICON7 (n = 1528) byly pacientky s histologicky verifikovaným karcinomem vaječníků, peritonea nebo vejcovodů po cytoredukční operaci u časných forem, nebo po biopsii u inoperabilních stadií rozděleny do dvou ramen. Kontrolní skupina absolvovala 6 cyklů chemoterapie v režimu karboplatina/paklitaxel, experimentální skupina navíc bevacizumab, který byl podáván do celkové doby 12 měsíců od zahájení chemoterapie. Získaná data potvrzují výsledky studie GOG 218 – bevacizumab v kombinaci s chemoterapií následovaný samotným bevacizumabem prodlužuje přežití bez progrese (PFS) o 2,3 měsíce, poměr rizik 0,79. Exploratorní analýza přežití bez progrese v podskupině nemocných podobné nemocným zařazeným do studie GOG-0218 podporuje léčbu karcinomu vaječníku bevacizumabem ve stadiu III a IV [9]. Ani jedna studie nepotvrdila prodloužení celkového přežívání.
Na základě výsledků těchto dvou studií byla v prosinci 2011 registrována první indikace cílené léčby pro karcinom ovaria, kdy byl bevacizumab (Avastin) schválen k primární léčbě pokročilého stadia (IIIB, IIIC nebo IV) ovariálního karcinomu nebo primárního karcinomu peritonea, a to v kombinaci s chemoterapeutickým režimem karboplatina + paklitaxel a s následnou udržovací léčbou samotným bevacizumabem.
V roce 2011 byly rovněž zveřejněny první výsledky studie OCEANS, ve které byl u pacientek s recidivou nemoci prokázán příznivý vliv přidání bevacizumabu ke standardnímu režimu s platinou u nemocných s nádorem citlivým k platině. I zde však šlo pouze o oddálení progrese (12,4 versus 8,4 měsíců), nikoliv o prodloužení života [15].
Česká onkologická společnost v 16. vydání tzv. Modré knihy (Zásady cytostatické léčby maligních onkologických onemocnění) Avastin doporučuje v kombinaci s karboplatinou a paklitaxelem k úvodní léčbě pokročilého (stadia III B, III C a IV podle FIGO) epitelového nádoru vaječníků, vejcovodů nebo primárního nádoru pobřišnice, čímž se shoduje s doporučením americké společnosti NCCN (National Comprehensive Cancer Network), avšak jde nad rámec evpropské společnosti ESMO (European Society for Medical Oncology). Tento přístup je zvláštní, neboť o úhradě přípravku Avastin v této indikaci ze zdravotního pojištění dosud nebylo rozhodnuto [16]. Kontroverzní situace je způsobená na jedné straně výsledky výzkumu, jenž dokladuje statisticky významný, ale klinicky diskutabilní přínos ve smyslu oddálení zhoršení stavu o několik měsíců za cenu, která je řádově vyšší než standardní chemoterapie. Je proto nanejvýš žádoucí přínos nově zaváděných technologií a léčebných přípravků zdůvodňovat nejenom výstupy z klinických studií, ale jejich začlenění do léčebných standardů obhájit i analýzou ekonomické náročnosti, např. podle modelu QALY (quality-adjusted life year).
Zkratky
HGSC – high-grade serózní karcinom
LGSC – low-grade serózní karcinom
MC – mucinózní karcinom
EC – endometrioidní karcinom
CCC – clear-cell karcinom
MUDr. Martin Majirský
Radioterapeutická a onkologická klinika
3. LF UK a FN Královské Vinohrady
Šrobárova 50
100 34 Praha 10
e-mail: m.majirsky@seznam.cz
Sources
1. Baluk, P., Hashizume, H., McDonald, DM., et al. Cellular abnormalities of blood vessels as targets in cancer. Curr Opin Genet Dev, 2005.
2. Breckwoldt, M., Martius, G., Pfleiderer, A., et al. Gynekologie a porodnictví. Martin: Osveta, 1997, 648 s.
3. Burger, RA., et al. Incorporation of bevacizumab in the primary treatment of ovarian cancer. N Engl J Med, 2011, 365, p. 2473–2483.
4. Colombo, N., Peiretti, M., Parma, G., et al. Newly diagnosed and relapsed epithelial ovarian carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2010, 21 (Supplemet 5), p. 23–30.
5. Folkman, J. Tumor angiogenesis: therapeutic implications. Review. N Engl J Med, 1971, 18, 285(21), p. 1182–1186.
6. Chovanec, J. Karcinom ovaria. Postgrad Med, 2012, 9, s. 71–78.
7. Klener, P., Klener, P. jr. Nová protinádorová léčiva a léčebné strategie v onkologii. Praha: Grada, 2010.
8. Novotný, J., Vítek, P., et al. Onkologie v klinické praxi. Praha: Mladá fronta, 2012.
9. Peren, TJ., et al. Phase 3 trial of bevacizumab in ovarian cancer. N Engl J Med. 2011, 365, p. 2484–2496.
10. Prat, J. Ovarian carcinomas: five distinct diseases with different origins, genetic alterations, and clinicopathological features. Virchows Arch, 2012, 460, p. 237–249.
11. Ramakrishnan, S., et al. Angiogenesis in normal and neoplastic ovaries. Angiogenesis, 2005; 8(2), p. 169–182.
12. Rustin, GJ., Van der Burg, ME., Griffin, CL., et al. Early versus delayed treatment of relapsed ovarian cancer (MRC OV 05/EORTC 55955): a randomised trial. Lancet, 2010, 376, p. 1155–1163.
13. ÚZIS ČR, NOR ČR 2012. Novotvary 2009 ČR.
14. Vergote, IB., Joly, F., Katsaros, D., et al. Randomized phase III study of erlotinib versus observation in patients with no evidence of disease progression after first-line platin-based chemotherapy for ovarian carcinoma: A GCIG and EORTC-GCG study.J Clin Oncol., 2012, 30 (suppl; abstr LBA5000).
15. http://jco.ascopubs.org/cgi/doi/10.1200/JCO.2012.42.0505
16. http://www.linkos.cz/informace-pro-praxi/modra-kniha/9-zhoubny-novotvar-ovarii-a-tuby - c56-57/
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2013 Issue 4-
All articles in this issue
- Nepenetrující poranění močového měchýře při antiinkontinenční operaci (TVT)
- Profylaktické užití antiinfekčních léčiv v gynekologii
- Solubilní Toll-like receptor 2 v pupečníkové krvi u těhotenství komplikovaných předčasným odtokem plodové vody
- Rýchla detekcia najbežnejších chromozómových aneuploídií z plodovej vody v druhom trimestri tehotnosti využitím QF-PCR
- Peripartální život ohrožující krvácení – intenzivní péče a hematologická léčba
- Léčba noční polyurie desmopresinem
- Aktuální otázky asistované reprodukce v České republice
- Teoretická a praktická náplň oboru klinická embryologie
- Gynekologicko-porodnická klinika FNKV před padesáti lety a dnes
- Diagnostika minimálních karcinomů prsní žlázy
- Laparoskopické řešení borderline tumorů ovaria u žen ve fertilním věku
- Spolupráce mamologa a radiodiagnostika při managementu mamárních lézí ve FNKV
- Retrospektivní analýza efektivity diagnostiky ektopické gravidity transvaginálním ultrazvukovým vyšetřením
- Význam stanovování cirkulujících nádorových buněk v diagnostickém a léčebném procesu u karcinomu ovaria
- Postavení cílené léčby v managementu ovariálního karcinomu
- Melanom vulvy
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Melanom vulvy
- Laparoskopické řešení borderline tumorů ovaria u žen ve fertilním věku
- Léčba noční polyurie desmopresinem
- Peripartální život ohrožující krvácení – intenzivní péče a hematologická léčba
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

