-
Medical journals
- Career
Zhodnotenie rutinného sledovania pacientok po primárnej liečbe pre karcinóm krčka maternice v I. a II. štádiu: retrospektívna analýza
Authors: E. Lajtman; Miloš Mlynček; P. Uharček; M. Matejka; M. Urban
Authors‘ workplace: Gynekologicko-pôrodnícka klinika FN Nitra a Univerzita Konštantína Filozofa Nitra, prednosta prof. MUDr. M. Mlynček, CSc.
Published in: Ceska Gynekol 2010; 75(2): 135-140
Overview
Cieľ:
Zhodnotiť rutinné sledovanie pacientok a diagnostiku recidív po primárnej liečbe pre karcinóm krčka maternice.Typ štúdie:
Retrospektívna analýza.Názov a sídlo pracoviska:
Gynekologicko-pôrodnícka klinika Fakultná nemocnica a Univerzita Konštantína Filozofa v Nitre, Slovenská republika.Materiál a metóda:
V štúdii sme retrospektívne analyzovali 199 pacientok, ktoré sa podrobili operačnému výkonu pre karcinóm krčka maternice v období od roku 2000 do roku 2008 na Gynekologicko--pôrodníckej klinike vo Fakultnej nemocnici v Nitre a následne podľa rizikových faktorov absolvovali rádioterapiu, resp. chemo-rádioterapiu. Sledovanie po skončení primárnej liečby pozostávalo z celkového fyzikálneho vyšetrenia, gynekologického vyšetrenia, abdominálnej a vaginálnej ultrasonografie, RTG hrudníka a stanovenia hladiny SCCA. Vyšetrenie realizoval gynekológ a klinický onkológ. Porovnali sme dĺžku prežívania pacientok so symptomatickou a asymptomatickou recidívou.Výsledky:
Recidíva ochorenia po 6 mesiacoch od ukončenia primárnej liečby sa zistila v 17 prípadoch. V čase zistenia recidívy boli 3 pacientky asymptomatické a 14 symptomatických. Recidívy všetkých 3 asymptomatických pacientok boli zistené počas pravidelnej kontroly. Nebol významný rozdiel v prežívaní pacientok so symptomatickou a asymptomatickou recidívou.Záver:
Pravidelné sledovanie pacientok po primárnej liečbe rakoviny krčka maternice v presne určených intervaloch a diagnostika recidívy v asymptomatickom štádiu nezlepšuje prežívanie v porovnaní so symptomatickými pacientkami, ktoré sa dostavia na kontrolu s klinickými prejavmi recidívy. Je potrebné prehodnotiť algoritmus follow-up nielen z hľadiska prežívania, ale aj z ekonomického hľadiska.Kľúčové slová:
rakovina krčka maternice, sledovanie, recidíva.ÚVOD
Celosvetovo je rakovina krčka maternice zodpovedná za 233 tisíc úmrtí ročne. Incidencia je 471 tisíc prípadov. 80 % prípadov sa vyskytuje v menej rozvinutých krajinách a v rozvinutých krajinách je len 4 % nových prípadov ročne [3, 9, 21].
Incidencia rakoviny krčka maternice v Slovenskej republike v roku 2007 bola 21,9 [12].
Radikálna hysterektómia a panvová lymfadenektómia predstavuje štandardný liečebný postup v štádiách IA2‑IIA. V závislosti od prognostických faktorov sa podáva chemo-rádioterapia.
U pacientok s pokročilým štádiom ochorenia a pacientok vo včasnom štádiu ochorenia s prítomnými vysokorizikovými faktormi sa objavuje recidíva ochorenia.
Prognóza pacientok s recidívou je zlá a liečebné možnosti sú limitované. Hoci sa väčšina recidív objaví do 2 rokov od ukončenia primárnej liečby, sledovanie po skončení primárnej liečby sa líši medzi jednotlivými zdravotníckymi zariadeniami [3, 26].
Všetky pacientky, ktoré sa podrobili primárnej liečbe pre karcinóm krčka maternice, majú byť doživotne sledované.
Sledovanie po primárnej liečbe je definované ako sledovanie asymptomatických pacientok, ktoré nemajú klinické príznaky ochorenia.
Rutinné sledovanie pacientok po ukončení primárnej liečby má za cieľ zistiť komplikácie po predchádzajúcej liečbe a zabezpečiť včasnú diagnostiku recidívy ochorenia. Predpokladá sa, že včasná diagnostika recidívy ochorenia a následná liečba zlepšuje prežívanie pacientok.
Ďalšie dôvody pre sledovanie sú vyhľadávanie a manažment komplikácií liečby, psychologická podpora pacientok a v neposlednom rade zbieranie údajov pre výskumné účely.
Doteraz bolo publikovaných niekoľko retrospektívnych štúdií, ktoré hodnotili spôsoby sledovania pacientok po liečbe karcinómu krčka maternice [1, 3, 7, 25]. Doporučenia sledovania pacientok (follow-up guidelines) existujú len v rámci jednotlivých pracovísk a líšia sa medzi jednotlivými inštitúciami a krajinami. Zatiaľ nebola publikovaná žiadna prospektívna randomizovaná analýza, ktorá by jednoznačne potvrdzovala efektívnosť pravidelného sledovania.
Úlohou tejto analýzy bolo stanoviť význam rutinného sledovania v detekcii recidívy karcinómu krčka maternice.
SÚBOR PACIENTOK A METODIKA
Vo Fakultnej nemocnici v Nitre sa od roku 2000 do roku 2008 podrobilo primárnej radikálnej operačnej liečbe pre karcinóm krčka maternice 113 pacientok v štádiu I a II podľa FIGO.
Na základe zhodnotenia rizikových faktorov nasledovala adjuvantná liečba. V 106 (93,8 %) prípadoch sa jednalo o spinocelulárny karcinóm, v 5 (4,4 %) prípadoch o adenokarcinóm a v 2 (1,7 %) prípadoch o adenoskvamózny karcinóm. Po ukončení primárnej liečby bolo sledovanie realizované prvé dva roky v trojmesačných intervaloch a nasledujúce 3 roky v šesťmesačných intervaloch. Od 6. roku po ukončení primárnej liečby bolo vyšetrenie realizované jedenkrát ročne. Vyšetrenie vykonával gynekológ a klinický onkológ a pozostávalo z celkového fyzikálneho vyšetrenia, palpačného gynekologického vyšetrenia, vyšetrenia v pošvových zrkadlách, abdominálnej a transvaginálnej ultrasonografie, stanovenia hladiny SCCA a jedenkrát ročne RTG vyšetrenia hrudníka.
Recidíva ochorenia bola definovaná ako objavenie sa ochorenia po 6 mesiacoch od ukončenia primárnej liečby.
Pacientky, u ktorých sa vyskytlo ochorenie do 6 mesiacov, boli zo sledovania vylúčené. V týchto prípadoch bol stav hodnotený ako progresia ochorenia.
Všetky pacientky s recidívou boli komplexne vyšetrené a recidívy boli cytologicky, prípadne histologicky verifikované.
Štatistickú analýzu sme uskutočnili programom XLSTAT pre Windows. Prežívanie pacientok sme zhodnotili Kaplanovou-Meierovou metódou. Mediány boli porovnávané použitím Wilcoxonovho testu. Hladina významnosti alfa 0,05 (p<0,05) bola považovaná za štatisticky významnú.
VÝSLEDKY
Do štúdie sme zaradili 113 pacientok, ktoré sa podrobili primárnej operácii a podľa rizikových faktorov následnej adjuvantnej liečbe. Recidíva ochorenia sa zistila u 17 (15 %) pacientok. V 9 (7,9 %) prípadoch sa ochorenie zistilo do 6 mesiacov od ukončenia primárnej liečby, preto boli zo súboru vyradené. Priemerný vek pacientok v čase primárnej liečby bol 43 rokov (rozptyl 31-63). Podľa FIGO sa jednalo o nasledujúce štádia: IB, n=10; IIA, n=4; IIB, n=3. Vo všetkých prípadoch sa jednalo o spinocelulárny karcinóm.
Lokalizácie recidív boli nasledovné: recidíva v panve 7 pacientok, vzdialená metastáza 7 pacientok a kombinácia recidívy v panve a vzdialenej metastázy 3 pacientky.
Charakteristika pacientok je uvedená v tabuľke 1.
Table 1. Charakteristika pacientok s recidívou ochorenia 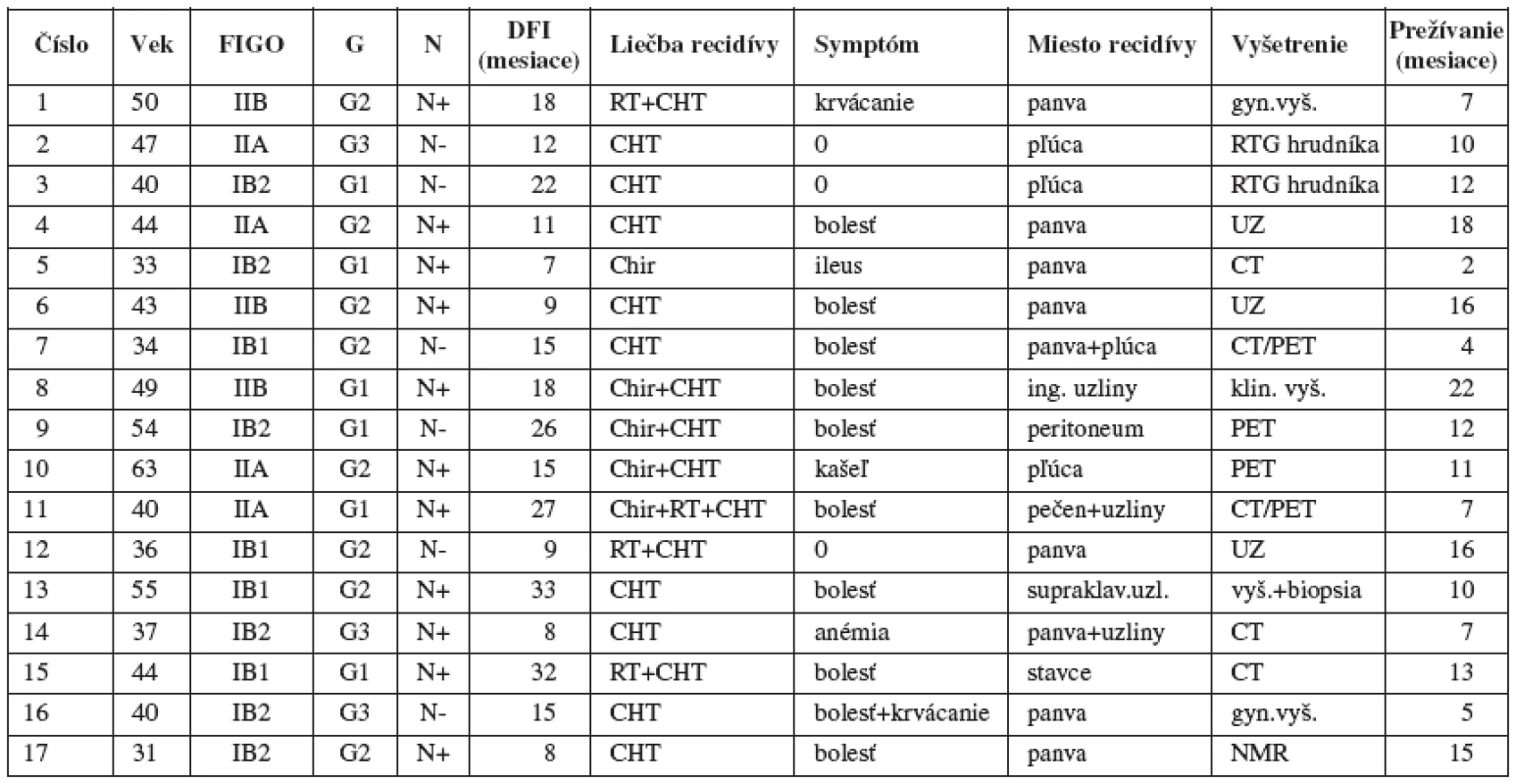
G-grade, N-pozitivita resp. negativita uzlín, DFI-disease-free interval, RT+CHT-chemorádioterapia, CHT-chemoterapia, Chir- operačná liečba Tri pacientky boli asymptomatické. Vo všetkých troch prípadoch sa recidíva ochorenia zistila v rámci pravidelného vyšetrenia. Všetky mali normálny cytologický ster z pošvovej klenby. V 2 prípadoch sa recidíva zistila v rámci pravidelného RTG vyšetrenia hrudníka a v jednom prípade bol nádor diagnostikovaný vaginálnym ultrazvukových vyšetrením.
Celkovo 14 pacientok bolo v čase zistenia recidívy symptomatických. Len v 3 prípadoch bola recidíva zistená v rámci pravidelného vyšetrenia a v 11 prípadoch bola recidíva zistená mimo pravidelného vyšetrenia, jednalo sa teda o „intervalovú recidívu“.
Najčastejším symptómom recidívy ochorenia bola bolesť (n=10). V jednom prípade sa jednalo o vaginálne krvácanie a v jednom prípade o kombináciu vaginálneho krvácania a bolesti. 6 (85 %) pacientok zo 7 s recidívou v panve bolo symptomatických. 8 (80 %) z 10 so vzdialenou metastázou bolo symptomatických.
Medián doby, ktorá uplynula od ukončenia primárnej liečby po zistenie recidívy ochorenia, (tzv. disease-free interval, DFI) bol 15 mesiacov (rozpätie 7-33). Medián DFI asymptomatických pacientok bol 12 mesiacov (rozpätie 9-22) a symptomatických pacientok bol 15 mesiacov (rozpätie 7-33). Medián DFI pacientok len s lokálnou recidívou v panve bol 9 mesiacov (rozpätie 7-18) a medián DFI pacientok len so vzdialenou metastázou bol 20 mesiacov (rozpätie 12-33). Výsledky porovnávania mediánov použitím štatistického testu boli nesignifikantné.
Liečba recidív je uvedená v tabuľke 1. V 9 prípadoch bola aplikovaná chemoterapia, v 3 prípadoch chemo-rádioterapia a v 5 prípadoch operačná liečba v kombinácii s chemoterapiou alebo samostatne.
Medián prežívania po zistení recidívy ochorenia bol 11 mesiacov (rozpätie 4-22). Medián prežívania asymptomatických pacientok bol 12 mesiacov (rozpätie 10-16) a symptomatických pacientok bol 10,5 mesiacov (rozpätie 4-22). Všetky pacientky zomreli do 2 rokov od zistenia recidívy ochorenia. Po 6 mesiacoch od zistenia recidívy žilo 14 (82 %) pacientok a po 12 mesiacoch 6 (35 %) pacientok. Prežívanie asymptomatických a symptomatických pacientok je zobrazené v grafe 1. Testy rovnosti distribučných funkcií prežitia sú uvedené v tabuľke 2. Výsledky neukázali štatisticky významný rozdiel v prežívaní symptomatických a asymptomatických pacientok.
Graph 1. Prežívanie symptomatických a asymptomatických pacientok podľa Kaplana-Meiera p=0,616 
Table 2. Výsledky štatistického spracovania prežívania symptomatických a asymptomatických pacientok 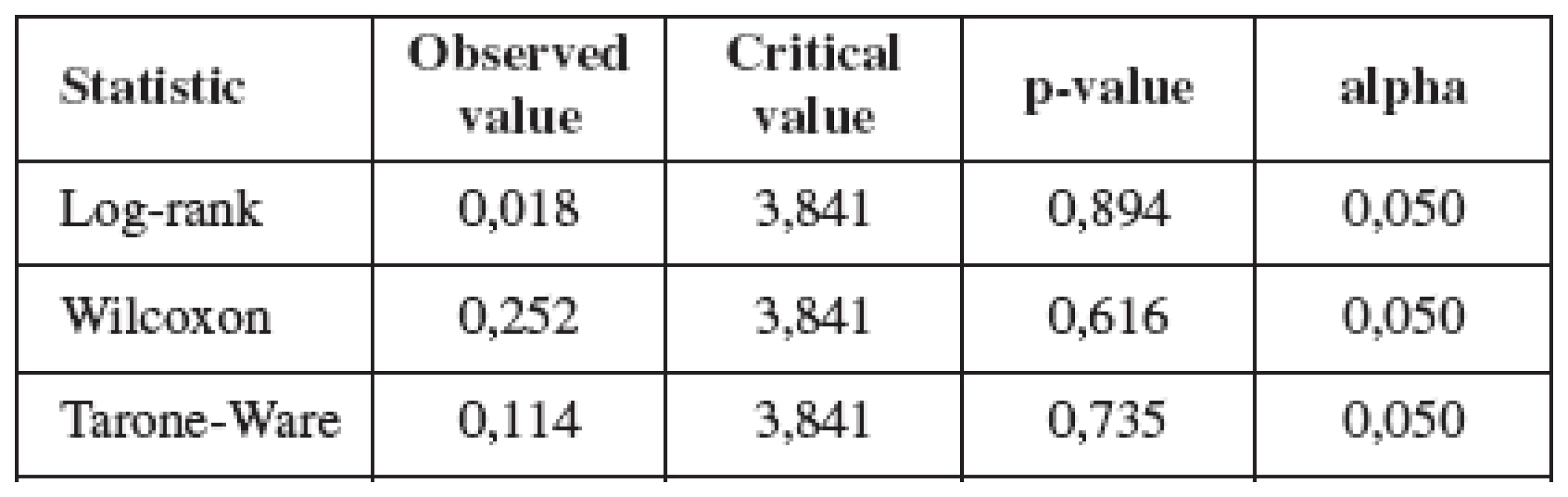
DISKUSIA
Výsledky štúdie potvrdzujú predpoklad, že väčšina pacientok má v čase recidívy symptómy, pričom prvé príznaky recidívy sa objavili medzi dvoma plánovanými vyšetreniami, tzv. „intervalové recidívy“. Podobné výsledky uvádzajú aj Bodurka-Bevers a spol. [3].
Morice a spol. v práci z roku 2004 uvádzajú celkové prežívanie v 2. roku u 25 % pacientok, pričom vyhodnotili 45 pacientok s recidívami [25].
Pravidelné vyšetrenie v rámci sledovania po ukončení primárnej liečby pozostáva z fyzikálneho vyšetrenia, palpačného gynekologického vyšetrenia, vyšetrenia v pošvových zrkadlách, transvaginálneho a abdominálneho ultrazvukového vyšetrenia, stanovenia hladiny SCCA a jedenkrát ročne RTG vyšetrenia hrudníka.
Hoci je Papanicolaou test efektívnou skríningovou metódou, jeho rutinné použitie v detekcii recidívy karcinómu porcia je diskutabilné [5].
Soisson a spol. uvádzajú senzitivitu vaginálnej cytológie 13 % a špecificitu 100 %, senzitivitu gynekologického palpačného vyšetrenia 58 % a špecificitu 96 %. Podľa týchto autorov sa jedná o metódu, ktorá odhalí recidívu v pošve [27].
Bodurka-Bevers a spol. uvádzajú, že vaginálna cytológia neviedla ani v jednom prípade k diagnostike asyptomatickej recidívy a nie je efektívnou metódou v detekcii asymptomatických recidív [3].
Duyn a spol. uvádzajú, že len 2 % recidív bolo zistených na základe pozitívnej cytológie [7].
Lim a spol. rovnako nedoporučujú cytologický ster ako obligátnu metódu na vyhľadávanie recidívy [22].
Chien a spol. uskutočnili rutínne cytologické vyšetrenia u pacientok, ktoré sa podrobili rádioterapii. Len v 3 % recidív cytologický ster koreloval s prítomnou HSIL, resp. s karcinómom. Senzitivita vyšetrenia pre detekciu izolovanej centrálnej recidívy bola 50 % a špecificita 100 % [14].
Injumpa a spol. uvádzajú, že vaginálna cytológia realizovaná po radikálnej hysterektómii a lymfadenektómii má limitovanú hodnotu [18].
Morice a spol. zistili na základe pozitívnej vaginálnej cytológie len jednu recidívu [25].
V našom súbore ani v jednom prípade neviedol cytologický ster k zisteniu recidívy ochorenia.
Recidívy vizualizované v pošve boli diagnostikované cielenou biopsiou. V súčasnosti cytologické stery obligátne nevykonávame, hoci ich použitie môže mať opodstatnenie u pacientok, u ktorých nebola aplikovaná rádioterapia.
Potenciálnou metódou na detekciu recidívy je vyšetrenie nádorového markera SCCA (squamous cell carcinoma antigen) a CEA (carcinoembryonic antigen), ktoré boli identifikované ako senzitívne indikátory recidívy spinocelulárneho karcinómu a adenokarcinómu.
Kato a Torigoe v roku 1977 izolovali SCCA a identifikovali ho ako senzitívny indikátor recidívy ochorenia, zvlášť u pacientov s eleváciou SCCA pred primárnou operáciou [20]. Nevysvetliteľná elevácia nádorových markerov sa môže objaviť bez iných príznakov recidívy ochorenia. Recidívu nemusí sprevádzať elevácia nádorových markerov [13].
Bolli a spol. vyhodnotili 1053 vzoriek u 272 pacientok. Zo 70 pacientok, u ktorých sa zistila recidíva karcinómu cervixu, malo 81 % elevovanú hladinu SCCA. Elevácia SCCA predikuje recidívu karcinómu krčka maternice o 6,9 mesiaca pred detekciou ďalšími metódami. Autori považujú SCCA za dobrý ukazovateľ recidívy ochorenia [4].
Esajas a spol. hodnotili pacientky vo včasných štádiách ochorenia, ktoré sa podrobili radikálnej hysterektómii a panvovej lymfadenektómii s alebo bez rádioterapie. Súčasťou každého vyšetrenia v sledovaní bolo stanovanie hladiny SCCA. Recidíva ochorenia sa vyskytla u 35 (16 %) z 225 pacientok a k elevácii SCCA došlo v 26 prípadoch. Senzitivita vyšetrenia bola 74 %. V 5 (14 %) prípadoch bola elevácia SCCA prvým príznakom recidívy ochorenia. Autori uvádzajú, že analýza SCCA môže pomôcť k skoršej diagnóze recidívy ochorenia, ale v konečnom dôsledku nemá vplyv na dĺžku prežívania pacientok [8]. Stanovenie hladiny SCCA má význam aj v diferenciálnej diagnostike fibrózy a recidívy ochorenia. V rámci pravidelného sledovania vykonávame rutinné stanovenie hladín SCCA v prípadoch spinocelulárneho karcinómu.
Zobrazovacie metódy sú kľúčové v diagnostike recidívy ochorenia. U väčšiny pacientok (80-90 %) s recidívou ochorenia sa zjavia symptómy a známky ochorenia, ktoré vedú k následným diagnostickým procedúram [6].
Ultrasonografickým vyšetrením sa najčastejšie zisťuje metastatické postihnutie pečene, dilatácia močovodov alebo prítomnosť tumoru v panve.
Rutínne použitie cystoskopie, rektoskopie či intravenóznej urografie nemá opodstatnenie [11].
Barter a spol. nedoporučujú rutínne vykonávanie RTG vyšetrenia hrudníka, nakoľko sa nedokázal rozdiel v prežívaní u asymptomatických a u symptomatických pacientok s metastázami v pľúcach [2].
Bodurka-Bevers a spol. doporučujú zahrnúť RTG vyšetrenie hrudníka medzi obligátne metódy sledovania po primárnej liečbe [3].
Soisson a spol. tiež doporučujú zaradiť do rutínneho sledovania RTG pľúc. Prežívanie asymptomatických a symptomatických pacientok s recidívou v pľúcach v našom súbore bolo rovnaké.
Niektorí autori doporučujú rutínne CT vyšetrenia brucha a malej panvy, ale nie je známy signifikantný dopad na dľžku prežívania [19, 24]. V literatúre existuje len málo informácií o benefite NMR oproti CT v diagnostike recidívy karcinómu krčka maternice, ale predpokladá sa, že NMR je presnejším vyšetrením v diagnostike recidívy procesu [15]. V diagnostike symptomatických pacientok hrá CT dôležitú úlohu. Priama biopsia alebo tenkoihlová aspiračná biopsia pod CT kontrolou je dôležitým postupom pri diagnostickom overení recidívy. Úspešnosť v detekcii metastáz v lymfatických uzlinách je pri použití CT od 73 do 83 % a pri použití NMR od 76 do 100 % [5].
Karcinóm krčka maternice je vírusom indukované ochorenie a perzistencia infekcie je jedným z rizikových faktorov zodpovedných za recidívu ochorenia [23].
PET preukázala vysokú citlivosť a presnosť v diagnostike recidívy ochorenia najmä v prípadoch nevysvetliteľných elevácií tumor markerov bez dôkazu recidívy ochorenia inými zobrazovacími technikami [10, 17].
Yen a spol. porovnávali PET a CT-NMR vyšetrenia [28]. Autori dospeli k názoru, že PET je schopné presnejšie diagnostikovať extrapelvické recidívy ako CT-NMR.
Chung a spol. publikovali štúdiu, v ktorej zhodnotili 52 pacientok so suspektnou recidívou karcinómu cervixu. V 31 prípadoch bola dokázaná recidíva. Senzitivita, špecificita a presnosť PET/CT bola stanovená na 90,3 %, 81 % a 86,5 % [16]. Autori uvádzajú, že PET/CT vyšetrenie má vyššiu interpretačnú hodnotu, zlepšuje manažment a liečebné možnosti zistenej recidívy a tiež má pozitívny vplyv na prežívanie pacientok s recidívou ochorenia.
Vzhľadom k vybaveniu Fakultnej nemocnice v Nitre spomínanými zobrazovacími prostriedkami, tieto využívame v rámci diferenciálnej diagnostiky recidívy ochorenia.
ZÁVER
V našom súbore sa nedokázal rozdiel v prežívaní pacientok so symptomatickou a asymptomatickou recidívou.
Kombinácia uvedených vyšetrovacích metód je zatiaľ najefektívnejším spôsobom sledovania pacientok po primárnej liečbe pre karcinóm krčka maternice. Dľžka sledovania je stanovená na 5 rokov, neskôr sú pacientky sledované v ročnom intervale. Vaginálna cytológia nepatrí k rutinnému spôsobu sledovania. Kombinácia zobrazovacích metód, najmä PET/CT umožňuje presnejšiu diagnostiku lokalizácie recidívy. Princípom sledovania je odhaliť recidívu, keď je liečiteľná. Po splnení tejto podmienky má sledovanie medicínsky a ekonomický prínos. Optimálne je sledovanie na základe výsledkov prospektívnych randomizovaných štúdií, ktoré objektívne porovnajú rôzne spôsoby follow-up. Rutinný intenzívny follow-up nemusí byť „cost-effective“ (cenovo efektívny) a zároveň môže neúmerne zvyšovať psychickú úzkosť pacientok.
MUDr. Erik Lajtman
Gynekologicko - pôrodnícka klinika
FN Nitra a UKF v Nitre
Špitálska 6
949 01 Nitra
Slovenská republika
lajtmanerik@gmail.com
Sources
1. Ansink, AC., De Barros Lopes, A., Naik, R., et al. Recurrent stage IB cervical carcinoma: evaluation of the effectiveness of routine follow-up of surveillance. Br J Obstet Gynaecol 1996, 103, p. 1156-1158.
2. Barter, JF., Soong, SJ., Hatch, KD., et al. Diagnosis and treatment of pulmonary metastases from cervical carcinoma. Gynecol Oncol 1990, 38, p. 347-351.
3. Bodurka-Bevers, D., Morris, M., Eifel, PJ., et al. Posttherapy surveillance of women with cervical cancer: an outcomes analysis. Gynecol Oncol 2000, 78, p. 187-193.
4. Bolli, JA., Doering, DL., Bosscher, JR., et al. Squamous cell carcinoma antigen: clinical utility in squamous cell carcinoma of the uterine cervix. Gynecol Oncol 1994, 55, p. 169-173.
5. Dooms, GC., Hricak, H., Crooks, LE., et al. Magnetic resonance imaging of the lymph nodes: comparison with CT. Radiology, 1984, 153, p. 719-728.
6. Dreyer, G., Snyman, L., Mount, A., et al. Management of recurrent cervical cancer. Best Pract Res Clin Obstet Gynecol 2006, 19, p. 631-644.
7. Duyn, A., Van Eijkeren, MV., Kenter, G., et al. Recurrent cervical cancer detection and prognosis. Acta Obstet Gynecol Scand 2002, 81, p. 351-355.
8. Esajas, MD., Duk, JM., de Bruijn, HW., et al. Clinical value of routine serum squamous cell carcinoma antigen in follow-up of patients with early-stage cervical cancer. J Clin Oncol 2001, 19, p. 3960-3966.
9. Greenlee, RT., Murray, T., Bolden, S., et al. Cancer statistics, 2000. CA Cancer J Clin, 2000, 50, p. 7-33.
10. Grigsby, PW., Siegel, BA., Dehdashti, F., et al. Posttherapy surveillance monitoring of cervical cancer by FDG-PET. Int J Radiat Oncol Biol Phys, 2003, 55, p. 907-913.
11. Hricak, H., Powell, CB., Yu, KK., et al. Invasive cervical carcinoma: role of MR imaging in pretreatment work-up versus cost minimization and diagnostic efficacy analysis. Radiology, 1996, 198, p. 403-409.
12. http://data.nczisk.sk/rocenky/rocenka_2007.pdf
13. Chan, YM., Ng, TY., Ngan, HY., et al. Monitoring of serum squamous cell carcinoma antigen levels in invasive cervical cancer: is it cost-effective? Gynecol Oncol, 2002, 84, p. 7-11.
14. Chien, CR., Ting, LL., Hsieh, CY., et al. Post-radiation Pap smear for Chinese patients with cervical cancer: a ten-year follow-up. Eur J Gynaecol Oncol, 2005, 26, p. 619-622.
15. Choi, JI., Kim, SH., Seong, CK., et al. Recurrent uterine cervical carcinoma: spectrum of imaging findings. Korean J Radiol, 2000, 1, p. 198-207.
16. Chung, HH., Jo, H., Kang WJ., et al. Clinical impact of integrated PET/CT on the management of suspected cervical cancer recurrence. Gynecol Oncol, 2007, 104, p. 529-534.
17. Chung, HH., Kim, SK., Kim, TH., et al. Clinical impact of FDG-PET imaging in post-therapy surveillance of uterine cervical cancer: from diagnosis to prognosis. Gynecol Oncol, 2006, 103, p. 165-170.
18. Injumpa, N., Suprasert, P., Srisomboon, J., et al. Limited value of vaginal cytology in detecting recurrent disease after radical hysterectomy for early stage cervical carcinoma. Asian Pac J Cancer Prev, 2006, 7, p. 656-658.
19. Jeong, YY., Kang, HK., Chung, TW., et al. Uterine cervical carcinoma after therapy: CT and MR imaging findings. Radiographics, 2003, 23, p. 969-981.
20. Kato, H., Torigoe, T. Radioimmunoassay for tumor antigen of human cervical squamous cell carcinoma. Cancer, 1977, 40, p. 1621-1628.
21. Kosary, CL., Schiffman, MH., Trimble, EL. Cervix uteri. In: Miller, BA., Ries, LAG., Hankey, BF., et al. SEER Cancer Statistic Review. Bethesda, MD: US Department of Health and Human Services, 1993, p. 1973-1990.
22. Lim, KC., Howells, RE., Evans, AS. The role of clinical follow up in early stage cervical cancer in South Wales. BJOG, 2004, 111, p. 1444-1448.
23. Mlynček, M. Sledování po ukončení léčby. In: Cibula, D., Petruželka, L. a kol. Onkogynekologie. Praha: Grada Publishing, 2009, p. 450-451.
24. Monk, BJ., Tewari, KS. Invasive cervical cancor. In: DiSaia, PJ., Creasman, WT. Clinical Gynecologic Oncology. 6th ed. St Louis, MO: Mosby, 2007, p. 55-125.
25. Morice, P., Deyrolle, C., Rey, A., et al. Value of routine follow-up procedures for patients with stage I/II cervical cancer treated with combined surgery-radiation therapy. Ann Oncol, 2004, 15, p. 218-223.
26. Olaitan, A., Murdoch, J., Anderson, R., et al. A critical evaluation of current protocols for the follow-up of women treated for gynecological malignancies: a pilot study. Int J Gynecol Cancer, 2001, 11, p. 349-353.
27. Soisson, AP., Geszler, G., Soper, JT., et al. A comparison of symptomatology, physical examination, and vaginal cytology in the detection of recurrent cervical carcinoma after radical hysterectomy. Obstet Gynecol, 1990, 76, p. 106-109.
28. Yen, TC., Lai, CH., Ma, SY., et al. Comparative benefits and limitations of (18)F-FDG PET and CT-MRI in documented or suspected recurrent cervical cancer. Eur J Nucl Med Mol Imaging, 2006, 33, p. 1399-1407.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2010 Issue 2-
All articles in this issue
- Aquaporiny a regulace cirkulace plodové vody
- Peripartálne hysterektómie – audit na Slovensku v roku 2007
- Monitorování hladin markerů aktivace endotelu během fyziologické gravidity
- První zkušenosti s novou minipáskou k léčbě stresové inkontinence moči u žen – MiniArc
- Význam resektoskopie v diagnostice karcinomu endometria
- Doporučení pro hormonální substituční terapii v postmenopauze
- Současné možnosti diagnostiky vulvovaginálních infekcí
- Vztah stresové inkontinence moči či urgence k defektu předního kompartmentu před jeho operačním řešením a po něm
- Alogenní prolenové implantáty ve srovnání se sakrospinální fixací v léčbě prolapsu; randomizovaná multicentrická prospektivní srovnávací studie
- Změny délky implantované síťky po rekonstrukčním výkonu přední stěny poševní
- Zhodnotenie rutinného sledovania pacientok po primárnej liečbe pre karcinóm krčka maternice v I. a II. štádiu: retrospektívna analýza
- Antikoncepční chování českých žen: Výsledky národního výzkumu
- K článku Běžný variabilní imunodeficit v těhotenství (soubor kazuistik)
- 20th World Congress on Ultrasound in Obstetrics and Gynecology
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současné možnosti diagnostiky vulvovaginálních infekcí
- Doporučení pro hormonální substituční terapii v postmenopauze
- Význam resektoskopie v diagnostice karcinomu endometria
- První zkušenosti s novou minipáskou k léčbě stresové inkontinence moči u žen – MiniArc
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

