-
Medical journals
- Career
Problematika interpretace výsledků molekulárně genetických vyšetření se zaměřením na mutace v CFTR genu u mužů s poruchami reprodukce a u dárců/dárkyň gamet
Authors: I. Hrdlička
Authors‘ workplace: Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha, přednostka doc. MUDr. M. Kohoutová, CSc.
Published in: Ceska Gynekol 2008; 73(6): 323-327
Overview
Cíl studie:
Prezentace výsledků molekulárně genetických vyšetření u mužů s poruchami reprodukce a u dárců/dárkyň gamet se zaměřením na problematiku interpretace výsledků vyšetření CFTR genu.Typ studie:
Původní práce.Název a sídlo pracoviště:
Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha.Metodika:
U 164 mužů s poruchami reprodukce jsme vyšetřili 36 vybraných mutací v CFTR genu, včetně T(n) polymorfismu a dále mikrodelece chromozomu Y. Mutace v CFTR genu včetně T(n) polymorfismu jsme vyšetřili rovněž u 104 dárců/dárkyň gamet.Výsledky:
U postižených mužů jsme ve 3 případech detekovali mikrodelece v oblasti AZF a v dalších 3 případech jsme zjistili mutaci F508del (heterozygoti) v CFTR genu s variantou T5 v pozici trans. Mimo to jsme u 5 postižených mužů detekovali „pouze“ heterozygotní mutace v CFTR genu a u 12 mužů „pouze“ variantu T5 v heterozygotní formě.
Mezi dárci/dárkyněmi gamet jsme zachytili 3 heterozygoty pro mutaci F508del a 11 heterozygotů pro variantu T5.Závěr:
Doporučujeme vyšetřovat u infertilních mužů a u dárců/dárkyň gamet mimo „klasické“ mutace v CFTR genu také relativně častou variantu T5, která se může za určitých okolností považovat za patogenní mutaci. Přenašeče varianty T5 je třeba vyloučit z dárcovství gamet.Klíčová slova:
poruchy reprodukce, dárci gamet, Y chromozom, gen CFTR, mutace, varianty.ÚVOD
S infertilitou se potýká až 15 % párů v reprodukčním věku. U postižených párů je až v 50 % zjištěna mužská infertilita [5]. U řady mužů mohou za neplodnost genetické příčiny, a to buď ve smyslu chromozomálních aberací, detekovaných cytogenetickými metodami, nebo ve smyslu genových mutací, které jsou prokazovány molekulárně genetickými metodami.
U některých infertilních párů, bez ohledu na to, zda je infertilní muž či žena, může být početí umožněno příjmem dárcovské gamety, buď spermie, nebo oocytu. Dárci/dárkyně gamet bývají, mimo jiné, rovněž molekulárně geneticky vyšetřeni.
Molekulárně genetická diagnostika u mužů s poruchami reprodukce, stejně jako molekulárně genetické vyšetření u dárců/dárkyň gamet, se dnes provádí, v podstatě rutinně, na řadě českých pracovišť.
U postižených mužů se obvykle vyšetřují mikrodelece Y chromozomu v oblasti AZF (AZoospermia Factor) s tím, že ve zmíněné oblasti se nacházejí geny regulující vývoj spermií a případné mikrodelece pak způsobují mužskou neobstrukční sterilitu [8]. Dále se u mužů s poruchami reprodukce vyšetřují vybrané mutace v genu CFTR (Cystic Fibrosis Transmembrane conductance Regulator), které mohou způsobovat izolovanou, zejména obstrukční, sterilitu [4]. Mutace v CFTR genu se jinak samozřejmě obecně vyšetřují při podezření na cystickou fibrózu (CF).
U dárců/dárkyň gamet se molekulárně geneticky vyšetřují „pouze“ mutace v CFTR genu, a to vzhledem k tomu, že každý zhruba 26. až 33. člověk v České republice je zdravým heterozygotním přenašečem těchto mutací [1].
Obecné genetické aspekty CFTR genu jsou velmi dobře, aktuálně a nad rámec tohoto sdělení probrány i v české literatuře, a to v pracích Balaščákové a Piskáčkové et al. [1] z roku 2008 a Vávrové et al. [10] z roku 2006. V publikaci Vávrové et al. [10] lze nalézt navíc komplexní informace o problematice CF. V tomto příspěvku se budeme zabývat zejména mutacemi v CFTR genu u mužů s poruchami reprodukce a u dárců/dárkyň gamet.
V posledních letech se objevila řada nových poznatků o mutacích a zdánlivě neškodných variantách v CFTR genu [1, 2, 9, 10]. Zdá se však, že ačkoliv je vyšetření mutací v CFTR genu u nás jedním z nejvíce nabízených molekulárně genetických vyšetření, chápání a interpretace některých nových poznatků se mezi genetiky a dalšími zainteresovanými specialisty mohou značně odlišovat (viz níže).
Připomeňme, že CFTR gen kóduje protein o 1480 aminokyselinách, kterýžto protein tvoří chloridový kanál buněk. Mutace v CFTR genu jsou známy coby mutace odpovědné za cystickou fibrózu, což je nejčastější závažné autozomálně recesivní onemocnění v Evropě. V ČR je incidence této choroby udávána obvykle 1 : 2736 novorozenců, tzn. že každý 26. člověk je „zdravý“ heterozygotní přenašeč s mutací „pouze“ na jednom párovém chromozomu. Statisticky je tak jedno z 676 manželství v ČR manželstvím dvou přenašečů s 25% rizikem narození dítěte postiženého CF [10]. Poslední publikované údaje však naznačují, že by incidence CF mohla být v naší zemi trochu nižší, asi 1 : 2700–3800, čímž by se počet heterozygotních přenašečů snížil na 1 : 26–33 [1].
Dosud je známo asi 1500 mutací v CFTR genu s tím, že nejčastější mutace je F508del, která zaujímá celosvětově asi dvě třetiny všech „CF chromozomů“. Z uvedených 1500 mutací je jich, z hlediska klinického efektu, více než 1200 patogenních. Avšak zhruba u více než 200 mutací je patogenita sporná, či přímo vyloučena. Nepatogenní mutace bývají nazývány variantami. Mezi variantami a patogenními mutacemi existuje kontinuum z hlediska jejich patogenního potenciálu. U některých variant tak není patogenita jednoznačná, navíc mohou mít varianty aditivní efekt a vytvářet polyvariantní haplotypy, které vedou k onemocnění [1, 2, 10].
Pro laboratorní diagnostiku a následnou interpretaci výsledků je žádoucí shrnout:
- Pokud je pacient vyšetřován pomocí různých komerčních souprav, kde bývají jako mutace označeny též změny, které jsou z hlediska klinického efektu neškodnými variantami, může, bez hlubší znalosti problematiky, docházet k mylným interpretacím. Například i v kvalitních a u nás používaných kitech INNO-Lipa je za mutaci označovaná varianta I148T, která se ovšem sama o sobě nechová jako mutace s klinickm efektem. O tom, že I148T již není považovaná za patogenní mutaci, se ví od roku 2004 [12].
- V případě dvou mutací v pozici trans, kdy každá z mutací leží na jiném z párových chromozomů, je pro fenotyp pacienta rozhodující „mírnější“ mutace. Pro efekt „mírnějších“ mutací platí, zdá se, formulace Vávrové [10], „…že nejvyšší požadavky na funkci proteinu CFTR má mužské reprodukční ústrojí. Mutace vedoucí k relativně „mírnější“ redukci hladiny funkčního CFTR způsobují mužskou neplodnost, aniž by ovlivnily jiné orgány, kde se obecně považuje úroveň 5% normy za hraniční pro rozvoj klasické formy CF.“ (str. 436). V pozici cis, tedy na stejném chromozomu, kdy je dvěma mutacemi postižen jeden ze dvojice CFTR genů, je rozhodující závažnější mutace. U dvou mutací v pozici cis však může docházet i k aditivnímu efektu.
- Některé varianty, resp. mutace, se v homozygotní formě tedy v pozici trans chovají jako varianty bez klinického efektu, avšak jsou-li v pozici trans k nějaké závažné mutaci (třeba F508del) mají klinický efekt, coby mírné mutace. Navíc tyto varianty/mutace mohou modelovat klinický efekt některých mutací v pozici cis. Pohled na takové varianty/mutace se v průběhu let a pokračujících výzkumů mění, což má za následek, že jsou tyto změny v CFTR genu brány jednou za nepatogenní (varianty), jindy zase jsou označeny za mutace s klinickým efektem. Typickým příkladem je polymorfismus v intronu 8, označovaný jako IVS-8 T(n) s 5, 7 či 9 tyminy (T), který způsobuje alteraci sestřihu exonu 9, ve smyslu snížení příslušné RNA asi na 60 % u alely T5 a asi na 90 % u alely T7 [4]. Uvádí se, že „variantu“ T5 má přibližně 5 % genů CFTR v náhodné evropské kontrolní populaci [1]. T(n) polymorfismus bývá však v poslední době uváděn v cis komplexu s dalším polymorfismem, označeným IVS-8 TG(n), který se nachází rovněž v intronu 8. V polymorfismu TG(n) se opakuje dinukleotid TG 11–13krát. Se stoupajícím počtem dinukleotidu TG(n) v cis kombinaci s T5 stoupá patogenetický efekt těchto tzv. komplexních alel [1, 2].
O patogenetické vazbě T(n) polymorfismu k mužské infertilitě se v česky psané literatuře zmiňují postupně Macek et al. [4], Simpson [9], Vávrová [10] a Balaščáková a Piskáčková et al. [1]. Nicméně uvedení autoři neříkají jednoznačně, zda je T5 subklinická varianta či mírná mutace. Z letošní publikace Balaščákové a Piskáčkové et al. [1] vyplývá, že T5 dokonce ani v kombinaci s TG13 nemusí vést ke klinickému efektu a dále, že i TG11-T5 může mít klinicky efekt. Nález T5 varianty u infertilního muže či u dárce gamet může tedy být, jak vidno podle naší literatury, trochu problematické interpretovat.
Česká literatura o CF je sice obdobná jako literatura zahraniční, nicméně v tuto chvíli asi nejaktuálnější letošní zahraniční publikace od Castellaniho et al. [2] uvádí zásadní informaci, že komplex TG13–T5 je mutace způsobující CF nebo onemocnění příbuzné CF (CFTRpatie). Dále Castellani et al. [2] uvádí, že komplex TG12–T5 je mutace, způsobující onemocnění příbuzné CF, jež však může způsobit i CF a kombinace TG11–T5 je uváděna jako mutace, která může způsobit onemocnění příbuzné CF, ale obvykle nemá žádný klinický efekt. Zdá se tedy, že pro detailnější interpretace nálezů varianty T5, by bylo vhodné zařadit i vyšetření TG(n) polymorfismu, což ovšem doporučuje i Balaščáková a Piskáčková et al. [1]. Je zřejmé, že TG12–T5 a TG11–T5 budou tvořit určitou hranici z hlediska klinického efektu, a to, zda bude určitý člověk bez klinického efektu, bude záležet také na dalších faktorech, jako jsou pohlaví, genové pozadí atd. Nález T5 ovšem ani v případě TG11–T5 nelze vyhodnotit jako nález bez určitého rizika, což sice komplikuje interpretaci nálezu u infertilních mužů, ale jistě umožňuje vyřadit samotné T5 nosiče (bez ohledu na TG(n) polymorfismus) z anonymního dárcovství gamet (viz také kapitolu Diskuse a závěr).
SOUBOR VYŠETŘOVANÝCH A METODIKA
Molekulárně genetické vyšetření mužů s poruchami reprodukce je pro naše pracoviště indikováno klinickým genetikem. Obvykle (v přibližně 85 %) jsou požadována dvě vyšetření.
První je vyšetření mikrodelecí Y chromozomu, konkrétně oblasti AZF, která má tři podoblasti (AZFa, AZFb, AZFc). Vyšetřuje se 6 úseků, a to vždy dva vybrané úseky v každé ze tří AZF podoblasti, podle příslušného uznávaného protokolu od Simoni et al. [7].
Druhým požadovaným vyšetřením je detekce vybraných mutací v CFTR genu. Vyšetřujeme 36 mutací plus T(n) polymorfismus intronu 8 v CFTR genu pomocí kitů INNO-Lipa CFTR17+Tn Update a INNO-Lipa CFTR19. Konkrétně vyšetřujeme tyto mutace:
F508del, G542X, N1303K, W1282X, G551D, 1717 1G→A, R553X, CFTRdele2,3(21kb), I507del, 711+1G→T, 3272-26A→G, 3905insT, R560T, 1898+1G→A, S1251N, „mutace“ I148T, 3199del6, 3120+1G→A, Q552X, 621+1G→T, 3849+10kbC→T, 2183AA→G, 394delTT, 2789+5G→A, R1162X, 3659delC, R117H, R334W, R347P, G85E, 1078delT, A455E, 2143delT, E60X, 2184delA, 711+5G→A.
Námi vyšetřované mutace z obou kitů představují záchyt 93,43 % z mutací (ve smyslu procentuálního zastoupení jednotlivých mutací), které byly v posledních 10 letech nalezeny u pacientů z České republiky vyšetřených v CF centru FN Motol [1].
Pokud jde o dárce a dárkyně gamet, je jejich vyšetření indikováno pro naše pracoviště rovněž klinickým genetikem. U dárců/dárkyň gamet vyšetřujeme samozřejmě „pouze“ výše uvedené mutace v CFTR genu plus T(n) polymorfismus.
V průběhu tří let (červen 2005 – květen 2008) jsme vyšetřili mikrodelece Y chromozomu a vybrané mutace v CFTR genu u 164 mužů s definovanými poruchami reprodukce, konkrétně u 72 mužů s azoospermií a 92 mužů s oligospermií.
Mutace v CFTR genu včetně T(n) polymorfismu v intronu 8 jsme během tří let vyšetřili rovněž u 104 dárců/dárkyň (16/88) gamet.
VÝSLEDKY
U 164 postižených mužů jsme ve 3 případech detekovali mikrodeleci v oblasti AZF (1x delAZFb, 2x delAZFb+c) a dále jsme ve 3 případech zjistili kombinaci závažné mutace F508del (heterozygozita) v CFTR genu s „variantou“ T5 v pozici trans k zjištěné mutaci. Příčinu poruchy reprodukce jsme tak naším vyšetřením nalezli u 6 (3,7 %) infertilních mužů (5 mužů s azoospermií a 1 muž s oligospermií).
Mimo to jsme u 5 postižených mužů (1 muž s azoospermií a 4 muži s oligospermií) detekovali „pouze“ heterozygotní mutace v CFTR genu (3x F508del, 1x CFTR dele2,3(21kb), 1x 3659delC) a u 12 mužů (3 muži s azoospermií a 9 mužů s oligospermií) „pouze“ „variantu“ T5 v heterozygotní formě. Mutace a polymorfismy, jež samy o sobě nestačí ke způsobení mužské infertility, ale spolupodílejí se na poruše reprodukce, jsme tak naším vyšetřením nalezli u 17 (10,4 %) infertilních mužů. U 2 postižených mužů jsme detekovali neškodný polymorfismus I148T. Přehled zjištěných mutací a polymorfismů u infertilních mužů viz v tabulce 1.
Table 1. Přehled zjištěných mutací a polymorfismů v souboru 164 infertilních mužů s azoospermií (č. 1–10) a oligospermií (č. 11–25). Wt = wild type, zde jde o standardní párovou alelu CFTR genu bez mutace 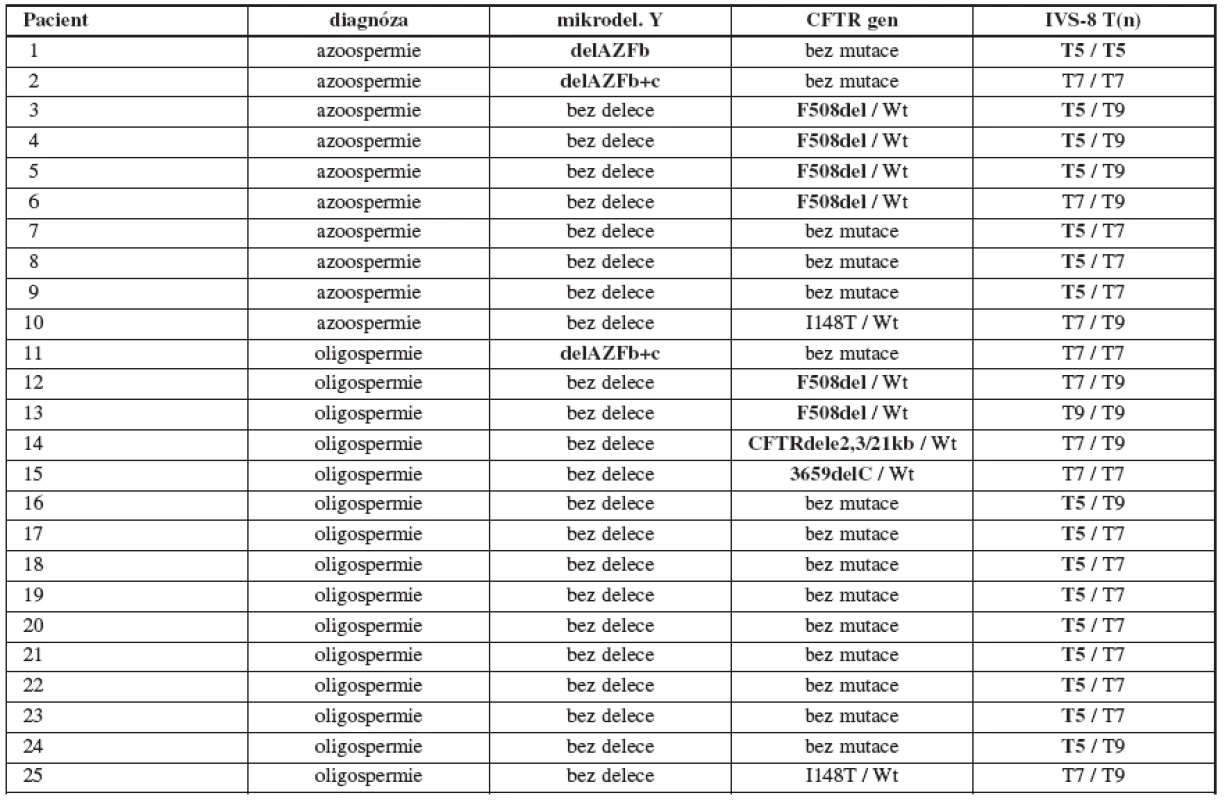
U jednoho pacienta (č. 1 v tab. 1) byla detekovaná jak mikrodelece v Y chromozomu, tak i homozygozita pro T5 variantu.
Mezi dárci/dárkyněmi gamet jsme zachytili 3 (2,9 %) heterozygoty pro mutaci F508del a 11 (10,6 %) heterozygotů pro „variantu“ T5, dohromady tak byly změny podílející se poruše reprodukce zachyceny u 14 (13,5 %) zdravých dárců/dárkyň gamet. Přehled zjištěných mutací a polymorfismů u dárců/dárkyň gamet viz v tabulce 2.
Table 2. Přehled zjištěných mutací a polymorfismů v souboru 104 dárců/dárkyň (16/88) gamet. Wt = wild type, zde jde o standardní párovou alelu CFTR genu bez mutace 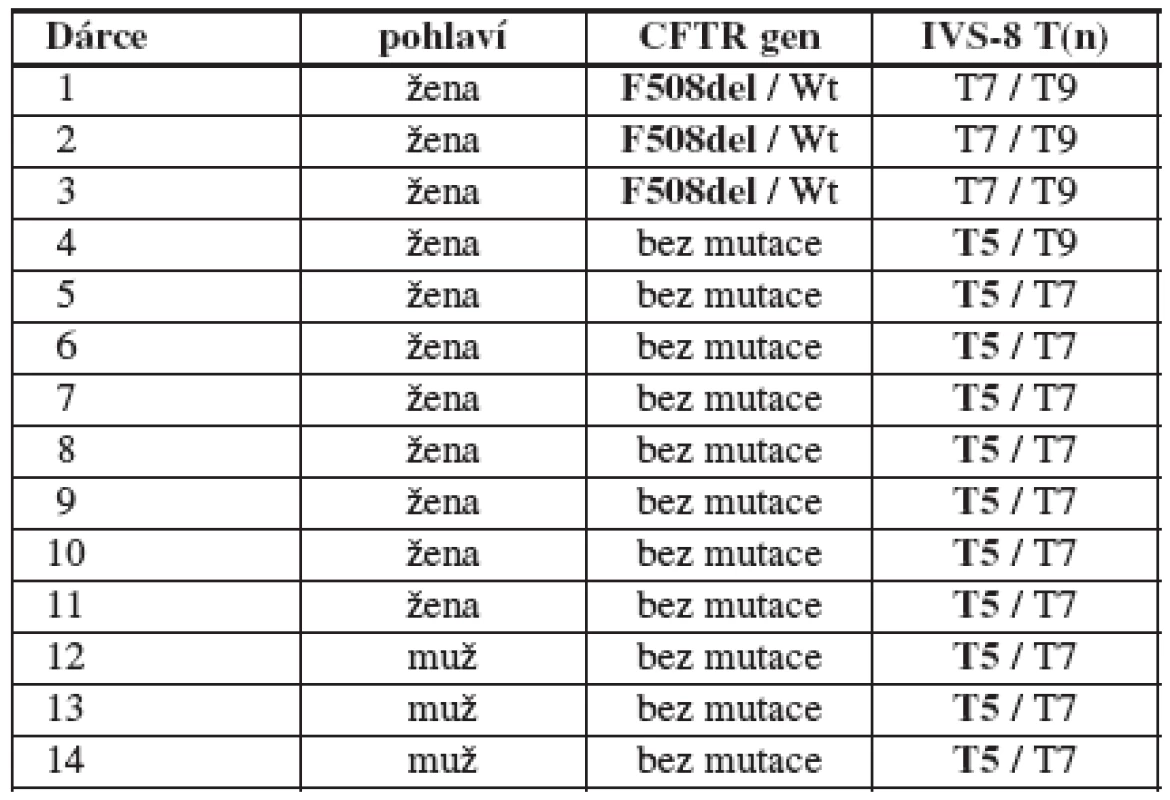
DISKUSE A ZÁVĚR
U infertilních pacientů se při rutinní diagnostice očekává záchyt mikrodelecí Y chromozomu pod 2 %, ovšem s tím, že u mužů s azoospermií je záchyt vyšší, asi 2–10 % [8]. V souladu s literaturou jsme tak v našem souboru 164 infertilních pacientů zjistili mikrodelece u tří mužů, tj. 1,8 %, přesněji ze 72 mužů s azoospermií byla zjištěna mikrodelece u dvou, tj. 2,8 % a z 92 mužů s oligospermií byla zjištěna mikrodelece u jednoho, tj. 1,1 %.
Mutacemi a „variantami“ v CFTR genu (konkrétně mutací F508del a T5 „variantou“ v pozici trans) jsme s vysokou mírou pravděpodobnosti objasnili infertilitu u tří mužů (1,8 %). Mutace a „varianty“ v CFTR genu tak byly v našem souboru stejně častou příčinou mužské infertility jako mikrodelece Y chromozomu. Incidence mutací v CFTR genu u infertilních mužů jako celku nebývá uváděna, v literatuře bývá obvykle uváděn záchyt u mužů s CBAVD (congenital bilateral absence of the vas deferens). U našich pacientů jsme ovšem neměli informace o jejich vyšetření na CBAVD, věděli jsme pouze, že mají poruchu reprodukce ve smyslu azoospermie či oligospermie. Výtěžnost našich vyšetření, tedy objasnění příčiny infertility, byla u mužů s azospermií výrazně vyšší (5 ze 72, tj. 6,9 %) než u mužů s oligospermií (1 z 92, tj. 1,1 %).
Mutace v CFTR genu byly v souboru infertilních mužů (u 8 ze 164) častější (1 : 20) než v běžné populaci (1 : 26–33), zatímco výskyt T5 „varianty“ u nich byl co do počtu alel (17 z 328) srovnatelný (5,2 %) se zdravými dárci/dárkyněmi gamet (5,3 %) i s náhodnou evropskou kontrolní populací (přibližně 5 % [1]) .
U dárců/dárkyň gamet byla incidence mutací v CFTR genu 1 : 35, oproti incidenci 1 : 26-33 u běžné populace.
Pokud jde o „variantu“ T5, tak, jak již bylo řečeno výše, je možno považovat ji v cis komplexu s TG13 a TG12 za CF mutaci a v kombinaci s TG11 za určitých okolností jako možnou CF mutaci [2]. Tato situace v budoucnu asi poněkud změní nazírání na incidenci mutací CFTR genu v různých populacích, protože vzhledem k Ī5% zastoupení T5 alel v náhodné evropské populaci je možno očekávat incidenci T5 heterozygotů zhruba 1 : 10. Podíl nosičů prokazatelně patogenních komplexních alel TG13–T5 a TG12–T5 ve větším souboru přenašečů T5 však zatím nebyl, pokud vím, zjišťován. Bohužel, komplexní alely TG13–T5 a TG12–T5 nejsou zatím uváděny jako CF mutace ani v přehledech mutací z významných pracovišť, např. z českého CF centra ve FN Motol. Navíc samo vyšetření TG(n) polymorfismu pro rutinní klinické využití je dost problematické [3, 6] a není zatím běžně prováděno. V ČR toto vyšetření neuvádí ve své nabídce (září 2008) ani CF centrum ve FN Motol, kde jsou však schopni vyšetření TG(n) polymorfismu zajistit.
Z poznatků o T(n) polymorfismu nicméně vyplývá (bez ohledu na TG(n) polymorfismus), že přenašeči T5 „varianty“ s poruchou reprodukce mají obecně při IVF či příp. spontánní koncepci (u oligospermie) vyšší riziko CF u potomků a v případě početí synů navíc vyšší riziko, že tito synové budou také trpět poruchami reprodukce. Ve světle těchto poznatků tak již úplně neplatí jen dva roky staré stanovisko z výborné publikace Vávrové [10], že při prenatální diagnostice je možno „….uklidnit a ujistit pacientky s genotypem F508del/ IVS-8 „5T“, že se v jejich případě jedná pouze o „kontextuálně patogenní“ variantu genu CFTR, klinicky se eventuálně projevující pouze u synů.“ (str. 424–425).
V současné době není rovněž pro řadu klinických genetiků důvodem vyřadit nosiče „varianty“ T5 z dárcovství gamet. Autor tohoto článku se dotazoval 6 zkušených atestovaných klinických genetiků s mnohaletou praxí, zda by pro ně byl důvod vyřadit nosiče T5 „varianty“ z dárcovství gamet a zjistil (personální informace), že pro polovinu dotazovaných by to nebyl důvod k vyřazení z dárcovství, což je, vzhledem k tomu, že T5 „varianta“ se může chovat jako CF mutace, poněkud zneklidňující.
Závěrem je možno shrnout, že je velice žádoucí vyšetřovat u infertilních mužů a u dárců/dárkyň gamet mimo „klasické“ mutace v CFTR genu také „variantu“ T5. V případě nálezu T5 u infertilního muže je nutno tento nález vyhodnotit jako pravděpodobnou mutaci a do budoucna je vhodné zvážit vyšetření TG(n) polymorfismu pro přibližné stanovení klinického efektu. Nutné je také, zejména před IVF, doplnit vyšetření partnerky na přenašečství mutací a T5 „varianty“.
Dárce/dárkyně gamet, kteří jsou přenašeči T5 „varianty“, je potřeba z dárcovství gamet vyloučit.
PODĚKOVÁNÍ
Za přečtení článku a cenné připomínky děkuji vedoucímu CF centra a přednostovi Ústavu biologie a lékařské genetiky 2. LF UK a FN Motol panu prof. MUDr. M. Mackovi, DrSc., a dále primáři Ústavu biologie a lékařské genetiky 1. LF UK a VFN panu MUDr. J. Kotlasovi. Za spolupráci při vyšetřování pacientů v naší laboratoři děkuji laborantce paní M. Škodové.
Mgr. Ivan Hrdlička, Ph.D.
Ústav biologie a lékařské genetiky 1. LF UK a VFN
Albertov 4
128 08 Praha 2
e-mail: hrdlickai@seznam.cz
Sources
1. Balaščáková, M., Piskačková, T., Holubová, A., et al. Současné metodické postupy a přehled preimplantační, prenatální a postnatální DNA diagnostiky cystické fibrózy v České republice. Čes-slov Pediatr, 2008, 63, 2, s. 62–75.
2. Castellani, C., Cuppens, H., Macek, M. ml., et al. Consensus on the use and interpretation of cystic fibrosis mutation analysis in clinical practice. J Cyst Fibrosis, 2008, 7, p. 179-196.
3. Costa, C., Goossens, M., Girodon E. Simultaneous molecular haplotyping of both IVS8 (TG)m and (T)n tracts in the CFTR gene: still a challenge. Clin Chem., 2006, 52, p. 1621-1622.
4. Macek, M., Vilímková, Š., Potužníková P., et al. Využití lékařské genetiky v reprodukční medicíně. Čas Lék čes, 2002, 141, 1, s. 28-34.
5. Martin, RH. Cytogenetic determinants of male fertility. Hum Reprod Update, 2008, 14, p. 379-390.
6. Millson, A., Pont-Kingdon, G., Page, S., Lyon, E. Direct molecular haplotyping of the IVS-8 poly(TG) and polyT repeat tracts in the cystic fibrosis gene by melting curve analysis of hybridization probes. Clin Chem, 2005, 51, p. 1619-1623.
7. Simoni, M., Bakker, E., Eurlings, MC., et al. Laboratory guidelines for molecular diagnosis of Y-chromosomal microdeletions. Int J Androl, 1999, 22, p. 292-299.
8. Simoni, M., Bakker, E., Krausz, C. EAA/EMQN best praktice guidelines for molecular diagnosis of y-chromosomal microdeletions. State of the art 2004. Int J Androl, 2004, 27, p. 240-249.
9. Simpson, JL. Hledání významu screeningu cystické fibrózy. Gyn po prom, 2005, s. 26-31.
10. Vávrová, V. Cystická fibróza 1. vyd. Praha: Grada Publishing, 2006, s. 516.
11. Vogt, H., Falcao, CL., Hanstein, R., Zimmer, J. The AZF proteins. Int J Androl, 2008, 31, p. 383-394.
12. Watson, MS., Cutting, GR., Desnick, RJ., et al. Cystic fibrosis population carrier screening: 2004 revision of American College of Medical Genetics mutation panel. Genet Med, 2004, 6, p. 387-391.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2008 Issue 6-
All articles in this issue
- Problematika interpretace výsledků molekulárně genetických vyšetření se zaměřením na mutace v CFTR genu u mužů s poruchami reprodukce a u dárců/dárkyň gamet
- Involuce fetálního thymu v ultrazvukovém obraze
- Vrozené vady v České republice v roce 2006
- Prenatální diagnostika vrozených vad diagnostikovaných ultrazvukem Česká republika 1994–2007
- Molekulární biologie preinvazivních a invazivních nádorů prsu
- Oxidační stres v diagnostice a léčbě idiopatické mužské neplodnosti
- Klinický význam mikrometastáz karcinomu prsu v sentinelové uzlině
- Opodstatnenosť hysteroskopie v klinickej praxi Analýza 605 výkonov jedného centra
- Efektivita a bezpečnost solifenacinu v běžné praxi – klinické hodnocení fáze IV
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Problematika interpretace výsledků molekulárně genetických vyšetření se zaměřením na mutace v CFTR genu u mužů s poruchami reprodukce a u dárců/dárkyň gamet
- Klinický význam mikrometastáz karcinomu prsu v sentinelové uzlině
- Opodstatnenosť hysteroskopie v klinickej praxi Analýza 605 výkonov jedného centra
- Efektivita a bezpečnost solifenacinu v běžné praxi – klinické hodnocení fáze IV
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

