-
Medical journals
- Career
Štúdium slinných proteínov proteomickými metódami pri parodontálnych ochoreniach
(Prehľadový článok)
Authors: V. Schwartzová 1; G. Laputková 2; J. Sabo 2
Authors‘ workplace: I. stomatologická klinika, Univerzita P. J. Šafárika, LF, Košice, Slovensko 1; Ústav lekárskej a klinickej biofyziky, Univerzita P. J. Šafárika, LF, Košice, Slovensko 2
Published in: Česká stomatologie / Praktické zubní lékařství, ročník 117, 2017, 3, s. 60-67
Category: Review Article
Overview
Predmet oznámenia:
Cieľom predkladanej práce je podať stručný prehľad o najnovších úspechoch pri štúdiu slinných proteínov proteomickými metódami pri parodontálnych ochoreniach.
Tradičné diagnostické metódy založené na posúdení vizuálnych a rádiografických informácií o stave parodontu zlyhávajú pri identifikácii osôb ohrozených vznikom ochorenia a pri stanovení stupňa susceptibility k progresii ochorenia.
V poslednom období došlo pri skúmaní telových tekutín, vrátane analýzy slín, k výraznému rastu použitia proteomických metód, ktoré sa stávajú doplnkovým nástrojom aj pri diagnostike ochorenia parodontu. Pri hľadaní potenciálnych biomarkerov sliny poskytujú rad výhod zahŕňajúcich dostupnosť vzorky, možnosť neinvazívneho odberu a komplexnosť obsahu proteínov.
Je preto veľkou výzvou stanoviť kritériá pre diagnostiku ochorení parodontu, ktoré by boli založené na dôkazoch (evidence-based criteria). Tento prístup, ktorý využíva technológie na báze hmotnostnej spektrometrie, je schopný identifikovať a kvantifikovať veľké počty proteínov a ich izoforiem v jednej komplexnej vzorke orálnej tekutiny a extrahovať podrobné informácie o regulačných mechanizmoch hostiteľa na úrovni proteínu.Záver:
Klinická diagnostika na báze analýzy orálnych tekutín, najmä tá, ktorá využíva proteomické metódy, umožňuje určiť vzťah medzi proteínami slín a daným ochorením. Preto je zámerom tohto článku snaha poskytnúť aktuálne informácie týkajúce sa štúdia slinných proteínov proteomickými metódami a ich vhodnosti použitia ako biomarkerov pre diagnostiku ochorení parodontu.Kľúčové slová:
slina – proteomické metódy – parodontálne ochoreniaÚVOD
Ochorenia parodontu sú globálne rozšírené mikrobiologicky vyvolané zápalové ochorenia, ktoré postihujú ústnu dutinu ovplyvňujúc štruktúry závesného aparátu zuba [5]. Parodontálne ochorenia zahŕňajú zápal ďasien, poruchy závesného aparátu zubov, periodontálnych ligament, alveolárnej kosti a vedú k progresívnej ireverzibilnej deštrukcii tkaniva, resorpcii alveolárnej kosti a nakoniec k strate zubov [13]. Je známe, že polymikrobiálne kolónie rastúce na povrchu zubov aktivujú zápalové a imunitné reakcie hostiteľa prostredníctvom interakcie hostiteľ-parazit. Subgingiválna mikroflóra pri parodontálnych ochoreniach pozostáva zo stoviek bakteriálnych druhov, no iba niektoré baktériálne kmene sú spájané s rozvojom ochorení parodontu [1]. Aj keď je v etiológii ochorení parodontu preukázaná primárna úloha zubného biofilmu, imunitná odpoveď hostiteľa hrá kľúčovú úlohu v patogenéze ochorenia viac než priamy atak baktérií.
Až donedávna boli ochorenia ústnej dutiny, vrátane parodontitídy, považované za poškodenia lokalizované v ústnej dutine. Najnovšie výskumy však naznačujú, že môžu byť prejavom celkového zdravotného stavu organizmu. Ochorenie parodontu môže byť sprievodným prejavom systémových ochorení, ako sú diabetes mellitus a ateroskleróza, leukémia alebo iné poruchy funkcie bielych krviniek. Ak sú však ochorenia parodontu neliečené, môžu na druhej strane pôsobiť ako rizikové faktory pri vzniku systémových ochorení, ako sú kardiovaskulárne a pľúcne ochorenia [27].
Diagnostika ochorení parodontu sa spolieha na analýzu údajov získaných počas posudzovania stavu parodontu a z tradičnej dentálnej rádiografie. Sledujú sa také klinické parametre, ako je prítomnosť alebo neprítomnosť vizuálnych prejavov zápalu, ulcerácie, množstvo pozorovaného zubného plaku a kameňa, krvácanie pri sondovaní (bleeding on probing), sondovanie hĺbky parodontálneho vačku, vyšetrenie kývavosti zubov a rozsah poškodenia závesného aparátu zuba a resorpcie alveolárnej kosti. Všetky tieto tradičné diagnostické metódy založené na posúdení vizuálnych a rádiografických informácií pomáhajú určiť závažnosť ochorenia a odrážajú jeho „históriu“, zlyhávajú však pri identifikácii osôb ohrozených vznikom ochorenia a pri stanovení stupňa susceptibility k progresii ochorenia.
Je preto veľkou výzvou stanoviť kritériá pre diagnostiku ochorení parodontu, ktoré by boli založené na dôkazoch (evidence-based criteria). Zmysluplný pokrok v chápaní patológie ochorenia nemôže nastať dovtedy, kým sa vedecko-výskumné snaženie nesústredí na identifikáciu parodontitídy v ranných štádiách, alebo dokonca v predklinickej fáze, čo by mohlo pomôcť zdravotníkom pri diagnostike ochorenia a voľbe vhodných liečebných postupov.
V poslednom období došlo pri skúmaní telových tekutín, vrátane analýzy ústnych tekutín, k výraznému rastu použitia proteomických metód, ktoré sa stávajú doplnkovým nástrojom aj pri diagnostike ochorenia parodontu. Pri štúdiu parodontálnych ochorení sa to týka napríklad amylázy [19], staterínu a histatínu [24], mucínu [17] a cystatínov [10].
Proteóm je definovaný ako súbor všetkých proteínov v bunke, vrátane ich zmenených foriem, ku ktorým dochádza v čase alebo v špecifických podmienkach, alebo pri akýchkoľvek zmenách, ktorým je bunka alebo organizmus vystavený. Proteomika je potom štúdium úplného súboru proteínov exprimovaných v organizme v danom prostredí a v určitom štádiu bunkového cyklu.
Predmetom skúmania je aj relatívna hojnosť proteínov, ich distribúcia, funkcie a interakcie s inými makromolekulami a ich posttranslačné modifikácie. Tento prístup, ktorý využíva technológie založené na báze hmotnostnej spektrometrie, je schopný identifikovať a kvantifikovať veľké počty proteínov a ich izoforiem v jednej komplexnej vzorke orálnej tekutiny a extrahovať podrobné informácie o regulačných mechanizmoch hostiteľa na úrovni proteínu.
Intenzívne hľadanie proteínových biomarkerov s prediktívnym významom pri ochoreniach parodontu je príznačné pre poslednú dekádu i vzhľadom na to, že tradičné klinické kritériá nepostačujú v počiatočnej fáze ochorenia, pri monitorovaní odpovede na liečbu, alebo pri posúdení možnej progresie ochorenia v budúcnosti. Pri hľadaní potenciálnych biomarkerov je úzkym miestom dostupnosť vzorky. Sliny v tomto smere poskytujú rad výhod. Vzhľadom na možnosť neinvazívneho odberu a komplexnosť obsahu proteínov je v poslednej dobe ich diagnostický potenciál predmetom početných štúdií [29]. Sliny ako komplexné exokrinné sekréty ústnych slinných žliaz a gingiválnej krevikulárnej tekutiny (GCF) odrážajú zloženie séra a obsahujú proteíny, ktoré vznikli v štrukturálnych tkanivách parodontu, baktérie kolonizujúce ústnu dutinu, zložky zubného plaku a reziduá potravy.
Napriek tomu, že sliny obsahujú veľké množstvo komponentov s diagnostickým potenciálom, až proteomické technológie otvorili cestu k využitiu toho najlepšieho z ich možností v klinickej stratégii. Klinická diagnostika na báze analýzy orálnych tekutín, najmä tá, ktorá využíva proteomické metódy, umožňuje určiť vzťah medzi proteínami slín a daným ochorením. Preto je zámerom tohto článku snaha poskytnúť aktuálne informácie týkajúce sa štúdia slinných proteínov proteomickými metódami a ich vhodnosti použitia ako biomarkerov pre diagnostiku ochorení parodontu.
SLINNÉ BIOMARKERY PRI PARODONTÁLNYCH OCHORENIACH
Skúmané možné špecifické slinné proteomické biomarkery patogénnych procesov pri ochoreniach parodontu sa týkajú najmä troch kľúčových prvkov: zápalových procesov, degradácie kolagénu a straty kosti. Tieto proteíny sú zapojené do molekulárnych procesov od štrukturálnych funkcií po enzymaticko/katalytické aktivity.
Proteomické metódy skúmania slín pri ochoreniach parodontu sa doposiaľ používali iba v obmedzenej miere. Spočiatku sa proteomický výskum zameral na odhalenie možných biomarkerov parodontitídy z GCF a krvného séra [14]. Wu a kol. sa po prvýkrát pokúsili porovnať proteómy celkových nestimulovaných slín pacientov s generalizovanou agresívnou parodontitídou (GAP) a kontrolnými jedincami [28].
Image 1. Parodontitída na OPG snímke 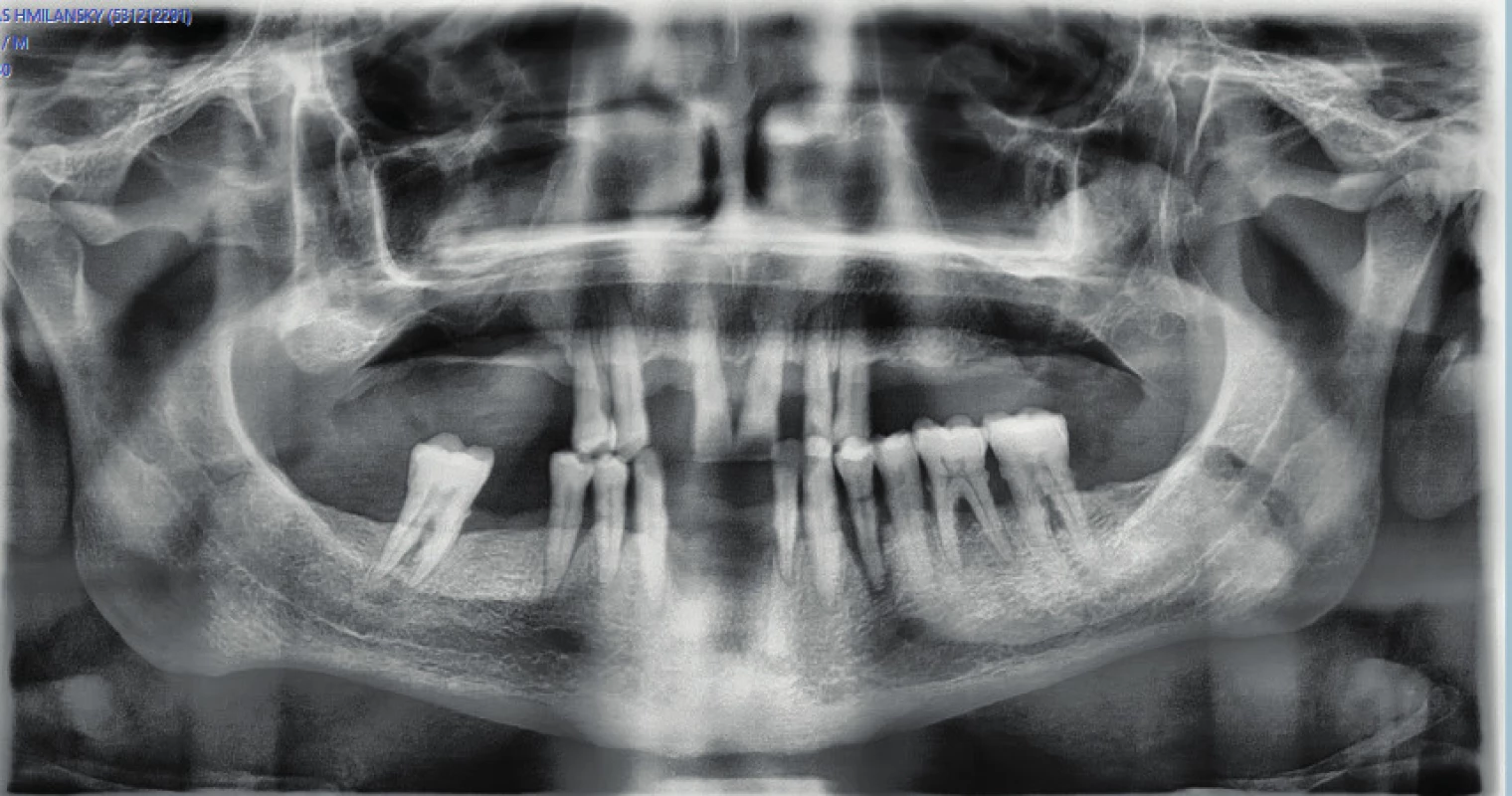
(I. stomatologická klinika UPJŠ LF, Košice) Image 2. Parodontitída v čeľusti pred liečbou 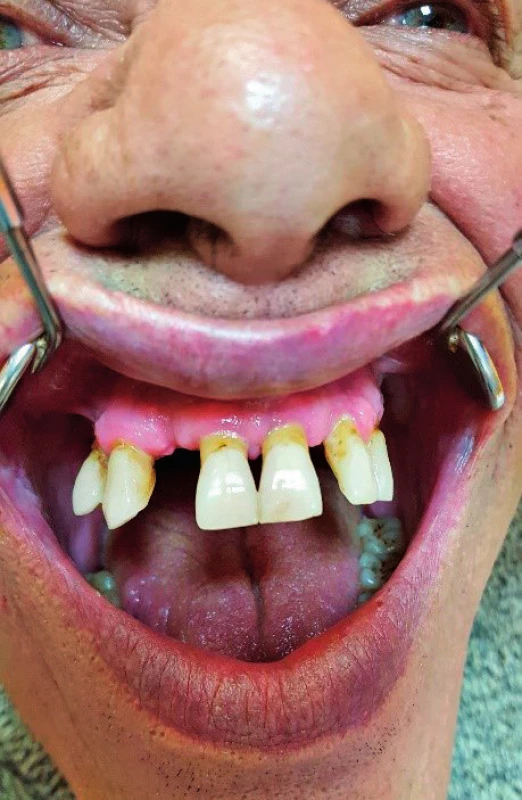
(I. stomatologická klinika UPJŠ LF, Košice) V skupine pacientov s GAP identifikoval 11 proteínov, ktoré vykazovali zmenenú hladinu oproti kontrolnej skupine. Tento počet nemusí predstavovať celkovú populáciu proteínov, hladina ktorých sa v slinách mení pri GAP v porovnaní so zdravými subjektmi, vzhľadom na obmedzenia zvolených postupov. V porovnaní s celkovými slinami zdravých jedincov vzrástla u GAP hladina sérového albumínu, imunoglobulínu (Ig)γ2 reťazec C oblasť, Ig α2 reťazec C oblasť, vitamín D-viažúceho proteínu, slinnej α-amylázy a zinok-2α glykoproteínu, zatiaľ čo hladina laktotransferínu, elongačného faktoru 2, 14–3–3 proteín sigma, PLUNC 2 prekurzora a karboanhydrázy 6 boli znížené [28].
Zvýšená exprimácia imunoglobulínov u pacientov s GAP svedčí o existujúcej imunitnej odpovedi. Orálna imunitná odpoveď je úzko prepojená so systémovou imunitnou odpoveďou [28]. Je všeobecne prijaté, že zápal a poškodenie tkaniva parodontu sú sprevádzané zmenami v kvalite, množstve a špecifickosti určitých protilátok. Sekretovaný Ig α2 v slinách hrá dôležitú úlohu v reakcii na prítomnosť patogénnych baktérií a vírusov a je jedným z hlavných faktorov obrany v slinách. Ig γ2, ktorý sa tvorí ako odpoveď na polysacharidové antigény, napr. proti opuzdreným baktériám, ako sú pneumokoky a streptokoky, je špecifickou sérovou protilátkou aj proti parodontálnym patogénom. Je produkovaný predovšetkým v tkanivách ďasien. Hladina Ig γ v GCF je podobná ako v sére [22].
Image 3. Parodontitída v sánke pred liečbou. 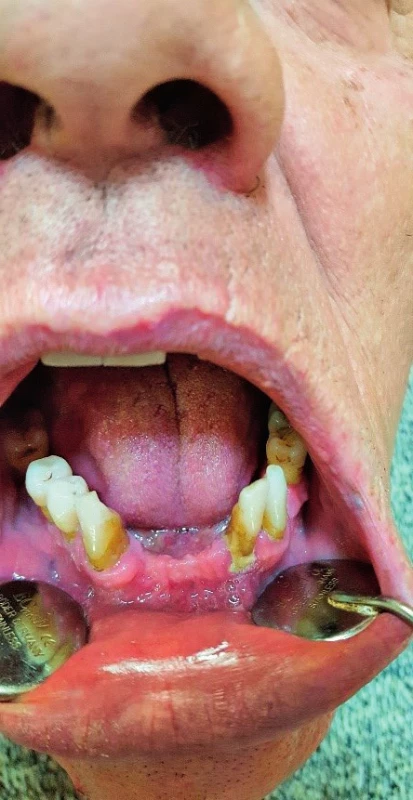
(I. stomatologická klinika UPJŠ LF, Košice) Image 4. Agresívna parodontitída na OPG snímke 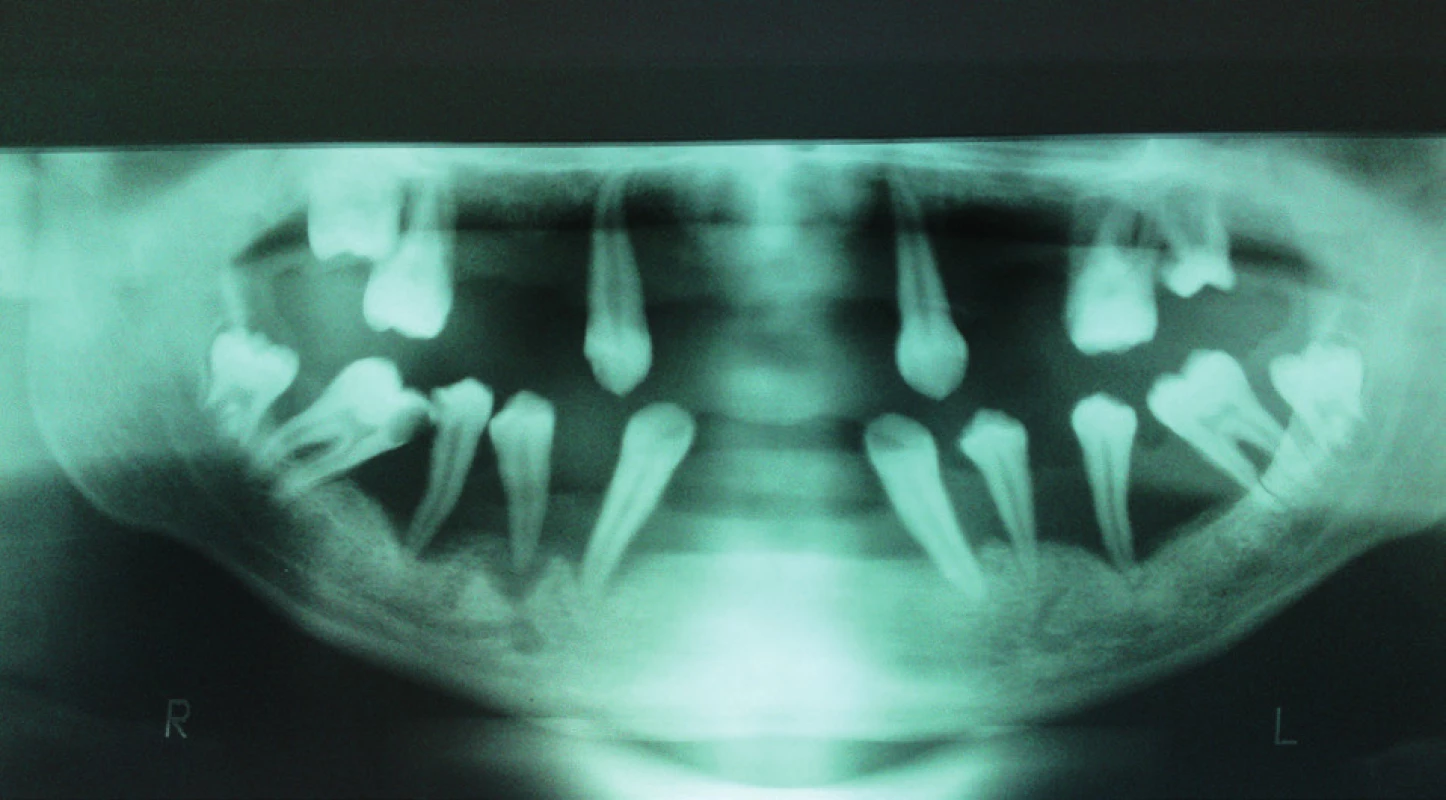
(I. stomatologická klinika UPJŠ LF, Košice) Neskôr Haigh a kol. [9] použili kvantitatívny proteomický prístup pre vyšetrenie celkových slín osôb s pokročilou parodontitídou. Ako porovnávaciu vzorku zvolili skupinu pacientov po terapii s viditeľným ústupom poškodenia tkanív, redukovaným zápalom so zníženým krvácaním z ďasien. Porovnaním 128 proteínových spotov vo vzorkách slín identifikovali 15 proteínov so signifikantne zmenenou exprimáciou medzi vzorkami slín pred liečbou a po liečbe. Podľa výsledkov skúmania v odpovedi hostiteľa s parodontitídou hrajú dôležitú úlohu najmä skupina S100 proteínov, ktoré predstavujú kalcium viažúce proteíny s rôznymi regulačnými vlastnosťami, vrátane regulácie zápalu. Dovtedy sa nepredpokladalo, že skupina S100 proteínov, ktoré boli identifikované ako prvky obrany hostiteľa, súvisí s ochorením parodontu. Zmeny boli pozorované najmä pre S100A8/A9/A6.
Skupiny proteinov S100A8 a S100A9 sa primárne nachádzajú v bunkách myeloidného pôvodu, najmä v neutrofiloch a monocytoch, ale môžu byť tiež detegované v skorých diferenciačných štádiách makrofágov a v keratinocytoch a epiteliálnych bunkách pri zápalových procesoch. Boli identifikované ako zaujímavé biomarkery pre sledovanie aktivity chronických zápalových ochorení [18]. S100A8/A9 inhibujú syntézu imunoglobulínu, modulujú adhéziu neutrofilov a vykazujú antimikrobiálnu aktivitu [2]. Už skôr bolo preukázané, že hladiny S100A8/A9 v GCF a slinách korelujú s chronickou parodontitídou a je pravdepodobné, že ich zmenené hladiny sú dôsledkom sekrécie infiltrácií neutrofilov a gingiválnych keratinocytov, ktoré produkujú S100A8/A9 v prítomnosti bakteriálnych lipopolysacharidov [3]. Na rozdiel od S100A8/A9, štúdií, ktoré spájajú S100A6 so zápalom, je menší počet. Hoci funkcia tohto proteínu je nejasná, výsledky Haigh a kol. [9] dokumentujú zvýšené hladiny S100A6 v ústnej dutine počas parodontálneho zápalu, čo môže byť dôsledkom cytokín - alebo patogéndependentnej aktivácie nukleárneho faktoru kappa B (NF-κB). Rodina NF-κB predstavuje heterodimérne transkripčné faktory, ktoré pôsobia na jadrovú DNA. Neaktívne komponenty NF-κB nachádzajúce sa v cytoplazme sú aktivovateľné cez mnohopočetné signálne dráhy. Pri aktivácii sú NF-κB proteíny translokované do jadra, kde dimerizujú a ovplyvňujú transkripciu génov, ktoré zohrávajú úlohu pri apoptóze a prežívaní buniek. NF-κB okrem iného reguluje produkciu prozápalových cytokínov, ktoré významne prispievajú k zápalovej odpovedi. Zároveň prispieva k spätnej kontrole zápalu rôznymi mechanizmami, ktoré ovplyvňujú veľkosť a trvanie zápalovej odpovede.
Image 5. Agresívna parodontitída 
(I. stomatologická klinika UPJŠ LF, Košice) Takmer súčasne bola s prácou Haigh a kol. [9] uverejnená štúdia Goncalvesa a kol. [6]. Autori porovnávali proteínové profily nestimulovaných slín pacientov s parodontitídou a zdravých jedincov dvoma komplementárnymi prístupmi (2D-gélovou elektroforézou a kvapalinovou chromatografiou). Proteínové spoty analyzovali pomocou hmotnostnej spektrofotometrie na MALDI-TOF-TOF a ESI-Q-TOF prístrojoch. Zistili, že pacienti s ochorením ďasien majú v slinách zvýšené množstvá krvných proteínov (sérový albumín a hemoglobín) a imunoglobulínu a nižšie hladiny cystatínu v porovnaní s kontrolnou skupinou. Vyšší počet proteínových spotov bol pozorovaný v skupine parodontitídy, z ktorých väčšina bola identifikovaná ako α-amylázy. Tento vyšší počet variantov α-amylázy sa zdá byť spôsobený hydrolýzou vyvolanou cysteínovými proteázami v podmienkach existujúceho zápalu.
Podobne Rangé a kol. [20] hmotnostnou spektrometriou SELDI-TOF-MS identifikovali osem možných markerov parodontitídy v slinách obéznych pacientov s parodontitídou v porovnaní s kontrolou: zvýšené hodnoty albumínu, α a β reťazca hemoglobínu a α-defenzínov 1, 2 a 3. Hladina α-defenzínov bola nižšia v slinách obéznych pacientov s parodontitídou oproti obéznym pacientom bez parodontitídy, zatiaľ čo defenzíny boli viac exprimované u obéznych pacientov oproti kontrolám. Parodontálny status mení slinný proteóm obéznych pacientov, pričom podľa autorov v tomto procese môže zohrávať dôležitú úlohu skupina defenzínov. Defenzíny tvoria rodinu antimikrobiálnych peptidov nachádzajúcich sa predovšetkým v neutrofiloch a epiteliálnych bunkách. Hrajú dôležitú úlohu v prirodzenej imunitnej obrane proti infekčným patogénom. Ich biologické funkcie, ich úloha v aj mimo vrodenej imunite, mechanizmy účinku a terapeutický potenciál sa stávajú zaujímavými témami výskumu [30]. Vo vzťahu k parodontitíde môžu α-defenzíny hrať úlohu pri vzniku zápalu ďasien a podieľať sa na vyššej citlivosti obéznych pacientov k ochoreniam parodontu.
V novších výskumoch Salazar a kol. [21] identifikovali pomocou kombinácie kvapalinovej chromatografie a hmotnostnej spektrometrie LC-MS/MS v plných stimulovaných slinách pacientov s parodontitídou 20 proteínov, ktorých hladina bola v porovnaní s kontrolnou skupinou zmenená najmenej jeden a polkrát, pričom vačšina týchto proteínov vykazovala zvýšené hodnoty u pacientov s parodontitídou. Skupina zahŕňala: ceruloplazmín, α-2-HS-glykoproteín, komplement C3, α-2-makroglobulín, fibrinogén α reťazec, plastín-2, kalretikulín, laktotransferín, profilín-1, gelsolín, peptidoglykán rozpoznávajúci proteín 1, neutrofil defenzín, neutrofil kolagenázu, matrix metaloproteinázu-9 (MMP 9), S100-P, inhibítor 2 Rho GDP-disociácie, katalázu, s adenylyl cyklázou-asociovaný proteín 1, leukotrién A-4 hydrolázu a laktoperoxidázu. Kategorizáciou týchto proteínov podľa molekulárnych a bunkových funkcií autori zistili, že v skupine sa nachádzajú najmä proteíny spojené s pohybom bunky, medzibunkovou signalizáciou a interakciou buniek a proteíny sprevádzajúce bunkovú smrť. Výskyt proteínov spojených s chemotaxiou buniek a migráciou mononukleárnych leukocytov podľa autorov potvrdzuje, že ochorenie je dôsledkom prebiehajúceho zápalového procesu. V kategórii ochorení sa niektoré zo zistených proteínov podieľajú na vzniku skeletálnych a muskulárnych porúch, dermatologických ochorení a porúch spojovacieho tkaniva. Okrem toho analýza ukázala, že päť up-regulovaných proteínov identifikovaných v slinách pacientov s ochorením parodontu (α-2-makroglobulín, ceruloplazmín, komplement C3, α-2-HS-glykoproteín, fibrinogén α-reťazec) sú súčasťou ciest odozvy akútnej fázy (acute phase response pathways), aktivácie heterodimér liver X a retinoid X receptorov LXR/RXR (LXR/RXR activation pathway) a signalizácie (signalling).
Zo zmienených proteínov bola prítomnosť ceruloplazmínu sprevádzajúceho zápalový proces preukázaná v leukocytoch a sére pacientov s lokalizovanou agresívnou parodontitídou [11]. O defenzínoch, laktotransferíne a laktoperoxidáze je všeobecne známe, že pôsobia antibakteriálne proti periodontopatickým baktériám a sú súčasťou antimikrobiálneho systému slín [32]. Príčiny zvýšených hladín profilínu-1, ktorý sa podieľa na polymerizácii aktínu ako odpoveď na extracelulárne signály, a jeho úloha v zápalových procesoch doteraz neboli objasnené.
Pôvodom bakteriálne a hostiteľské enzýmy, proteíny a iné zápalové mediátory sa zdajú byť nádejnými slinnými diagnostickými markermi ochorení parodontu. Bakteriálne lipopolysacharidy a iné mikrobiálne komponenty aktivujú prirodzenú obranu hostiteľa, čo vedie k zvýšeniu počtu neutrofilov, monocytov a aktivovaných makrofágov. Tie uvoľňujú početné cytokíny, tumor nekrotizujúci faktor (TNF α), interleukíny IL-1 a IL-6, ktoré ďalej riadia zápalový proces. V dôsledku toho sú v alveolárnej kosti a polymorfonukleárnych leukocytoch produkované kolagén ničiace enzýmy – matrixmetaloproteinázy (MMP) [7, 23].
MMP sú od zinku závislé endopeptidázy, ktoré sú považované za kľúčové iniciátory degradácie extracelulárneho matrixu v normálnych fyziologických procesoch (napr. embryonálny vývoj, reprodukcia alebo tkanivová remodelácia), ale podieľajú sa tiež na chorobných procesoch [16]. Sú všeobecne považované za hlavné enzýmy, ktoré sa podieľajú na deštrukcii tkanív aj pri parodontitíde [8, 12]. Preto by up-regulovný MMP-8 (neutrofil kolagenáza) a MMP-9 identifikovaný v slinách podľa Salazara a kol. [21] mohol slúžiť ako jeden z markerov ochorení parodontu.
Degradácie kolagénového matrixu takými pro-teázami, ako je MMP, vedie k uvoľneniu fragmentov kolagénu do obehu, uvoľnené peptidy by potom mohli byť použité na stanovenie stupňa resorpcie kosti pri parodontitíde [4].
Zosumarizovať možné proteínové biomarkery parodontálnych ochorení získaných skúmaním celého proteómu slín, respektíve jednotlivých proteínov obsiahnutých v slinách, sa roku 2014 pokúsil Taylor [26]. Prišiel k záveru, že analýza slinných patogénov ako biomarker parodontálnych ochorení sa neukázala byť úspešnou [15, 31]. Klinické prejavy ochorenia nie vždy korelujú s bakteriálnym obsahom zubného plaku [25]. Lepšou cestou, po odstránení niektorých obmedzení, by mohli byť ľudské sliny. Autor rozdelil doteraz uvažované slinné biomarkery ochorení parodontu na štyri kategórie (tab. 1). „Robustné“ biomarkery parodontitídy sú autorom definované ako tie slinné proteíny, ktoré boli uvedené aspoň v troch štúdiách (s malými alebo žiadnymi dôkazmi o opaku), schopné odlíšiť subjekty s parodontitídou a zdravou ústnou dutinou. Podobne sú autorom definované „potenciálne“ biomarkery, s tou výnimkou, že boli uvedené aspoň v dvoch prierezových štúdiách. „Neisté“ biomarkery sú proteíny, pri ktorých existuje len jediná práca potvrdzujúca ich existenciu. Za „nepravdepodobné“ autor považuje tie proteíny, ak v troch alebo viacerých prípadoch boli zistené skutočnosti, ktoré protirečia ich možnej asociácii s ochoreniami parodontu. Zaradenie do kategórií sa môže meniť vzhľadom na možné dosiaľ nepublikované dáta.
Table 1. Rozdelenie slinných biomarkerov parodontitídy, podľa Taylora [26] ![Rozdelenie slinných biomarkerov parodontitídy, podľa Taylora [26]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/adeb52e3a32d136d5ab87b0bd0905e8d.png)
ZÁVER
Poznanie ľudského slinného proteómu je významným predpokladom pochopenia fyziologických a patologických procesov, ktoré sú dôležité pre zdravie ústnej dutiny. Má rovnako zásadný význam pre identifikáciu vhodných biomarkerov chorôb, a to nielen tých, ktoré sa týkajú orálneho zdravia. Kým budúcnosť diagnózy ochorení parodontu pomocou skúmania proteómu slín vyzerá povzbudivo, nové prekážky môžu vzniknúť pri aplikácii týchto prístupov v klinickej praxi. V blízkej budúcnosti je preto pri diagnóze ochorenia parodontu nevyhnutné overiť a validovať tieto postupy vo veľkých populáciách pacientov tak, aby boli dáta medzi laboratóriami reprodukovateľné, technologicky zlepšiť zariadenia pre hmotnostnú spektrometriu a zaviesť štandardy pri príprave vzoriek.
Poďakovanie
Touto cestou autorka vyjadruje poďakovanie RNDr. Galine Laputkovej, CSc., kolektívu Ústavu lekárskej a klinickej biofyziky, Lekárskej fakulty Univerzity P. J. Šafárika v Košiciach, pod vedením pána prednostu doc. RNDr. Jána Saba, CSc., mim. prof., za ochotu a spoluprácu, ktorá prinesie nové poznatky pre zubných lekárov a môže byť veľkým prínosom pre našich pacientov.
MUDr. Vladimíra Schwartzová, PhD., MHA
Oddelenie ústnej, čeľustnej a tvárovej chirurgie
I. stomatologická klinika UPJŠ LF a UNLP
Trieda SNP 1
040 11 Košice
e-mail: vladimira.schwartzova@upjs.sk
Sources
1. AlJehani, Y. A.: Risk factors of periodontal disease: review of the literature. Int. J. Dent., 2014, s. 1–9.
2. Anceriz, N., Vandal, K., Tessier, P. A.: S100A9 mediates neutrophil adhesion to fibronectin through activation of β2 integrins. Biochem. Biophys. Res. Commun., roč. 354, 2007, č. 1, s. 84–89.
3. Andersen, E., Dessaix, I. M., Perneger, T., Mombelli, A.: Myeloid-related protein (MRP8/14) expression in gingival crevice fluid in periodontal health and disease and after treatment. J. Periodontal Res., roč. 45, 2010, č. 4, s. 458–463.
4. Giannobile, W. V., Al-Shammari, K. F., Sarment, D. P.: Matrix molecules and growth factors as indicators of periodontal disease activity. Periodontology, 2000, roč. 31, 2003, č. 1, s. 125–134.
5. Giannobile, W. V., Beikler, T., Kinney, J. S., Ramseier, C. A., Morelli, T., Wong, D. T.: Saliva as a diagnostic tool for periodontal disease: current state and future directions. Periodontology, 2000, roč. 50, 2009, č. 1, s. 52–64.
6. Goncalves, LdaR., Soares, M. R., Nogueira, F. C. et al.: Comparative proteomic analysis of whole saliva from chronic periodontitis patients. J. Proteomics, roč. 73, 2010, č. 7, s. 1334–1341.
7. Golub, L. M., Lee, H. M., Greenwald, R. A., Ryan, M. E., Sorsa, T., Salo, T., Giannobile, W. V.: A matrix metalloproteinase inhibitor reduces bone-type collagen degradation fragments and specific collagenases in gingival crevicular fluid during adult periodontitis. Inflamm. Res., roč. 46, 1997, č. 8, s. 310–319.
8. Gursoy, U. K., Könönen, E., Huumonen, S., Tervahartiala, T., Pussinen, P. J., Suominen, A. L., Sorsa, T.: Salivary type I collagen degradation end-products and related matrix metalloproteinases in periodontitis. J. Clin. Periodontol., roč. 40, 2013, č. 1, s. 18–25.
9. Haigh, B. J., Stewart, K. W., Whelan, J. R., Barnett, M. P., Smolenski, G. A., Wheeler, T. T.: Alterations in the salivary proteome associated with periodontitis. J. Clin. Periodontol., roč. 37, 2010, č. 3, s. 241–247.
10. Henskens, Y. M., Veerman, E. C., Nieuw Amerongen, A. V.: Cystatins in health and disease. Biol. Chem. Hoppe Seyler, roč. 377, 1996, č. 2, s. 71–86.
11. Iwata, T., Kantarci, A., Yagi, M., Jackson, T., Hasturk, H., Kurihara, H., Van Dyke, T. E.: Ceruloplasmin induces polymorphonuclear leukocyte priming in localized aggressive periodontitis. J. Periodontol., roč. 80, 2009, č. 8, s. 1300–1306.
12. Javed, F., Ahmed, H. B., Saeed, A., Mehmood, A., Bain, C.: Whole salivary interleukin-6 and matrix metalloproteinase-8 levels in patients with chronic periodontitis with and without prediabetes. J. Periodontol., roč. 85, 2014, č. 5, s. 130–135.
13. Khiste, S. V., Ranganath, V., Nichani, A. S., Rajani, V.: Critical analysis of biomarkers in the current periodontal practice. J. Indian Soc. Periodontol., roč. 15, 2011, č. 2, s. 104.
14. Kojima, T., Andersen, E., Sanchez, J. C., Wilkins, M. R., Hochstrasser, D. F., Pralong, W. F., Cimasoni, G.: Human gingival crevicular fluid contains MRP8 (S100A8) and MRP14 (S100A9), two calcium-binding proteins of the S100 family. J. Dent. Res., roč. 79, 2000, č. 2, s. 740–747.
15. Listgarten, M. A., Loomer, P. M.: Microbial identification in the management of periodontal diseases. A systematic review. Ann. Periodontol., roč. 8, 2003, č. 1, s. 182–192.
16. Mirrielees, J., Crofford, L. J., Lin, Y., Kryscio, R. J., Dawson III, D. R., Ebersole, J. L., Miller, C. S.: Rheumatoid arthritis and salivary biomarkers of periodontal disease. J. Clin. Periodontol., roč. 37, 2010, č. 12, s. 1068–1074.
17. Nieuw Amerongen, A., Bolscher, J. G. M., Veerman, E. C. I.: Salivary mucins: protective functions in relation to their heterogeneity. Glycobiology, 1995, č. 5, s. 733–740.
18. Pruenster, M., Vogl, T., Roth, J., Sperandio, M.: S100A8/A9: from basic science to clinical application. Pharmacol. Ther., roč. 167, 2016, s. 120–131.
19. Rai, B., Kaur, J., Anand, S. C., Jacobs, R.: Salivary stress markers, stress, and periodontitis: a pilot study. J. Periodontol., roč. 82, 2011, č. 2, s. 287–292.
20. Rangé, H., Léger, T., Huchon, C., Ciangura, C., Diallo, D., Poitou, C., Chaussain, C.: Salivary proteome modifications associated with periodontitis in obese patients. J. Clin. Periodontol., roč. 39, 2012, č. 9, s. 799–806.
21. Salazar, M. G., Jehmlich, N., Murr, A., Dhople, V. M., Holtfreter, B., Hammer, E., Kocher, T.: Identification of periodontitis associated changes in the proteome of whole human saliva by mass spectrometric analysis. J. Clin. Periodontol., roč. 40, 2013, č. 9, s. 825–832.
22. Sandholm, L., Tolo, K., Olsen, I.: Salivary IgG, a parameter of periodontal disease activity? J. Clin. Periodontol., roč. 14, 1987, č. 5, s. 289–294.
23. Séguier, S., Gogly, B., Bodineau, A., Godeau, G., Brousse, N.: Is collagen breakdown during periodontitis linked to inflammatory cells and expression of matrix metalloproteinases and tissue inhibitors of metalloproteinases in human gingival tissue? J. Periodontol., roč. 72, 2001, č. 10, s. 1398–1406.
24. Siqueira, W. L., Oppenheim, F. G.: Small molecular weight proteins/peptides present in the in vivo formed human acquired enamel pellicle. Arch. Oral Biol., roč. 54, 2009, č. 5, s. 437–444.
25. Slots, J.: Periodontology: past, present, perspectives. Periodontology, 2000, roč. 62, 2013, č. 1, s. 7–19.
26. Taylor, J. J.: Protein biomarkers of periodontitis in saliva. ISRN Inflammation, 2014. doi: 10.1155/2014/593151.
27. Trindade, F., Oppenheim, F. G., Helmerhorst, E. J., Amado, F., Gomes, P. S., Vitorino, R.: Uncovering the molecular networks in periodontitis. Proteomics Clin. Appl., roč. 8, 2014, č. 9–10, s. 748–761.
28. Wu, Y., Shu, R., Luo, L. J., Ge, L. H., Xie, Y. F.: Initial comparison of proteomic profiles of whole unstimulated saliva obtained from generalized aggressive periodontitis patients and healthy control subjects. J. Periodontal Res., roč. 44, 2009, č. 5, s. 636–644.
29. Yoshizawa, J. M., Schafer, C. A., Schafer, J. J., Farrell, J. J., Paster, B. J., Wong, D. T.: Salivary biomarkers: toward future clinical and diagnostic utilities. Clin. Microbiol. Rev., roč. 26, 2013, č. 4, s. 781–791.
30. Zhao, L., Lu, W.: Defensins in innate immunity. Curr. Opin. Hematol., roč. 21, 2014, č. 1, s. 37–42.
31. Zhang, L., Henson, B. S., Camargo, P. M., Wong, D. T. The clinical value of salivary biomarkers for periodontal disease. Periodontol, 2000, roč. 51, 2009, č. 1, s. 25–37.
32. van‘t Hof, W., Veerman, E. C., Nieuw Amerongen, A. V., Ligtenberg, A. J.: Antimicrobial defense systems in saliva. Monogr. Oral Sci., 2014, č. 24, s. 40–51.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2017 Issue 3-
All articles in this issue
-
Štúdium slinných proteínov proteomickými metódami pri parodontálnych ochoreniach
(Prehľadový článok) -
Porovnání terapie stálých zubů s nedokončeným vývojem a nekrotickou dření apexifikací hydroxidem vápenatým a maturogenezí
(Původní práce – klinická retrospektivní kohortová studie) -
Syndrom pálenia úst
(Prehľadový článok) -
Predikce přítomnosti interdentální papily v oblasti horních středních řezáků v závislosti na vzdálenosti bodu kontaktu od kostního septa a mezizubní vzdálenosti
(Původní práce – klinická studie) -
Gingivostomatitis herpetica acuta ako primárna infekcia ľudským herpetickým vírusom
(Prehľadový článok)
-
Štúdium slinných proteínov proteomickými metódami pri parodontálnych ochoreniach
- Czech Dental Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Syndrom pálenia úst
(Prehľadový článok) -
Gingivostomatitis herpetica acuta ako primárna infekcia ľudským herpetickým vírusom
(Prehľadový článok) -
Porovnání terapie stálých zubů s nedokončeným vývojem a nekrotickou dření apexifikací hydroxidem vápenatým a maturogenezí
(Původní práce – klinická retrospektivní kohortová studie) -
Predikce přítomnosti interdentální papily v oblasti horních středních řezáků v závislosti na vzdálenosti bodu kontaktu od kostního septa a mezizubní vzdálenosti
(Původní práce – klinická studie)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

