-
Medical journals
- Career
Ekonomický pohled na léčbu bevacizumabem u metastatického kolorektálního karcinomu
: Irena Sehnalová; Barbora Říhová; Regina Demlová
: Čes. slov. Farm., 2019; 68, 43-47
: Review Articles
Cílená léčba znamená velký přínos v léčbě onkologických pacientů. Bevacizumab v léčbě metastatického kolorektálního karcinomu (mCRC) zlepšuje celkové přežívání pacientů (OS) a prodlužuje dobu přežití bez progrese onemocnění (PFS). Výsledky z klinické praxe potvrzují účinnost bevacizumabu v souladu s randomizovanými studiemi, avšak nákladová efektivita léčby bevacizumabem, stejně jako dalšími přípravky cílené biologické léčby, je častým tématem diskuze mezi odbornými společnostmi, regulačními autoritami a plátci zdravotní péče. U bevacizumabu stále chybí biomarkery, které by pomohly lépe selektovat skupinu pacientů s nejlepší léčebnou odpovědí. V souhrnném článku je představen farmakoekonomický pohled na léčbu bevacizumabem u mCRC. Náklady na jeden 14denní cyklus léčby bevacizumabem v podmínkách České republiky se pohybují kolem 31 000 Kč. Publikované zahraniční farmakoekonomické analýzy nemají jednoznačné závěry. Jejich výsledky jsou zpravidla vyjadřované jako cena za získané QALY při použití hodnocené intervence ve srovnání s komparátorem a liší se v závislosti na ekonomické situaci v konkrétních zemích. Výsledky farmakoekonomických analýz je však nutné potvrdit i v reálné klinické praxi a následně přehodnotit rozhodnutí o úhradě léčivého přípravku s ohledem na konkrétní zdravotní systém dle jednotné metody typu HTA (Health Technology Assessment).
Klíčová slova:
bevacizumab – cílená biologická léčba – QALY – metastatický kolorektální karcinom
Úvod
V uplynulých 20 letech došlo v medicíně ke značnému rozvoji léčivých přípravků selektivně zaměřených na různé specifické struktury, např. na receptor pro EGFR (epidermální růstový faktor), na TNF-α (tumor nekrotizující faktor alfa) nebo na inhibici tyrozinkinázové aktivity. Tyto léčivé látky se začaly využívat nejen v řadě onkologických diagnóz, ale i v revmatologii, gastroenterologii a dermatologii. Díky těmto léčivům se daří zbrzdit rozvoj nemoci a zlepšit kvalitu života nemocných. V onkologii máme v současnosti řadu látek, které v klinických studiích prokázaly svoji účinnost a bezpečnost a staly se součástí doporučených postupů léčby nádorových onemocnění.
K nejčastějším onkologickým diagnózám v České republice patří zhoubné novotvary kolorekta (dg. C18-C21).
Toto onemocnění zachycené v časných stadiích je dobře léčitelné chirurgicky, ale záchyt onemocnění v pokročilém stavu nebo ve stadiu s metastázami má špatnou prognózu. Léčebné postupy s využitím cílených léčiv zlepšily celkové přežívání pacientů s mCRC. Medián celkového přežívání pacientů (OS) se v současnosti pohybuje okolo 30 měsíců1). V roce 2016 bylo nahlášeno celkem 7610 případů kolorektálního karcinomu, což představuje mírný absolutní pokles oproti předchozímu roku. Přesto se jedná o druhou nejčastější onkologickou diagnózou po karcinomu prostaty u mužů a po karcinomu prsu u žen2). Každoročně asi 20 % z nově diagnostikovaných pacientů má onemocnění odhaleno v klinickém stadiu IV, tedy s přítomností vzdálených metastáz (mCRC). Predikční odhady pro rok 2018 uvádějí 1393 nově diagnostikovaných pacientů v klinickém stadiu IV3).
V mezinárodním srovnání incidence a mortality kolorektálního karcinomu dle Globocan 2012 obsadila Česká republika 6. místo2).Biologická léčba u mCRC
V léčbě mCRC jsou v současnosti ze zdravotního pojištění za splnění indikačních podmínek hrazena antiangiogenní léčiva zaměřená proti VEGF (vaskulární endoteliální růstový faktor) bevacizumab a aflibercept, inhibitory EGFR (epidermální růstový faktor) cetuximab a panitumumab, nejnověji pak multikinázový inhibitor regorafenib. Všechna tato léčiva prokázala v randomizovaných studiích svoji bezpečnost a účinnost a jejich podání vedlo k prodloužení doby do progrese onemocnění (TTP), přežití bez progrese onemocnění (PFS) nebo prodloužení celkového přežívání pacientů (OS)4–10). Randomizované klinické studie však nemohou v dostatečné míře odpovědět na otázku, zda budou tato léčiva vykazovat stejný efekt v širší populaci pacientů indikovaných k léčbě v běžné klinické praxi. Velmi diskutovaným tématem je pak v reálné praxi také úhrada těchto léčiv z prostředků veřejného zdravotního pojištění.
S rozvojem a aplikací principů personalizované medicíny hrají u mCRC důležitou roli prognostické a prediktivní farmakogenomické biomarkery11). Ačkoliv bylo objeveno několik biomarkerů, v rutinní praxi v léčbě mCRC se uplatňuje pouze vyšetření mutací RAS onkogenů (KRAS a NRAS). Divoký typ (WT) RAS onkogenů je podmínkou pro léčbu inhibitory EGFR12, 13). Pro podání léčiv proti VEGF však nebyl zatím v klinické praxi představen žádný vhodný marker, který by predikoval pacienty s nejlepší odpovědí na tuto léčbu. Dodatečná statistická analýza klinické studie dospěla k závěru, že léčebný benefit anti-VEGF léčiva bevacizumabu je nezávislý na přítomnosti KRAS mutace14).
Bevacizumab v léčbě mCRC
Bevacizumab (registrovaný léčivý přípravek Avastin) je indikován pacientům s mCRC nezávisle na mutačním stavu RAS onkogenů3). V České republice je registrován a hrazen od roku 2005. Jeho účinnost a bezpečnost byla v klinickém prostředí dále sledována v registru Corect15). Z jeho výstupů je patrné, že klinický efekt léčby bevacizumabem u mCRC je v souladu s proběhlými randomizovanými klinickými studiemi5, 16). Medián PFS u pacientů léčených v České republice dosahuje téměř 11 měsíců a medián OS se pohybuje okolo 26 měsíců. Ročně je u nás bevacizumabem v indikaci mCRC léčeno přibližně 1000 pacientů15). Počet pacientů léčených v jednotlivých letech uvádí obrázek 1.
1. Počet pacientů se zahájenou léčbou bevacizumabem 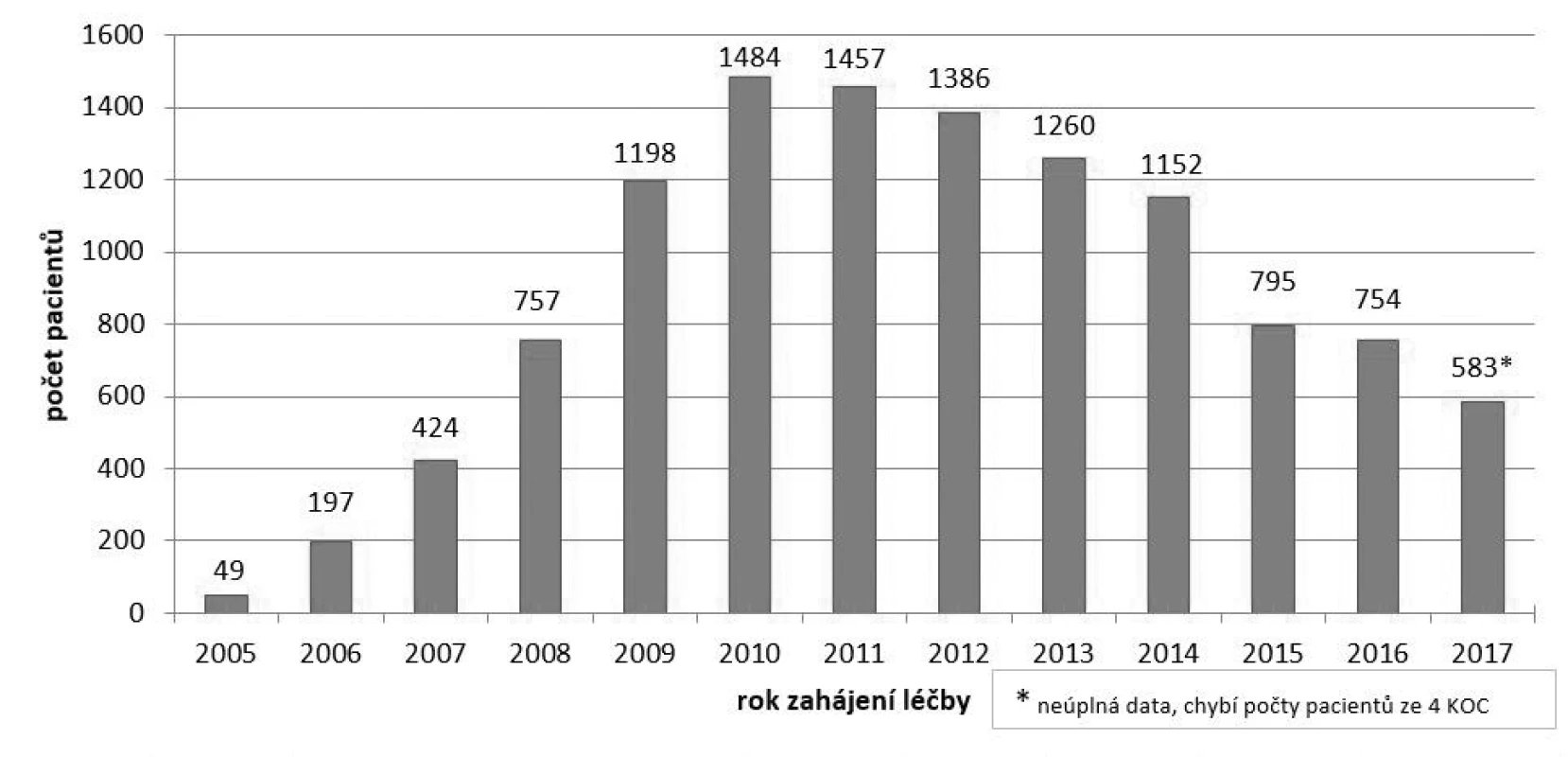
V současnosti je bevacizumab ze zdravotního pojištění hrazen k léčbě pacientů s mCRC v první a druhé linii v kombinaci s chemoterapeutickými režimy obsahujícími fluoropyrimidin. Konkrétní druh chemoterapeutického režimu je volen individuálně. Nejčastěji indikovanými režimy jsou FOLFOX (oxaliplatina, leukovorin, 5-fluorouracil) a XELOX (oxaliplatina, kapecitabin)15). Bevacizumab je v první linii léčby podáván intravenózně v dávce 5 mg/kg každé 2 týdny nebo 7,5 mg/kg každé 3 týdny do progrese onemocnění. Při podávání ve druhé linii léčby je aplikován v dávce 10 mg/kg každé 2 týdny do progrese onemocnění (PD). Vždy po 2–3 měsících léčby je doporučeno přehodnocení účinnosti terapie3, 17). Kromě léčby mCRC jsou dalšími indikacemi bevacizumabu v onkologii metastatický karcinom prsu, neresekabilní pokročilý metastatický nebo rekurentní nemalobuněčný karcinom plic, pokročilý nebo metastatický karcinom ledviny, metastatický, rekurentní nebo perzistentní karcinom děložního čípku, pokročilý karcinom vaječníků, vejcovodů a primární nádor pobřišnice17).
Farmakoekonomické hodnocení bevacizumabu u mCRC
Léčba bevacizumabem, stejně jako i jinými cílenými léčivy přináší značné finanční náklady. V podmínkách České republiky stojí jeden 14denní cyklus léčby bevacizumabem v první linii přibližně 31 000 Kč17). Retrospektivní analýza nákladů na léčbu bevacizumabem vycházející z dat reálné klinické praxe hodnocená z pohledu plátce zdravotní péče publikovaná v roce 2014 potvrdila vysoké výdaje spojené s aplikací této léčby. Průměrné náklady na léčbu mCRC při aplikaci bevacizumabu společně s některým z chemoterapeutických režimů v první linii léčby se pohybovaly kolem 1 000 000 Kč pro jednoho pacienta, přičemž samotný bevacizumab představoval 69 % veškerých přímých nákladů do PD (medián doby do PD byl 9,1 měsíce)18).
V posledních letech stoupá počet publikovaných studií hodnotících nákladovou efektivitu bevacizumabu. Výsledky jsou zpravidla vyjádřeny jako náklady za 1 QALY (quality adjusted life year), případně jako náklady na 1 LYG (life year gained) při použití hodnocené intervence ve srovnání s vhodným komparátorem. Ačkoliv koncept QALY má i své nevýhody, možnost poměřovat efektivitu léčby napříč různými diagnózami je jedním z důvodů, proč analýzy tohoto typu bývají regulačními autoritami včetně České republiky požadovány nejčastěji. Farmakoekonomické analýzy publikované v uplynulých letech se liší ve svých závěrech, zda lze léčbu bevacizumabem u mCRC považovat za nákladově efektivní. Studie hodnotící nákladovou efektivitu bevacizumabu v první a druhé linii léčby mCRC z pohledu plátce zdravotní péče ve Spojených státech amerických publikovaná v roce 2015 považuje léčbu za neefektivní. Inkrementální náklady (ICER) pro první linii léčby byly 571 240 USD/QALY, při léčbě ve druhé linii 364 083 USD/QALY19). K podobným závěrům již dříve dospěla studie nákladové efektivity bevacizumabu v první linii léčby mCRC v Velké Británii. Náklady na léčbu bevacizumabem s režimem IFL (irinotekan, 5-fluorouracil, leukovorin) představovaly přibližně
62 857 liber za QALY, tedy asi dvojnásobek hranice ochoty platit (WTP)20). Nověji publikované analýzy zaměřené na léčbu bevacizumabem společně s chemoterapeutickými režimy XELOX nebo FOLFOX uvádějí ICER 36 000 GBP/QALY a 31 000 GBP/QALY, tedy příznivější ve prospěch léčby bevacizumabem21). V rámci rozhodovacích řízení o úhradě léčby a cenotvorbě léčiv jsou tyto analýzy důležitým argumentem, přihlíží se však i k dalším okolnostem, jako jsou závažnost onemocnění, dostupnost alternativní terapie a celkový dopad na zdravotní rozpočet (budget impact). Příklady některých analýz typu cost utility společně s WTP uvádí tabulka 119–23).1. Příklady některých analýz typu cost utility společně s WTP 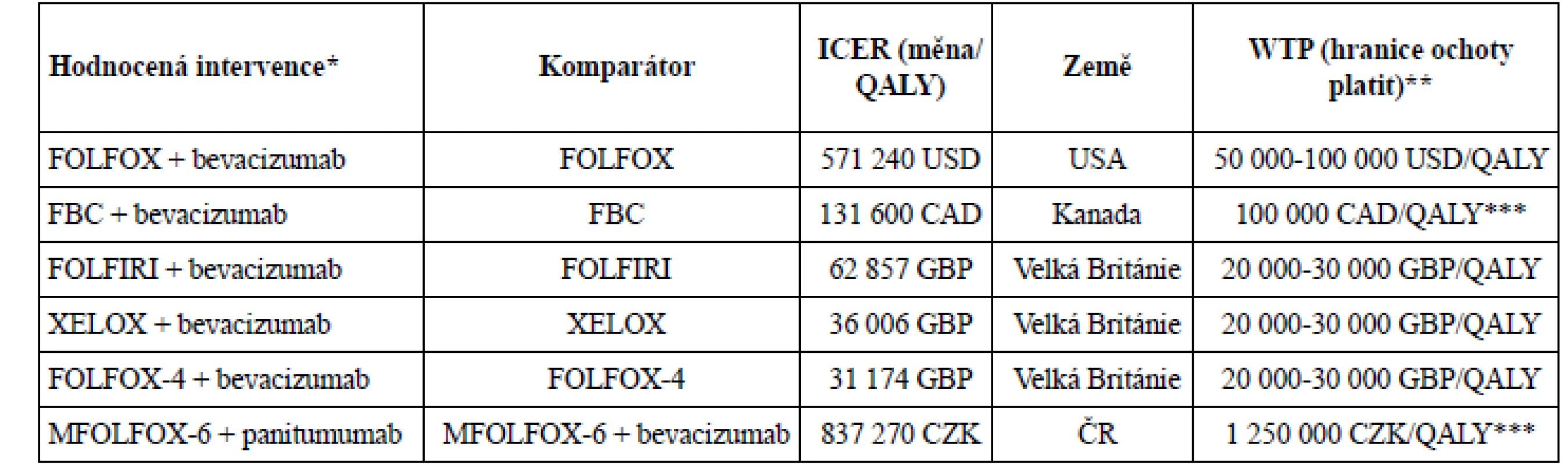
* chemoterapeutické režimy: FOLFOX (oxaliplatina, leukovorin, 5-fluorouracil), FBC (fluoropyrimidine-based chemotherapy), FOLFIRI (irinotekan, leukovorin, 5-fluorouracil), XELOX (oxaliplatina, kapecitabin)
** WTP (willingness to pay) přestavuje zpravidla doporučené rozmezí, o přiznání úhrady rozhodují další parametry (závažnost onemocnění, alternativní terapie, budget impact).
***doporučená horní hranice WTPDůležité je i zpětné hodnocení již dosažených výsledků léčby v běžné praxi. Příkladem může být retrospektivní analýza zaměřená na pacienty starší 65 let léčených bevacizumabem ve Spojených státech amerických (USA) v první linii léčby mCRC provedená v reálné klinické praxi, která vyhodnotila inkrementální náklady na 75 303 USD/LYG. Ačkoliv k vyjádření nevyužili autoři QALY, přesto v podmínkách USA by tato intervence byla pravděpodobně hodnocena jako nákladově efektivní24).
Nový pohled na hodnocení přínosů léčby bevacizumabem a inhibitory EGFR přináší projekt vypracovaný expertní skupinou České onkologické společnosti ČLS JEP pomocí parametrického systému Magnitude of Clinical Benefit Scale (ESMO-MCBS), který je založen na skórování daného léčiva ve srovnání s komparátorem (tj. stávajícími možnostmi léčby) podle zlepšení celkového přežití, přežití do progrese, kvality života a toxicity. Zde byl bevacizumab vyhodnocen jako léčivo s nižším terapeutickým benefitem pro pacienty s mCRC (skóre 1 až 2)25).
Závěr
Léčba mCRC bevacizumabem je pouze jedním z příkladů zvýšení nákladů na zdravotní péči po vstupu cílených molekul na trh. Publikované farmakoekonomické analýzy mohou být podkladem pro další diskuze o benefitu aplikace léčiva. Stejně tak důležité je retrospektivní hodnocení účinnosti v běžné klinické praxi. K účelnému využívání nákladných léčiv přispívají biomarkery, které napomáhají určit, zda daná léčba bude efektivní. Klinická praxe však nemá prozatím žádný biomarker pro selekci pacientů s dobrou léčebnou odpovědí na bevacizumab – na rozdíl od terapie inhibitory EGFR, která může být indikována pouze pacientům s WT RAS. Farmakoekonomické hodnocení nových léčiv má v České republice svoji oporu v Zákoně o veřejném zdravotním pojištění č. 48/1997 Sb. a úhradové vyhlášce č. 63/2007 Sb. Státní ústav pro kontrolu léčiv při rozhodování o výši a podmínkách úhrady požaduje vypracování analýzy nákladové efektivity a dopadu na rozpočet v případech, kdy je požadováno rozšíření podmínek úhrady (vedoucí ke zvýšení počtu léčených pacientů) či zvýšení úhrady oproti základní úhradě v referenční skupině.
Ve zdravotnictví je využívána řada nákladných technologií, pro jejichž hodnocení není zatím v České republice vypracovaná jednotná metodika. Mezinárodně uznávanou metodou hodnocení zdravotnických technologií včetně léčiv je koncept Health Technology Assessement (HTA, např. HTA Core Model), který shromažďuje a hodnotí informace o medicínských, sociálních, ekonomických a etických dopadech zdravotnických technologií v daném zdravotním systému26). Principem je oddělení fáze hodnocení určité technologie, tzv. assessment, které shromažďuje data a hodnotí intervenci, a následně posouzení, tzv. appraisal, tedy rozhodnutí o hodnocené technologii v daném zdravotním systému ve smyslu jejího přijetí či zamítnutí do systému úhrad ze zdravotního pojištění. Tyto principy jsou využívány např. ve Velké Británii, kde existuje National Institute for Health and Care Excellence (NICE) poskytující odborná stanoviska pro National Health Service (NHS) k používání nákladných technologií. Podobně v Německu existuje od roku 2004 Institut für Qualität und Wirtschaftlichkeit und Gesundheitswesen (IQWiG). Česká republika patří k zemím s vyspělou zdravotní péčí, která je však také finančně velmi náročná. Lze předpokládat, že náklady na zdravotní péči s dalším rozvojem nových léčiv a nových technologií budou narůstat. Otázka hodnocení a rozhodování o vstupu nových technologií do systému úhrad bude nadále klíčová. Avšak zatím žádná z mezinárodně používaných metod komplexního hodnocení zdravotnických technologií nemá v České republice politickou ani legislativní oporu.
Střet zájmů: žádný.
PharmDr. Irena Sehnalová
B. Říhová
R. Demlová*
Farmakologický ústav, Lékařská fakulta MU
Kamenice 5, 625 00 Brno-Bohunice
e-mail: 403506@mail.muni.cz
*Masarykův onkologický ústav Brno
Sources
1. van Cutsem E., Cervantes A., Adam R., et al. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol. 2016; 27(8), 1386–422. doi.org/10.1093/annonc/mdw235
2. Ústav zdravotnických informací a statistiky ČR. Novotvary 2016. Available from: http://www.uzis.cz/katalog/zdravotnicka-statistika/novotvary (accessed on 10. 3. 2019).
3. Vyzula R. Modrá kniha České onkologické společnosti. Brno 2018. Available from: http://www.linkos.cz/informace-pro-praxi/modra-kniha/ (accessed on 10. 3. 2019).
4. Giantonio B. J., Catalano P. J., Meropol N. J., et al. Bevacizumab in Combination With Oxaliplatin, Fluorouracil, and Leucovorin (FOLFOX4) for Previously Treated Metastatic Colorectal Cancer: Results From the Eastern Cooperative Oncology Group Study E3200. J. Clin. Oncol. 2007; 25(12), 1539–1544. doi:10.1200/JCO.2006.09.6305
5. Hurwitz H., Fehrenbacher L., Novotny W., et al. Bevacizumab plus Irinotecan, Fluorouracil, and Leucovorin for Metastatic Colorectal Cancer. N. Engl. J. Med. 2004; 350(23), 2335–2342. doi:10.1056/NEJMoa032691
6. Douillard J. Y., Siena S., Cassidy J., et al. Final results from PRIME: randomized phase III study of panitumumab with FOLFOX4 for first-line treatment of metastatic colorectal cancer. Ann Oncol. 2014; 25(7), 1346–1355. doi.org/10.1093/annonc/mdu141
7. Bokemeyer C., Bondarenko I., Hartmann J. T., et al. Efficacy according to biomarker status of cetuximab plus FOLFOX-4 as first-line treatment for metastatic colorectal cancer: the OPUS study. Ann Oncol. 2011; 22(7), 1535–1546. doi.org/10.1093/annonc/mdq632
8. Cutsem E. V., Tabernero J., Lakomy R., et al. Addition of Aflibercept to Fluorouracil, Leucovorin, and Irinotecan Improves Survival in a Phase III Randomized Trial in Patients With Metastatic Colorectal Cancer Previously Treated With an Oxaliplatin-Based Regimen. J. Clin. Oncol. 2012; 30(28), 3499–3506. doi:10.1200/JCO.2012.42.8201
9. Cutsem E. V., Köhne C.-H., Láng I., et al. Cetuximab Plus Irinotecan, Fluorouracil, and Leucovorin As First-Line Treatment for Metastatic Colorectal Cancer: Updated Analysis of Overall Survival According to Tumor KRAS and BRAF Mutation Status. J. Clin. Oncol. 2011; 29(15), 2011–2019. doi:10.1200/JCO.2010.33.5091
10. Grothey A., Cutsem E. V., Sobrero A., et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2012; 381(9863), 303–312. doi.org/10.1016/S0140-6736(12)61900-X
11. Aghagolzadeh P., Radpour R. New trends in molecular and cellular biomarker discovery for colorectal cancer. World J. Gastroenterol. 2016; 22(25), 5678–5693. doi:10.3748/wjg.v22.i25.5678
12. Státní ústav pro kontrolu léčiv. Vectibix, detail léčivého přípravku, ceny a úhrady, indikační omezení. Available from: http://www.sukl.cz/modules/medication/detail.php?code=0029248&tab=
texts (accessed on 10. 3. 2019).13. Státní ústav pro kontrolu léčiv. Erbitux, detail léčivého přípravku, ceny a úhrady, indikační omezení. Available from: http://www.sukl.cz/modules/medication/detail.php?code=0028761&tab=
prices (accessed on 10. 3. 2019).14. Hurwitz H. I., Yi J., Ince W., Novotny W. F., et al. The clinical benefit of bevacizumab in metastatic colorectal cancer is independent of K-ras mutation status: analysis of a phase III study of bevacizumab with chemotherapy in previously untreated metastatic colorectal cancer. The Oncologist. 2009; 14(1): 22–28. doi:10.1634/theoncologist.2008-0213
15. Linkos. Klinický registr CORECT. Available from: http://www.linkos.cz/prehled-registru/klinicky-registr-corect/ (accessed on 12. 2. 2019).
16. Cutsem E. V., Rivera F., Berry S., et al. Safety and efficacy of first-line bevacizumab with FOLFOX, XELOX, FOLFIRI and fluoropyrimidines in metastatic colorectal cancer: the BEAT study. Ann Oncol. 2009; 20(11), 1842–1847. doi.org/10.1093/annonc/mdp233
17. Státní ústav pro kontrolu léčiv. Avastin, detail léčivého přípravku, ceny a úhrady, indikační omezení [Internet]. Available from: http://www.sukl.cz/modules/medication/detail.php?code
=0028396&tab=prices (accessed on 10. 2. 2019).18. Hradecká I., Ríhová B., Horová R., et al. The cost study of first - line treatment of metastatic colorectal carcinoma with bevacizumab - containing regimen in the Czech Republic]. Klin. Onkol. 2014; 27(4), 255–260.
19. Goldstein D. A., Chen Q., Ayer T., et al. First - and second-line bevacizumab in addition to chemotherapy for metastatic colorectal cancer: A United States-based cost-effectiveness analysis. J. Clin. Oncol. 2015; 33(10), 1112–1118. doi:10.1200/JCO.2014.58.4904
20. Tappenden P., Jones R., Paisley S., et al. The cost-effectiveness of bevacizumab in the first-line treatment of metastatic colorectal cancer in England and Wales. Eur. J. Cancer 2007; 43(17), 2487–2494. doi.org/10.1016/j.ejca.2007.08.017
21. Jain S., Shankaran V. The Economics of personalized therapy in metastatic colorectal cancer. Curr Colorectal Cancer Rep. 2016; 12(3), 123–129. doi.org/10.1080/14737167.2016.1259070
22. Lawrence D., Maschio M., Leahy K. J., et al. Economic analysis of bevacizumab, cetuximab, and panitumumab with fluoropyrimidine-based chemotherapy in the first-line treatment of KRAS wild-type metastatic colorectal cancer (mCRC). J. Med. Econ. 2013; 16(12), 1387–1398. doi.org/10.3111/13696998.2013.852097
23. Fínek J., Skoupá J., Jandová P. Cost-effectiveness analysis of panitumumab plus mFOLFOX6 compared to bevacizumab plus mFOLFOX6 for first-line treatment of patients with wild-type RAS metastatic colorectal cancer – Czech Republic model adaptation. Klin Onkol. 2015; 28(4), 265–272.
24. Shankaran V., Mummy D., Koepl L., et al. Survival and lifetime costs associated with first-line bevacizumab use in older patients with metastatic colorectal cancer. The Oncologist August 2014; 19(8), 892–899.
25. Büchler T., Melichar B., Vrána D., et al. Evaluation of anti-cancer therapies with reimbursement limited to comprehensive cancer centres using the European Society for Medical Oncology Magnitude of Clinical Benefit Scale. Klin. Onkol. 2017; 30(5): 349–360.
26. EUnetHTA Joint Action 2, Work Package 8. HTA Core Model ® version 3.0 (Pdf); 2016. Available from: www.htacoremodel.info/BrowseModel.aspx (accessed 10. 2. 2019).
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2019 Issue 2-
All articles in this issue
- Bevacizumab treatment in metastatic colorectal carcinoma – an economic perspective
- Prenylated phenols with cytotoxic and antiproliferative activity isolated from Morus alba
- Influence of formulation and process parameters on the properties of Cu2+/alginate particles prepared by external ionic gelation evaluated by principal component analysis
- OTC market – comparing Czech Republic and Greece
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- OTC market – comparing Czech Republic and Greece
- Bevacizumab treatment in metastatic colorectal carcinoma – an economic perspective
- Prenylated phenols with cytotoxic and antiproliferative activity isolated from Morus alba
- Influence of formulation and process parameters on the properties of Cu2+/alginate particles prepared by external ionic gelation evaluated by principal component analysis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

