-
Medical journals
- Career
Myasthenia gravis – současné terapeutické možnosti a nové trendy
Authors: Markéta Komlóová 1; Kamil Musílek 2,4; Kamil Kuča 3,4
Authors‘ workplace: Univerzita Karlova v Praze, Farmaceutická fakulta Hradec Králové, Katedra farmaceutické chemie a kontroly léčiv 1; Univerzita obrany Hradec Králové, Fakulta vojenského zdravotnictví, Katedra toxikologie 2; Univerzita obrany Hradec Králové, Fakulta vojenského zdravotnictví, Centrum pokročilých studií 3; Fakultní nemocnice Hradec Králové 4
Published in: Čes. slov. Farm., 2011; 60, 47-53
Category: Review Articles
Overview
Myasthenia gravis je velmi vzácné autoimunitní onemocnění nervosvalové ploténky, klinicky se projevující slabostí a zvýšenou unavitelností příčně pruhovaného svalstva. Tato choroba byla v minulosti pro pacienta velmi limitující a nezřídka končila smrtí. Díky kvalitním diagnostickým metodám a četným terapeutickým možnostem se dnes daří plně kompenzovat chorobu a navrátit pacienta k plnohodnotnému životu. Výčet metod používaných v léčbě myasthenia gravis je spolu s charakteristikou nemoci obsahem tohoto pojednání.
Klíčová slova:
myasthenia gravis – rešerše – diagnostika – terapie – vyvíjená léčivaÚvod
Za první zmínku o myasthenii gravis (MG) je považován v záznamech anglického doktora Thomase Willise z roku 1672 1) popis pacienta, který po dlouhodobém mluvení ztratil náhle schopnost řeči z důvodu progresivní ochablosti jazyka. Popis nemoci nazvané „Myasthenia gravis pseudoparalytica“ nicméně poskytl až o dvě století později (1878) německý neurolog Heinrich Erb 2) a podle něho byla také choroba nazývána Erbova-Goldflamova nemoc.
Jedná se o velmi vzácné autoimunitní onemocnění, při kterém dochází k poškození postsynaptické membrány nervosvalové ploténky, způsobené ve většině případů protilátkami proti acetylcholinovým receptorům. Porušený nervosvalový přenos pak vede k typickému příznaku – ochablosti kosterních svalů. Vážnější formy tohoto onemocnění končily nezřídka smrtí, dnes je však dostupná účinná symptomatická léčba kompenzující plně většinu příznaků choroby a navracející pacienty k plnohodnotnému životu 3).
Epidemiologie
V nedávné době byla provedena meta-analýza shrnující výsledky epidemiologických studií zaznamenávajících incidenci, prevalenci a mortalitu MG v průběhu posledních šedesáti let 4). Bylo zjištěno, že udávané údaje mají rostoucí tendenci, což je připisováno především stále dokonalejším diagnostickým metodám 5). Z analýzy je například patrné, že v osmdesátých letech 20. století, kdy bylo do praxe zavedeno sérologické vyšetření protilátek proti acetylcholinovým receptorům, se udávaná incidence i prevalence téměř zdvojnásobila. V současné době se uvádí prevalence 90–130/1 mil. obyvatel (1200–1300 pacientů v České republice) a počet nově hlášených onemocnění je 7–10/1 mil./rok. Myasthenia gravis se může projevit v jakémkoliv věku, ale lze pozorovat dva vrcholy incidence, a to kolem 30. roku, kdy jsou postiženy spíše ženy, a kolem 60. roku, kdy je choroba častěji pozorována u mužů 6).
Etiopatogeneze
Myasthenii gravis je autoimunitní onemocnění, při kterém protilátky napadají struktury na postsynaptické membráně neurosvalové ploténky. Role protilátek při rozvoji MG byla potvrzena v sedmdesátých letech 20. století, kdy při aplikování pacientem produkovaných IgG protilátek do těla laboratorního zvířete došlo k manifestaci příznaků MG 7).
Ve většině případů jsou protilátky namířeny proti nikotinovým acetylcholinovým receptorům (nAChR). Protilátky vázané na nAChR blokují vazebná místa pro neurotransmiter acetylcholin (ACh) a zároveň dochází k odstartování imunologické reakce vedoucí k depleci funkčních nAChR a celkové destrukci postsynaptické membrány, především ke snížení množství záhybů membrány a rozšíření synaptické štěrbiny. Tyto morfologické změny mají pak za následek sníženou možnost úspěšného přenosu signálu 8). Protilátky proti AChR jsou detekovatelné v séru pacienta a jejich stanovení je nyní běžnou součástí diagnostických testů při podezření na MG. Při potvrzení přítomnosti protilátek proti AChR hovoříme o séropozitivní MG 9).
Přibližně 20 % pacientů s MG nemá v séru detekovatelné protilátky proti AChR, jedná se o tzv. séronegativní MG. U velké části pacientů v rámci této skupiny však byly nalezeny protilátky proti svalově specifické tyrosinkinase (MuSK), enzymu který hraje důležitou roli při formování postsynaptické membrány, především při shlukování AChR a jejich ukotvení v membráně 10).
U velké části pacientů jsou přidruženy abnormality thymu. Ve většině případů se jedná o jeho hyperplazii. Zhruba ve 20 % je choroba asociována s výskytem thymomu. V thymomu jsou často přítomny buňky podobné svalovým buňkám, tzv. myoidní buňky, které na svém povrchu exprimují AChR. Předpokládá se, že právě tyto buňky fungují jako zdroj autoantigenu. MG může být doprovázena výskytem dalších autoimunitních onemocnění, především hypertyreózou, revmatoidní artritidou, perniciózní anémií, systémovým lupus erythematodes, popř. ulcerózní kolitidou 11).
Přechodná novorozenecká MG je způsobena pasivním přenosem protilátek z matky na novorozence a objevuje se přibližně v 10 % případů, kdy je rodička myasteničkou. U novorozenců se může projevovat stíženým dýcháním a celkovou hypotonií 12). Myastenický syndrom může být také navozen některými léčivy (D-penicilamin, aminoglykosidová antibiotika, chinin, blokátory kalciového kanálu) 13). Takto získaná myastenická slabost se klinicky manifestuje stejně jako klasická autoimunitní MG, dokonce i protilátky proti AChR mohou být přítomny v séru pacienta.
Symptomatologie
Charakteristickým symptomem MG je bezbolestná slabost příčně pruhovaných svalů často se zhoršující po námaze. Faktory, které mohou urychlit rozvoj svalové ochablosti, jsou např. zvýšená teplota, stres, viróza, těhotenství. Slabost může zůstat po dlouhou dobu lokalizována pouze na určitou skupinu svalů, nejčastěji očních (oční MG). Pokud dojde k rozšíření i na další skupiny kosterního svalstva, jedná se generalizovanou formu MG 14).
Počátečním příznakem nemoci zpravidla bývá nesymetrická ptóza očních víček a rozmazané vidění až diplopie. V důsledku postižení svalů obličeje má pacient často apatický výraz a rozvíjejí se potíže se žvýkáním, polykáním a mluvením. Progrese choroby na svaly krku vede k poklesnutí hlavy. Dále mohou být postiženy svaly končetin 14).
Při myastenické krizi hrozí paralýza dýchacích svalů s nutností asistované ventilace 15). Podle závažnosti příznaků se MG dělí na pět typů. Tato klasifikace byla zavedena Americkou nadací pro myasthenii gravis (MGFA) 16):
- oční MG – jiné svaly než oční nejsou postiženy,
- mírná MG s postižením i jiných svalů než očních, dělí se na podtyp A s postižením svalů trupu a končetin a B s postižením dýchacích svalů a svalů oka,
- střední MG,
- závažná MG,
- MG s nutnou intubací pacienta.
Diagnostika
Klinické vyšetření při podezření na MG na základě popsaných symptomů zpravidla zahrnuje sérii zátěžových testů za účelem oslabení jednotlivých skupin svalů. K vyloučení, popř. potvrzení diagnózy MG následuje elektromyografické vyšetření, při kterém je snímán akční potenciál (AP) svalu po jeho předchozí opakované stimulaci elektrodou. Poruchu nervosvalového přenosu signalizuje pokles AP mezi jednotlivými impulzy o více než 10 % 11, 17).
Krátkodobě působící inhibitor acetylcholinesterasy edrophonium chlorid (Tensilon®) (obr. 1) se využívá zejména v diagnostice oční formy MG. Intravenózní aplikace edrophonia pacientovi s porušeným neuromuskulárním přenosem vede k dočasnému, rychle nastupujícímu zlepšení svalové funkce 14).
Image 1. Inhibitory acetylcholinesterasy používané v symptomatické terapii MG 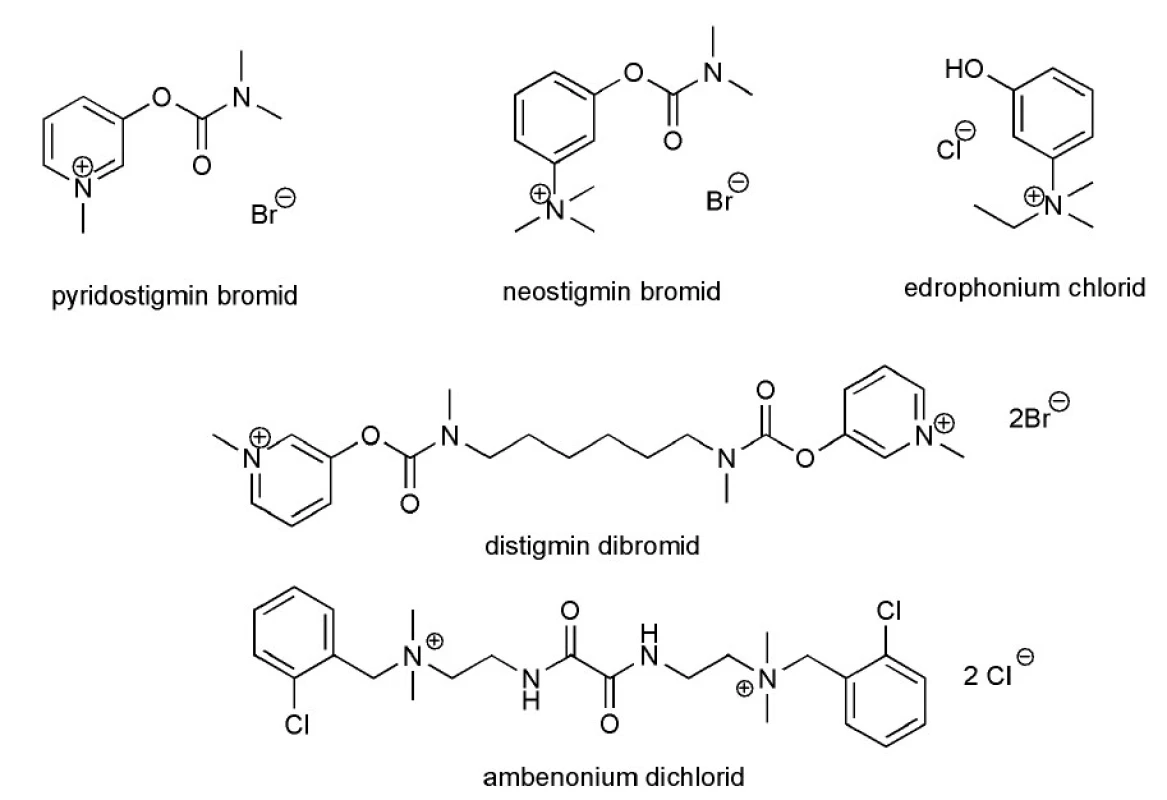
Velmi specifickým vyšetřením je důkaz protilátek proti AChR v séru pacienta. Vyšetření protilátek bylo poprvé provedeno v roce 1976 18). V případě, že protilátky proti AChR nejsou detekovány, provádí se dodatečný test na přítomnost protilátek proti MuSK. Vyšetření protilátek proti AChR je pozitivní u cca 80 % pacientů s generalizovanou formou MG a u asi 55 % pacientů s oční MG 19, 20). U pacientů s thymomem a u některých starších pacientů jsou pozitivní protilátky proti příčně pruhovaným svalům, tzv. antistriatální protilátky (ASMaB), které se však rutinně nevyšetřují.
Současná farmakoterapie
Léčba MG by měla být individuální pro každého pacienta a odvíjet se od závažnosti MG, věku pacienta a komorbidit.
Inhibitory acetylcholinesterasy
Nejdéle používanými léčivy při terapii MG jsou inhibitory acetylcholinesterasy (AChEI). Poprvé je použila ve třicátých letech 20. století skotská lékařka Mary Walker, která vypozorovala, že příznaky MG se shodují s projevy otravy kurare. Při aplikaci protijedu při otravách kurare fysostigminu pak pozorovala u pacienta úlevu a přechodné zlepšení svalových funkcí 21).
AChEI jsou sloučeniny, které mají schopnost snižovat aktivitu acetylcholinesterasy (AChE) – enzymu, odpovědného za degradaci acetylcholinu v místech jeho působení. Inhibicí AChE dojde k nahromadění acetylcholinu v synapsi a usnadnění šíření vzruchu, ovšem pouze za předpokladu, že zůstane zachováno dostatečné množství AChR. Jedná se tedy pouze o symptomatickou léčbu. Přesto je inhibitorů v klinické praxi hojně využíváno, a to především u oční a mírné formy generalizované MG, dále u pacientů, kteří nemohou přijímat imunosupresivní léčbu, popř. jako podpůrná léčba u pacientů s imunosupresivy s přetrvávající svalovou slabostí 14).
Zástupci AChEI užívaných v klinické praxi jsou pyridostigmin bromid (Mestinon®) (obr. 1), ambenonium dichlorid (Mytelase®) (obr. 1), distigmin dibromid (Ubretid®) a neostigmin bromid (Syntostigmin®) (obr. 1). Užívání těchto léčiv je spojeno s výskytem nežádoucích účinků vyplývajících z aktivace muskarinových receptorů. Zahrnují nauzeu, zvracení, průjem, abdominální křeče, zvýšenou salivaci a bronchiální sekreci. Předávkování může vyústit v cholinergní krizi, při které nastává depolarizační blokáda vedoucí k ještě větší svalové slabosti a vystupňování vedlejších muskarinových příznaků 14).
Lékem první volby je pyridostigmin s obecně nižším výskytem nežádoucích účinků. Dávkování je 30–90 mg 3–4× denně a jeho účinek nastupuje zhruba 30 minut po podání. Ambenonium, podobně jako distigmin, má výhodu dlouhodobějšího působení a používá se u pacientů, kteří z nějakého důvodu nemohou být léčeni pyridostigminem 22). Distigmin se navíc s výhodou podává pacientům se zvýšeným výskytem ranní slabosti, jelikož při podání večer jeho účinky přetrvají do druhého dne.
Z pohledu možných nových léčiv bylo v posledních dekádách připraveno velké množství periferních inhibitorů AChE, které vykazují velmi dobré inhibiční schopnosti v porovnání se standardně užívanými léčivy 23). Pro tyto sloučeniny je společným faktorem kvarterní dusík, který omezuje jejich prostup přes hematoencefalickou bariéru, a tak zaručuje jejich periferní působení 24, 25). Navíc design některých molekul byl navržen tak, aby přesně vyplňovaly aktivní místo lidské AChE a byly jejími selektivními inhibitory. Ačkoliv tyto sloučeniny nebyly dosud testovány v symptomatické terapii MG, jejich případné použití by mohlo zmírnit nebo odstranit vedlejší účinky současných symptomatických léčiv, popř. prodloužit požadovaný terapeutický efekt.
Imunosupresivní léčiva
Kortikosteroidy
Nejčastěji používanými imunomodulačními látkami jsou kortikosteroidy. Užívají se jako počáteční léčba u pacientů s oční a generalizovanou MG, kteří nedostatečně odpovídají na léčbu AChEI. Strategie dávkování je vysoká iniciační dávka (2 mg/kg/den prednisonu) (obr. 2) udržovaná po dobu 2–4 týdnů. Poté je postupně titrována na dávku udržovací, při které je zachována dostatečná síla svalstva za minimálního dávkování steroidního léčiva. Vzhledem k tomu, že při nasazení kortikosteroidní léčby hrozí v počátečních dvou týdnech přechodná exacerbace nemoci, je alternativním způsobem nízká iniciační dávka s postupným zvyšováním a posléze opět snižováním dávkování 26, 27). Opatrnosti je třeba i při přerušení léčby, protože náhlé vysazení může podstatně zhoršit projevy nemoci. Dlouhodobé užívání kortikosteroidů prokazatelně vede k signifikantnímu zlepšení příznaků MG, nicméně je spojeno s výskytem řady nežádoucích účinků, které jsou závislé na dávce a mohou být velmi závažné. Zahrnují hypertenzi, hypokalémii, hyperlipidémii, diabetes mellitus, osteoporózu, žaludeční ulcerace a retenci tekutin 28, 29).
Azathioprin (Imuran®, Azaprin®)
Nejčastěji užívaným imunosupresivem určeným pro dlouhodobou léčbu je azathioprin (obr. 2). Je považován za kortikosteroidy šetřící léčivo 30). Jedná se o nejčastěji užívané imunosupresivum pro dlouhodobou léčbu MG. Má dobrou toleranci a poměrně nízký výskyt nežádoucích účinků. Nasazuje se u pacientů, kteří neadekvátně odpovídají na léčbu kortikoidy, často v kombinaci s prednisonem. Počáteční dávka je 2–3 mg/kg 31). Zhruba u 10 % pacientů se mohou rozvinout vedlejší účinky, jako je útlum kostní dřeně nebo příznaky podobné chřipkovému onemocnění. Azathioprin je také značně hepatotoxický. Některé studie poukazují na zvýšený výskyt lymfomu CNS v souvislosti s dlouhodobým užíváním azathioprinu 32).
Cyklosporin (Equoral®, Sandimun®), cyklofosfamid (Endoxan®, Cytoxan®)
Cyklosporin a cyklofosfamid (obr. 2) tvoří další možnosti léčby uplatňované v případě pacientů se závažnou generalizovanou formou MG. Využívá se zejména u pacientů neschopných tolerovat léčbu kortikoidy a azathioprinem nebo u pacientů nedostatečně odpovídajících na tuto léčbu. Kancerogenita, myelotoxicita a nefrotoxicita těchto sloučenin z nich však dělá až léčiva druhé volby.
Nedávná studie doporučuje užití cyklofosfamidu ve formě i.v. bolusů, což umožňuje snížení dávky kortikoidu bez zhoršení svalové funkce a současně snižuje nežádoucí účinky cyklofosfamidu 33).
Mykofenolát mofetil (CellCept®) (obr. 2)
Image 2. Imunosupresiva používaná v symptomatické terapii MG 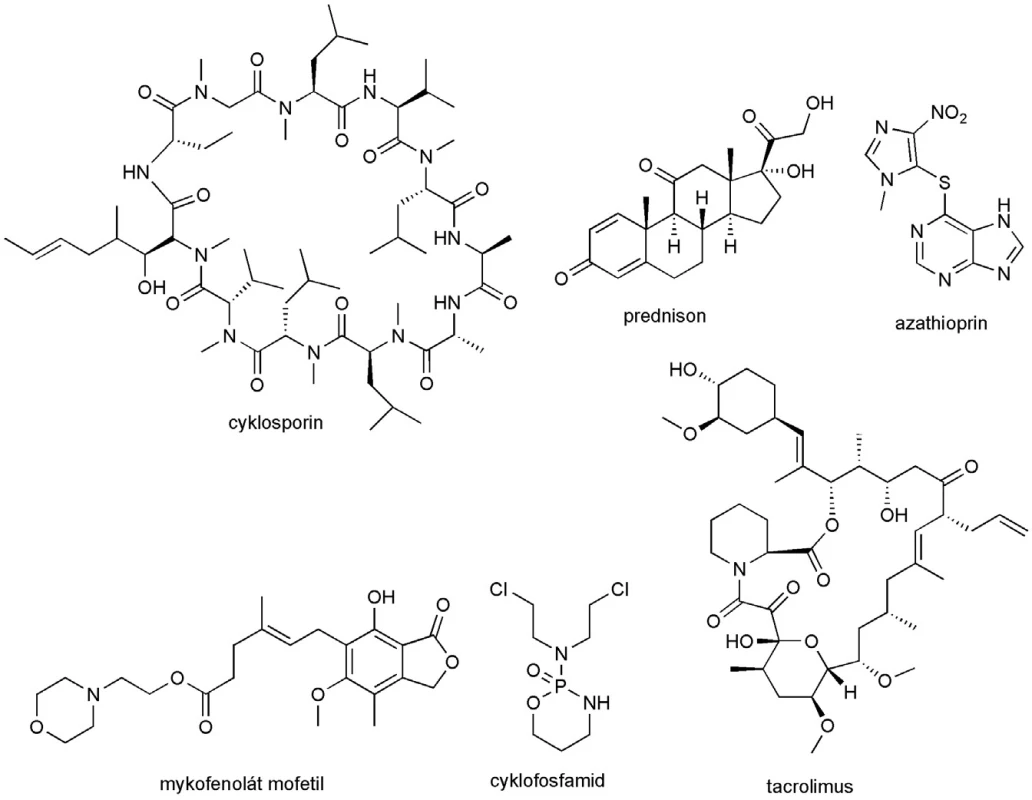
Je užíván jako doplněk léčby u velmi závažných forem MG s výraznou svalovou slabostí a sklony k exacerbaci choroby navzdory léčbě dvojkombinací kortikoidů s azathioprinem, popř. cyklosporinem 34). Retrospektivní studie provedená Chaudhrym potvrdila zlepšení svalových funkcí u většiny pacientů za snížení dávky kortikoidů a dále poukazuje na dobrou toleranci a bezpečnost látky 35). Standardní dávka je 1–1,5 g dvakrát denně, kdy se zvyšující se dávkou stoupá i riziko myelosuprese.
Tacrolimus (Advagraf®) (obr. 2)
Tacrolimus je makrolid izolovaný z bakterie Streptomyces tskubaensis. Jeho imunosupresivní účinek vychází z inhibice kalcineurinu, což vede ke snížené produkci interleukinu IL-2 a zpomalení rozvoje zánětlivé imunitní reakce. Látka je zatím užívána především v transplantologii, nicméně zkouší se i pro indikaci MG. Studie naznačují, že hlavní význam tacrolimu spočívá především v dlouhodobé terapii MG 36).
Biologická léčiva
Biologická léčiva představují výhodnou alternativu k dosud zavedeným léčebným postupům. Potenciál produktů imunitního systému (IS) k využití při terapii chorob je znám již více než 100 let. Pro jejich zavedení do klinické praxe je však významný především rok 1974, kdy byl C. Milsteinem a G. F. Köhlerem objeven postup přípravy monoklonálních protilátek 37).
Zástupcem této skupiny léčiv je např. chimérická myší/lidská monoklonální protilátka basiliximab (Simulect®) (obr. 3), používaná při prevenci rejekce transplantovaných orgánů, především ledvin 38). Jedná se o specifickou protilátku proti receptoru pro interleukin 2 (IL-2), signální molekulu IS produkovanou T‑lymfocyty a hrající důležitou úlohu v aktivaci dalších buněk IS a rozvoji imunitní reakce 39). Při podání basiliximabu v kombinaci s kortikoidy a cyklosporinem pacientovi se závažnou formou MG bylo pozorováno zlepšení svalových funkcí a dlouhodobější podávání umožnilo úplné vysazení kortikoidní léčby. Léčba basiliximabem musela být nicméně zastavena kvůli často se opakujícím infekcím. Použití se jeví jako vhodné právě u závažných forem MG, které neodpovídají dobře na klasickou léčbu, avšak vyžaduje stálé sledování pacienta 40).
Image 3. Molekula basiliximabu v komplexu s ektodoménou IL-2Rα (fialová) 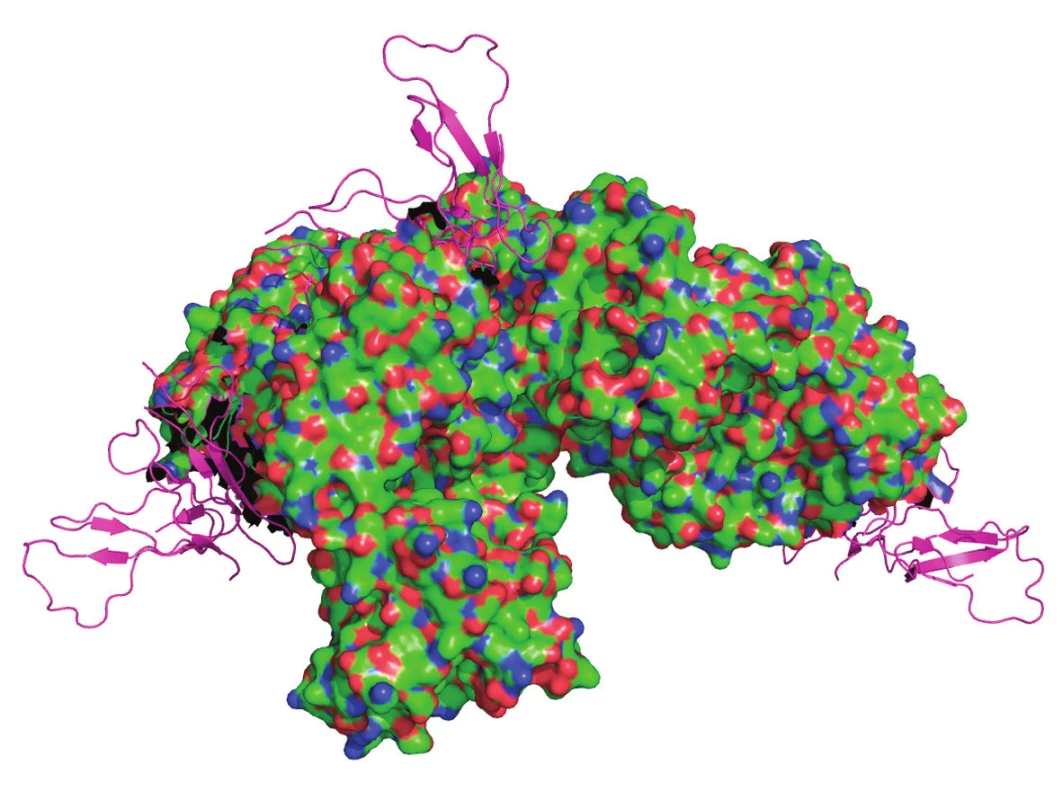
Dalším zástupcem biologických léčiv využitelných při terapii MG je etanercept (Enbrel®) (obr. 4), což je tzv. fúzní, popř. chimérický protein. Ten vzniká expresí uměle spojených genů, kódujících původně různé bílkoviny 39). Makromolekula etanerceptu je tvořena kombinací dvou rozpustných receptorů pro tumor nekrotizující faktor (TNF-α) spojených Fc fragmentem lidského IgG1. Jeho úlohou je vychytávat v oběhu cytokin TNF-α, produkovaný monocyty a makrofágy při imunitní reakci 41). Bylo zjištěno, že T-buňky MG pacientů exprimují na svém povrchu mnohem větší množství receptorů pro TNF-α než T-buňky zdravého jedince 42). Použití etanerceptu bylo podrobeno klinickým studiím, které potvrdily jeho účinnost zejména u refrakterní MG dlouhodobě léčené kortikosteroidy 43).
Image 4. Molekula etanerceptu s Fc fragmentem (fialový) 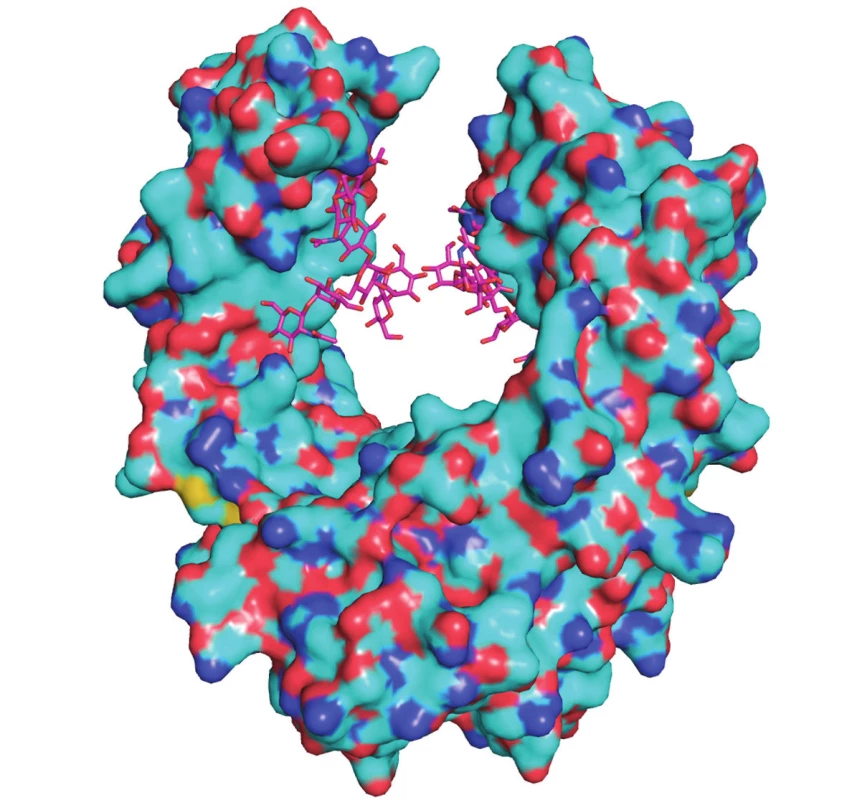
Ve fázi klinického testování je lék zvaný Monarsen® (hEN101; patentovaná struktura 5’-CTGCCACG - -TTCT CCTGCACC-3’), zástupce tzv. „antisense therapy“ 44). Ta je založena na použití uměle připraveného oligonukleotidu, navrženého tak, aby byl komplementární ke konkrétní mRNA v buňce. Navázáním oligonukleotidu se následně vytváří „mRNA-antisense“ komplex, který je degradován RNA-asou, a nedojde tudíž k syntéze proteinu kódovanému původní mRNA 45). U pokusných zvířat s experimentálně navozenou autoimunitní MG (EAMG) byl pozorován zvýšený výskyt, rozpustné monomerní izoformy AChE (AChE-R), která na rozdíl od hlavní izoformy (AChE‑S) není ukotvena na postsynaptické membráně. Na základě hypotézy, že tato rozpustná forma je při MG odpovědná za zvýšenou degradaci ACh, a tudíž svalovou slabost, byl připraven oligonukleotid Monarsen komplementární k mRNA kódující AChE 46). Přestože je Monarsen namířen proti transkriptům všech izoforem AChE, AChE-R mRNA je k jeho účinkům díky své struktuře citlivější 47) a po jeho podání pokusným zvířatům byl pozorován rychlý pokles koncentrace AChE-R, zatímco AChE-S zůstávala neovlivněna. Při porovnání reakce EAMG myší na podání pyridostigminu a Monarsenu, byl pozorován rychlejší nástup účinku pyridostigminu, zatímco účinek Monarsenu byl výrazně delší. Svalový akční potenciál zůstával stabilní bez fluktuací, které jsou při podání pyridostigminu způsobené právě jeho krátkodobým účinkem. Výzkumy také naznačují, že prvotní odpověď organismu na podání AChEI je sice zpomalený rozklad ACh, kompenzující nedostatek AChR, ale následná zvýšená produkce AChE-R limituje jejich účinek při dlouhodobějším podávání 48). Monarsen se proto ve srovnání s AChEI jeví jako léčivo vhodnější pro dlouhodobé podávání.
Další možnosti terapie
Při akutní exacerbaci MG, myastenické krizi či přípravě pacienta na thymektomii jsou účinnou avšak krátkodobou formou léčby plazmaferéza 14, 49) a podání intravenózního imunoglobulinu (IV-Ig). Další základní nefarmakologickou terapeutickou metodou je thymektomie, a to nejen u pacientů s thymomem, ale u všech pacientů s generalizovanou nebo těžší formou okulární MG v jinak dobré zdravotním stavu 50).
ZÁVĚR
Přestože se onemocnění Myasthenia gravis vyskytuje poměrně vzácně, byla jeho studiu věnována značná pozornost a v průběhu posledních sta let došlo k významnému vývoji při objasnění mechanismů vedoucích k rozvoji nemoci. Podařilo se také vyvinout řadu rychlých a spolehlivých diagnostických metod pro včasné odhalení nemoci a úroveň současné farmakoterapie umožňuje plné začlenění pacienta do společnosti a prožití plnohodnotného života. Ačkoliv jsou pro terapii dostupné inhibitory cholinesteras, imunosupresiva a nově i biologických léčiva, jedná se vždy jen o symptomatickou léčbu. Proto vyžaduje diagnóza myasthenia gravis celoživotní terapii, která je navíc ve většině případů komplikována řadou nežádoucích účinků. Zůstává zde tudíž stále prostor pro další studium a hledání nových účinných sloučenin.
Autoři práce děkují za finanční podporu Grantové agentuře České republiky (203/09/P130), Grantové agentuře Univerzity Karlovy v Praze (117909/2009/B-CH/FaF) a Ministerstvu zdravotnictví České republiky (MZO00179906).
Došlo 17. ledna 2011
Přijato 24. ledna 2011
Adresa pro korespondenci:
PharmDr. Kamil Musílek, Ph.D.
Katedra toxikologie FVZ UO
Třebešská 1575, 500 01 Hradec Králové
e-mail: kamil.musilek@gmail.com
Sources
1. Willis, T.: De anima brutorum. Oxford, UK: Theatro Sheldoniano 1672; 404–406.
2. Schmidt, J. E.: Medical Discoveries, Who and When, Springfield, Illinois. USA: Thomas 1959.
3. Barohn, R. J.: Treatment and clinical research in myasthenia gravis. Ann. NY Acad. Sci. 2008; 1132, 225–232.
4. Carr, A. S., Cardwell, C. R., McCarron, P. O., McConville, J.: A systematic review of population based epidemiological studies in myasthenia gravis. BMC Neurol. 2010; 10(1), 46.
5. Phillips, L. H., Torner, J. C.: Epidemiologic evidence for changing natural history of myasthenia gravis. Neurology 1996; 47, 1233–1238.
6. Špalek, P.: Myasténia gravis. Cesk. Slov. Neurol. 2008; 71, 7–24.
7. Toyka, K. V., Drachman, D. B., Griffin, D. E.: Myasthenia gravis: study of humoral immune mechanisms by passive transfer to mice. N. Engl. J. Med. 1977; 296, 125–131.
8. Santa, T., Engel, A. G., Lambert, E. H.: Histomeric study of neuromuscular junction ultrastructure I. Myasthenia gravis. Neurology 1972; 22, 71–82.
9. Lennon, V. A.: Serological diagnosis of myasthenia gravis and Lambert-Eaton myasthenic syndrome. Handbook of myasthenia gravis and myasthenic syndromes. New York: Marcel-Dekker 1994; 149–164.
10. Hoch, W., McConville, J., Helms, S.: Auto-antibodies to the receptor tyrosine kinase MuSK in patients with myasthenia gravis without acetylcholine receptor antibodies. Nature Med. 2001; 7, 365–368.
11. Thanvi, B. R., Lo, T. C. N.: Update on myasthenia gravis. Postgrad. Med. J. 2004; 80, 690–700.
12. Warrell, D. A., Cox, T. M., Firth, J. D., Weatherall, D.: Oxford Texbook of Medicine. 4. vyd. Oxford: Oxford University Press 2003.
13. Pen, A. S., Low, B. W,, Jaffe, J. L.: Drug-induced autoimmune myastenia gravis. Ann. N Y Acad. Sci. 1998; 841, 433–449.
14. Juel, V. C., Massey, J. M.: Myasthenia gravis. Orphanet J. Rare Dis. 2007; 2, 44.
15. Bedlack, R. S., Sanders, D. B.: How to handle myasthenic crisis. Essential steps in patient care. Postgrad. Med. 2000; 107, 211–222.
16. Jablecki, A. 3rd, Barohn, R. J., Ernstoff, R. M.: Myasthenia gravis: recommendations for clinical research standards. Task Force of the Medical Scientific Advisory Board of the Myasthenia Gravis Foundation of America. Neurology 2000; 55, 16–23.
17. Oh, S. J., Kim, D. E., Kuruoglu, R.: Diagnostic sensitivity of the laboratory tests in myasthenia gravis. Muscle Nerve. 1992; 15, 720–724.
18. Lindstrom, J. M., Seybold, M. E., Lennon, V. A.: Antibody to acetylcholine receptor in myasthenia gravis. Prevalence, clinical correlates, and diagnostic value. Neurology 1976; 26, 1054–1059.
19. Lindstrom, J.: An assay for antibodies to human acetylcholine receptor in serum from patients with myasthenia gravis. Clin. Immunol. Immunopathol. 1977; 7, 36–43.
20. Vincent, A., Newsom-Davis, J.: Acetylcholine receptor antibody as a diagnostic test for myasthenia gravis: results in 153 validated cases and 2967 diagnostic assays. J. Neurol. Neurosurg. Psychiatry 1985; 48, 1246–1252.
21. Keesey, J. C.: Contemporary Opinions about Mary Walker. A shy pioneer of therapeutic neurology. Neurology 1998; 51, 1433–1439.
22. Hodge, A. S., Humphrey, D. R., Rosenberry, T. L.: Ambenonium is a rapidly reversible noncovalent inhibitor of acetylcholinesterase, with one of the highest known affinities. Mol. Pharmacol. 1992; 41, 937–942.
23. Komloova, M., Musilek, K., Dolezal, M., Gunn--Moore, F., Kuca, K.: Structure-activity relationship of quaternary acetylcholinesterase inhibitors – Outlook for early myasthenia gravis treatment. Curr. Med. Chem. 2010; 17, 1810–1824.
24. Musilek, K., Komloova, M., Zavadova, V., Holas, O., Hrabinova, M., Pohanka, M.: Preparation and in vitro screening of symmetrical bispyridinium cholinesterase inhibitors bearing different connecting linkage – initial study for myasthenia gravis implications. Bioorg. Med. Chem. Lett. 2010; 20, 1763–1766.
25. Musilek, K., Komloova, M., Holas, O., Hrabinova, M., Pohanka, M., Dohnal, V., Kuca, K.: Preparation and in vitro screening of symmetrical bis-isoquinolinium cholinesterase inhibitors bearing various connecting linkage – implications for early Myasthenia gravis treatment. Eur. J. Med. Chem. 2011; 46, 811 – 818.
26. Seybold, M. E., Drachman, D. B.: Gradually increasing doses of prednisone in myasthenia gravis: reducing the hazards of treatment. N. Engl. J. Med. 1974; 290, 81–84.
27. Sghirlanzoni, A., Peluchetti, D., Mantegazza, R., Fiacchino, F., Cornelio, F.: Myasthenia gravis: prolonged treatment with steroids. Neurology 1984; 34, 170–174.
28. Pascuzzi, R. M., Coslett, H. B., Johns, T. R.: Long-term corticosteroid treatment of myasthenia gravis: Report of 116 patients. Ann. Neurol. 1984; 15, 291–298.
29. Johns, T. R.: Long-term corticosteroid treatment of myasthenia gravis. Ann. NY Acad. Sci. 1987; 505, 568–583.
30. Kokontis, L., Gutmann, L.: Current treatment of neuromuscular diseases. Arch. Neurol. 2000; 57, 939–943.
31. Schwendimann, R. N., Burton, E., Minagar, A.: Management of myasthenia gravis. Am. J. Ther. 2005; 12, 262–268.
32. Herrlinger, U., Weller, M., Dichgans, J., Melms, A.: Association of primary central nervous system lymphoma with long-term azathioprine therapy for myasthenia gravis. Ann. Neurol. 2000; 47, 682–683.
33. De Feo, L. G., Schottlender, J., Martelli, N. A., Molfino, N. A.: Use of intravenous pulsed cyclophosphamide in severe, generalized myasthenia gravis. Muscle Nerve 2002; 26, 31–36.
34. Ciafaloni, E., Sanders, D. B.: Advances in myasthenia gravis. Curr. Neurol. Neurosci. Rep. 2002; 2, 89–95.
35. Chaudhry, V., Cornblath, D. R., Griffin, J. W., O’Brien, R., Drachman, D. B.: Mycophenolate mofetil: a safe and promising immunosupressant in neuromuscular diseases. Neurology 2001; 56, 94–96.
36. Konishi, T., Yoshiyama, Y., Takamori, M., Saida, T.: Long-term treatment of generalized myasthenia gravis with FK506 (tacrolimus). J. Neurol. Neurosurg. Psychiatry 2005; 76, 448–450.
37. Cwiertka, K., Trojanec, R., Špačková, K., Hajdúch, M.: Terapeutické monoklonální protilátky v onkologii. Klin. Farmakol. Farm. 2004; 18, 165–170.
38. Du, J., Yang, H., Zhang, D., Wang, J., Guo, H., Peng, B.: Structural basis for the blockage of IL-2 signaling by therapeutic antibody basiliximab. J. Immunol. 2010; 184, 1361–1368.
39. Sobotková, M., Bartůňková, J.: Monoklonální protilátky a další biologická léčiva užívaná v imunosupresivní léčbě. Remedia. 2008; 5, 18.
40. Kakoulidou, M., Pirskanen-Matell, R., Lefvert, A. K.: Treatment of a patient with myasthenia gravis using antibodies against CD25. Acta Neurol. Scand. 2008; 117, 211–216.
41. Madhusudan, S., Muthuramalingam, S. R., Braybrooke, J. P.: Study of etanercept, a tumor necrosis factor-alpha inhibitor, in recurrent ovarian cancer. J. Clin. Oncol. 2005; 23, 5950–5959.
42. Bongioanni, P., Ricciardi, R., Pellegrino, D., Romano, M. R.: T-cell tumor necrosis factor-alpha receptor binding in myasthenic crisis. J. Neuroimmunol. 1999; 93, 203–207.
43. Rowin, J., Meriggioli, M. N., Tüzün, E., Leurgans, S., Christadoss, P.: Etanercept treatment in corticosteroid-dependent myasthenia gravis. Neurology. 2004; 63, 2390–2932.
44. Soreq, H., Saidman, S., Saidman, J., Evron, T.: Antisense oligonucleotide against human acetylcholinesterase (AChE) and uses thereof. US patent 2006, US7074915.
45. Sussman, J.D., Argov, Z., McKee, D., Hazum, E., Brawer, S., Soreq, H.: Antisense treatment for myasthenia gravis: experience with monarsen, Ann. N Y Acad. Sci. 2008; 1132, 283–290.
46. Brenner, T., Hamra-Amitay, Y., Evron, T., Boneva, N.: The role of readthrough acetylcholinesterase in the pathophysiology of myasthenia gravis. FASEB J. 2003; 17, 214–222.
47. Legay, C. S., Bon, P., Vernier, F.: Cloning and expansion of a rat acetylcholinesterase subunit: generation of a Torpedo collagenic subunit. J. Neurochem. 1993; 60, 337–346.
48. Kaufer, D., Friedman, A., Seidman, S.: Acute stress facilitates long-lasting changes in cholinergic gene expression. Nature 1998; 393, 373–377.
49. NIH Consensus Conference: The utility of therapeutic plasmapheresis for neurological disorders. JAMA 1986; 256, 1333–1337.
50. Evoli, A., Batcchi, A. P., Provenzano, C.: Thymectomy in the treatment of myasthenia gravis: report of 247 patients. J. Neurol. 1988; 235, 272–276.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2011 Issue 2-
All articles in this issue
- Myasthenia gravis – současné terapeutické možnosti a nové trendy
- Peletizace tavenin a kapalin
- Kručinka barvířská (Genista tinctoria L.) – obsahové látky a biologická aktivita
- Bakteriocíny produkované baktériami mliečneho kvasenia
- Generická substituce, záměny a náhrady léčiv – současný rozsah
- Štúdium lokálnych anestetík – časť 194*Hodnotenie karbopolových hydrogélov s lidokaínom
- Analytické hodnotenie mono[{3-[4-(2-etoxyetoxy)-benzoyloxy]-2-hydroxypropyl}-izo-propylamónium]fumarátu
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Generická substituce, záměny a náhrady léčiv – současný rozsah
- Myasthenia gravis – současné terapeutické možnosti a nové trendy
- Bakteriocíny produkované baktériami mliečneho kvasenia
- Peletizace tavenin a kapalin
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

