-
Medical journals
- Career
Kručinka barvířská (Genista tinctoria L.) – obsahové látky a biologická aktivita
Authors: Lenka Tůmová 1; Jiří Tůma 2
Authors‘ workplace: Univerzita Karlova v Praze, Farmaceutická fakulta Hradec Králové, Katedra farmakognozie 1; Univerzita Hradec Králové, Přírodovědecká fakulta, Katedra biologie 2
Published in: Čes. slov. Farm., 2011; 60, 61-64
Category: Review Articles
Overview
Kručinka barvířská (Genista tinctoria L.) – obsahové látky a biologická aktivita
Cílem práce bylo uvést všechny důležité obsahové látky v rostlině Genista tinctoria, které vykazují různou biologickou aktivitu. Jsou zde také zmíněny metody chemického hodnocení těchto látek.Klíčová slova:
Genista tinctoria – isoflavonoidy – chinolizidinové alkaloidy – in vitroÚvod
Rostliny musíme stále ještě považovat za dosud málo prozkoumanou zásobárnu farmaceuticky důležitých látek. Řada rostlinných látek je pro člověka nenahraditelná jako farmaka. K důležitým obsahovým látkám některých rostlin se řadí isoflavonoidy, které byly prokázány v různých druzích rodu Genista. Rod Genista L. (Fabaceae) zahrnuje 87 druhů převážně se vyskytujících ve Středomoří a je charakterizován přítomností flavonů, glykoflavonů a zejména vysokou koncentrací isoflavonů. Genista tinctoria – kručinka barvířská (Fabaceae) je 20–60 (až 200) cm vysoký polokeř rozšířený téměř po celé Evropě i Asii. Je to typická rostlina světlých lesů (doubrav), sušších luk, mezí, pastvin, slunných strání od nížin do podhorského pásma 1, 2). Celá rostlina je jedovatá. Kvetoucí nať se sbírá od května do srpna. Suší se ve stínu. Umělá teplota při sušení nesmí být vyšší než 35 °C. Droga je bez pachu a chutná nahořkle svíravě. V lidovém léčitelství se používá pro svůj značně močopudný účinek při chorobách ledvin a močových cest jako diuretikum. Diuretický účinek způsobují hlavně flavony a silice. Též se podává při nedostatečné srdeční činnosti a při otocích. Zrychluje střevní peristaltiku 1 ,2). Aplikuje se formou nálevu.
Isoflavonoidy a jejich biologická aktivita
Isoflavonoidy plní funkce v obranném systému rostliny jako přirozená ochrana proti infekci při klíčení semen, napadení hmyzem a poškozením škůdci 1) . Biologické účinky isoflavonoidů jsou podmíněny vazbou fenylu na třetí uhlík. Byl prokázán antivirotický, antimykotický, protizánětlivý, analgetický účinek a také ulceroprotektivní účinek. Isoflavonoidy snižují krevní tlak a mohou navodit hypoglykémii. Některá literatura uvádí i spazmolytický účinek, ale studie zaměřená na farmakologický screening methanolových extraktů z rodu Genista tento účinek nepotvrdila. Další vlastností je antagonismus a agonismus na estrogenních receptorech 6–13).
Isoflavonoidy patří k nejznámějším látkám s estrogenní aktivitou. Hrají důležitou roli v prevenci menopauzálních příznaků, osteoporózy, aterosklerózy, kardiovaskulárních onemocnění a inhibují rozvoj a růst buněk nádorů prsu, vaječníků, prostaty a štítné žlázy 6–14). Role fytoestrogenů v prevenci rakoviny je stále dále zkoumána a diskutována. Pro získávání isoflavonoidů je dnes nejvíce využívána čeleď Fabaceae, například sója (Glycine max) nebo jetel (Trifolium pratense). Dalšími, především potravinovými zdroji jsou semena a ořechy bohaté na oleje-slunečnicová semena (Helianthus spp., Asteraceae) a vlašské ořechy (Juglans regia L., Juglandaceae). Isoflavonoidy byly prokázány i v čeledích Iridaceae a Euphorbiaceae. Jako alternativní zdroj isoflavonoidů by mohly být využívány zástupci rodu Genista.
V nati Genista tinctoria byly HPLC analýzou prokázány tyto flavonoidy a isoflavonoidy: genistein 7-O -diglukosid; puerarin; 2’hydroxygenistein 7-O-glukosid; daidzin; apigenin 7-O-glukosid; luteolin 7-O-glukosid; genistin; genistein 7-O-(6’’malonyl)-glukosid; 3’,4’,7--trihydroxyflavon; genistein 7-O-(6’’-acetyl)-glukosid; ononin; 4’,7-dihydroxyisoflavan; daidzein; sissotrin; genistein; luteolin 3, 15). Obdobné flavonoidy byly prokázány i v jiných druzích tohoto rodu například v Genista tricuspidata, G. aucherii, G. burdurensis, G. sadrasica, G. involucrata, G. vuralii, G. tenerea, G. morsii a G. epheroides.
Při metabolizaci v gastrointestinálním traktu savců dochází k přeměně biochaninu A a formononetinu na genistein, resp. daidzein. Daidzein může být dále přeměněn na dihydrodaidzein a poté na O-desmethylangolensin a equol. Equol je metabolizován jednotlivými organismy velmi individuálně, což může být důvodem jistých rozdílů ve výsledcích studií estrogenních účinků isoflavonoidů. Genistein je lidským organismem metabolizován na dihydrogenistein a dále na 6’-hydroxy-O-desmethylangolensin a hormonálně inertní p-ethylfenol 16) (obr. 2).
Image 1. Chemická struktura některých isoflavonů BIOCHANIN A 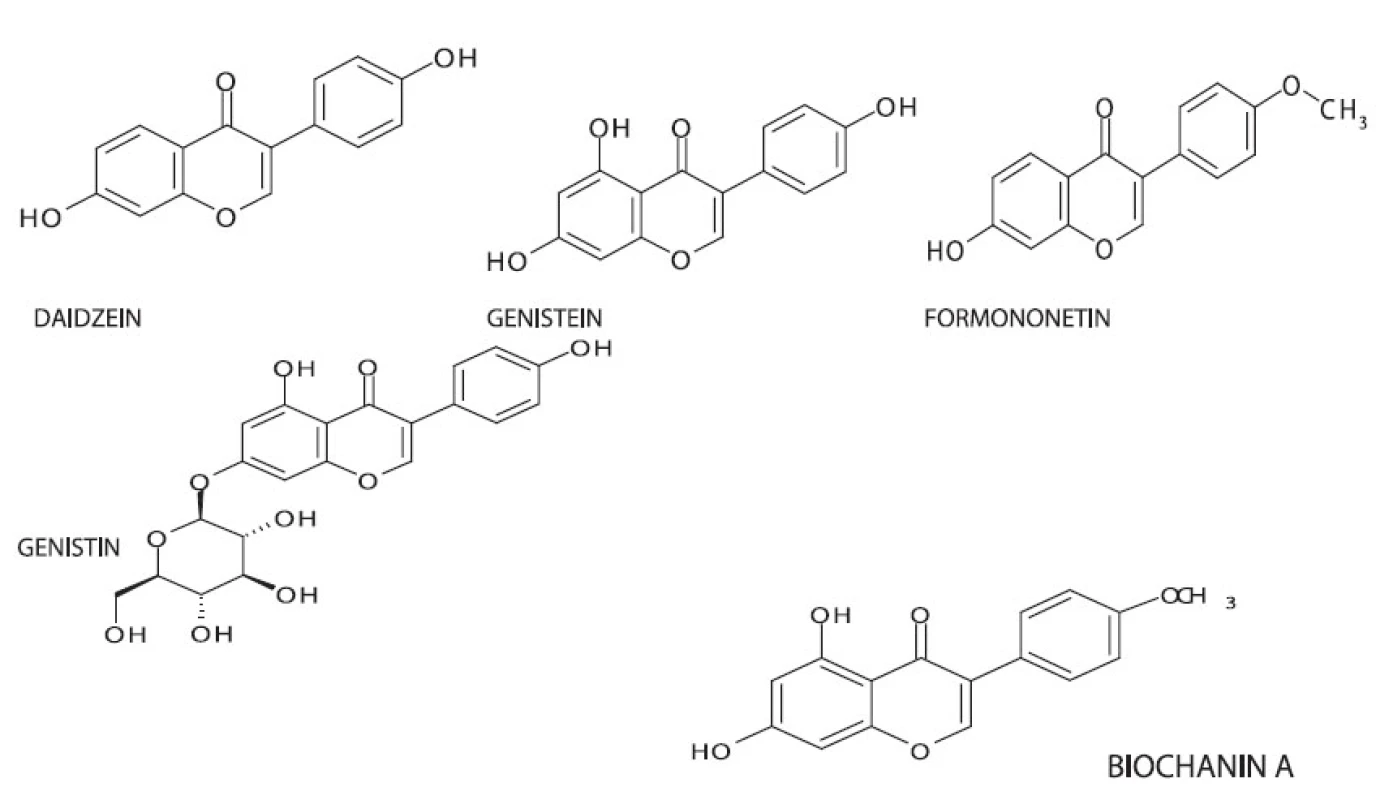
Image 2. Struktura metabolitů isoflavonoidů 6’-hydroxy-O-DMA 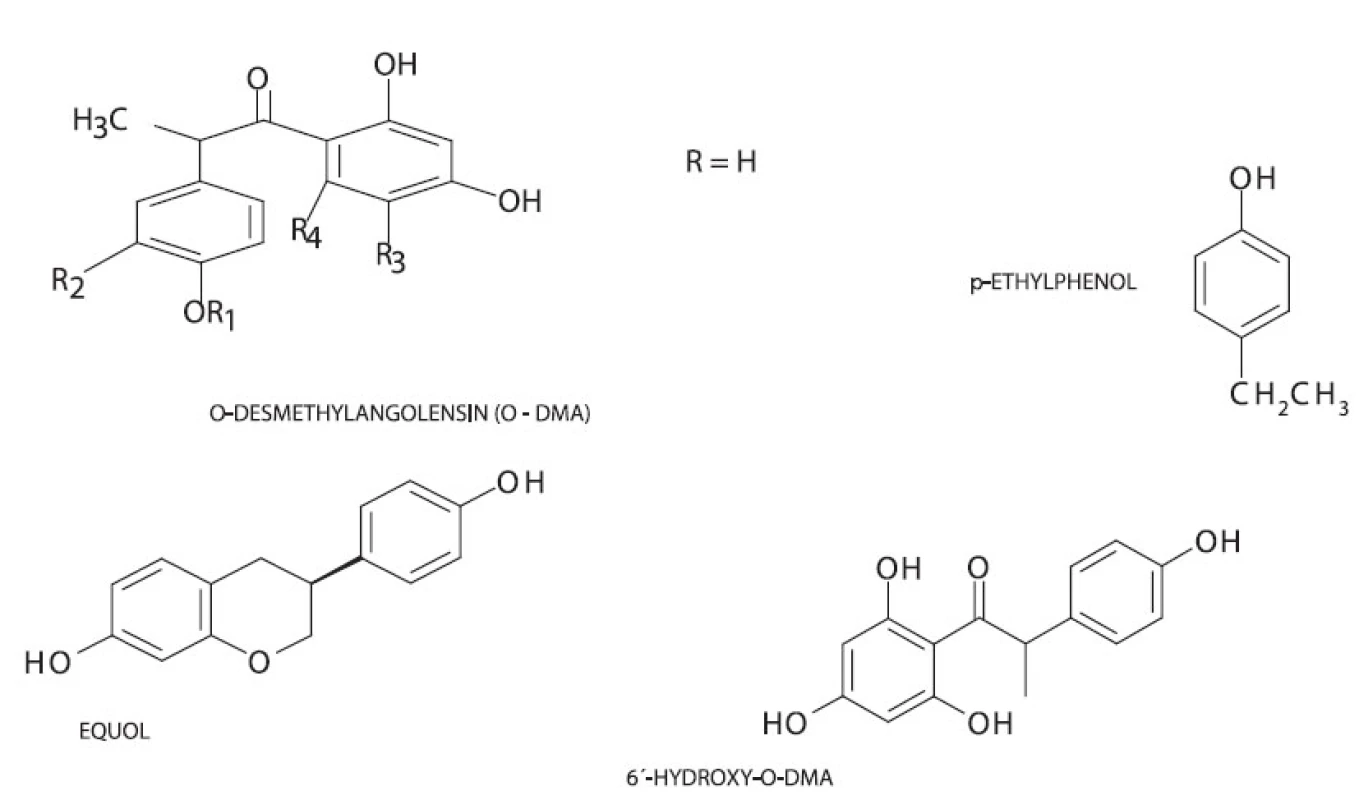
Image 3. Chemická struktura některých chinolidizinových alkaloidů 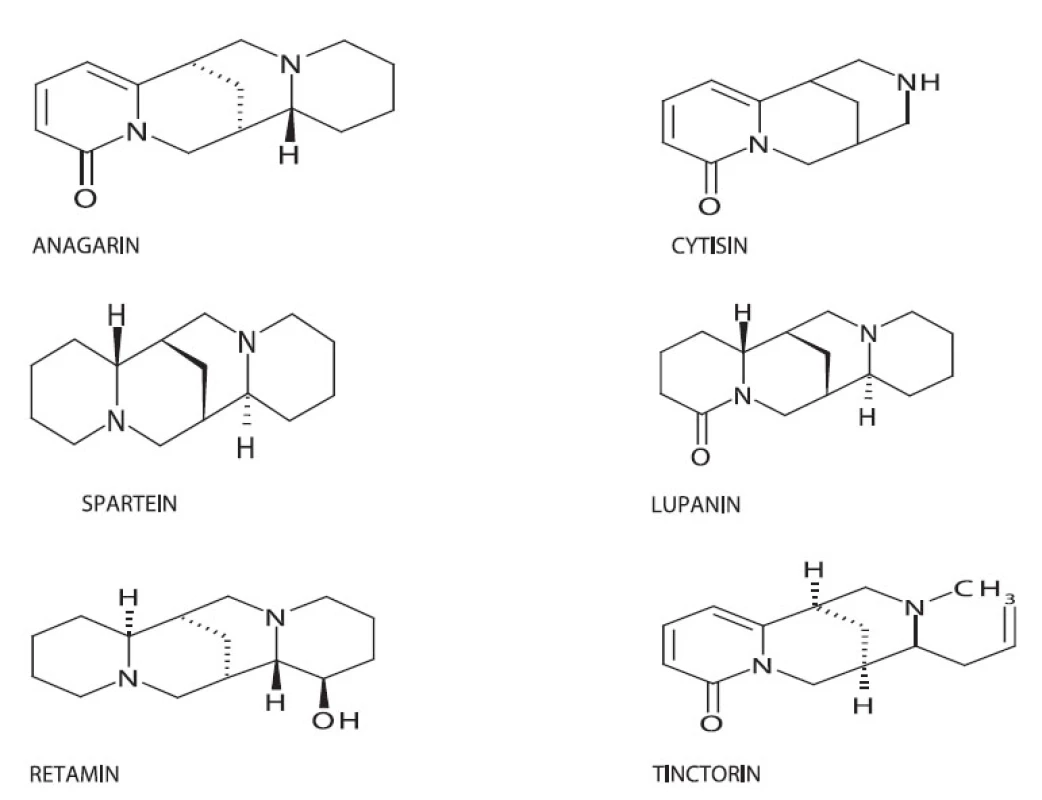
Chinolizidinové alkaloidy a jejich biologická aktivita
Chinolizidinové alkaloidy jsou charakteristické alkaloidy pro čeleď Fabaceae. Jsou budovány z lysinu, resp. jeho metabolického ekvivalentu, kadaverinu. Lupinin vzniká ze dvou, spartein ze tří molekul tohoto prekursoru. Cytisin se považuje za štěpný produkt sparteinu. Terapeutický význam mají hlavně spartein a cytisin.
V rodu Genista prokázal Luczkiewicz tyto chinolizidinové alkaloidy: cytisin, retamin, L-isospartein, methylcytisin, spartein. V intaktní rostlině Genista tinctoria prokázal cytisin, retamin, spartein a L-isospartein. V kalusové kultuře Genista tinctoria byl stanoven pouze retamin a spartein 17).V literatuře se ještě zmiňuje obsah anagyrinu a lupaninu 4), Knöfel ve své studii uvádí také nový alkaloid tinctorin 18).
Biologická aktivita všech zmíněných alkaloidů není v literatuře podrobně popsána. U anagyrinu se zkoumá působení na RVS (respiratory syncitial virus) 20). Cytisin působí jako agonista na neuronálních nikotinacetylcholinových receptorech, vykazuje také analgetický účinek, antihypertenzní a inotropní působení. Spartein působí jako profylaktikum předsíňových dysrytmií a sinusové tachykardie. Lupanin má baktericidní účinek na Pseudomonas syringae P.V. tomato, Pseudomonas syringae P.U. phaselolica, Erurnia carotvora, Pseudomonas libida 20).
Izolace a stanovení obsahových látek Genista tinctoria
Quinuli Wu a Mingfu Wang ve své práci zkoumali optimální analytické metody pro stanovení obsahu estrogennů obsažených v rostlinách. Využívali zejména metody plynové chromatografie (GC), vysokoúčinné kapalinové chromatografie (HPLC) a kapilární elektroforézu (CE) propojené s UV, DAD, ED, fluorescenčním detektorem, MS a NMR a imunoanalýzu 17).
Kombinace GC s MS umožňuje velmi spolehlivou identifikaci a přesné stanovení obsahu fytoestrogenů a jejich metabolitů v rostlinném materiálu. I přes vysokou spolehlivost a citlivost této metody se kvůli vysokým nákladům na provoz tato kombinace nevyužívá. Častěji se využívá kombinace HPLC-MS, nebo HPLC s UV, DAD a fluorescenčními detektory. Fytoestrogeny mají ve struktuře minimálně 1 aromatický kruh s maximem UV absorpce v rozmezí 230–280 nm, proto lze k detekci použít UV detektor nebo dokonalejší detektor s nastavitelnou vlnovou délkou. Nevýhodou UV detekce je snížená citlivost a potřeba aplikace relativně vysoké koncentrace fytoestrogenů ve vzorku. Fluorescenční a elektrochemický detektor jsou mnohem citlivější 17, 19).
Luczkiewicz používal k určení a stanovení komplexu isoflavonoidů a flavonů (volných aglykonů, monoglykosidů, diglykosidů a esterů) obsažených v Genista tinctoria HPLC s DAD UV a MS detektory. Zjistil, že použití tenkovrstvé chromatografie (TLC) s desintometrickou detekcí k analýze fytoestrogenů obsažených v Genista tinctoria je nevhodné stejně jako použití GC, které vyžaduje velice drahou derivatizaci látek 3, 6, 13). Isoflavonoidy vykazují typické spektrum v UV oblasti. Luczkiewicz upozorňuje, že malonáty a acetáty isoflavonoidů vykazují signál ve stejné oblasti UV spektra jako glykosidy. MS detekce umožňuje komplexnější identifikaci sekundárních metabolitů. Glykosidy mají mnohem slabší odezvu než aglykony 13).
K HPLC separaci fytoestrogenů se obecně používají tyto mobilní fáze 80% methanol (MeOH) nebo acetonitril (CH3CN, ACN) a voda s přídavkem malého množství kyseliny. Struktura fytoestrogenů a jejich metabolitů často obsahuje hydroxylové skupiny vázané na fenylech, které mají slabě kyselý charakter. Proto se přidává k mobilní fázi malé množství kyseliny – nejčastěji kyseliny mravenčí (HCOOH), octové (AcOH), trifluoroctové (TFA) a fosforečné (H3PO4) 17).
Luczkiewicz extrahoval isoflavonoidy z lyofilizovaného rostlinného materiálu. Rostlinný materiál byl homogenizován v 80% methanolu a vzniklá suspenze zfiltrována. Pročištěný extrakt byl nastříknut do kolony.
Flavonoidy byly separovány gradientovou elucí s použitím mobilních fází: A (voda: AcOH, 99,9 : 0,1), B (ACN: AcOH, 99,9 : 0,1); Eluční profil: 0–35 min: 10 → 35% B v A; 35–80 min: 35 → 80% B v A. Průtok: 1,5 ml/min; Detekce byla prováděna při 262 nm 6).
Mikelová ve své práci ke stanovení isoflavonoidů používala rovněž metodu HPLC s detekcí pomocí diodového detektoru. Extrakt ze soji (Glycine max) byl získán převedením rozemleté drogy do 80% methanolu a extrahováním za pomoci ultrazvuku. Nežádoucí interferující látky byly odstraněny na kolonách SPE (solid phase extraction). Isoflavony byly z kolony eluovány 60, 80, 100% MeOH s 2% hydroxidem amonným. Mobilní fáze: 0,3% HCOOH (v/v) a acetonitril v různých koncentracích (mobilní fáze A); Eluční profil: 0–20 min 10 → 20% A; 20–25 min 20 → 50% A; 30–45 min 60 → 10 % A; Průtok: 0,8 ml/min. Detekce byla prováděna při 254 nm 5).
Práce byla podpořena Výzkumným záměrem MSM 0021620822 a Projektem Specifického vysokoškolského výzkumu 2010-261-002.
Došlo 25. ledna 2011
Přijato 28. března 2011
Adresa pro korespondenci:
doc. PharmDr. Lenka Tůmová, CSc.
Katedra farmakognozie FaF UK
Heyrovského 1203, 500 05 Hradec Králové
e-mail: tumova@faf.cuni.cz
Sources
1. Korbelář, J., Endris, Z.: Naše rostliny v lékařství. Praha: Avicenum 1985; 216–217.
2. Janča, J., Zentrich, J. A.: Herbář léčivých rostlin, 2. díl. Praha: Eminent 1995; 264–267.
3. Luczkiewicz, M., Migas, P., Kokotkiewicz, A., Walijewska, M., Cisowski, W.: Two-dimensional TLC with Adsorbent Gradient for Separation of Quinolidizine Alkaloids in the Herb and in vitro Cultures of several Genista Species. Journal of Plant Chromatography 2004; 17, 89–94.
4. Resen, I., Veit, M.: Simultaneous Determination of Phenolics and Alkaloids Using Ion Exchange Chromatography for sample. Preparation Phytochemical Analysis. 1995; 6, 121–124.
5. Mikelová, R., Klejdus, B., Zehnálek, J., Vacek, J.: Chromatografické stanovení isoflavonů ve vegetativních a generativních částech rostlin sóje (Glycine max). CHEMagazín 2004; 14, 13–15.
6. Luczkiewicz, M., Głód, D.: Callus cultures of Genista plants-in vitro material producing high amounts of isoflavones of phytoestrogenic activity. Plant Science 2003; 165, 1101–1108.
7. Bello, R., Barrachina, M. D., Martínez-Cuesta, M. A., Esplugues, J.: Pharmacological Screening of the Methanol and Dichlormethanol Extracts of Genista patens. Phytotherapy Research 1995; 9, 495–499.
8. Ososki, L. A., Kennelly, E. J.: Phytoestrogens: a Review of the present state of research, Phytotherapy Research 2003; 17, 845–869.
9. Jedinak, A., Farago, J., Psenakova, I., Maliar, T.: Approaches to flavonoid production in plant tissue culture. Biologia 2004; 59, 697–710.
10. Borges, C., Martinho, P., Martins, A., Rauter, A. P., Ferreira, M. A. A.: Structural characterisation of flavonoids and flavonoid-O-glycosides extracted from Genista tenerea by fast atom bombardement tandem mass. Rapid communications in mass spectrometry 2001; 15, 1760–1767.
11. Rainova, L., Nakov, N., Bogdanova, S., Minkov, E.: Ulceroprotective activity of the flavonoids of Genista rumelica Vel. Phytotherapy Research 1988; 2, 137–139.
12. Garritano, S., Pinto, B., Giachi, I., Pistelli, L., Reali, D.: Assessment of estrogenic activity of flavonoids from Mediterranean plants using an in vitro short-term test. Phytomedicine 2005; 12, 143–145.
13. Aaron, M. Rashotte, Hyun Sook Chae, Bridey, B., Maxwell, J., Kieber, J.: The interaction of cytokinin with other signals.Physiologia Plantarum 2005; 123, 184.
14. Dostál J.: Nová květena ČSSR. 1. díl. Praha: Academia 1989; 516.
15. Luczkiewicz, M., Głód, D., Bączek, T., Buciński, A.: LC-DAD UV and LC-MS for the Analysis of Isoflavones and Flavones from in vitro and in vivo biomass of Genista tinctoria L. Chromatographia 2004; 60, 179–185.
16. Buton, B. J., Patel, N.: Phytoestrogens for Osteoporosis. Clinical Reviews in Bone and Mineral Metabolism 2004; 2, 341–356.
17. Wu, Q., Wang, M., Simon, J. E.: Analytical methods to determine phytoestrogenic Compounds. Journal of Chromatography B 2004; 812, 325–355.
18. Knöfel, D., Schütte, R. H.: Chinolizidinalkaloide: Konstitution und Konfiguration von Tinctorin aus Genista tinctoria. Journal fűr Praktische Chemie 2004; 312, 887–895.
19. Federici, E., Touché, A., Choquart, S., Avanti, O., Fay, L., Offord, E., Courtois, D.: Hihg isoflavone content and estrogenic activity of 25-year old Glycine max tissue cultures. Phytochemistry 2003; 64, 717–724.
20. http://faf.vfu.cz/html/index.2html (staženo 15. 3. 2006).
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2011 Issue 2-
All articles in this issue
- Myasthenia gravis – současné terapeutické možnosti a nové trendy
- Peletizace tavenin a kapalin
- Kručinka barvířská (Genista tinctoria L.) – obsahové látky a biologická aktivita
- Bakteriocíny produkované baktériami mliečneho kvasenia
- Generická substituce, záměny a náhrady léčiv – současný rozsah
- Štúdium lokálnych anestetík – časť 194*Hodnotenie karbopolových hydrogélov s lidokaínom
- Analytické hodnotenie mono[{3-[4-(2-etoxyetoxy)-benzoyloxy]-2-hydroxypropyl}-izo-propylamónium]fumarátu
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Generická substituce, záměny a náhrady léčiv – současný rozsah
- Myasthenia gravis – současné terapeutické možnosti a nové trendy
- Bakteriocíny produkované baktériami mliečneho kvasenia
- Peletizace tavenin a kapalin
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

